2.2.1 原子核外电子排布的周期性 课件(共32张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 2.2.1 原子核外电子排布的周期性 课件(共32张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览








文档简介
(共32张PPT)
专题2 原子结构与元素性质
第二单元 第1课时 原子核外电子排布的周期性
素 养 目 标
1.能从电子排布的角度解释元素周期表的分区、周期和族的划分,培养宏观辨识与微观探析的化学核心素养。
2.了解元素周期表的应用价值。能根据元素周期表与核外电子排布变化规律的认知模型,解释化学现象,揭示现象的本质和规律,培养科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
原子核外电子排布的周期性
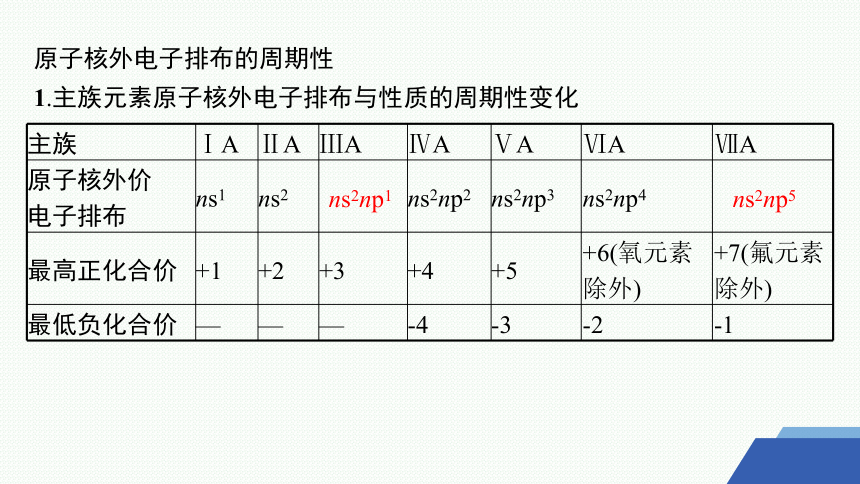
1.主族元素原子核外电子排布与性质的周期性变化
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价 电子排布 ns1 ns2 ns2np2 ns2np3 ns2np4
最高正化合价 +1 +2 +3 +4 +5 +6(氧元素除外) +7(氟元素除外)
最低负化合价 — — — -4 -3 -2 -1
ns2np1
ns2np5
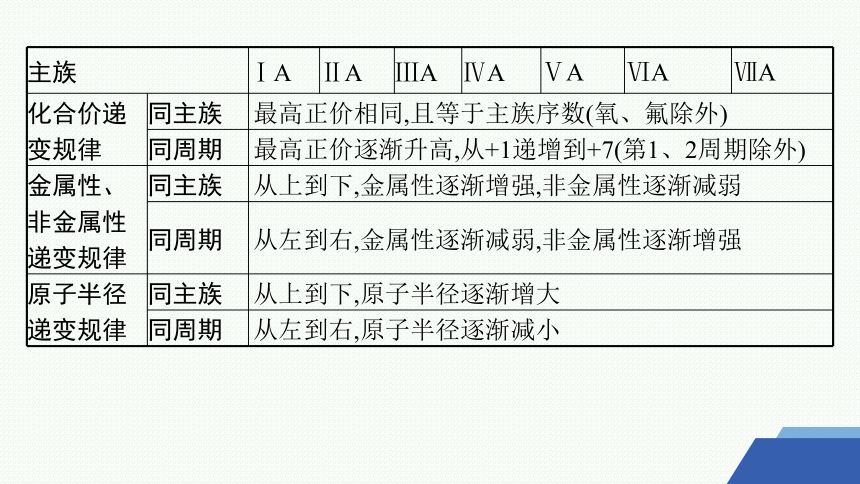
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
化合价递 变规律 同主族 最高正价相同,且等于主族序数(氧、氟除外)
同周期 最高正价逐渐升高,从+1递增到+7(第1、2周期除外)
金属性、非金属性递变规律 同主族 从上到下,金属性逐渐增强,非金属性逐渐减弱
同周期 从左到右,金属性逐渐减弱,非金属性逐渐增强
原子半径 递变规律 同主族 从上到下,原子半径逐渐增大
同周期 从左到右,原子半径逐渐减小
2.最外层电子数目的变化
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从
逐渐增加到 的周期性变化。
3.核外电子排布的周期性变化规律
每隔一定数目的元素,元素原子的外围电子排布重复出现从 到
的周期性变化(第1周期除外)。
周期与电子层数n相关,最外层电子所在轨道的电子层数为n时,该原子所属元素属于第 周期。
1
8
ns1
ns2np6
n
4.外围电子排布的变化
(1)第2、3周期从左到右,元素原子的外围电子排布呈现从 到
的变化。
(2)第4周期从左到右,元素原子的外围电子排布呈现从 经过
逐渐过渡到 的变化。
(3)第5周期元素原子的外围电子排布与第4周期元素原子的外围电子排布有相似的变化规律。
ns1
ns2np6
4s1
3d1~104s1~2
4s24p6
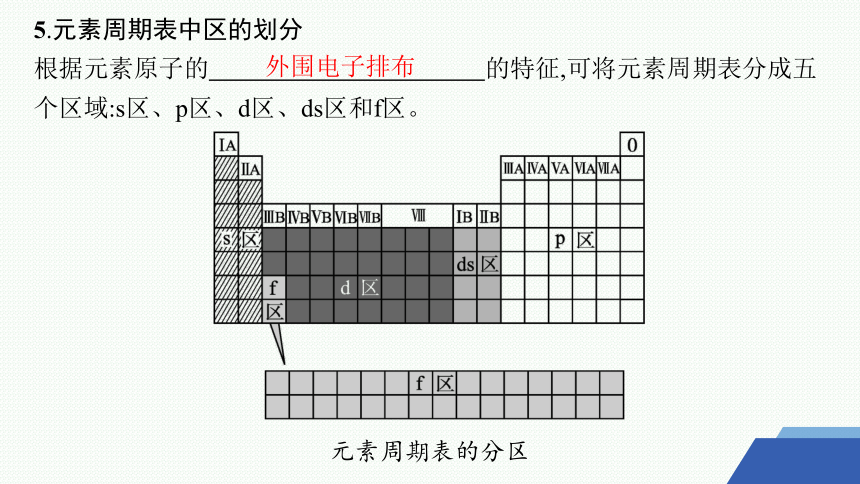
5.元素周期表中区的划分
根据元素原子的 的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区。
元素周期表的分区
外围电子排布
分区 元素位置 价电子排布式
s区 ⅠA族、ⅡA族 ns1~2
p区 ⅢA~ⅦA族、0族 ns2np1~6(氦除外)
d区 ⅢB~ⅦB族(镧系、锕系除外)、Ⅷ族 (n-1)d1~9ns1~2(钯除外)
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2
f区 镧系元素和锕系元素 —
教材阅读 想一想阅读教材本单元“温故知新”。
思考:根据元素原子核外电子排布的周期性变化规律,同一周期元素原子半径从左到右逐渐减小,简单离子的半径从左到右是否也逐渐减小
提示 不是,阳离子比阴离子少一个电子层,因此同一周期的阴离子半径大于阳离子半径,如第3周期元素的离子半径S2->Cl->Na+>Mg2+>Al3+。
易错辨析 判一判
(1)价电子排布式为4s24p3的元素位于第4周期ⅤA族,是p区元素。( )
(2)最外层电子排布式为ns2的基态原子所对应元素一定位于ⅡA族。( )
提示 He的最外层电子排布式为1s2。
(3)元素周期表5个区中都有金属元素。( )
(4)所有非金属元素都分布在p区,d区和ds区均为金属元素。( )
提示 H元素在s区。
√
×
√
×
重难探究·能力素养全提升
探究 原子核外电子排布的周期性
情境探究
按矿泉水特征成分达到国家标准的主要类型分为九大类:①偏硅酸矿泉水;②锶矿泉水;③锌矿泉水;④锂矿泉水;⑤硒矿泉水;⑥溴矿泉水;⑦碘矿泉水;⑧碳酸矿泉水;⑨盐类矿泉水。国家标准中规定的九项界限指标包括锂、锶、锌、硒、溴化物、碘化物、偏硅酸、游离二氧化碳和溶解性总固体,矿泉水中必须有一项或一项以上达到界限指标的要求,其要求含量分别为(单位:mg·L-1)锂、锌、碘化物均≥0.2,硒≥0.01,溴化物≥1.0,偏硅酸≥25,游离二氧化碳≥250和溶解性总固体≥1 000。
1.填写下表。
元素名称 外围电子排布式 周期表中位置 分区
硅
锂
硒
溴
碳
3s23p2
第3周期ⅣA族
p
2s1
第2周期ⅠA族
s
4s24p4
第4周期ⅥA族
p
4s24p5
第4周期ⅦA族
p
2s22p2
第2周期ⅣA族
p
2.碘位于元素周期表第5周期ⅦA族,试写出碘原子外围电子排布式。
3.已知Sr2+、Br-电子层排布相同,试比较Sr2+、Br-、I-离子半径的大小。
提示 5s25p5。
提示 I->Br->Sr2+。
方法突破
1.核外电子排布与周期的划分
2.核外电子排布与族的划分
(1)外围电子排布与族序数之间的关系
(2)有关规律
①主族元素的最外层电子数,等于其族序数;
②副族元素中ⅢB~ⅦB族元素外围电子数为其族序数;
③稀有气体单独列为0族。
3.各区元素化学性质及原子价电子排布特点
分区 包括的元素 价电子排布 化学性质
s区 ⅠA族、 ⅡA族 ns1~2(最后的电子填在ns上) 除氢外,都是活泼金属元素
(碱金属和碱土金属)
p区 ⅢA~ⅦA族、0族 ns2np1~6(除氦外,最后的电子填在np上) 最外层电子参与反应,随着最外层电子数目的增加,非金属性增强,金属性减弱(0族除外)
d区 ⅢB~ⅦB族(镧系、锕系除外)、Ⅷ族 (n-1)d1~9ns1~2[最后的电子填在(n-1)d上] 均为过渡金属,由于d轨道都未充满电子,因此d轨道上的电子可以不同程度参与化学键的形成
分区 包括的元素 价电子排布 化学性质
ds 区 ⅠB族、ⅡB族 (n-1)d10ns1~2[(n-1)d全充满] 均为过渡金属,d轨道已充满电子,因此d轨道上的电子一般不再参与化学键的形成
f区 镧系、锕系 (n-2)f0~14(n-1) d0~2ns2 镧系元素的化学性质非常相近;锕系元素的化学性质也非常相近
4.微粒半径大小规律
影响微粒半径的因素主要是核电荷数和电子层数。一般来说,同周期中,核电荷数越大,半径越小;同主族中,电子层数越多,半径越大。主要有以下规律:
微粒特点 比较方法 实例
原子 同周期元素 核电荷数越大,半径越小 r(Na)>r(Mg)>r(Al)
同主族元素 电子层数越多,半径越大 r(F)多数原子 一般电子层数越多,半径越大 r(S)>r(C)
离子 具有相同电子层结构 核电荷数越大,半径越小 r(Na+)>r(Mg2+)>r(Al3+)
同主族元素 电子层数越多,半径越大 r(F-)同种元素的 原子和离子 价态越高,半径越小 r(Fe)>r(Fe2+)>r(Fe3+)、r(H-)>r(H)>r(H+)
应用体验
视角1 原子核外电子排布与元素周期表
1.[2023河北唐山一中期末]下列说法正确的是( )
A.基态原子的2s电子的能量较高,其一定在比1s电子离核更远的区域运动
B.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于元素周期表中的d区
C.处于最低能量的原子叫做基态原子, 过程中形成的是吸收光谱
D.最外层电子数为ns2的元素都在元素周期表第2列或第12列
B
解析 电子层和能级只是表示电子能量差异和主要运动区域的不同,故基态原子的2s电子的能量较高,不一定在比1s电子离核更远的区域运动,A错误;某元素+3价离子的电子排布式为1s22s22p63s23p63d5,离子的核外电子数是23,所以原子序数是26,即是铁元素,位于第4周期Ⅷ族,属于d区,B正确;
,2p轨道上的能量一样,两者之间没有能量变化,也就不形成光谱,C错误;最外层电子数为ns2的元素在元素周期表第2列或第12列,还有第18列的He,还有一些过渡元素最外层电子数也为ns2,D错误。
2.[2023河北邢台一中月考]肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
C.基态A原子2p轨道上有一个未成对电子,基态B原子3p轨道上也有一个未成对电子
D.基态A原子2p轨道上有一对成对电子,基态B原子3p轨道上也有一对成对电子
D
解析 核外电子排布式为1s22s2的原子为Be,为ⅡA族元素,核外电子排布式为1s2的原子为He,为0族元素,故不选A; 为Ne, 为Na+,Ne与Na+不是同族元素,故不选B;基态时,A原子2p轨道上有一个未成对电子,最外层电子排布为2s22p1或2s22p5,为B元素或F元素,B原子3p轨道上也有一个未成对电子,最外层电子排布为3s23p1或3s23p5,为Al元素或Cl元素,二者不一定处于同一主族,故不选C;基态时,A原子2p轨道上有一对成对电子,最外层电子排布为2s22p4,是O元素,B原子3p轨道上也有一对成对电子,最外层电子排布为3s23p4,是S元素,二者处于同一主族,性质相似,故选D。
3.具有以下结构的原子,一定属于主族元素的是( )
A.最外层有2个电子的原子
B.最外层电子排布为ns2的原子
C.最外层有3个未成对电子的原子
D.次外层无未成对电子的原子
C
解析 在元素周期表中,最外层有2个电子的原子、最外层电子排布为ns2的原子,可能是ⅡA族元素,还可能是He或过渡元素,如Sc、Ti、V、Zn等,因此最外层有2个电子的原子不一定是主族元素,故A、B项均错误;最外层有3个未成对电子的原子,其最外层有5个电子(ns2np3),一定是主族元素,故C项正确;次外层无未成对电子的原子包括全部主族元素、0族元素及ⅠB、ⅡB族元素,故D项错误。
视角2 微粒半径大小比较
4.具有下列核外电子排布式的原子:
①1s22s22p5,②1s22s2,③1s22s22p63s2,④1s22s22p63s23p4
下列说法错误的是( )
A.原子半径最大的为③ B.离子半径最大的是③
C.②③均为ⅡA族元素 D.①④均为p区元素
B
解析 根据原子的核外电子排布式可知,①中原子为氟(F),②中原子为铍(Be),③中原子为镁(Mg),④中原子为硫(S)。原子半径Mg>S>Be>F,因此原子半径最大的为③,A正确;离子半径>F->Mg2+>Be2+,B错误;②③的外围电子排布均为ns2,因此均为ⅡA族元素,C正确;①④均为p区元素,D正确。
【变式设问】
(1)试比较①和④的非金属性强弱。
(2)请写出原子序数是③的2倍的元素原子基态电子排布式,并判断元素在周期表中的位置和分区。
提示 非金属性F>S。
提示 电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,在元素周期表第4周期ⅥB族,位于d区。
5.下列微粒半径大小比较错误的是( )
A.K>Na>Li
B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F-
D.Cl->F->F
C
解析 同主族元素,由上到下原子半径逐渐增大,A项正确;核外电子排布相同的微粒,核电荷数越大,微粒半径越小,B项正确;C项错误,应该为F->Na+ >Mg2+;D项正确。
6.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.离子半径:Am+B.原子半径:A>B
C.A的原子序数比B的小m+n
D.b=a-n-m
C
解析 因为aAm+与bBn-的核外电子排布相同,A的原子序数比B的大,则离子半径Am+B,B正确;aAm+与bBn-的核外电子排布相同,则a-m=b+n,推知a-b=m+n,b=a-m-n,因此A的原子序数比B的大m+n,C错误,D正确。
本 课 结 束
专题2 原子结构与元素性质
第二单元 第1课时 原子核外电子排布的周期性
素 养 目 标
1.能从电子排布的角度解释元素周期表的分区、周期和族的划分,培养宏观辨识与微观探析的化学核心素养。
2.了解元素周期表的应用价值。能根据元素周期表与核外电子排布变化规律的认知模型,解释化学现象,揭示现象的本质和规律,培养科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
原子核外电子排布的周期性
1.主族元素原子核外电子排布与性质的周期性变化
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价 电子排布 ns1 ns2 ns2np2 ns2np3 ns2np4
最高正化合价 +1 +2 +3 +4 +5 +6(氧元素除外) +7(氟元素除外)
最低负化合价 — — — -4 -3 -2 -1
ns2np1
ns2np5
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
化合价递 变规律 同主族 最高正价相同,且等于主族序数(氧、氟除外)
同周期 最高正价逐渐升高,从+1递增到+7(第1、2周期除外)
金属性、非金属性递变规律 同主族 从上到下,金属性逐渐增强,非金属性逐渐减弱
同周期 从左到右,金属性逐渐减弱,非金属性逐渐增强
原子半径 递变规律 同主族 从上到下,原子半径逐渐增大
同周期 从左到右,原子半径逐渐减小
2.最外层电子数目的变化
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从
逐渐增加到 的周期性变化。
3.核外电子排布的周期性变化规律
每隔一定数目的元素,元素原子的外围电子排布重复出现从 到
的周期性变化(第1周期除外)。
周期与电子层数n相关,最外层电子所在轨道的电子层数为n时,该原子所属元素属于第 周期。
1
8
ns1
ns2np6
n
4.外围电子排布的变化
(1)第2、3周期从左到右,元素原子的外围电子排布呈现从 到
的变化。
(2)第4周期从左到右,元素原子的外围电子排布呈现从 经过
逐渐过渡到 的变化。
(3)第5周期元素原子的外围电子排布与第4周期元素原子的外围电子排布有相似的变化规律。
ns1
ns2np6
4s1
3d1~104s1~2
4s24p6
5.元素周期表中区的划分
根据元素原子的 的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区。
元素周期表的分区
外围电子排布
分区 元素位置 价电子排布式
s区 ⅠA族、ⅡA族 ns1~2
p区 ⅢA~ⅦA族、0族 ns2np1~6(氦除外)
d区 ⅢB~ⅦB族(镧系、锕系除外)、Ⅷ族 (n-1)d1~9ns1~2(钯除外)
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2
f区 镧系元素和锕系元素 —
教材阅读 想一想阅读教材本单元“温故知新”。
思考:根据元素原子核外电子排布的周期性变化规律,同一周期元素原子半径从左到右逐渐减小,简单离子的半径从左到右是否也逐渐减小
提示 不是,阳离子比阴离子少一个电子层,因此同一周期的阴离子半径大于阳离子半径,如第3周期元素的离子半径S2->Cl->Na+>Mg2+>Al3+。
易错辨析 判一判
(1)价电子排布式为4s24p3的元素位于第4周期ⅤA族,是p区元素。( )
(2)最外层电子排布式为ns2的基态原子所对应元素一定位于ⅡA族。( )
提示 He的最外层电子排布式为1s2。
(3)元素周期表5个区中都有金属元素。( )
(4)所有非金属元素都分布在p区,d区和ds区均为金属元素。( )
提示 H元素在s区。
√
×
√
×
重难探究·能力素养全提升
探究 原子核外电子排布的周期性
情境探究
按矿泉水特征成分达到国家标准的主要类型分为九大类:①偏硅酸矿泉水;②锶矿泉水;③锌矿泉水;④锂矿泉水;⑤硒矿泉水;⑥溴矿泉水;⑦碘矿泉水;⑧碳酸矿泉水;⑨盐类矿泉水。国家标准中规定的九项界限指标包括锂、锶、锌、硒、溴化物、碘化物、偏硅酸、游离二氧化碳和溶解性总固体,矿泉水中必须有一项或一项以上达到界限指标的要求,其要求含量分别为(单位:mg·L-1)锂、锌、碘化物均≥0.2,硒≥0.01,溴化物≥1.0,偏硅酸≥25,游离二氧化碳≥250和溶解性总固体≥1 000。
1.填写下表。
元素名称 外围电子排布式 周期表中位置 分区
硅
锂
硒
溴
碳
3s23p2
第3周期ⅣA族
p
2s1
第2周期ⅠA族
s
4s24p4
第4周期ⅥA族
p
4s24p5
第4周期ⅦA族
p
2s22p2
第2周期ⅣA族
p
2.碘位于元素周期表第5周期ⅦA族,试写出碘原子外围电子排布式。
3.已知Sr2+、Br-电子层排布相同,试比较Sr2+、Br-、I-离子半径的大小。
提示 5s25p5。
提示 I->Br->Sr2+。
方法突破
1.核外电子排布与周期的划分
2.核外电子排布与族的划分
(1)外围电子排布与族序数之间的关系
(2)有关规律
①主族元素的最外层电子数,等于其族序数;
②副族元素中ⅢB~ⅦB族元素外围电子数为其族序数;
③稀有气体单独列为0族。
3.各区元素化学性质及原子价电子排布特点
分区 包括的元素 价电子排布 化学性质
s区 ⅠA族、 ⅡA族 ns1~2(最后的电子填在ns上) 除氢外,都是活泼金属元素
(碱金属和碱土金属)
p区 ⅢA~ⅦA族、0族 ns2np1~6(除氦外,最后的电子填在np上) 最外层电子参与反应,随着最外层电子数目的增加,非金属性增强,金属性减弱(0族除外)
d区 ⅢB~ⅦB族(镧系、锕系除外)、Ⅷ族 (n-1)d1~9ns1~2[最后的电子填在(n-1)d上] 均为过渡金属,由于d轨道都未充满电子,因此d轨道上的电子可以不同程度参与化学键的形成
分区 包括的元素 价电子排布 化学性质
ds 区 ⅠB族、ⅡB族 (n-1)d10ns1~2[(n-1)d全充满] 均为过渡金属,d轨道已充满电子,因此d轨道上的电子一般不再参与化学键的形成
f区 镧系、锕系 (n-2)f0~14(n-1) d0~2ns2 镧系元素的化学性质非常相近;锕系元素的化学性质也非常相近
4.微粒半径大小规律
影响微粒半径的因素主要是核电荷数和电子层数。一般来说,同周期中,核电荷数越大,半径越小;同主族中,电子层数越多,半径越大。主要有以下规律:
微粒特点 比较方法 实例
原子 同周期元素 核电荷数越大,半径越小 r(Na)>r(Mg)>r(Al)
同主族元素 电子层数越多,半径越大 r(F)
离子 具有相同电子层结构 核电荷数越大,半径越小 r(Na+)>r(Mg2+)>r(Al3+)
同主族元素 电子层数越多,半径越大 r(F-)
应用体验
视角1 原子核外电子排布与元素周期表
1.[2023河北唐山一中期末]下列说法正确的是( )
A.基态原子的2s电子的能量较高,其一定在比1s电子离核更远的区域运动
B.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于元素周期表中的d区
C.处于最低能量的原子叫做基态原子, 过程中形成的是吸收光谱
D.最外层电子数为ns2的元素都在元素周期表第2列或第12列
B
解析 电子层和能级只是表示电子能量差异和主要运动区域的不同,故基态原子的2s电子的能量较高,不一定在比1s电子离核更远的区域运动,A错误;某元素+3价离子的电子排布式为1s22s22p63s23p63d5,离子的核外电子数是23,所以原子序数是26,即是铁元素,位于第4周期Ⅷ族,属于d区,B正确;
,2p轨道上的能量一样,两者之间没有能量变化,也就不形成光谱,C错误;最外层电子数为ns2的元素在元素周期表第2列或第12列,还有第18列的He,还有一些过渡元素最外层电子数也为ns2,D错误。
2.[2023河北邢台一中月考]肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
C.基态A原子2p轨道上有一个未成对电子,基态B原子3p轨道上也有一个未成对电子
D.基态A原子2p轨道上有一对成对电子,基态B原子3p轨道上也有一对成对电子
D
解析 核外电子排布式为1s22s2的原子为Be,为ⅡA族元素,核外电子排布式为1s2的原子为He,为0族元素,故不选A; 为Ne, 为Na+,Ne与Na+不是同族元素,故不选B;基态时,A原子2p轨道上有一个未成对电子,最外层电子排布为2s22p1或2s22p5,为B元素或F元素,B原子3p轨道上也有一个未成对电子,最外层电子排布为3s23p1或3s23p5,为Al元素或Cl元素,二者不一定处于同一主族,故不选C;基态时,A原子2p轨道上有一对成对电子,最外层电子排布为2s22p4,是O元素,B原子3p轨道上也有一对成对电子,最外层电子排布为3s23p4,是S元素,二者处于同一主族,性质相似,故选D。
3.具有以下结构的原子,一定属于主族元素的是( )
A.最外层有2个电子的原子
B.最外层电子排布为ns2的原子
C.最外层有3个未成对电子的原子
D.次外层无未成对电子的原子
C
解析 在元素周期表中,最外层有2个电子的原子、最外层电子排布为ns2的原子,可能是ⅡA族元素,还可能是He或过渡元素,如Sc、Ti、V、Zn等,因此最外层有2个电子的原子不一定是主族元素,故A、B项均错误;最外层有3个未成对电子的原子,其最外层有5个电子(ns2np3),一定是主族元素,故C项正确;次外层无未成对电子的原子包括全部主族元素、0族元素及ⅠB、ⅡB族元素,故D项错误。
视角2 微粒半径大小比较
4.具有下列核外电子排布式的原子:
①1s22s22p5,②1s22s2,③1s22s22p63s2,④1s22s22p63s23p4
下列说法错误的是( )
A.原子半径最大的为③ B.离子半径最大的是③
C.②③均为ⅡA族元素 D.①④均为p区元素
B
解析 根据原子的核外电子排布式可知,①中原子为氟(F),②中原子为铍(Be),③中原子为镁(Mg),④中原子为硫(S)。原子半径Mg>S>Be>F,因此原子半径最大的为③,A正确;离子半径>F->Mg2+>Be2+,B错误;②③的外围电子排布均为ns2,因此均为ⅡA族元素,C正确;①④均为p区元素,D正确。
【变式设问】
(1)试比较①和④的非金属性强弱。
(2)请写出原子序数是③的2倍的元素原子基态电子排布式,并判断元素在周期表中的位置和分区。
提示 非金属性F>S。
提示 电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,在元素周期表第4周期ⅥB族,位于d区。
5.下列微粒半径大小比较错误的是( )
A.K>Na>Li
B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F-
D.Cl->F->F
C
解析 同主族元素,由上到下原子半径逐渐增大,A项正确;核外电子排布相同的微粒,核电荷数越大,微粒半径越小,B项正确;C项错误,应该为F->Na+ >Mg2+;D项正确。
6.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.离子半径:Am+
C.A的原子序数比B的小m+n
D.b=a-n-m
C
解析 因为aAm+与bBn-的核外电子排布相同,A的原子序数比B的大,则离子半径Am+
本 课 结 束
