2.2.2 元素第一电离能的周期性变化 元素电负性的周期性变化 课件(共53张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 2.2.2 元素第一电离能的周期性变化 元素电负性的周期性变化 课件(共53张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览










文档简介
(共53张PPT)
专题2 原子结构与元素性质
第二单元 第2课时 元素第一电离能的周期性变化
元素电负性的周期性变化
素 养 目 标
1.能说出元素电离能的含义,能描述主族元素第一电离能变化的一般规律,培养证据推理与模型认知的化学核心素养。
2.认识元素的电负性的周期性变化。形成“结构决定性质”的观念,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、元素第一电离能的周期性变化
1.定义
某元素的气态原子失去一个电子形成+1价气态阳离子所需的最低能量,叫做该元素的第一电离能,用符号I1表示,单位:kJ·mol-1。
2.意义
(1)第一电离能可以衡量元素的 原子失去一个电子的难易程度。
(2)第一电离能数值越小,该气态原子越 失去一个电子;第一电离能数值越大,该气态原子越 失去一个电子。
气态
容易
难
3.递变规律
同主族元素 同主族元素的原子 相同,随着核电荷数的增大,原子半径逐渐 ,失电子能力逐渐 ,第一电离能逐渐
同周期元素 同一周期的主族元素具有相同的 ,随着核电荷数的递增,最外层电子数 ,原子半径逐渐 ,失电子能力逐渐 ,第一电离能呈现 的趋势。同周期元素碱金属元素第一电离能最小,稀有气体第一电离能最大
外围电子排布 通常,当原子核外电子排布在能量相等的轨道上形成 结构时,原子的能量较低,该元素具有较 的第一电离能。例如,Mg的外围电子排布为3s2,s轨道处于 状态,P的外围电子排布为3s23p3,p轨道处于 状态,因此二者,第一电离能相对较
最外层电子数
增大
增强
减小
电子层数
增加
减小
减弱
增大
全空、半充
满和全充满
大
全充满
半充满
高
4.电离能的应用
(1)根据电离能数据,确定元素核外电子的排布。如Li:I1 I2(2)根据电离能数据,确定元素在化合物中的化合价。如K:I1 I2(3)判断元素的金属性、非金属性强弱:I1越大,元素的 性越强;
I1越小,元素的 性越强。
非金属
金属
教材阅读 想一想自学教材“元素第一电离能的周期性变化”。
思考:为什么N的第一电离能大于O
提示 N的外围电子排布为2s22p3,p轨道处于半充满状态,原子能量较低,失去一个电子消耗能量较多;O的外围电子排布为2s22p4,失去1个电子可使p轨道达到半充满状态,因此失去1个电子较容易,导致N的第一电离能大于O。
易错辨析 判一判
(1)第3周期所含元素中钠的第一电离能最小。( )
(2)第一电离能F>Cl>Br。( )
(3)最外层电子排布式为2s22p6的原子,第一电离能较大。( )
(4)对同一元素(原子核外有3个以上电子)而言,电离能:I1>I2>I3。( )
提示 对同一元素逐级电离能逐渐增大,即:I1√
√
√
×
二、元素电负性的周期性变化
1.电负性
(1)定义:元素的原子在化合物中 能力的标度。
(2)标准:指定氟的电负性为 ,并以此为标准确定其他元素的电负性。
吸引电子
4.0
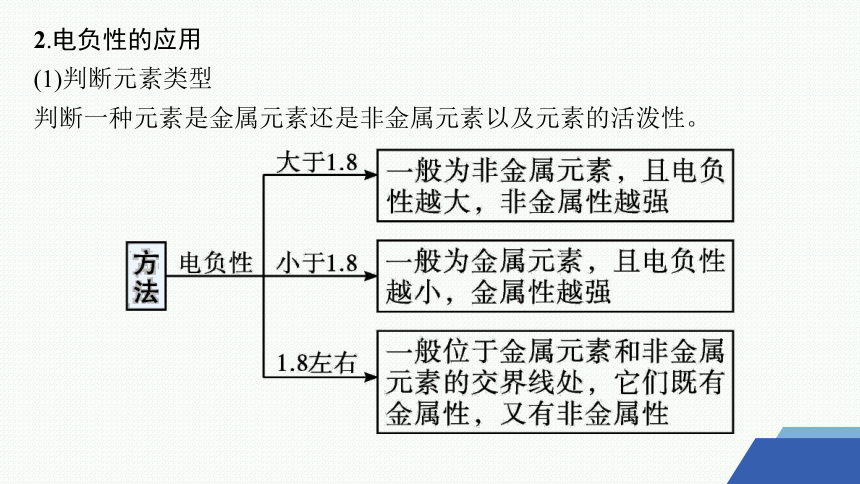
2.电负性的应用
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
(2)衡量元素在化合物中吸引电子能力的大小
①电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;
②电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
(3)判断化学键类型
3.主族元素电负性的变化规律
同一 周期 主族元素的电负性从左到右依次 ,表明其吸引电子的能力逐渐 , 逐渐减弱, 逐渐增强
同一 主族 元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐 , 逐渐增强, 逐渐减弱
增大
增强
金属性
非金属性
减弱
金属性
非金属性
4.“对角线”规则
(1)含义:“对角线”规则又称斜线关系,指元素周期表中某一元素及其化合物的性质与它左上方或右下方的另一元素及其化合物性质相类似。
(2)“对角线”规则的表现
在第2、3周期中,具有典型“对角线”规则的元素有三对:锂和镁、铍和铝、硼和硅。
锂和镁的相似性:
①在氧气中燃烧生成氧化物 、 ,而其他碱金属则易生成过氧化物、超氧化物;
②能直接与氮作用,生成氮化物 、 ,而其他碱金属不与氮直接反应;
③氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
Li2O
MgO
Li3N
Mg3N2
铍和铝的相似性:
①单质在冷的浓硝酸中钝化;
②氧化物、氢氧化物都有 性;
③氯化物都是 化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
①硼和硅的密度相近;
②硼和硅的简单气态氢化物能直接被氧气氧化;
③最高价氧化物的水化物都是 酸等。
两
共价
弱
教材阅读 想一想自学教材“图2-14主族元素的电负性”。
思考:根据常见的物质分析,两成键元素的电负性差值大于1.7,它们一定形成离子键吗
提示 不一定。F的电负性为4.0,H的电负性为2.1,它们的电负性差值大于1.7,但二者形成的H—F键为共价键。
易错辨析 判一判
(1)金属元素的电负性一定大于1.8。( )
提示 金属元素的电负性一般小于1.8。
(2)同周期元素中,稀有气体的电负性数值最大。( )
提示 同周期元素中,卤族元素的电负性数值最大。
(3)根据“对角线规则”,B和Mg元素的电负性接近。( )
提示 根据“对角线规则”,B和Si元素的电负性接近。
(4)与第一电离能相比,电负性是与物质宏观性质表现关联性更强的参数。
( )
×
×
×
√
重难探究·能力素养全提升
探究一 电离能
情境探究
下表为Na、Mg、Al的电离能(kJ·mol-1)
1.为什么同一元素的电离能逐级增大
2.为什么Mg的I1大于铝的I1
提示 原子失电子时,首先失去的是能量最高的电子,故第一电离能较小,原子失去电子后变成阳离子,离子半径变小,原子核对电子的引力增强,从而使电离能逐级增大。
提示 Al原子的外围电子排布式为3s23p1,3p能级上的1个电子较易失去,而Mg原子的外围电子排布式为3s2,3s能级处于全充满状态,较难失去电子,所以Mg原子的第一电离能大于铝。
3.从电离能的角度分析为什么Na、Mg、Al的化合价分别为+1、+2、+3
提示 Na的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成+2价离子;Al的I1、I2、I3相差不多,而I3比I4小很多,所以Al容易失去三个电子形成+3价离子。
方法突破
1.影响电离能的因素
电离能的数值大小主要取决于原子的核电荷数、原子半径以及原子的核外电子排布特点。
2.逐级电离能
(1)定义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,依次类推。可以表示为
M(g)══M+(g)+e- I1(第一电离能)
M+(g)══M2+(g)+e- I2(第二电离能)
M2+(g)══M3+(g)+e- I3(第三电离能)
……
(2)变化规律
①同一元素的逐级电离能逐渐增大,即I1I2、I4>I3……In+1>In。
②元素的逐级电离能逐渐增大并且会发生一个突变即突然增大多倍,这是由于电子是分层排布的,主族元素几乎不能失去内层电子的缘故。如Na原子的I1、I2、I3的值分别是(单位为kJ·mol-1)496、4 562、6 912,在I1和I2之间发生突变。
3.电离能的应用
电离能衡量的是原子失电子的能力,基本与元素的金属性一致
(1)用来衡量原子失去电子的难易,比较金属的活泼程度和元素的金属性。一般地,元素的第一电离能越小,金属性越强;碱金属元素的第一电离能越小,碱金属越活泼。
(2)判断原子易失去电子的数目、元素的化合价和原子核外电子排布
元素的各级电离能逐渐增大并且会发生一个突变(由于电子是分层排布的,内层电子比外层电子难于失去,因此会发生突变),如Mg原子的I1、I2、I3的值分别是(单位为kJ·mol-1)738、1 451、7 733,在I2和I3之间发生突变,则镁元素易失去最外层2个电子,则最外层电子排布为ns2,常见化合价为+2价。
应用体验
视角1 电离能的大小判断
1.[2022海南学业水平选择性考试]钠和钾是两种常见金属,下列说法正确的是( )
A.钠元素的第一电离能大于钾
B.基态钾原子外围电子轨道表示式为
C.钾能置换出NaCl溶液中的钠
D.钠元素与钾元素的原子序数相差18
A
解析 同一主族元素的第一电离能从上到下依次减小,金属性越强的元素,其第一电离能越小,因此,钠元素的第一电离能大于钾,A说法正确;基态钾原子外围电子排布为4s1,其轨道表示式为 ,B说法不正确;钾和钠均能与水发生反应产生氢气,因此钾不能置换出NaCl溶液中的钠,C说法不正确;钠元素与钾元素的原子序数分别为11和19,两者相差8,D说法不正确。
2.下列四种元素中,第一电离能由大到小顺序正确的是( )
①原子含有未成对电子最多的第2周期元素
②原子核外电子排布为1s2的元素
③元素周期表中非金属性最强的元素
④原子最外层电子排布为2s22p4的元素
A.②③①④ B.③①④②
C.①③④② D.②③④①
A
解析 根据题意可知①为N元素、②为He元素、③为F元素、④为O元素。He为稀有气体元素,难以失去电子,第一电离能最大。同周期元素从左到右第一电离能呈增大趋势,N原子的最外层p能级为半充满结构,第一电离能大于相邻的O元素,则第一电离能由大到小的顺序为②③①④。
3.具有下列外围电子排布式的元素中,第一电离能最小的是( )
A.ns2np3
B.ns2np4
C.ns2np5
D.ns2np6
B
解析 ns2np3的p轨道为半充满稳定结构,第一电离能为ns2np3>ns2np4,对于题给四个选项,其第一电离能由小到大顺序为ns2np4归纳总结 比较不同元素电离能的大小方法
书写原子的外围电子排布式,分析其外围电子结构,若具有半充满或全充满的结构,则失去一个电子消耗能量较多,电离能较大。
视角2 电离能数值的应用
4.[2023河北唐山开滦第一中学期末]已知X、Y是主族元素,表中数据I1~I4为逐级电离能(单位为kJ·mol-1)。下列说法错误的是( )
元素 I1 I2 I3 I4
X 500 4 600 6 900 9 500
Y 580 1 800 2 700 11 600
A.元素Y是ⅢA族元素
B.X单质还原性比Y的强
C.元素X的常见化合价是+1价
D.若元素Y处于第3周期,其单质可与冷水剧烈反应
D
解析 X的第二电离能与第一电离能相差较大,则说明X原子核外最外层有1个电子,则X属于ⅠA族元素;Y的第三电离能和第四电离能相差较大,说明Y原子核外最外层有3个电子,则Y是ⅢA族元素。元素Y是ⅢA族元素,A正确;X第一电离能较小,失电子能力更强,即X单质的还原性强于Y的,B正确;X为ⅠA族元素,则其常见化合价为+1价,C正确;如果Y是第3周期元素,最外层有3个电子,则Y为Al,单质Al与冷水不反应,故D错误。
5.某主族元素X的逐级电离能如图所示,下列说法正确的是( )
A.X元素显+4价 B.X为非金属元素
C.X为第5周期元素 D.X与氯气反应时最可能生成的阳离子为X3+
D
解析 由题图可知,该元素的I4 I3,故该元素易形成+3价阳离子,X可为金属,故A、B错误;周期数=核外电子层数,根据图中信息无法确定X原子有多少电子层,因此不能确定该元素是否位于第5周期,故C错误;由题图可知,该元素易形成+3价阳离子,因此X与氯反应时最可能生成的阳离子为X3+,故D正确。
探究二 电负性
情境探究
雄与雌,一般是指有生命体的性别,
我们把类似的矿物分为雄与雌却是
极少的。雄黄与雌黄是共生矿物,
有“矿物鸳鸯”的说法,其化学式分
别为As4S4、As2S3。古时写字用黄纸,写错了就用雌黄
涂抹后重写。因此,在汉语环境中,雌黄有篡改文章的
意思,并且有着“胡说八道”的引申义,如成语“信口雌黄”。
硫元素与砷元素在元素周期表中的相对位置及电负性数
值如图。
1.试写出硫原子与砷原子的外围电子排布式。
2.根据硫元素与砷元素的电负性判断As2S3中元素化合价的正负及化学键类型。
3.根据电负性的递变规律来看,Se的电负性可能是( )
A.1.8 B.3.0 C.2.4
提示 硫原子与砷原子的外围电子排布式分别为3s23p4、4s24p3。
提示 As2S3中的S元素的电负性大于As,因此S元素显负价,As元素显正价;由于两元素的电负性差值小于1.7,因此两元素形成的化学键为共价键。
提示 根据元素电负性的递变规律可以知道,Se元素的电负性应大于As,而小于S,应该在2.0~2.5范围内,因此C项正确。
C
方法突破
比较元素电负性大小的方法
(1)根据元素周期表
(2)非金属元素的电负性一般比金属元素的电负性大。
(3)二元化合物中,显负价的元素的电负性更大。
应用体验
视角1 电负性数值的应用
1.已知七种元素H、O、S、N、Al、Cl、Si的电负性分别为2.1、3.5、2.5、3.0、1.5、3.0、1.8。一般认为,如果两种成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果成键元素间的电负性差值小于1.7,通常形
成共价键。某有机化合物A的结构简式为 ,下列有关说法正确的是( )
A.A中S和O的共用电子对偏向S
B.A中S和N的共用电子对偏向N
C.AlCl3、AlN和Al2S3都是离子化合物
D.在化合物H2S、NH3和SiH4中,H的化合价都是+1价
B
解析 元素的电负性越大,元素原子对键合电子的吸引力越大;电负性越小,元素原子对键合电子的吸引力越小。由于S元素的电负性小于O和N元素的电负性,因此S和O的共用电子对偏向O,S和N的共用电子对偏向N,A项错误,B项正确。AlCl3中Al和Cl的电负性差值为1.5,小于1.7,因此Al和Cl之间的化学键是共价键,AlCl3是共价化合物,同理可知AlN和Al2S3都是共价化合物,C项错误。N、S的电负性大于H的电负性,则在H2S和NH3中H为+1价;Si元素的电负性小于H元素的电负性,因此在SiH4中H为-1价,D项错误。
【变式设问】
在CH4分子中,碳显-4价,试判断C、Si、H电负性的大小顺序。
提示 电负性由大到小的顺序为C>H>Si。
2.用电负性数据不能判断的是( )
A.某元素是金属元素还是非金属元素
B.氢化物HY和HX中键的极性强弱
C.化学键是离子键还是共价键
D.化合物的溶解度
D
解析 一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,利用电负性可以判断元素是金属元素还是非金属元素,故A不符合。电负性越大的原子对键合电子的吸引力越强,即该原子与氢原子形成的化合物中键的极性越强,可以利用电负性判断氢化物HY和HX中键的极性强弱,故B不符合。一般来说电负性差值小于1.7的两种元素的原子之间形成共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物,可以依据电负性数据判断化学键是离子键还是共价键,故C不符合。利用电负性不能判断物质的溶解度,故D符合。
视角2 电负性大小的判断
3.[2023河北高二2月联考]在常用退烧药中,对乙酰氨基酚(结构简式如图所示)是目前应用最广泛的OTC类药品之一,关于其分子结构中涉及的元素,下列说法错误的是( )
A.N2的电子式:N N
B.O2-的结构示意图:
C.第一电离能:N>O>C
D.电负性:O>N>C>H
A
4.X、Y均为非金属元素,不能说明X的电负性比Y的电负性大的是( )
A.X单质比Y单质容易与H2化合
B.X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强
C.X原子的最外层电子数比Y原子的最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
C
解析 A、B、D三项均能说明X的非金属性比Y的强。C中原子的最外层电子数不能决定元素得失电子的能力。
5.下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4
B.1s22s22p63s23p3
C.1s22s22p63s23p2
D.1s22s22p63s23p64s2
A
解析 A、B、C、D四种元素分别为O、P、Si、Ca,电负性最大的是氧。
6.Ⅰ.自1869年门捷列夫给出第一张元素周期表以来,至少出现过700多种不同形式的周期表。1905年,瑞士化学家维尔纳根据元素周期律将当时发现的元素进行排列,制成了众所周知的维尔纳长式元素周期表。这种元素周期表是针对化学课程的需求而制作的,具有很强的科学性和系统性。当前应用最多的就是这张维尔纳长式周期表,根据元素在周期表中的位置,分析元素的性质。
(1)在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 。
(2)在元素周期表中,电负性最大的元素是 ,电负性最小的元素是
(放射性元素除外)。
(3)最活泼的金属元素是 (放射性元素除外)。
(4)最活泼的非金属元素是 。
(5)第2、3、4周期元素中p轨道半充满的原子是 。
Ⅱ.下面给出15种元素的电负性
元素 Al B Be C Cl F Li Mg N Na O P S Si H
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8 2.1
已知:一般来说,两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是 。
(2)判断下列物质是离子化合物还是共价化合物:
Mg3N2 ,BeCl2 ,AlCl3 ,SiC 。
答案 Ⅰ.(1)Na Ar (2)F Cs (3)Cs (4)F (5)N、P、As
Ⅱ.(1)随原子序数的递增,元素的电负性呈周期性变化
(2)离子化合物 共价化合物 共价化合物 共价化合物
解析 Ⅰ.一般来说,同周期从左到右,元素的第一电离能呈逐渐增大的趋势(除ⅡA族、ⅤA族元素反常外),同周期中碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大,故第3周期中第一电离能最小的元素为Na,最大的元素为Ar。电负性的递变规律:一般来说,同周期从左到右元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,故周期表中,电负性最大的元素是F,电负性最小的元素是Cs。
Ⅱ.(1)把表中元素按原子序数递增的顺序排序,然后对应写出它们的电负性数值,从Li→F电负性增大,到Na时电负性又突然变小,从Na→Cl又逐渐增大,所以随着原子序数的递增,元素的电负性呈周期性变化。
(2)根据已知条件及表中数值,Mg3N2中两元素电负性差值为1.8,大于1.7,形成离子键,为离子化合物;BeCl2、AlCl3、SiC中两元素电负性差值分别为1.5、1.5、0.7,均小于1.7,形成共价键,为共价化合物。
本 课 结 束
专题2 原子结构与元素性质
第二单元 第2课时 元素第一电离能的周期性变化
元素电负性的周期性变化
素 养 目 标
1.能说出元素电离能的含义,能描述主族元素第一电离能变化的一般规律,培养证据推理与模型认知的化学核心素养。
2.认识元素的电负性的周期性变化。形成“结构决定性质”的观念,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、元素第一电离能的周期性变化
1.定义
某元素的气态原子失去一个电子形成+1价气态阳离子所需的最低能量,叫做该元素的第一电离能,用符号I1表示,单位:kJ·mol-1。
2.意义
(1)第一电离能可以衡量元素的 原子失去一个电子的难易程度。
(2)第一电离能数值越小,该气态原子越 失去一个电子;第一电离能数值越大,该气态原子越 失去一个电子。
气态
容易
难
3.递变规律
同主族元素 同主族元素的原子 相同,随着核电荷数的增大,原子半径逐渐 ,失电子能力逐渐 ,第一电离能逐渐
同周期元素 同一周期的主族元素具有相同的 ,随着核电荷数的递增,最外层电子数 ,原子半径逐渐 ,失电子能力逐渐 ,第一电离能呈现 的趋势。同周期元素碱金属元素第一电离能最小,稀有气体第一电离能最大
外围电子排布 通常,当原子核外电子排布在能量相等的轨道上形成 结构时,原子的能量较低,该元素具有较 的第一电离能。例如,Mg的外围电子排布为3s2,s轨道处于 状态,P的外围电子排布为3s23p3,p轨道处于 状态,因此二者,第一电离能相对较
最外层电子数
增大
增强
减小
电子层数
增加
减小
减弱
增大
全空、半充
满和全充满
大
全充满
半充满
高
4.电离能的应用
(1)根据电离能数据,确定元素核外电子的排布。如Li:I1 I2
I1越小,元素的 性越强。
非金属
金属
教材阅读 想一想自学教材“元素第一电离能的周期性变化”。
思考:为什么N的第一电离能大于O
提示 N的外围电子排布为2s22p3,p轨道处于半充满状态,原子能量较低,失去一个电子消耗能量较多;O的外围电子排布为2s22p4,失去1个电子可使p轨道达到半充满状态,因此失去1个电子较容易,导致N的第一电离能大于O。
易错辨析 判一判
(1)第3周期所含元素中钠的第一电离能最小。( )
(2)第一电离能F>Cl>Br。( )
(3)最外层电子排布式为2s22p6的原子,第一电离能较大。( )
(4)对同一元素(原子核外有3个以上电子)而言,电离能:I1>I2>I3。( )
提示 对同一元素逐级电离能逐渐增大,即:I1
√
√
×
二、元素电负性的周期性变化
1.电负性
(1)定义:元素的原子在化合物中 能力的标度。
(2)标准:指定氟的电负性为 ,并以此为标准确定其他元素的电负性。
吸引电子
4.0
2.电负性的应用
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
(2)衡量元素在化合物中吸引电子能力的大小
①电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;
②电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
(3)判断化学键类型
3.主族元素电负性的变化规律
同一 周期 主族元素的电负性从左到右依次 ,表明其吸引电子的能力逐渐 , 逐渐减弱, 逐渐增强
同一 主族 元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐 , 逐渐增强, 逐渐减弱
增大
增强
金属性
非金属性
减弱
金属性
非金属性
4.“对角线”规则
(1)含义:“对角线”规则又称斜线关系,指元素周期表中某一元素及其化合物的性质与它左上方或右下方的另一元素及其化合物性质相类似。
(2)“对角线”规则的表现
在第2、3周期中,具有典型“对角线”规则的元素有三对:锂和镁、铍和铝、硼和硅。
锂和镁的相似性:
①在氧气中燃烧生成氧化物 、 ,而其他碱金属则易生成过氧化物、超氧化物;
②能直接与氮作用,生成氮化物 、 ,而其他碱金属不与氮直接反应;
③氟化物、碳酸盐、磷酸盐都难溶于水,而其他碱金属的相应盐易溶于水等。
Li2O
MgO
Li3N
Mg3N2
铍和铝的相似性:
①单质在冷的浓硝酸中钝化;
②氧化物、氢氧化物都有 性;
③氯化物都是 化合物,易汽化,能升华,能溶于有机溶剂等。
硼和硅的相似性:
①硼和硅的密度相近;
②硼和硅的简单气态氢化物能直接被氧气氧化;
③最高价氧化物的水化物都是 酸等。
两
共价
弱
教材阅读 想一想自学教材“图2-14主族元素的电负性”。
思考:根据常见的物质分析,两成键元素的电负性差值大于1.7,它们一定形成离子键吗
提示 不一定。F的电负性为4.0,H的电负性为2.1,它们的电负性差值大于1.7,但二者形成的H—F键为共价键。
易错辨析 判一判
(1)金属元素的电负性一定大于1.8。( )
提示 金属元素的电负性一般小于1.8。
(2)同周期元素中,稀有气体的电负性数值最大。( )
提示 同周期元素中,卤族元素的电负性数值最大。
(3)根据“对角线规则”,B和Mg元素的电负性接近。( )
提示 根据“对角线规则”,B和Si元素的电负性接近。
(4)与第一电离能相比,电负性是与物质宏观性质表现关联性更强的参数。
( )
×
×
×
√
重难探究·能力素养全提升
探究一 电离能
情境探究
下表为Na、Mg、Al的电离能(kJ·mol-1)
1.为什么同一元素的电离能逐级增大
2.为什么Mg的I1大于铝的I1
提示 原子失电子时,首先失去的是能量最高的电子,故第一电离能较小,原子失去电子后变成阳离子,离子半径变小,原子核对电子的引力增强,从而使电离能逐级增大。
提示 Al原子的外围电子排布式为3s23p1,3p能级上的1个电子较易失去,而Mg原子的外围电子排布式为3s2,3s能级处于全充满状态,较难失去电子,所以Mg原子的第一电离能大于铝。
3.从电离能的角度分析为什么Na、Mg、Al的化合价分别为+1、+2、+3
提示 Na的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成+2价离子;Al的I1、I2、I3相差不多,而I3比I4小很多,所以Al容易失去三个电子形成+3价离子。
方法突破
1.影响电离能的因素
电离能的数值大小主要取决于原子的核电荷数、原子半径以及原子的核外电子排布特点。
2.逐级电离能
(1)定义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,依次类推。可以表示为
M(g)══M+(g)+e- I1(第一电离能)
M+(g)══M2+(g)+e- I2(第二电离能)
M2+(g)══M3+(g)+e- I3(第三电离能)
……
(2)变化规律
①同一元素的逐级电离能逐渐增大,即I1
②元素的逐级电离能逐渐增大并且会发生一个突变即突然增大多倍,这是由于电子是分层排布的,主族元素几乎不能失去内层电子的缘故。如Na原子的I1、I2、I3的值分别是(单位为kJ·mol-1)496、4 562、6 912,在I1和I2之间发生突变。
3.电离能的应用
电离能衡量的是原子失电子的能力,基本与元素的金属性一致
(1)用来衡量原子失去电子的难易,比较金属的活泼程度和元素的金属性。一般地,元素的第一电离能越小,金属性越强;碱金属元素的第一电离能越小,碱金属越活泼。
(2)判断原子易失去电子的数目、元素的化合价和原子核外电子排布
元素的各级电离能逐渐增大并且会发生一个突变(由于电子是分层排布的,内层电子比外层电子难于失去,因此会发生突变),如Mg原子的I1、I2、I3的值分别是(单位为kJ·mol-1)738、1 451、7 733,在I2和I3之间发生突变,则镁元素易失去最外层2个电子,则最外层电子排布为ns2,常见化合价为+2价。
应用体验
视角1 电离能的大小判断
1.[2022海南学业水平选择性考试]钠和钾是两种常见金属,下列说法正确的是( )
A.钠元素的第一电离能大于钾
B.基态钾原子外围电子轨道表示式为
C.钾能置换出NaCl溶液中的钠
D.钠元素与钾元素的原子序数相差18
A
解析 同一主族元素的第一电离能从上到下依次减小,金属性越强的元素,其第一电离能越小,因此,钠元素的第一电离能大于钾,A说法正确;基态钾原子外围电子排布为4s1,其轨道表示式为 ,B说法不正确;钾和钠均能与水发生反应产生氢气,因此钾不能置换出NaCl溶液中的钠,C说法不正确;钠元素与钾元素的原子序数分别为11和19,两者相差8,D说法不正确。
2.下列四种元素中,第一电离能由大到小顺序正确的是( )
①原子含有未成对电子最多的第2周期元素
②原子核外电子排布为1s2的元素
③元素周期表中非金属性最强的元素
④原子最外层电子排布为2s22p4的元素
A.②③①④ B.③①④②
C.①③④② D.②③④①
A
解析 根据题意可知①为N元素、②为He元素、③为F元素、④为O元素。He为稀有气体元素,难以失去电子,第一电离能最大。同周期元素从左到右第一电离能呈增大趋势,N原子的最外层p能级为半充满结构,第一电离能大于相邻的O元素,则第一电离能由大到小的顺序为②③①④。
3.具有下列外围电子排布式的元素中,第一电离能最小的是( )
A.ns2np3
B.ns2np4
C.ns2np5
D.ns2np6
B
解析 ns2np3的p轨道为半充满稳定结构,第一电离能为ns2np3>ns2np4,对于题给四个选项,其第一电离能由小到大顺序为ns2np4
书写原子的外围电子排布式,分析其外围电子结构,若具有半充满或全充满的结构,则失去一个电子消耗能量较多,电离能较大。
视角2 电离能数值的应用
4.[2023河北唐山开滦第一中学期末]已知X、Y是主族元素,表中数据I1~I4为逐级电离能(单位为kJ·mol-1)。下列说法错误的是( )
元素 I1 I2 I3 I4
X 500 4 600 6 900 9 500
Y 580 1 800 2 700 11 600
A.元素Y是ⅢA族元素
B.X单质还原性比Y的强
C.元素X的常见化合价是+1价
D.若元素Y处于第3周期,其单质可与冷水剧烈反应
D
解析 X的第二电离能与第一电离能相差较大,则说明X原子核外最外层有1个电子,则X属于ⅠA族元素;Y的第三电离能和第四电离能相差较大,说明Y原子核外最外层有3个电子,则Y是ⅢA族元素。元素Y是ⅢA族元素,A正确;X第一电离能较小,失电子能力更强,即X单质的还原性强于Y的,B正确;X为ⅠA族元素,则其常见化合价为+1价,C正确;如果Y是第3周期元素,最外层有3个电子,则Y为Al,单质Al与冷水不反应,故D错误。
5.某主族元素X的逐级电离能如图所示,下列说法正确的是( )
A.X元素显+4价 B.X为非金属元素
C.X为第5周期元素 D.X与氯气反应时最可能生成的阳离子为X3+
D
解析 由题图可知,该元素的I4 I3,故该元素易形成+3价阳离子,X可为金属,故A、B错误;周期数=核外电子层数,根据图中信息无法确定X原子有多少电子层,因此不能确定该元素是否位于第5周期,故C错误;由题图可知,该元素易形成+3价阳离子,因此X与氯反应时最可能生成的阳离子为X3+,故D正确。
探究二 电负性
情境探究
雄与雌,一般是指有生命体的性别,
我们把类似的矿物分为雄与雌却是
极少的。雄黄与雌黄是共生矿物,
有“矿物鸳鸯”的说法,其化学式分
别为As4S4、As2S3。古时写字用黄纸,写错了就用雌黄
涂抹后重写。因此,在汉语环境中,雌黄有篡改文章的
意思,并且有着“胡说八道”的引申义,如成语“信口雌黄”。
硫元素与砷元素在元素周期表中的相对位置及电负性数
值如图。
1.试写出硫原子与砷原子的外围电子排布式。
2.根据硫元素与砷元素的电负性判断As2S3中元素化合价的正负及化学键类型。
3.根据电负性的递变规律来看,Se的电负性可能是( )
A.1.8 B.3.0 C.2.4
提示 硫原子与砷原子的外围电子排布式分别为3s23p4、4s24p3。
提示 As2S3中的S元素的电负性大于As,因此S元素显负价,As元素显正价;由于两元素的电负性差值小于1.7,因此两元素形成的化学键为共价键。
提示 根据元素电负性的递变规律可以知道,Se元素的电负性应大于As,而小于S,应该在2.0~2.5范围内,因此C项正确。
C
方法突破
比较元素电负性大小的方法
(1)根据元素周期表
(2)非金属元素的电负性一般比金属元素的电负性大。
(3)二元化合物中,显负价的元素的电负性更大。
应用体验
视角1 电负性数值的应用
1.已知七种元素H、O、S、N、Al、Cl、Si的电负性分别为2.1、3.5、2.5、3.0、1.5、3.0、1.8。一般认为,如果两种成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果成键元素间的电负性差值小于1.7,通常形
成共价键。某有机化合物A的结构简式为 ,下列有关说法正确的是( )
A.A中S和O的共用电子对偏向S
B.A中S和N的共用电子对偏向N
C.AlCl3、AlN和Al2S3都是离子化合物
D.在化合物H2S、NH3和SiH4中,H的化合价都是+1价
B
解析 元素的电负性越大,元素原子对键合电子的吸引力越大;电负性越小,元素原子对键合电子的吸引力越小。由于S元素的电负性小于O和N元素的电负性,因此S和O的共用电子对偏向O,S和N的共用电子对偏向N,A项错误,B项正确。AlCl3中Al和Cl的电负性差值为1.5,小于1.7,因此Al和Cl之间的化学键是共价键,AlCl3是共价化合物,同理可知AlN和Al2S3都是共价化合物,C项错误。N、S的电负性大于H的电负性,则在H2S和NH3中H为+1价;Si元素的电负性小于H元素的电负性,因此在SiH4中H为-1价,D项错误。
【变式设问】
在CH4分子中,碳显-4价,试判断C、Si、H电负性的大小顺序。
提示 电负性由大到小的顺序为C>H>Si。
2.用电负性数据不能判断的是( )
A.某元素是金属元素还是非金属元素
B.氢化物HY和HX中键的极性强弱
C.化学键是离子键还是共价键
D.化合物的溶解度
D
解析 一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,利用电负性可以判断元素是金属元素还是非金属元素,故A不符合。电负性越大的原子对键合电子的吸引力越强,即该原子与氢原子形成的化合物中键的极性越强,可以利用电负性判断氢化物HY和HX中键的极性强弱,故B不符合。一般来说电负性差值小于1.7的两种元素的原子之间形成共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物,可以依据电负性数据判断化学键是离子键还是共价键,故C不符合。利用电负性不能判断物质的溶解度,故D符合。
视角2 电负性大小的判断
3.[2023河北高二2月联考]在常用退烧药中,对乙酰氨基酚(结构简式如图所示)是目前应用最广泛的OTC类药品之一,关于其分子结构中涉及的元素,下列说法错误的是( )
A.N2的电子式:N N
B.O2-的结构示意图:
C.第一电离能:N>O>C
D.电负性:O>N>C>H
A
4.X、Y均为非金属元素,不能说明X的电负性比Y的电负性大的是( )
A.X单质比Y单质容易与H2化合
B.X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强
C.X原子的最外层电子数比Y原子的最外层电子数多
D.X单质可以把Y从其氢化物中置换出来
C
解析 A、B、D三项均能说明X的非金属性比Y的强。C中原子的最外层电子数不能决定元素得失电子的能力。
5.下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4
B.1s22s22p63s23p3
C.1s22s22p63s23p2
D.1s22s22p63s23p64s2
A
解析 A、B、C、D四种元素分别为O、P、Si、Ca,电负性最大的是氧。
6.Ⅰ.自1869年门捷列夫给出第一张元素周期表以来,至少出现过700多种不同形式的周期表。1905年,瑞士化学家维尔纳根据元素周期律将当时发现的元素进行排列,制成了众所周知的维尔纳长式元素周期表。这种元素周期表是针对化学课程的需求而制作的,具有很强的科学性和系统性。当前应用最多的就是这张维尔纳长式周期表,根据元素在周期表中的位置,分析元素的性质。
(1)在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 。
(2)在元素周期表中,电负性最大的元素是 ,电负性最小的元素是
(放射性元素除外)。
(3)最活泼的金属元素是 (放射性元素除外)。
(4)最活泼的非金属元素是 。
(5)第2、3、4周期元素中p轨道半充满的原子是 。
Ⅱ.下面给出15种元素的电负性
元素 Al B Be C Cl F Li Mg N Na O P S Si H
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8 2.1
已知:一般来说,两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是 。
(2)判断下列物质是离子化合物还是共价化合物:
Mg3N2 ,BeCl2 ,AlCl3 ,SiC 。
答案 Ⅰ.(1)Na Ar (2)F Cs (3)Cs (4)F (5)N、P、As
Ⅱ.(1)随原子序数的递增,元素的电负性呈周期性变化
(2)离子化合物 共价化合物 共价化合物 共价化合物
解析 Ⅰ.一般来说,同周期从左到右,元素的第一电离能呈逐渐增大的趋势(除ⅡA族、ⅤA族元素反常外),同周期中碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大,故第3周期中第一电离能最小的元素为Na,最大的元素为Ar。电负性的递变规律:一般来说,同周期从左到右元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,故周期表中,电负性最大的元素是F,电负性最小的元素是Cs。
Ⅱ.(1)把表中元素按原子序数递增的顺序排序,然后对应写出它们的电负性数值,从Li→F电负性增大,到Na时电负性又突然变小,从Na→Cl又逐渐增大,所以随着原子序数的递增,元素的电负性呈周期性变化。
(2)根据已知条件及表中数值,Mg3N2中两元素电负性差值为1.8,大于1.7,形成离子键,为离子化合物;BeCl2、AlCl3、SiC中两元素电负性差值分别为1.5、1.5、0.7,均小于1.7,形成共价键,为共价化合物。
本 课 结 束
