3.1.1 金属键与金属特性 课件 (共23张PPT)2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 3.1.1 金属键与金属特性 课件 (共23张PPT)2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
专题3 微粒间作用力与物质性质
第一单元 第1课时 金属键与金属特性
素 养 目 标
了解金属晶体中金属键的成键特征,能用金属键理论解释金属的典型性质。能从微观角度分析金属晶体中的构成微粒及微粒之间的相互作用,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
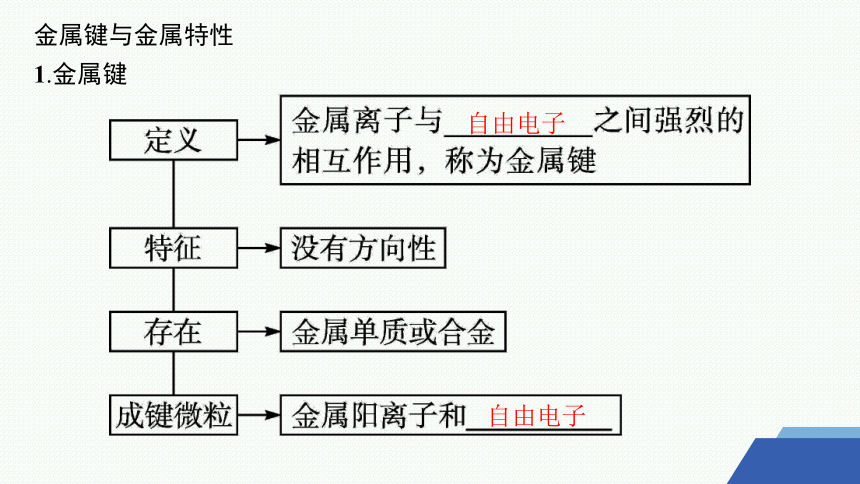
金属键与金属特性
1.金属键
自由电子
自由电子
2.金属的物理性质
3.金属键的强弱对金属性质的影响
(1)金属键的强弱比较:金属键的强弱主要取决于金属元素的原子半径和单位体积内自由电子的数目,一般而言,原子半径越 ,单位体积内自由电子的数目越 ,金属键越强。
(2)金属键对金属性质的影响
并非所有金属的熔点都较高,如汞在常温下为液体,熔点很低,为-38.9 ℃
金属键越强,金属熔、沸点越高,硬度越大;金属键越强,金属元素原子越难失电子。
小
多
教材阅读 想一想阅读教材“交流讨论”。
思考:“金属的原子化热是指1 mol金属固体完全气化成相互远离的气态原子时吸收的能量”,原子化热的大小与金属键有何联系
提示 金属的原子化热数值越大,金属键越强。
易错辨析 判一判
(1)金箔是用黄金制成的薄片。黄金具有良好的延展性和可塑性,31.25克纯金可制成万分之一毫米厚、面积约为16.2平方米的金箔。黄金制成金箔的过程中金属键没有被破坏。( )
(2)碱金属单质的熔、沸点随原子序数的增大而减小,是因为金属阳离子半径随原子序数的增大逐渐变大,金属键减弱。( )
(3)常温下,金属单质都以金属晶体的形式存在。( )
提示 金属汞常温下呈液态。
(4)金属键的强弱影响金属单质的熔点和硬度。( )
√
√
×
√
重难探究·能力素养全提升
探究 金属键与金属性质
情境探究
某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线。当玻璃被击碎时,与金属线相连的警报系统就会立即报警。
1.“防盗玻璃”能报警是利用了金属的什么性质 金属具有这种性质的原理是什么
2.金属线中含有哪种化学键
3.金属在拉成金属线的过程中化学键被破坏了吗
提示 利用了金属的导电性。金属导电的原理是金属晶体中的自由电子在外加电场作用下发生定向移动。
提示 金属键。
提示 金属在拉成金属线的过程中,金属原子之间发生相对滑动,但金属键不会断裂,故金属具有良好的延展性。
方法突破
1.金属的结构和性质的关系
2.金属性质的递变规律
应用体验
视角1 金属键与金属通性
1.金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
B
解析 在外电场作用下,自由电子在金属内部会发生定向移动,从而形成电流,所以金属具有导电性。
2.金属具有的通性是( )
①具有良好的导电性 ②具有良好的导热性 ③具有延展性 ④都具有较高的熔点 ⑤都是固体 ⑥都具有很大的硬度
A.①②③ B.②④⑥
C.④⑤⑥ D.①③⑤
A
解析 金属并不一定具有较高的熔点,汞在常温下是液态,钠、钾等的硬度都不大,所以④⑤⑥均错误。
3.下列关于金属键的叙述不正确的是( )
A.金属键的实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,有方向性和饱和性
C.金属键无饱和性和方向性
D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动
B
解析 从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用;自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键无方向性和饱和性。
4.物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽。请在下面金属用途后的横线上填上金属主要性质对应的序号。(每空限选一个)
(1)用铝锭制成包装用的铝箔: 。
(2)用铝制成的高压铝锅: 。
(3)用铁粉回收照相业废液中的银: 。
(4)电信业中大量使用的金属电缆: 。
④
①
③
②
视角2 金属性质的比较
5.物质结构理论指出:金属晶体中金属离子与“自由电子”之间存在的强的相互作用叫金属键。金属键越强,金属的硬度越大,熔、沸点越高,且据研究表明,一般来说,金属原子半径越小,价电子数目越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝 B.镁的熔、沸点低于钙
C.镁的硬度大于钾 D.钙的熔、沸点高于钾
B
解析 根据规律,原子半径Mg>Al,价电子数目MgCa,B说法错误;原子半径MgK,因此硬度Mg>K,C说法正确;原子半径CaK,因此熔、沸点Ca>K,D说法正确。
考题点睛
【变式设问】
(1)金属铝的硬度和金属钠的硬度哪个大
(2)碱金属单质的熔、沸点从Li到Cs是怎样变化的
提示 金属铝。金属铝的原子半径小于金属钠,价电子数目比金属钠多,则金属铝的金属键强。所以金属铝的硬度大于金属钠的硬度。
提示 从Li到Cs原子半径逐渐增大,金属键逐渐减弱,熔、沸点逐渐降低。
6.铝的熔点比镁高的原因是( )
A.镁比铝活泼
B.铝的化合价比镁高
C.铝的价电子数比镁多、原子半径比镁小
D.铝能与酸或碱反应
C
解析 铝和镁均为金属,金属的熔点与金属键的强弱有关,铝与镁比较,原子半径比镁小,价电子数比镁多,故金属键也比镁的强,则熔点比镁高,C项正确。
本 课 结 束
专题3 微粒间作用力与物质性质
第一单元 第1课时 金属键与金属特性
素 养 目 标
了解金属晶体中金属键的成键特征,能用金属键理论解释金属的典型性质。能从微观角度分析金属晶体中的构成微粒及微粒之间的相互作用,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
金属键与金属特性
1.金属键
自由电子
自由电子
2.金属的物理性质
3.金属键的强弱对金属性质的影响
(1)金属键的强弱比较:金属键的强弱主要取决于金属元素的原子半径和单位体积内自由电子的数目,一般而言,原子半径越 ,单位体积内自由电子的数目越 ,金属键越强。
(2)金属键对金属性质的影响
并非所有金属的熔点都较高,如汞在常温下为液体,熔点很低,为-38.9 ℃
金属键越强,金属熔、沸点越高,硬度越大;金属键越强,金属元素原子越难失电子。
小
多
教材阅读 想一想阅读教材“交流讨论”。
思考:“金属的原子化热是指1 mol金属固体完全气化成相互远离的气态原子时吸收的能量”,原子化热的大小与金属键有何联系
提示 金属的原子化热数值越大,金属键越强。
易错辨析 判一判
(1)金箔是用黄金制成的薄片。黄金具有良好的延展性和可塑性,31.25克纯金可制成万分之一毫米厚、面积约为16.2平方米的金箔。黄金制成金箔的过程中金属键没有被破坏。( )
(2)碱金属单质的熔、沸点随原子序数的增大而减小,是因为金属阳离子半径随原子序数的增大逐渐变大,金属键减弱。( )
(3)常温下,金属单质都以金属晶体的形式存在。( )
提示 金属汞常温下呈液态。
(4)金属键的强弱影响金属单质的熔点和硬度。( )
√
√
×
√
重难探究·能力素养全提升
探究 金属键与金属性质
情境探究
某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线。当玻璃被击碎时,与金属线相连的警报系统就会立即报警。
1.“防盗玻璃”能报警是利用了金属的什么性质 金属具有这种性质的原理是什么
2.金属线中含有哪种化学键
3.金属在拉成金属线的过程中化学键被破坏了吗
提示 利用了金属的导电性。金属导电的原理是金属晶体中的自由电子在外加电场作用下发生定向移动。
提示 金属键。
提示 金属在拉成金属线的过程中,金属原子之间发生相对滑动,但金属键不会断裂,故金属具有良好的延展性。
方法突破
1.金属的结构和性质的关系
2.金属性质的递变规律
应用体验
视角1 金属键与金属通性
1.金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
B
解析 在外电场作用下,自由电子在金属内部会发生定向移动,从而形成电流,所以金属具有导电性。
2.金属具有的通性是( )
①具有良好的导电性 ②具有良好的导热性 ③具有延展性 ④都具有较高的熔点 ⑤都是固体 ⑥都具有很大的硬度
A.①②③ B.②④⑥
C.④⑤⑥ D.①③⑤
A
解析 金属并不一定具有较高的熔点,汞在常温下是液态,钠、钾等的硬度都不大,所以④⑤⑥均错误。
3.下列关于金属键的叙述不正确的是( )
A.金属键的实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,有方向性和饱和性
C.金属键无饱和性和方向性
D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动
B
解析 从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用;自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键无方向性和饱和性。
4.物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽。请在下面金属用途后的横线上填上金属主要性质对应的序号。(每空限选一个)
(1)用铝锭制成包装用的铝箔: 。
(2)用铝制成的高压铝锅: 。
(3)用铁粉回收照相业废液中的银: 。
(4)电信业中大量使用的金属电缆: 。
④
①
③
②
视角2 金属性质的比较
5.物质结构理论指出:金属晶体中金属离子与“自由电子”之间存在的强的相互作用叫金属键。金属键越强,金属的硬度越大,熔、沸点越高,且据研究表明,一般来说,金属原子半径越小,价电子数目越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝 B.镁的熔、沸点低于钙
C.镁的硬度大于钾 D.钙的熔、沸点高于钾
B
解析 根据规律,原子半径Mg>Al,价电子数目Mg
考题点睛
【变式设问】
(1)金属铝的硬度和金属钠的硬度哪个大
(2)碱金属单质的熔、沸点从Li到Cs是怎样变化的
提示 金属铝。金属铝的原子半径小于金属钠,价电子数目比金属钠多,则金属铝的金属键强。所以金属铝的硬度大于金属钠的硬度。
提示 从Li到Cs原子半径逐渐增大,金属键逐渐减弱,熔、沸点逐渐降低。
6.铝的熔点比镁高的原因是( )
A.镁比铝活泼
B.铝的化合价比镁高
C.铝的价电子数比镁多、原子半径比镁小
D.铝能与酸或碱反应
C
解析 铝和镁均为金属,金属的熔点与金属键的强弱有关,铝与镁比较,原子半径比镁小,价电子数比镁多,故金属键也比镁的强,则熔点比镁高,C项正确。
本 课 结 束
