3.3.2 共价键键能与化学反应的反应热 共价晶体 课件(共39张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 3.3.2 共价键键能与化学反应的反应热 共价晶体 课件(共39张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览










文档简介
(共39张PPT)
专题3 微粒间作用力与物质性质
第三单元 第2课时 共价键键能与化学反应的反应热 共价晶体
素 养 目 标
1.认识键能、键长等键参数的概念。能用键能、键长等说明简单分子的某些性质,会利用键能比较共价键的强弱和分子的稳定性,会利用键能计算化学反应的反应热,培养宏观辨识与微观探析的化学核心素养。
2.认识共价晶体中的微粒及其微粒之间的相互作用,借助金刚石模型认识共价晶体的结构特点及物理性质,学会比较共价晶体的熔、沸点及硬度大小,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、共价键键能与化学反应的反应热
1.共价键的键能
(1)定义
共价键的键能是指在101 kPa、298 K条件下,_________________________
的过程中所 的能量,称为AB间共价键的键能。其单位为kJ·mol-1。如101 kPa、298 K条件下,使1 mol H2离解成2 mol气态氢原子时需要吸收436 kJ的能量,即H—H键的键能为
。
(2)与物质稳定性的关系
键能越大→共价键越 →共价分子越 。
1 mol气态AB分子生成1 mol
气态A原子和1 mol气态B原子
吸收
436 kJ·mol-1
牢固
稳定
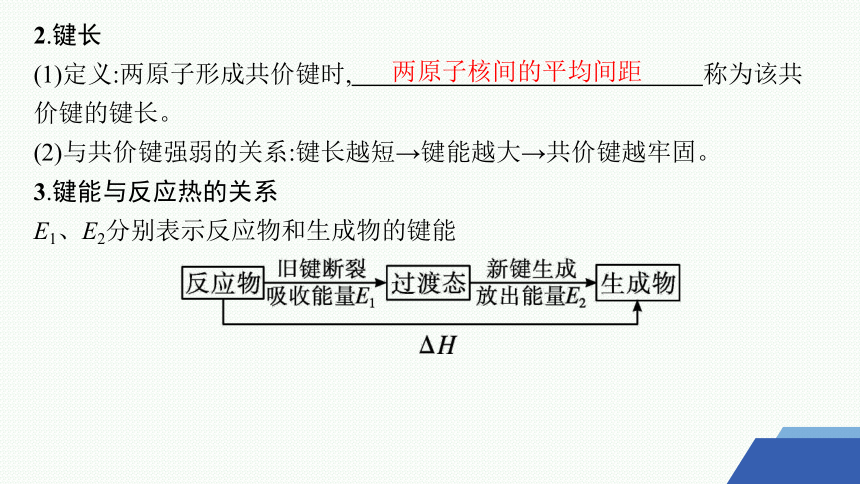
2.键长
(1)定义:两原子形成共价键时, 称为该共价键的键长。
(2)与共价键强弱的关系:键长越短→键能越大→共价键越牢固。
3.键能与反应热的关系
E1、E2分别表示反应物和生成物的键能
两原子核间的平均间距
教材阅读 想一想阅读教材“表3-4 部分共价键的键长和键能”。
思考:根据HF、HCl、HBr、HI的键长和键能数据,思考键长、键能与分子稳定性有何关系
提示 HF、HCl、HBr、HI的键长逐渐增大,键能依次减小,四种分子的稳定性依次减弱,即HF分子很稳定,难分解,HI分子不稳定,易分解。即分子中键长越短,键能越大,共价键越牢固,分子越稳定。
易错辨析 判一判
(1)在分子中,两个原子间的距离叫键长。( )
提示 形成共价键的两个原子核间的平均间距为键长。
(2)非极性键的键能大于极性键的键能。( )
提示 键能的大小取决于成键原子的半径和共用电子对数,与键的极性无必然联系。
(3)结构相似的分子中键能越大,键越牢固,该分子越稳定。( )
(4)键长与成键原子的半径和成键数目有关。( )
×
×
√
√
二、共价晶体
定义 所有原子通过 结合,形成 结构,这样的晶体叫共价晶体
常见的共 价晶体 (1)单质:金刚石、晶体硅、晶体硼、晶体Ge等;
(2)化合物:金刚砂(SiC)、 、氮化硼(BN)、氮化铝(AlN)等
性质 共价晶体一般有 的熔点、沸点和 的硬度
共价晶体 的性质比较 结构相似的共价晶体,共价键的键长越长,键能越 ,晶体的熔、沸点越 ,硬度越
共价键
空间网状
二氧化硅(SiO2)
很高
很大
小
低
小
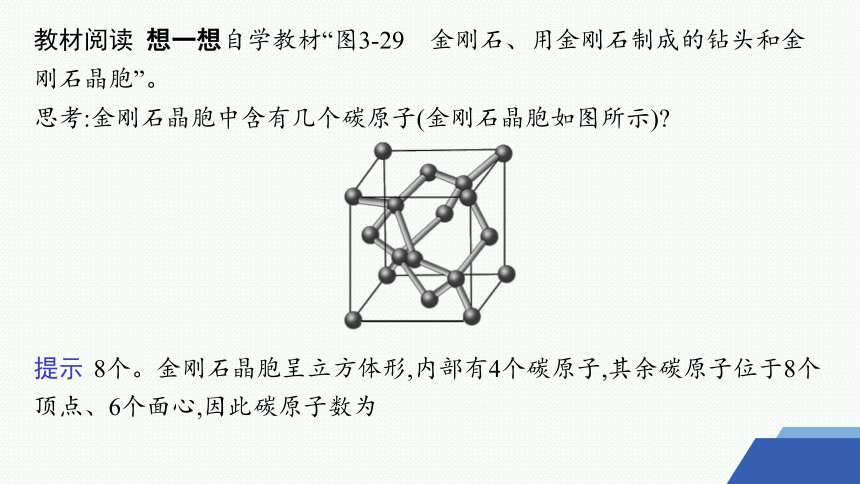
教材阅读 想一想自学教材“图3-29 金刚石、用金刚石制成的钻头和金刚石晶胞”。
思考:金刚石晶胞中含有几个碳原子(金刚石晶胞如图所示)
提示 8个。金刚石晶胞呈立方体形,内部有4个碳原子,其余碳原子位于8个顶点、6个面心,因此碳原子数为
易错辨析 判一判
(1)“SiO2”是二氧化硅的分子式。( )
提示 SiO2为共价晶体,共价晶体中无分子存在。
(2)金属晶体的熔点不一定比共价晶体低。( )
(3)具有共价键的晶体叫做共价晶体。( )
提示 如HCl、H2O、CO2、CH3CH2OH分子中都有共价键,但它们都不是共价晶体;再如NaOH、Na2O2中既含有共价键又含有离子键,属于离子晶体。
×
√
×
重难探究·能力素养全提升
探究一 键能、键长与化学反应的反应热
情境探究
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
1.通常条件下,CH4和SiH4的稳定性有怎样的关系
2.硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是什么
3.SiH4比CH4更易与O2反应,具有一定浓度的硅烷在-180 ℃的温度下也会与氧发生爆炸反应生成氧化物,原因是什么
提示 因为C—H键的键能大于Si—H键的键能,所以CH4比SiH4稳定。
提示 C—C键和C—H键的键能比Si—Si键和Si—H键的键能都大,因此烷烃比较稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
提示 C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能却小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
方法突破
1.键能和键长的应用
2.键长的比较方法
应用体验
视角1 键参数对物质性质的影响
1.[2021河北学业水平选择性考试]已知有关氮、磷的单键和三键的键能(kJ·mol-1)如下表:
从能量角度看,氮以N2、白磷以P4(结构式可表示为 )形式存在的原因是 。
答案 1个N≡N键的键能大于3个N—N键的键能之和,而6个P—P键的键能之和大于2个P≡P键的键能之和
解析 根据题给键能数据,可知1个N≡N键的键能大于3个N—N键的键能之和,因此氮以N2形式存在,而6个P—P键的键能之和大于2个P≡P键的键能之和,因此白磷以P4形式存在。
【变式设问】
(1)元素的非金属性N>P,为什么N2的化学性质非常稳定,而白磷P4的化学性质非常活泼。请分析原因。
(2)根据元素周期律可知,NH3的稳定性强于PH3,你能利用键参数进行解释吗
提示 N2分子中存在N≡N键,该键键能大,破坏该共价键需要很大的能量;而P4分子中的P—P键的键能较小,破坏该共价键所需能量较小。
提示 N原子的半径比P原子的半径小,故键长N—H键比P—H键小,则N—H键的键能比P—H键的键能大,N—H键更难被破坏,NH3更稳定。
2.已知H—H键的键能为436 kJ·mol-1,O═O键的键能为498 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,N≡N键的键能为946 kJ·mol-1,则下列叙述正确的是( )
A.N—N键的键能为 ×946 kJ·mol-1≈315.3 kJ·mol-1
B.氮气分子中的共价键的键长比氢气分子中的短
C.氧气分子中氧原子是以共价单键结合的
D.氮气分子比氯气分子稳定
D
解析 N—N键的键能并不是N≡N键键能的 ,故A项错误;共价键的键长和成键原子的半径有关,由于原子半径r(H)3.下列说法正确的是( )
A.键能越大,表示该分子越容易受热分解
B.共价键都具有方向性
C.在分子中,两个成键的原子间的距离叫键长
D.H—Cl键的键能为431 kJ·mol-1,H—Br键的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
D
解析 键能越大,分子越稳定,A错误、D正确;s-s σ键没有方向性,B错误;形成共价键的两个原子之间的核间的平均间距叫键长,C错误。
视角2 键能与化学反应的反应热
4.白磷与氧气可发生反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为P—P:a kJ·mol-1、P—O:b kJ·mol-1、P═O:c kJ·mol-1、O═O:d kJ·mol-1。根据如图所示分子结构和有关数据计算1 mol白磷与足量氧气反应放出的热量,
其中正确的是( )
A.(6a+5d-4c-12b) kJ
B.(4c+12b-6a-5d) kJ
C.(4c+12b-4a-5d) kJ
D.(4a+5d-4c-12b) kJ
B
解析 化学反应的实质是反应物中化学键的断裂和生成物中化学键的形成。依据键能的数据可以计算化学反应的热效应,即ΔH=反应物的键能总和-生成物的键能总和。根据反应P4+5O2 P4O10,并结合物质的分子结构可知,1个白磷分子中含有6个P—P键,1个氧气分子中含有1个O═O键,1个P4O10分子中含有4个P═O键和12个P—O键,因此该反应的ΔH=(6a+5d-4c-12b) kJ·mol-1,由于该反应为放热反应,ΔH为负值,故1 mol白磷反应放出的热量为(4c+12b-6a-5d) kJ。
易错提醒 根据键能计算焓变时,首先要正确理解物质的结构,正确计算物质中所含有的化学键数目,像本题中1 mol P4含有6 mol P—P键而不是4 mol。
白磷的燃烧为放热反应,要计算1 mol白磷燃烧放出的热量,切勿当成计算ΔH。
5.表中列出部分化学键的键能:
据此判断下列说法正确的是( )
A.表中最稳定的共价键是Si—Si键
B.Cl2(g)→2Cl(g) ΔH=-243 kJ·mol-1
C.H2(g)+Cl2(g)══2HCl(g) ΔH=-183 kJ·mol-1
D.根据表中数据能计算出SiCl4(g)+2H2(g)══Si(s)+4HCl(l)的ΔH
C
解析 键能越大形成的化学键越稳定,表中键能最大的是Si—O键,则最稳定的共价键是Si—O键,A错误;101 kPa、298 K条件下,1 mol氯气变为氯原子吸收的能量即Cl—Cl键的键能,B错误;依据键能计算反应焓变=反应物键能总和-生成物键能总和,则H2(g)+Cl2(g)══2HCl(g) ΔH=436 kJ·mol-1+ 243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,C正确;HCl(g)══HCl(l)的ΔH未告知,故无法计算SiCl4(g)+2H2(g)══Si(s)+4HCl(l)的ΔH,D错误。
探究二 常见共价晶体的结构
情境探究
1950年,沅水流域发现了湖南首个具有经济价值的钻石砂矿,虽然产量不高,但产出金刚石品位极高。收藏于湖南省地质博物馆的镇馆之宝——沅水金刚石,就来自湖南沅水流域。沅水金刚石重达13.58 ct,为淡黄色宝石级钻石原石。沅水金刚石的意义远不止于稀有宝石的名贵。1979年,国防科技大学学生潘存云,主动将这颗作为传家宝的钻石原石上交至地质局,希望以此推动国家找矿力度,在湖南勘探出大型金刚石矿。二十世纪八十年代后,沅水流域陆续发现数颗20 ct以上的金刚石。
随着全球气候的变暖,环境污染已成为全世界关注的问题,从传统能源向可再生能源的转变势在必行,其中太阳能作为可再生能源的重要部分,目前已经得到了很广泛的应用。晶体硅太阳能电池是目前多种太阳能电池中技术最为成熟、光电转换效率最高、应用最广泛的一种。
上面涉及的金刚石和晶体硅两种晶体结构相似,金刚石的熔点明显高于晶体硅。
1.为什么金刚石的熔点高于晶体硅
2.根据金刚石的结构分析,晶体硅中的最小环为几元环 晶体硅中1 mol Si形成几摩尔Si—Si键
3.SiO2晶体可看作在晶体硅中每两个硅原子间加入一个氧原子形成,则SiO2中最小的环为几元环 1 mol SiO2中含有几摩尔Si—O键
提示 金刚石和晶体硅都是共价晶体,构成金刚石的碳原子半径比构成晶体硅的硅原子半径小,则两晶体中碳碳键键长小于硅硅键,碳碳键键能大于硅硅键,因此金刚石熔点高于晶体硅。
提示 晶体硅中最小环为六元环。晶体硅中1 mol Si形成2 mol Si—Si键。
提示 SiO2晶体中最小环为12元环。1 mol SiO2中含有4 mol Si—O键。
方法突破
1.金刚石和SiO2晶体结构的比较
共价 晶体 金刚石 若以Si代替金刚石中的C即得晶体硅 SiO2晶体
结构 特点 每个碳原子以共价键与相邻的4个碳原子相结合,成为正四面体; C—C—C夹角为109°28' 硅原子和氧原子交替排列,只有Si—O键,即1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键
最小环 原子数 6个碳原子 每个碳原子为12个六元环所共有 6个硅原子和6个氧原子组成十二元环
2.金刚石晶胞结构
金刚石晶胞中碳原子位置:8个顶点、6个面心(面心立方堆积),还有4个在内部。若把上面的晶胞分成8个相同的小立方体,则小立方体的8个顶点只有一半含有碳原子,即4个碳原子,这4个碳原子构成正四面体结构。在8个小立方体(碳原子连成的正四面体)中心有一半含有碳原子,即内部有4个碳原子。
每个金刚石晶胞中含有8个碳原子。
3.解共价晶体类题目的注意事项
(1)共价晶体中一定存在共价键,但含有共价键的晶体不一定是共价晶体,只有原子间的共价键形成空间网状结构时才形成共价晶体。
(2)共价晶体中,构成晶体的微粒为原子,原子间连接形成空间网状结构,晶体中不存在单个分子,共价晶体的化学式仅表示物质中的原子个数的比例关系,不是分子式。
(3)共价晶体中的共价键具有饱和性和方向性,
原子间不是紧密堆积原则,而是较松散排列的结构。
应用体验
视角1 共价晶体的特点
1.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体:①金刚石 ②晶体硅
③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
A
解析 题给三种晶体都属于共价晶体,而且结构相似,晶体的熔点由微粒间的共价键强弱决定,这里的共价键强弱可根据键长确定,键长可以看作是成键原子的半径之和,由于硅原子半径大于碳原子,所以键的强弱为C—C>C—Si>Si—Si,则熔点从高到低的顺序为金刚石>碳化硅>晶体硅。
视角2 共价晶体的结构
2.二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅晶体的下列说法中不正确的是( )
A.晶体中Si、O原子个数比为1∶4
B.晶体中Si、O原子最外层都满足8电子结构
C.晶体中一个硅原子形成Si—O键数目为4
D.晶体中最小环上的原子数为12
A
解析 由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为1∶2,A错误;硅原子最外层有4个电子,在晶体中硅原子形成4个共用电子对,氧原子最外层有6个电子,形成2个共用电子对,这样两种原子都满足8电子结构,B正确;依据二氧化硅晶体结构图可知1个硅原子与4个氧原子形成4个Si—O键,C正确;由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D正确。
3.(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为 ;在SiC中,每个C原子周围距离最近的C原子数目为 ;若晶胞的边长为a pm,则金刚砂的密度表达式为 。
(2)硅的某种单质的晶胞如图乙所示。GaN晶体晶胞结构与该硅晶体相似。则GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为 。
解析 (1)金刚砂(SiC)的硬度为9.5,硬度大,属于共价晶体;每个碳原子连接4个硅原子,每个硅原子连接4个碳原子,碳原子呈面心立方堆积(硅原子也呈面心立方堆积),所以每个碳原子周围距离最近的碳原子数目为12;
(2)根据硅晶体结构可知,在GaN晶体中,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为正四面体,其实GaN晶胞与SiC晶胞相似。
本 课 结 束
专题3 微粒间作用力与物质性质
第三单元 第2课时 共价键键能与化学反应的反应热 共价晶体
素 养 目 标
1.认识键能、键长等键参数的概念。能用键能、键长等说明简单分子的某些性质,会利用键能比较共价键的强弱和分子的稳定性,会利用键能计算化学反应的反应热,培养宏观辨识与微观探析的化学核心素养。
2.认识共价晶体中的微粒及其微粒之间的相互作用,借助金刚石模型认识共价晶体的结构特点及物理性质,学会比较共价晶体的熔、沸点及硬度大小,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、共价键键能与化学反应的反应热
1.共价键的键能
(1)定义
共价键的键能是指在101 kPa、298 K条件下,_________________________
的过程中所 的能量,称为AB间共价键的键能。其单位为kJ·mol-1。如101 kPa、298 K条件下,使1 mol H2离解成2 mol气态氢原子时需要吸收436 kJ的能量,即H—H键的键能为
。
(2)与物质稳定性的关系
键能越大→共价键越 →共价分子越 。
1 mol气态AB分子生成1 mol
气态A原子和1 mol气态B原子
吸收
436 kJ·mol-1
牢固
稳定
2.键长
(1)定义:两原子形成共价键时, 称为该共价键的键长。
(2)与共价键强弱的关系:键长越短→键能越大→共价键越牢固。
3.键能与反应热的关系
E1、E2分别表示反应物和生成物的键能
两原子核间的平均间距
教材阅读 想一想阅读教材“表3-4 部分共价键的键长和键能”。
思考:根据HF、HCl、HBr、HI的键长和键能数据,思考键长、键能与分子稳定性有何关系
提示 HF、HCl、HBr、HI的键长逐渐增大,键能依次减小,四种分子的稳定性依次减弱,即HF分子很稳定,难分解,HI分子不稳定,易分解。即分子中键长越短,键能越大,共价键越牢固,分子越稳定。
易错辨析 判一判
(1)在分子中,两个原子间的距离叫键长。( )
提示 形成共价键的两个原子核间的平均间距为键长。
(2)非极性键的键能大于极性键的键能。( )
提示 键能的大小取决于成键原子的半径和共用电子对数,与键的极性无必然联系。
(3)结构相似的分子中键能越大,键越牢固,该分子越稳定。( )
(4)键长与成键原子的半径和成键数目有关。( )
×
×
√
√
二、共价晶体
定义 所有原子通过 结合,形成 结构,这样的晶体叫共价晶体
常见的共 价晶体 (1)单质:金刚石、晶体硅、晶体硼、晶体Ge等;
(2)化合物:金刚砂(SiC)、 、氮化硼(BN)、氮化铝(AlN)等
性质 共价晶体一般有 的熔点、沸点和 的硬度
共价晶体 的性质比较 结构相似的共价晶体,共价键的键长越长,键能越 ,晶体的熔、沸点越 ,硬度越
共价键
空间网状
二氧化硅(SiO2)
很高
很大
小
低
小
教材阅读 想一想自学教材“图3-29 金刚石、用金刚石制成的钻头和金刚石晶胞”。
思考:金刚石晶胞中含有几个碳原子(金刚石晶胞如图所示)
提示 8个。金刚石晶胞呈立方体形,内部有4个碳原子,其余碳原子位于8个顶点、6个面心,因此碳原子数为
易错辨析 判一判
(1)“SiO2”是二氧化硅的分子式。( )
提示 SiO2为共价晶体,共价晶体中无分子存在。
(2)金属晶体的熔点不一定比共价晶体低。( )
(3)具有共价键的晶体叫做共价晶体。( )
提示 如HCl、H2O、CO2、CH3CH2OH分子中都有共价键,但它们都不是共价晶体;再如NaOH、Na2O2中既含有共价键又含有离子键,属于离子晶体。
×
√
×
重难探究·能力素养全提升
探究一 键能、键长与化学反应的反应热
情境探究
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
1.通常条件下,CH4和SiH4的稳定性有怎样的关系
2.硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是什么
3.SiH4比CH4更易与O2反应,具有一定浓度的硅烷在-180 ℃的温度下也会与氧发生爆炸反应生成氧化物,原因是什么
提示 因为C—H键的键能大于Si—H键的键能,所以CH4比SiH4稳定。
提示 C—C键和C—H键的键能比Si—Si键和Si—H键的键能都大,因此烷烃比较稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
提示 C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能却小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
方法突破
1.键能和键长的应用
2.键长的比较方法
应用体验
视角1 键参数对物质性质的影响
1.[2021河北学业水平选择性考试]已知有关氮、磷的单键和三键的键能(kJ·mol-1)如下表:
从能量角度看,氮以N2、白磷以P4(结构式可表示为 )形式存在的原因是 。
答案 1个N≡N键的键能大于3个N—N键的键能之和,而6个P—P键的键能之和大于2个P≡P键的键能之和
解析 根据题给键能数据,可知1个N≡N键的键能大于3个N—N键的键能之和,因此氮以N2形式存在,而6个P—P键的键能之和大于2个P≡P键的键能之和,因此白磷以P4形式存在。
【变式设问】
(1)元素的非金属性N>P,为什么N2的化学性质非常稳定,而白磷P4的化学性质非常活泼。请分析原因。
(2)根据元素周期律可知,NH3的稳定性强于PH3,你能利用键参数进行解释吗
提示 N2分子中存在N≡N键,该键键能大,破坏该共价键需要很大的能量;而P4分子中的P—P键的键能较小,破坏该共价键所需能量较小。
提示 N原子的半径比P原子的半径小,故键长N—H键比P—H键小,则N—H键的键能比P—H键的键能大,N—H键更难被破坏,NH3更稳定。
2.已知H—H键的键能为436 kJ·mol-1,O═O键的键能为498 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,N≡N键的键能为946 kJ·mol-1,则下列叙述正确的是( )
A.N—N键的键能为 ×946 kJ·mol-1≈315.3 kJ·mol-1
B.氮气分子中的共价键的键长比氢气分子中的短
C.氧气分子中氧原子是以共价单键结合的
D.氮气分子比氯气分子稳定
D
解析 N—N键的键能并不是N≡N键键能的 ,故A项错误;共价键的键长和成键原子的半径有关,由于原子半径r(H)
A.键能越大,表示该分子越容易受热分解
B.共价键都具有方向性
C.在分子中,两个成键的原子间的距离叫键长
D.H—Cl键的键能为431 kJ·mol-1,H—Br键的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
D
解析 键能越大,分子越稳定,A错误、D正确;s-s σ键没有方向性,B错误;形成共价键的两个原子之间的核间的平均间距叫键长,C错误。
视角2 键能与化学反应的反应热
4.白磷与氧气可发生反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为P—P:a kJ·mol-1、P—O:b kJ·mol-1、P═O:c kJ·mol-1、O═O:d kJ·mol-1。根据如图所示分子结构和有关数据计算1 mol白磷与足量氧气反应放出的热量,
其中正确的是( )
A.(6a+5d-4c-12b) kJ
B.(4c+12b-6a-5d) kJ
C.(4c+12b-4a-5d) kJ
D.(4a+5d-4c-12b) kJ
B
解析 化学反应的实质是反应物中化学键的断裂和生成物中化学键的形成。依据键能的数据可以计算化学反应的热效应,即ΔH=反应物的键能总和-生成物的键能总和。根据反应P4+5O2 P4O10,并结合物质的分子结构可知,1个白磷分子中含有6个P—P键,1个氧气分子中含有1个O═O键,1个P4O10分子中含有4个P═O键和12个P—O键,因此该反应的ΔH=(6a+5d-4c-12b) kJ·mol-1,由于该反应为放热反应,ΔH为负值,故1 mol白磷反应放出的热量为(4c+12b-6a-5d) kJ。
易错提醒 根据键能计算焓变时,首先要正确理解物质的结构,正确计算物质中所含有的化学键数目,像本题中1 mol P4含有6 mol P—P键而不是4 mol。
白磷的燃烧为放热反应,要计算1 mol白磷燃烧放出的热量,切勿当成计算ΔH。
5.表中列出部分化学键的键能:
据此判断下列说法正确的是( )
A.表中最稳定的共价键是Si—Si键
B.Cl2(g)→2Cl(g) ΔH=-243 kJ·mol-1
C.H2(g)+Cl2(g)══2HCl(g) ΔH=-183 kJ·mol-1
D.根据表中数据能计算出SiCl4(g)+2H2(g)══Si(s)+4HCl(l)的ΔH
C
解析 键能越大形成的化学键越稳定,表中键能最大的是Si—O键,则最稳定的共价键是Si—O键,A错误;101 kPa、298 K条件下,1 mol氯气变为氯原子吸收的能量即Cl—Cl键的键能,B错误;依据键能计算反应焓变=反应物键能总和-生成物键能总和,则H2(g)+Cl2(g)══2HCl(g) ΔH=436 kJ·mol-1+ 243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,C正确;HCl(g)══HCl(l)的ΔH未告知,故无法计算SiCl4(g)+2H2(g)══Si(s)+4HCl(l)的ΔH,D错误。
探究二 常见共价晶体的结构
情境探究
1950年,沅水流域发现了湖南首个具有经济价值的钻石砂矿,虽然产量不高,但产出金刚石品位极高。收藏于湖南省地质博物馆的镇馆之宝——沅水金刚石,就来自湖南沅水流域。沅水金刚石重达13.58 ct,为淡黄色宝石级钻石原石。沅水金刚石的意义远不止于稀有宝石的名贵。1979年,国防科技大学学生潘存云,主动将这颗作为传家宝的钻石原石上交至地质局,希望以此推动国家找矿力度,在湖南勘探出大型金刚石矿。二十世纪八十年代后,沅水流域陆续发现数颗20 ct以上的金刚石。
随着全球气候的变暖,环境污染已成为全世界关注的问题,从传统能源向可再生能源的转变势在必行,其中太阳能作为可再生能源的重要部分,目前已经得到了很广泛的应用。晶体硅太阳能电池是目前多种太阳能电池中技术最为成熟、光电转换效率最高、应用最广泛的一种。
上面涉及的金刚石和晶体硅两种晶体结构相似,金刚石的熔点明显高于晶体硅。
1.为什么金刚石的熔点高于晶体硅
2.根据金刚石的结构分析,晶体硅中的最小环为几元环 晶体硅中1 mol Si形成几摩尔Si—Si键
3.SiO2晶体可看作在晶体硅中每两个硅原子间加入一个氧原子形成,则SiO2中最小的环为几元环 1 mol SiO2中含有几摩尔Si—O键
提示 金刚石和晶体硅都是共价晶体,构成金刚石的碳原子半径比构成晶体硅的硅原子半径小,则两晶体中碳碳键键长小于硅硅键,碳碳键键能大于硅硅键,因此金刚石熔点高于晶体硅。
提示 晶体硅中最小环为六元环。晶体硅中1 mol Si形成2 mol Si—Si键。
提示 SiO2晶体中最小环为12元环。1 mol SiO2中含有4 mol Si—O键。
方法突破
1.金刚石和SiO2晶体结构的比较
共价 晶体 金刚石 若以Si代替金刚石中的C即得晶体硅 SiO2晶体
结构 特点 每个碳原子以共价键与相邻的4个碳原子相结合,成为正四面体; C—C—C夹角为109°28' 硅原子和氧原子交替排列,只有Si—O键,即1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键
最小环 原子数 6个碳原子 每个碳原子为12个六元环所共有 6个硅原子和6个氧原子组成十二元环
2.金刚石晶胞结构
金刚石晶胞中碳原子位置:8个顶点、6个面心(面心立方堆积),还有4个在内部。若把上面的晶胞分成8个相同的小立方体,则小立方体的8个顶点只有一半含有碳原子,即4个碳原子,这4个碳原子构成正四面体结构。在8个小立方体(碳原子连成的正四面体)中心有一半含有碳原子,即内部有4个碳原子。
每个金刚石晶胞中含有8个碳原子。
3.解共价晶体类题目的注意事项
(1)共价晶体中一定存在共价键,但含有共价键的晶体不一定是共价晶体,只有原子间的共价键形成空间网状结构时才形成共价晶体。
(2)共价晶体中,构成晶体的微粒为原子,原子间连接形成空间网状结构,晶体中不存在单个分子,共价晶体的化学式仅表示物质中的原子个数的比例关系,不是分子式。
(3)共价晶体中的共价键具有饱和性和方向性,
原子间不是紧密堆积原则,而是较松散排列的结构。
应用体验
视角1 共价晶体的特点
1.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体:①金刚石 ②晶体硅
③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
A
解析 题给三种晶体都属于共价晶体,而且结构相似,晶体的熔点由微粒间的共价键强弱决定,这里的共价键强弱可根据键长确定,键长可以看作是成键原子的半径之和,由于硅原子半径大于碳原子,所以键的强弱为C—C>C—Si>Si—Si,则熔点从高到低的顺序为金刚石>碳化硅>晶体硅。
视角2 共价晶体的结构
2.二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅晶体的下列说法中不正确的是( )
A.晶体中Si、O原子个数比为1∶4
B.晶体中Si、O原子最外层都满足8电子结构
C.晶体中一个硅原子形成Si—O键数目为4
D.晶体中最小环上的原子数为12
A
解析 由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为1∶2,A错误;硅原子最外层有4个电子,在晶体中硅原子形成4个共用电子对,氧原子最外层有6个电子,形成2个共用电子对,这样两种原子都满足8电子结构,B正确;依据二氧化硅晶体结构图可知1个硅原子与4个氧原子形成4个Si—O键,C正确;由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D正确。
3.(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为 ;在SiC中,每个C原子周围距离最近的C原子数目为 ;若晶胞的边长为a pm,则金刚砂的密度表达式为 。
(2)硅的某种单质的晶胞如图乙所示。GaN晶体晶胞结构与该硅晶体相似。则GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为 。
解析 (1)金刚砂(SiC)的硬度为9.5,硬度大,属于共价晶体;每个碳原子连接4个硅原子,每个硅原子连接4个碳原子,碳原子呈面心立方堆积(硅原子也呈面心立方堆积),所以每个碳原子周围距离最近的碳原子数目为12;
(2)根据硅晶体结构可知,在GaN晶体中,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为正四面体,其实GaN晶胞与SiC晶胞相似。
本 课 结 束
