3.4.1 范德华力 氢键 课件(共33张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 3.4.1 范德华力 氢键 课件(共33张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:57:15 | ||
图片预览










文档简介
(共33张PPT)
专题3 微粒间作用力与物质性质
第四单元 第1课时 范德华力 氢键
素 养 目 标
1.了解范德华力的实质及对物质性质的影响,培养宏观辨识与微观探析的化学核心素养。
2.了解氢键的实质、特点、形成条件及对物质性质的影响,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
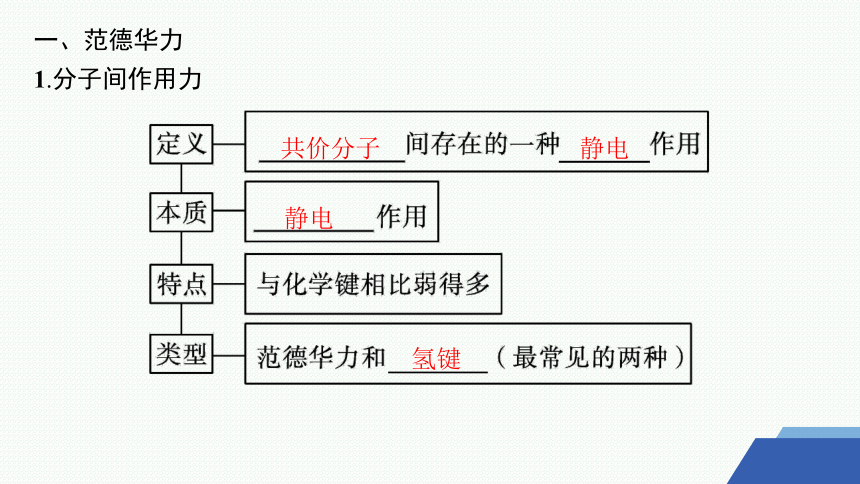
一、范德华力
1.分子间作用力
共价分子
静电
静电
氢键
2.范德华力
(1)定义:范德华力是 普遍存在的相互作用力,它使得许多物质能以一定的凝聚态(固态和液态)存在。
(2)存在
范德华力是普遍存在于固体、 和气体中分子之间的作用力。
(3)特点
范德华力较小,一般 (填“有”或“没有”)饱和性和方向性。
(4)影响因素
①分子的大小、空间构型以及分子中电荷分布是否均匀等。
②组成和结构相似的分子,其范德华力一般随着相对分子质量的增大而 。如F2 Cl2 Br2 I2。
分子之间
液体
没有
增大
<
<
<
(5)范德华力对物质性质的影响
主要影响物质的熔点、沸点、溶解度等 (填“物理”或“化学”)性质。
①分子间范德华力越大,物质的熔、沸点 。
②溶质与溶剂分子间的范德华力越大,物质的溶解度 。
物理
越高
越大
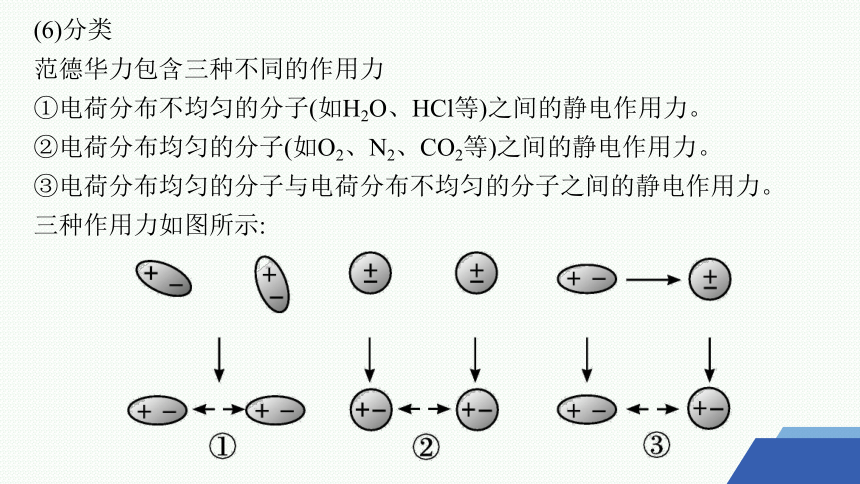
(6)分类
范德华力包含三种不同的作用力
①电荷分布不均匀的分子(如H2O、HCl等)之间的静电作用力。
②电荷分布均匀的分子(如O2、N2、CO2等)之间的静电作用力。
③电荷分布均匀的分子与电荷分布不均匀的分子之间的静电作用力。
三种作用力如图所示:
教材阅读 想一想阅读教材“卤素单质的熔、沸点数据变化表明”一段和“拓展视野”。
思考:范德华力与化学键的作用微粒有什么不同
提示 化学键的成键微粒包括原子、离子、电子,范德华力存在于分子之间。
易错辨析 判一判
(1)分子间作用力是化学键的一种。( )
提示 分子间作用力不是化学键,分子间作用力比化学键弱得多。
(2)水分解以及水的三态变化,水分子中的化学键都被破坏。( )
提示 水的三态变化过程中,水分子没有发生变化,化学键没有被破坏,只有分子间作用力发生变化。
(3)Cl2、Br2、I2在常温常压下分别为气态、液态和固态,是因为分子间作用力逐渐增大。( )
×
×
√
二、氢键
1.形成和表示
H原子与 的原子X以共价键结合时,H原子能够跟另一个 的原子Y之间形成氢键,通常用
表示。上述X、Y通常指 等。
电负性大、半径较小
电负性大、半径较小
X—H…Y
N、O、F
2.类型
氢键有 氢键和 氢键两种。
如(1)H2O与NH3分子间存在分子间氢键,
分子内
分子间
分子内
分子间
3.氢键对物质物理性质的影响
(1)含有 氢键的物质具有较高的熔点、沸点。
(2)含有 氢键的物质具有较低的熔、沸点。
(3)与溶剂分子易形成氢键的物质溶解度 。
(4)对物质密度的影响:氢键的存在会使某些物质的密度反常,如水的密度比冰的密度 。
分子间
分子内
较大
大
教材阅读 想一想自学教材“氢键”。
思考:为什么H2O、H2S、H2Se的沸点高低顺序为H2O>H2Se>H2S
提示 H2O分子之间形成氢键,使H2O的熔、沸点高于H2S;H2S和H2Se结构相似,相对分子质量越大,范德华力越大,因此范德华力H2Se大于H2S,因此H2Se熔、沸点高于H2S。
易错辨析 判一判
(1)ⅦA族元素形成的气态氢化物沸点最低的是HCl。( )
(2)水结冰时体积膨胀是因为水分子间形成氢键增多,水分子间间隙增大造成的。( )
(3)H2O比H2S稳定是因为水分子间存在氢键。( )
提示 H2O比H2S稳定是因为H2O分子中O—H键键能比H2S分子中S—H键键能大,不易断裂,与分子间的氢键无关。
(4)H2和O2之间存在氢键。( )
提示 H2和O2之间不存在氢键,只存在范德华力。
√
√
×
×
重难探究·能力素养全提升
探究 范德华力、氢键和化学键
情境探究
一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见表格。CH4与H2O形成的水合物晶体俗称“可燃冰”。
分子 参数
分子直径/nm 分子与H2O的结合能E/(kJ·mol-1)
CH4 0.436 16.40
CO2 0.512 29.91
1.“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子;另外2个笼被游离的H2O分子填充,则“可燃冰”平均组成如何表示
提示 CH4·8H2O。晶体中共含甲烷分子和水分子两种分子;晶体中平均每46个H2O构建成8个笼,8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充,所以晶体中有48个水分子、6个CH4分子,6CH4·48H2O即CH4·8H2O。
3.为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是什么
2.“可燃冰”中是否存在氢键 甲烷分子和水分子间是否存在氢键
提示 “可燃冰”中存在氢键,在水分子和水分子间;甲烷分子和水分子间不存在氢键,二者存在范德华力。
提示 根据题给数据可知,笼状空腔的直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与水分子之间的结合能大于CH4,因此可以实现用CO2置换CH4的设想。
方法突破
范德华力、氢键和共价键比较
应用体验
视角1 范德华力
1.下列关于范德华力的叙述正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键
B.范德华力与化学键的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
B
解析 范德华力是分子之间的一种相互作用,其实质也是一种电性作用,但比较微弱,化学键是强相互作用,故范德华力不是化学键,A错误,B正确;范德华力普遍存在于分子之间,但也必须满足一定的距离要求,若分子间的距离足够大,分子之间很难产生相互作用,C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
视角2 氢键
2.下列说法不正确的是( )
A.所有含氢元素的化合物中都存在氢键,氢键是一种类似于共价键的化学键
B.离子键、氢键、范德华力本质上都是静电作用
C.只有电负性很强、半径很小的原子(如F、O、N)才可能形成氢键
D.氢键是一种分子间作用力,氢键比范德华力强
A
解析 氢键不是化学键,本质上是一种分子间作用力,氢键要比化学键弱得多,比范德华力强,一般只有电负性很强、半径很小的原子才能形成氢键,故A错,B、C、D正确。
视角3 范德华力、氢键对物质物理性质的影响
3.下列事实中与氢键的形成有关的是( )
A.HF比HCl稳定是因为HF分子间存在氢键
B.水结成冰体积膨胀,密度变小
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.CH4、SiH4、GeH4的沸点依次升高
B
解析 HF比HCl稳定,是因为HF分子中H—F键比HCl分子中H—Cl键稳定,与氢键无关,A项错误;氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大,密度减小,B项正确;水和乙醇分别与金属钠反应,是化学性质,与羟基的活性有关,与氢键无关,C项错误;CH4、SiH4、GeH4的沸点依次升高,是因为这三种分子之间的范德华力逐渐增大,与氢键无关,D项错误。
考题点睛
易错提醒 物质的稳定性与物质内部的化学键有关,与氢键无关,与分子间作用力无关;氢键、范德华力主要影响物质的物理性质,如熔、沸点和溶解性等。
4.下列叙述正确的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高,与分子间作用力大小有关
B.H2S的相对分子质量比H2O的大,其沸点比水的高
C.稀有气体的化学性质比较稳定,是因为其键能很大
D.干冰汽化时破坏了共价键
A
解析 从F2→I2,相对分子质量增大,分子间作用力增大,熔、沸点升高,A项正确;H2O分子之间有氢键,其沸点高于H2S,B项错误;稀有气体分子为单原子分子,分子内无化学键,其化学性质稳定是因为原子的最外层为8电子稳定结构(He为2个),C项错误;干冰汽化破坏的是范德华力,并未破坏共价键,D项错误。
5.中科院国家纳米科学中心的科研人员在国际上首次“拍到”氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列说法不正确的是( )
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点的大小顺序为HF>HCl>HBr>HI
D.蛋白质中存在氢键
C
解析 由于氢键具有方向性,在结冰时,水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,导致冰的密度比水的小,浮在水面上,A项正确;乙醇中的羟基氢原子与水分子中的氧原子可形成分子间氢键,乙醇的羟基氧原子与水分子中的氢原子之间也可以形成氢键,致使其与水混溶,而甲醚中的O与H不相连,无法形成氢键,难溶于水,B项正确;HF分子间能形成氢键,故沸点大小顺序为HF>HI>HBr>HCl,C项错误;蛋白质分子中,氨基和羧基中分别存在N与H相连和O与H相连,可形成氢键,D项正确。
6.下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物的沸点的是曲线
;表示ⅣA族元素气态氢化物的沸点的是曲线 ;同一主族中第3、4、5周期元素的气态氢化物的沸点依次升高,其原因是 。
A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是 ;如果把这些氢化物分子间存在的主要影响沸点的相互作用表示为X—H…Y,则X元素一般具有的特点是 。
答案 A D 组成和结构相似,相对分子质量越大,范德华力越大,沸点越高 H2O、HF、NH3都存在分子间氢键 电负性大,原子半径小
解析 ⅣA、ⅤA、ⅥA、ⅦA族第2周期元素的气态氢化物中沸点最高的是水,最低的是甲烷;由题图可知,A、B、C、D曲线中表示ⅥA族元素气态氢化物沸点的是曲线A;表示ⅣA族元素气态氢化物沸点的是曲线D。同一主族中第3、4、5周期元素的气态氢化物中分子间的范德华力依次增大,所以沸点依次升高。
A、B、C曲线中第2周期元素的气态氢化物中分子间都存在氢键,所以它们的沸点显著高于第3周期元素气态氢化物的沸点。
本 课 结 束
专题3 微粒间作用力与物质性质
第四单元 第1课时 范德华力 氢键
素 养 目 标
1.了解范德华力的实质及对物质性质的影响,培养宏观辨识与微观探析的化学核心素养。
2.了解氢键的实质、特点、形成条件及对物质性质的影响,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、范德华力
1.分子间作用力
共价分子
静电
静电
氢键
2.范德华力
(1)定义:范德华力是 普遍存在的相互作用力,它使得许多物质能以一定的凝聚态(固态和液态)存在。
(2)存在
范德华力是普遍存在于固体、 和气体中分子之间的作用力。
(3)特点
范德华力较小,一般 (填“有”或“没有”)饱和性和方向性。
(4)影响因素
①分子的大小、空间构型以及分子中电荷分布是否均匀等。
②组成和结构相似的分子,其范德华力一般随着相对分子质量的增大而 。如F2 Cl2 Br2 I2。
分子之间
液体
没有
增大
<
<
<
(5)范德华力对物质性质的影响
主要影响物质的熔点、沸点、溶解度等 (填“物理”或“化学”)性质。
①分子间范德华力越大,物质的熔、沸点 。
②溶质与溶剂分子间的范德华力越大,物质的溶解度 。
物理
越高
越大
(6)分类
范德华力包含三种不同的作用力
①电荷分布不均匀的分子(如H2O、HCl等)之间的静电作用力。
②电荷分布均匀的分子(如O2、N2、CO2等)之间的静电作用力。
③电荷分布均匀的分子与电荷分布不均匀的分子之间的静电作用力。
三种作用力如图所示:
教材阅读 想一想阅读教材“卤素单质的熔、沸点数据变化表明”一段和“拓展视野”。
思考:范德华力与化学键的作用微粒有什么不同
提示 化学键的成键微粒包括原子、离子、电子,范德华力存在于分子之间。
易错辨析 判一判
(1)分子间作用力是化学键的一种。( )
提示 分子间作用力不是化学键,分子间作用力比化学键弱得多。
(2)水分解以及水的三态变化,水分子中的化学键都被破坏。( )
提示 水的三态变化过程中,水分子没有发生变化,化学键没有被破坏,只有分子间作用力发生变化。
(3)Cl2、Br2、I2在常温常压下分别为气态、液态和固态,是因为分子间作用力逐渐增大。( )
×
×
√
二、氢键
1.形成和表示
H原子与 的原子X以共价键结合时,H原子能够跟另一个 的原子Y之间形成氢键,通常用
表示。上述X、Y通常指 等。
电负性大、半径较小
电负性大、半径较小
X—H…Y
N、O、F
2.类型
氢键有 氢键和 氢键两种。
如(1)H2O与NH3分子间存在分子间氢键,
分子内
分子间
分子内
分子间
3.氢键对物质物理性质的影响
(1)含有 氢键的物质具有较高的熔点、沸点。
(2)含有 氢键的物质具有较低的熔、沸点。
(3)与溶剂分子易形成氢键的物质溶解度 。
(4)对物质密度的影响:氢键的存在会使某些物质的密度反常,如水的密度比冰的密度 。
分子间
分子内
较大
大
教材阅读 想一想自学教材“氢键”。
思考:为什么H2O、H2S、H2Se的沸点高低顺序为H2O>H2Se>H2S
提示 H2O分子之间形成氢键,使H2O的熔、沸点高于H2S;H2S和H2Se结构相似,相对分子质量越大,范德华力越大,因此范德华力H2Se大于H2S,因此H2Se熔、沸点高于H2S。
易错辨析 判一判
(1)ⅦA族元素形成的气态氢化物沸点最低的是HCl。( )
(2)水结冰时体积膨胀是因为水分子间形成氢键增多,水分子间间隙增大造成的。( )
(3)H2O比H2S稳定是因为水分子间存在氢键。( )
提示 H2O比H2S稳定是因为H2O分子中O—H键键能比H2S分子中S—H键键能大,不易断裂,与分子间的氢键无关。
(4)H2和O2之间存在氢键。( )
提示 H2和O2之间不存在氢键,只存在范德华力。
√
√
×
×
重难探究·能力素养全提升
探究 范德华力、氢键和化学键
情境探究
一定条件下,CH4、CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见表格。CH4与H2O形成的水合物晶体俗称“可燃冰”。
分子 参数
分子直径/nm 分子与H2O的结合能E/(kJ·mol-1)
CH4 0.436 16.40
CO2 0.512 29.91
1.“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子;另外2个笼被游离的H2O分子填充,则“可燃冰”平均组成如何表示
提示 CH4·8H2O。晶体中共含甲烷分子和水分子两种分子;晶体中平均每46个H2O构建成8个笼,8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充,所以晶体中有48个水分子、6个CH4分子,6CH4·48H2O即CH4·8H2O。
3.为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是什么
2.“可燃冰”中是否存在氢键 甲烷分子和水分子间是否存在氢键
提示 “可燃冰”中存在氢键,在水分子和水分子间;甲烷分子和水分子间不存在氢键,二者存在范德华力。
提示 根据题给数据可知,笼状空腔的直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与水分子之间的结合能大于CH4,因此可以实现用CO2置换CH4的设想。
方法突破
范德华力、氢键和共价键比较
应用体验
视角1 范德华力
1.下列关于范德华力的叙述正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键
B.范德华力与化学键的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
B
解析 范德华力是分子之间的一种相互作用,其实质也是一种电性作用,但比较微弱,化学键是强相互作用,故范德华力不是化学键,A错误,B正确;范德华力普遍存在于分子之间,但也必须满足一定的距离要求,若分子间的距离足够大,分子之间很难产生相互作用,C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
视角2 氢键
2.下列说法不正确的是( )
A.所有含氢元素的化合物中都存在氢键,氢键是一种类似于共价键的化学键
B.离子键、氢键、范德华力本质上都是静电作用
C.只有电负性很强、半径很小的原子(如F、O、N)才可能形成氢键
D.氢键是一种分子间作用力,氢键比范德华力强
A
解析 氢键不是化学键,本质上是一种分子间作用力,氢键要比化学键弱得多,比范德华力强,一般只有电负性很强、半径很小的原子才能形成氢键,故A错,B、C、D正确。
视角3 范德华力、氢键对物质物理性质的影响
3.下列事实中与氢键的形成有关的是( )
A.HF比HCl稳定是因为HF分子间存在氢键
B.水结成冰体积膨胀,密度变小
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.CH4、SiH4、GeH4的沸点依次升高
B
解析 HF比HCl稳定,是因为HF分子中H—F键比HCl分子中H—Cl键稳定,与氢键无关,A项错误;氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大,密度减小,B项正确;水和乙醇分别与金属钠反应,是化学性质,与羟基的活性有关,与氢键无关,C项错误;CH4、SiH4、GeH4的沸点依次升高,是因为这三种分子之间的范德华力逐渐增大,与氢键无关,D项错误。
考题点睛
易错提醒 物质的稳定性与物质内部的化学键有关,与氢键无关,与分子间作用力无关;氢键、范德华力主要影响物质的物理性质,如熔、沸点和溶解性等。
4.下列叙述正确的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高,与分子间作用力大小有关
B.H2S的相对分子质量比H2O的大,其沸点比水的高
C.稀有气体的化学性质比较稳定,是因为其键能很大
D.干冰汽化时破坏了共价键
A
解析 从F2→I2,相对分子质量增大,分子间作用力增大,熔、沸点升高,A项正确;H2O分子之间有氢键,其沸点高于H2S,B项错误;稀有气体分子为单原子分子,分子内无化学键,其化学性质稳定是因为原子的最外层为8电子稳定结构(He为2个),C项错误;干冰汽化破坏的是范德华力,并未破坏共价键,D项错误。
5.中科院国家纳米科学中心的科研人员在国际上首次“拍到”氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列说法不正确的是( )
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点的大小顺序为HF>HCl>HBr>HI
D.蛋白质中存在氢键
C
解析 由于氢键具有方向性,在结冰时,水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,导致冰的密度比水的小,浮在水面上,A项正确;乙醇中的羟基氢原子与水分子中的氧原子可形成分子间氢键,乙醇的羟基氧原子与水分子中的氢原子之间也可以形成氢键,致使其与水混溶,而甲醚中的O与H不相连,无法形成氢键,难溶于水,B项正确;HF分子间能形成氢键,故沸点大小顺序为HF>HI>HBr>HCl,C项错误;蛋白质分子中,氨基和羧基中分别存在N与H相连和O与H相连,可形成氢键,D项正确。
6.下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物的沸点的是曲线
;表示ⅣA族元素气态氢化物的沸点的是曲线 ;同一主族中第3、4、5周期元素的气态氢化物的沸点依次升高,其原因是 。
A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是 ;如果把这些氢化物分子间存在的主要影响沸点的相互作用表示为X—H…Y,则X元素一般具有的特点是 。
答案 A D 组成和结构相似,相对分子质量越大,范德华力越大,沸点越高 H2O、HF、NH3都存在分子间氢键 电负性大,原子半径小
解析 ⅣA、ⅤA、ⅥA、ⅦA族第2周期元素的气态氢化物中沸点最高的是水,最低的是甲烷;由题图可知,A、B、C、D曲线中表示ⅥA族元素气态氢化物沸点的是曲线A;表示ⅣA族元素气态氢化物沸点的是曲线D。同一主族中第3、4、5周期元素的气态氢化物中分子间的范德华力依次增大,所以沸点依次升高。
A、B、C曲线中第2周期元素的气态氢化物中分子间都存在氢键,所以它们的沸点显著高于第3周期元素气态氢化物的沸点。
本 课 结 束
