3.4.2 分子晶体 课件 (共53张PPT)2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 3.4.2 分子晶体 课件 (共53张PPT)2023-2024学年高二化学苏教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:57:16 | ||
图片预览










文档简介
(共53张PPT)
专题3 微粒间作用力与物质性质
第四单元 第2课时 分子晶体
素 养 目 标
1.知道分子晶体的定义,认识分子晶体的微粒及其微粒之间的相互作用,培养宏观辨识与微观探析的化学核心素养。
2.了解典型的分子晶体,借助冰、干冰等模型认识分子晶体的结构特点及物理性质,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、分子晶体
1.定义
分子通过 构成的固态物质叫分子晶体。
2.物理性质
(1)分子晶体由于以比较弱的 相结合,因此一般熔点
,硬度 。
分子晶体熔化时,克服分子间作用力,不破坏化学键
(2)对组成和结构 ,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力 ,熔、沸点 ;分子间存在氢键的晶体熔、沸点 。
分子间作用力
分子间作用力
较低
较小
相似
增强
升高
较高
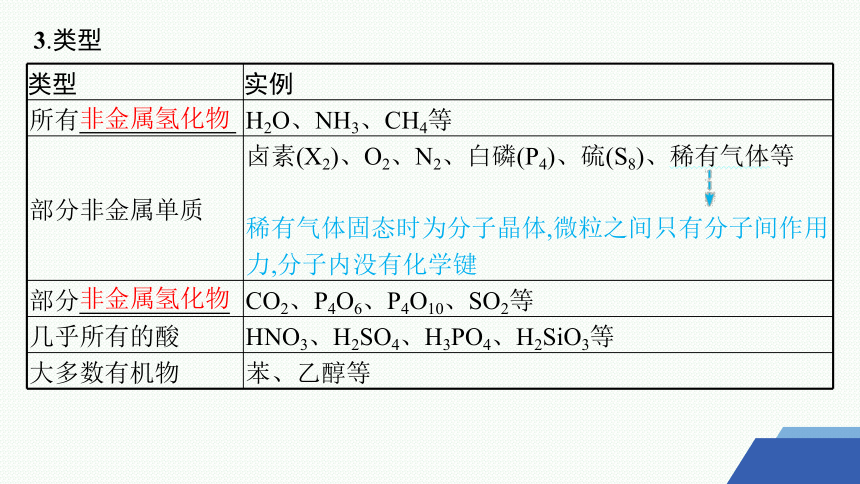
3.类型
类型 实例
所有 H2O、NH3、CH4等
部分非金属单质 卤素(X2)、O2、N2、白磷(P4)、硫(S8)、稀有气体等
稀有气体固态时为分子晶体,微粒之间只有分子间作用力,分子内没有化学键
部分 CO2、P4O6、P4O10、SO2等
几乎所有的酸 HNO3、H2SO4、H3PO4、H2SiO3等
大多数有机物 苯、乙醇等
非金属氢化物
非金属氢化物
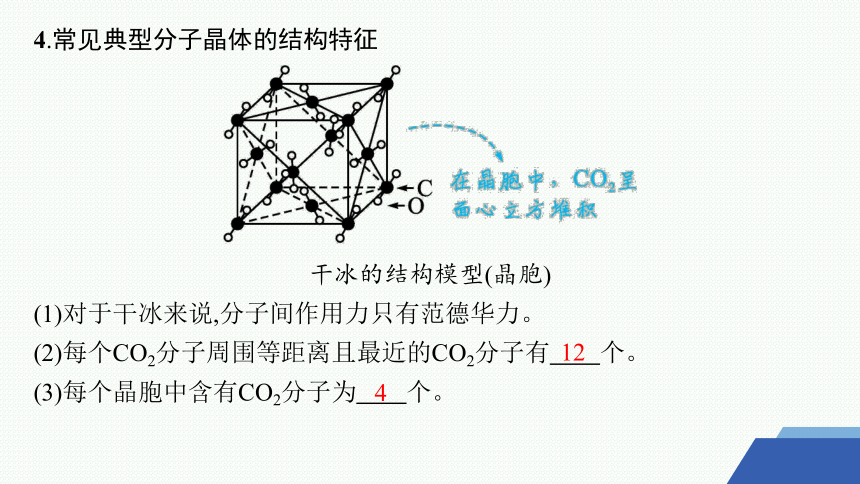
4.常见典型分子晶体的结构特征
干冰的结构模型(晶胞)
(1)对于干冰来说,分子间作用力只有范德华力。
(2)每个CO2分子周围等距离且最近的CO2分子有 个。
(3)每个晶胞中含有CO2分子为 个。
12
4
教材阅读 想一想阅读教材“学以致用”。
思考:二氧化硅和二氧化碳的熔、沸点为何相差很大
提示 SiO2为共价晶体,CO2为分子晶体,熔化时破坏的分别为共价键和分子间作用力,故SiO2熔、沸点高,而CO2熔、沸点低。
易错辨析 判一判
(1)分子晶体中均存在共价键。( )
提示 稀有气体分子形成的分子晶体中不存在共价键。
(2)分子晶体的状态变化时,只需克服分子间作用力。( )
(3)干冰升华时,分子内共价键不会发生断裂。( )
(4)分子晶体中,共价键键能越大,该分子晶体的熔、沸点越高。( )
提示 分子晶体的熔、沸点高低与其共价键键能大小无关。
×
√
√
×
二、石墨晶体
1.结构特点
(1)石墨晶体是层状结构,在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。碳原子有4个价电子,而每个碳原子仅用了3个价电子形成共价键,还有1个电子处于碳原子的2p轨道上。层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成 键,而这些p轨道中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有 性。
(2)层与层之间以 相结合,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的 性。
大π
导电
分子间作用力
润滑
2.所属晶体类型
石墨中既有共价键,又有分子间作用力,是一种混合型晶体。具有熔点高、质软、易导电等性质。
教材阅读 想一想自学教材“拓展视野——石墨晶体”。
思考:石墨层状结构中,平均每个正六边形占有的C原子数和C—C键数各是多少 每一层中碳原子数与C—C键数之比为多少
易错辨析 判一判
(1)石墨晶体属于共价晶体,熔化时需要破坏共价键。( )
提示 石墨晶体属于混合型晶体,不是共价晶体。
(2)石墨的熔点高于金刚石,是因为石墨中的碳碳键键长更短,键能更大。
( )
(3)石墨晶体中含有共价键和分子间作用力。( )
×
√
√
三、晶体的共性与个性
1.晶体概述
、 、 和 是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
2.晶体的共性
(1)晶体物质各个部分的宏观性质总是 ,例如具有相同的密度、相同的化学组成等。
(2)晶体总能自发地形成 外形。
(3)晶体都具有确定的 。
金属晶体
离子晶体
共价晶体
分子晶体
相同的
多面体
熔点
3.晶体的个性
(1)绝大多数金属晶体是电和热的良导体,延展性好。
(2)食盐为 晶体,质脆,熔融状态下 导电。
(3)金刚石为 晶体,无色透明、坚硬、质脆,常温下不导电。
(4)干冰属于 晶体,只能在低温下存在。
离子
能
共价
分子
教材阅读 想一想自学教材“晶体的共性与个性”。
思考:根据第3周期元素的几种氯化物熔、沸点分析,这几种物质分别属于什么晶体
氯化物 NaCl MgCl2 AlCl3 SiCl4
熔点/℃ 801 712 194 -70.4
沸点/℃ 1 465 1 418 178(升华) 57
提示 MgCl2、NaCl熔、沸点很高,由金属阳离子和阴离子构成,属于离子晶体;AlCl3、SiCl4熔、沸点较低,AlCl3易升华,属于分子晶体。
易错辨析 判一判
(1)共价晶体的原子间只存在共价键,而分子晶体内只存在范德华力。
( )
提示 共价晶体的原子间只存在共价键,分子晶体内可能存在范德华力、氢键和共价键。
(2)干冰晶体中既有共价键又有范德华力,因此属于混合型晶体。( )
提示 干冰属于分子晶体。
×
×
(3)十二苯取代并四苯(如图),是目前人们能够得到的最大的全苯取代并多苯结构,呈深红色,发出强烈的荧光。十二苯取代并四苯形成的晶体是分子晶体。( )
(4)在晶体中,若含有金属阳离子,则一定含有阴离子。( )
提示 金属晶体中含有金属阳离子和自由电子。
√
×
重难探究·能力素养全提升
探究一 分子晶体的结构与物理性质
情境探究
冰山是极为宝贵的淡水资源,冰山产生的速率在北冰洋为每年约2 800亿立方米,在南极为每年约18 000亿立方米。大多数冰山的比重为0.9,因此其质量的 在海面以下。冰山露出水面的一角仅仅是整座冰山的 左右。北冰洋的冰山高可达数十米,长可达一二百米,形状多样。南极冰山一般呈平板状,同北冰洋冰山相比,不仅数量多,而且体积巨大。
已知:冰的结构和干冰的晶胞如图
冰
干冰
1.冰为什么会浮在水面上
2.为什么冰刚刚融化为水时,密度增大
提示 由于氢键具有方向性,冰晶体中四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引,形成空隙较大的晶体,密度比液态水小,所以冰会浮在水面上。
提示 在冰晶体中,每个水分子周围只有4个紧邻的水分子,由于水分子之间的主要作用力是氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,氢键数目减少,水分子间的空隙减小,密度增大。
3.为什么干冰的熔、沸点比冰低而密度却比冰大
提示 由于干冰中的CO2之间只存在范德华力,冰中除了范德华力外还有氢键作用,所以冰的熔、沸点比干冰高。
干冰中1个分子周围有12个紧邻的分子,而水分子间由于氢键的方向性,导致晶体中有相当大的空隙,所以干冰的密度比冰大。
方法突破
1.常见分子晶体的结构分析
(1)干冰
如图表示的是CO2晶体的晶胞。
①CO2晶体的晶胞是面心立方结构,立方体的每个顶点上有1个CO2分子,6个面的面心还有6个CO2分子。
②每个CO2分子周围离该分子距离最近且相等的CO2分子有12个。
③每个晶胞中实际有4个CO2分子。
(2)冰
①冰中水分子之间的相互作用力除范德华力外还有氢键,冰晶体主要是水分子依靠分子间氢键形成的。
②由于氢键具有方向性,每个水分子与周围4个水分子结合,4个水分子也按照这样的规律再与其他的水分子结合。
③每个水分子中的氧原子周围都有4个氢原子,氧原子
与其中的2个氢原子通过共价键结合,距离较近;与其他
水分子的另外2个氢原子靠氢键结合,距离较远。在这
种排列中,分子的间距较大,有很多空隙,比较松散。
因此,液态水变成固态,即水凝固成冰、雪、霜时,密度变小。
2.分子晶体的物理性质
(1)分子晶体熔、沸点低的原因
(2)分子晶体的熔、沸点比较
比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范德华力和氢键)的大小。
(3)分子晶体的导电性
离子晶体熔融状态下可以导电
分子晶体在固态和熔融状态下均不存在自由离子,因而不能导电;易溶于水的电解质在水中全部或部分电离而能够导电(如HCl、H2SO4在水溶液中完全电离,CH3COOH、NH3·H2O部分电离,溶液导电),不溶于水的物质(如CCl4、CH4)或易溶于水的非电解质(如CH3CH2OH、葡萄糖)不能导电。
不能根据水溶液能否导电判断是离子晶体还是分子晶体
应用体验
视角1 分子晶体的判断
1.根据下列各物质的物理性质,判断其固态肯定不属于分子晶体的是( )
①溴化铝(无色晶体,熔点98 ℃,熔融态不导电)
②碳化铝(黄色晶体,熔点2 200 ℃,熔融态不导电)
③氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力)
④五氟化钒(无色晶体,熔点19.5 ℃,易溶于乙醇)
A.①② B.③④
C.②③ D.①④
C
解析 溴化铝的熔点98 ℃,熔融态不导电,说明溴化铝属于分子晶体,故①不选;碳化铝熔点2 200 ℃,熔融态不导电,应为共价晶体,故②选;氟化铝熔融时或溶于水时破坏了相同的作用力,说明破坏的是离子键,应为离子晶体,故③选;五氟化钒熔点19.5 ℃,易溶于乙醇,说明五氟化钒属于分子晶体,故④不选;故选C。
视角2 分子晶体的结构
2.C60分子和C60晶胞示意图如图所示。下列关于C60分子和晶体的说法不正确的是( )
A.C60晶体可能具有很高的熔、沸点
B.C60分子中含有90条C—C键
C.C60晶体的一个晶胞中含有的碳原子数为240
D.C60晶体中每个C60分子与12个C60分子紧邻
A
解析 构成C60晶体的基本微粒是C60分子,因此C60晶体是分子晶体,不可能具有很高的熔、沸点,A错误;根据C60分子结构示意图,可以看出每个碳原
考题点睛
【变式设问】
已知在简单多面体中,存在等量关系:顶点数+面数-棱数=2,该关系为欧拉公式。C60分子由五边形和六边形组成,试计算五边形和六边形个数。
提示 五边形有12个,六边形有20个。
设五边形个数为x,六边形个数为y。
C60分子中顶点数,即碳原子数为60;面数即五边形和六边形总数,为x+y;
棱数即C—C键数,为90,则60+(x+y)-90=2;
视角3 分子晶体熔、沸点的比较
3.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
解析 对结构和组成相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但HF、H2O分子之间都存在氢键,熔、沸点反常,所以A中应为HF>HI>HBr>HCl;B中应为I2>Br2>Cl2>F2;C中应为H2O>H2Te>H2Se>H2S; 只有D正确。
思维建模 解答有关分子晶体组成和性质问题的思维流程如下:
【变式设问】
(1)上题A项物质稳定性的排序如何
(2)上题A项、D项物质在水中的溶解性如何 溶解时化学键是否断裂
提示 HF>HCl>HBr>HI。物质稳定性与化学键的强弱有关。
提示 A项物质易溶于水,溶解时化学键断裂;D项物质难溶于水。
探究二 四类晶体比较
情境探究
钛和钛的合金大量用于航空工业,有“空间金属”之称;钛具有“亲生物”性,在人体内,能抵抗分泌物的腐蚀且无毒,对任何杀菌方法都适用,被广泛用于制医疗器械、人造关节、头盖骨等。
1.K、Ca、Sc、Ti为同周期相邻元素,原子半径相近,为什么单质的熔、沸点逐渐升高
提示 K、Ca、Sc、Ti均为金属晶体,原子半径相近,价电子数增多,金属键增强,因此单质的熔、沸点逐渐升高。
2.Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,为什么
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
提示 TiF4为离子化合物,熔点高;其他三种均为共价化合物,其组成和结构相似,随着相对分子质量增大,分子间作用力增大,熔点逐渐升高。
3.Ti的一种化合物碳化钛是一种灰色金属光泽的结晶固体,硬度仅次于金刚石,熔点3 140 ℃,沸点4 820 ℃,可用于制硬质合金,也用作弧光灯的电极和研磨剂。碳化钛的晶胞结构如图:
则碳化钛属于哪种晶体类型 试写出其化学式。
提示 碳化钛属于共价晶体,化学式为TiC。
方法突破
四类晶体结构与性质比较
类型 离子晶体 共价晶体 分子晶体 金属晶体
构成晶体的粒子 阴、阳离子 原子 分子 金属离子和自由电子
粒子间的作用 离子键 共价键 分子间作用力(范德华力或氢键) 金属离子和自由电子之间的强烈相互作用
确定作用力强弱的一般判断方法 离子电荷、半径 键长(原子半径) 组成结构相似时,比较相对分子质量 离子半径、外围电子数
类型 离子晶体 共价晶体 分子晶体 金属晶体
熔、沸点 较高 熔、沸点一般: 共价晶体>离子晶体>分子晶体 高 低 差别较大(汞常温下为液态,钨熔点为3 410 ℃)
硬度 略硬而脆 大 较小 差别较大
导电性 不良导体(熔化后或溶于水时导电) 不良导体(个别为半导体) 不良导体(部分溶于水电离后导电) 良导体
类型 离子晶体 共价晶体 分子晶体 金属晶体
溶解性 多数易溶于水 不溶于常见溶剂 相似相溶 相似相溶规则将在专题4中学习 一般不溶于水,少数与水反应
机械加工性能 不良 不良 不良 优良
延展性 差 差 差 优良
应用体验
视角1 四种晶体类型的判断
1.有下列几种晶体:A.水晶;B.冰醋酸;C.白磷;D.金刚石;E.晶体氩;F.干冰。
(1)属于分子晶体的是 ,直接由原子构成的分子晶体是 。
(2)属于共价晶体的化合物是 。
(3)直接由原子构成的晶体是 。
(4)受热熔化时,需克服共价键的是 。
答案 (1)B、C、E、F E (2)A (3)A、D、E (4)A、D
解析 (1)根据构成晶体的微粒不同,分子晶体仅由分子构成,大多数共价化合物、非金属单质可构成分子晶体。
(2)常见的共价晶体包括金刚石、晶体硅、SiC、SiO2等。共价晶体有A、D,但化合物只有A。
(3)共价晶体和单原子分子晶体都是由原子直接构成的。
(4)分子晶体熔化时,一般不破坏化学键;共价晶体熔化时,破坏共价键;稀有气体中没有化学键。
2.有关晶体的下列说法中正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.共价晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
B
解析 分子的稳定性与分子间作用力无关,与分子内的共价键有关,分子内共价键键能越大,分子越稳定,A错误;共价晶体熔化时,破坏共价键,因此共价键越强,熔点越高,B正确;冰中水分子间存在氢键,冰融化时断裂了氢键,共价键未发生变化,C错误;NaCl中Na+、Cl-之间存在离子键,NaCl熔化时一定破坏离子键,D错误。
视角2 晶体熔、沸点的判断
3.硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图(即轨道表示式)为 ,晶体硅和碳化硅熔点较高的是 (填化学式)。
(2)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如表所示。
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 。
物质 SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 202.7 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
答案 (1) SiC
(2)SiCl4 SiX4都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大
解析 (1)硅元素的原子序数为14,价电子排布式为3s23p2,则最外层电子的轨道表示式为 。
共价晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是共价晶体,碳原子的原子半径小于硅原子,非金属性强于硅原子,碳硅键的键能大于硅硅键、键长小于硅硅键,则碳硅键强于硅硅键,碳化硅的熔点高于晶体硅。
(2)由题给熔、沸点数据可知,0 ℃即273 K时,SiF4为气态,SiCl4为液态,SiBr4、SiI4为固态。SiX4都是结构相似的分子晶体,分子晶体的沸点取决于分子间作用力的大小,相对分子质量依次增大,分子间作用力依次增大,则SiF4、SiCl4、SiBr4、SiI4的沸点依次升高。
归纳总结 晶体熔、沸点的比较方法
一看晶体之类型:即先判断晶体类型,一般是:共价晶体>离子晶体>分子晶体;
二分类型看晶体:是指把同一类型的晶体放在一起比较,分子晶体比较分子间作用力(氢键和范德华力),共价晶体比较共价键强弱,离子晶体比较离子键强弱,金属晶体比较金属键强弱;
三看氢键特殊性:即在比较分子晶体时还要注意分子间氢键使熔、沸点升高,分子内氢键使熔、沸点降低。
4.下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-24.12 ℃,沸点136.2 ℃,所以TiCl4属于离子晶体
A
解析 C60、I2均为分子晶体,汽化或升华时均克服范德华力,A正确;乙酸分子可形成氢键,其熔、沸点比甲酸甲酯高,B错误;HCl溶于水时破坏的是共价键,C错误;TiCl4熔、沸点很低,属于分子晶体,D错误。
5.航天飞机表层的防热瓦曾成为航天飞机能否安全着陆的制约因素,防热瓦是以石墨材料为主要成分的十分疏松的泡沫陶瓷。下列有关说法合理的是( )
A.石墨成为该泡沫陶瓷主要成分的主要原因是石墨是共价晶体
B.石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C.石墨中碳碳键之间的夹角是109°28'
D.C60也可代替石墨用作航天飞机表层的防热瓦材料
B
解析 石墨为混合型晶体,碳碳键之间的夹角为120°,熔点高,可用作防热瓦材料,B正确,A、C错误;C60晶体为分子晶体,熔点低,不能用作防热瓦材料,D错误。
本 课 结 束
专题3 微粒间作用力与物质性质
第四单元 第2课时 分子晶体
素 养 目 标
1.知道分子晶体的定义,认识分子晶体的微粒及其微粒之间的相互作用,培养宏观辨识与微观探析的化学核心素养。
2.了解典型的分子晶体,借助冰、干冰等模型认识分子晶体的结构特点及物理性质,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、分子晶体
1.定义
分子通过 构成的固态物质叫分子晶体。
2.物理性质
(1)分子晶体由于以比较弱的 相结合,因此一般熔点
,硬度 。
分子晶体熔化时,克服分子间作用力,不破坏化学键
(2)对组成和结构 ,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力 ,熔、沸点 ;分子间存在氢键的晶体熔、沸点 。
分子间作用力
分子间作用力
较低
较小
相似
增强
升高
较高
3.类型
类型 实例
所有 H2O、NH3、CH4等
部分非金属单质 卤素(X2)、O2、N2、白磷(P4)、硫(S8)、稀有气体等
稀有气体固态时为分子晶体,微粒之间只有分子间作用力,分子内没有化学键
部分 CO2、P4O6、P4O10、SO2等
几乎所有的酸 HNO3、H2SO4、H3PO4、H2SiO3等
大多数有机物 苯、乙醇等
非金属氢化物
非金属氢化物
4.常见典型分子晶体的结构特征
干冰的结构模型(晶胞)
(1)对于干冰来说,分子间作用力只有范德华力。
(2)每个CO2分子周围等距离且最近的CO2分子有 个。
(3)每个晶胞中含有CO2分子为 个。
12
4
教材阅读 想一想阅读教材“学以致用”。
思考:二氧化硅和二氧化碳的熔、沸点为何相差很大
提示 SiO2为共价晶体,CO2为分子晶体,熔化时破坏的分别为共价键和分子间作用力,故SiO2熔、沸点高,而CO2熔、沸点低。
易错辨析 判一判
(1)分子晶体中均存在共价键。( )
提示 稀有气体分子形成的分子晶体中不存在共价键。
(2)分子晶体的状态变化时,只需克服分子间作用力。( )
(3)干冰升华时,分子内共价键不会发生断裂。( )
(4)分子晶体中,共价键键能越大,该分子晶体的熔、沸点越高。( )
提示 分子晶体的熔、沸点高低与其共价键键能大小无关。
×
√
√
×
二、石墨晶体
1.结构特点
(1)石墨晶体是层状结构,在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。碳原子有4个价电子,而每个碳原子仅用了3个价电子形成共价键,还有1个电子处于碳原子的2p轨道上。层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成 键,而这些p轨道中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有 性。
(2)层与层之间以 相结合,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的 性。
大π
导电
分子间作用力
润滑
2.所属晶体类型
石墨中既有共价键,又有分子间作用力,是一种混合型晶体。具有熔点高、质软、易导电等性质。
教材阅读 想一想自学教材“拓展视野——石墨晶体”。
思考:石墨层状结构中,平均每个正六边形占有的C原子数和C—C键数各是多少 每一层中碳原子数与C—C键数之比为多少
易错辨析 判一判
(1)石墨晶体属于共价晶体,熔化时需要破坏共价键。( )
提示 石墨晶体属于混合型晶体,不是共价晶体。
(2)石墨的熔点高于金刚石,是因为石墨中的碳碳键键长更短,键能更大。
( )
(3)石墨晶体中含有共价键和分子间作用力。( )
×
√
√
三、晶体的共性与个性
1.晶体概述
、 、 和 是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
2.晶体的共性
(1)晶体物质各个部分的宏观性质总是 ,例如具有相同的密度、相同的化学组成等。
(2)晶体总能自发地形成 外形。
(3)晶体都具有确定的 。
金属晶体
离子晶体
共价晶体
分子晶体
相同的
多面体
熔点
3.晶体的个性
(1)绝大多数金属晶体是电和热的良导体,延展性好。
(2)食盐为 晶体,质脆,熔融状态下 导电。
(3)金刚石为 晶体,无色透明、坚硬、质脆,常温下不导电。
(4)干冰属于 晶体,只能在低温下存在。
离子
能
共价
分子
教材阅读 想一想自学教材“晶体的共性与个性”。
思考:根据第3周期元素的几种氯化物熔、沸点分析,这几种物质分别属于什么晶体
氯化物 NaCl MgCl2 AlCl3 SiCl4
熔点/℃ 801 712 194 -70.4
沸点/℃ 1 465 1 418 178(升华) 57
提示 MgCl2、NaCl熔、沸点很高,由金属阳离子和阴离子构成,属于离子晶体;AlCl3、SiCl4熔、沸点较低,AlCl3易升华,属于分子晶体。
易错辨析 判一判
(1)共价晶体的原子间只存在共价键,而分子晶体内只存在范德华力。
( )
提示 共价晶体的原子间只存在共价键,分子晶体内可能存在范德华力、氢键和共价键。
(2)干冰晶体中既有共价键又有范德华力,因此属于混合型晶体。( )
提示 干冰属于分子晶体。
×
×
(3)十二苯取代并四苯(如图),是目前人们能够得到的最大的全苯取代并多苯结构,呈深红色,发出强烈的荧光。十二苯取代并四苯形成的晶体是分子晶体。( )
(4)在晶体中,若含有金属阳离子,则一定含有阴离子。( )
提示 金属晶体中含有金属阳离子和自由电子。
√
×
重难探究·能力素养全提升
探究一 分子晶体的结构与物理性质
情境探究
冰山是极为宝贵的淡水资源,冰山产生的速率在北冰洋为每年约2 800亿立方米,在南极为每年约18 000亿立方米。大多数冰山的比重为0.9,因此其质量的 在海面以下。冰山露出水面的一角仅仅是整座冰山的 左右。北冰洋的冰山高可达数十米,长可达一二百米,形状多样。南极冰山一般呈平板状,同北冰洋冰山相比,不仅数量多,而且体积巨大。
已知:冰的结构和干冰的晶胞如图
冰
干冰
1.冰为什么会浮在水面上
2.为什么冰刚刚融化为水时,密度增大
提示 由于氢键具有方向性,冰晶体中四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引,形成空隙较大的晶体,密度比液态水小,所以冰会浮在水面上。
提示 在冰晶体中,每个水分子周围只有4个紧邻的水分子,由于水分子之间的主要作用力是氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶点方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,氢键数目减少,水分子间的空隙减小,密度增大。
3.为什么干冰的熔、沸点比冰低而密度却比冰大
提示 由于干冰中的CO2之间只存在范德华力,冰中除了范德华力外还有氢键作用,所以冰的熔、沸点比干冰高。
干冰中1个分子周围有12个紧邻的分子,而水分子间由于氢键的方向性,导致晶体中有相当大的空隙,所以干冰的密度比冰大。
方法突破
1.常见分子晶体的结构分析
(1)干冰
如图表示的是CO2晶体的晶胞。
①CO2晶体的晶胞是面心立方结构,立方体的每个顶点上有1个CO2分子,6个面的面心还有6个CO2分子。
②每个CO2分子周围离该分子距离最近且相等的CO2分子有12个。
③每个晶胞中实际有4个CO2分子。
(2)冰
①冰中水分子之间的相互作用力除范德华力外还有氢键,冰晶体主要是水分子依靠分子间氢键形成的。
②由于氢键具有方向性,每个水分子与周围4个水分子结合,4个水分子也按照这样的规律再与其他的水分子结合。
③每个水分子中的氧原子周围都有4个氢原子,氧原子
与其中的2个氢原子通过共价键结合,距离较近;与其他
水分子的另外2个氢原子靠氢键结合,距离较远。在这
种排列中,分子的间距较大,有很多空隙,比较松散。
因此,液态水变成固态,即水凝固成冰、雪、霜时,密度变小。
2.分子晶体的物理性质
(1)分子晶体熔、沸点低的原因
(2)分子晶体的熔、沸点比较
比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范德华力和氢键)的大小。
(3)分子晶体的导电性
离子晶体熔融状态下可以导电
分子晶体在固态和熔融状态下均不存在自由离子,因而不能导电;易溶于水的电解质在水中全部或部分电离而能够导电(如HCl、H2SO4在水溶液中完全电离,CH3COOH、NH3·H2O部分电离,溶液导电),不溶于水的物质(如CCl4、CH4)或易溶于水的非电解质(如CH3CH2OH、葡萄糖)不能导电。
不能根据水溶液能否导电判断是离子晶体还是分子晶体
应用体验
视角1 分子晶体的判断
1.根据下列各物质的物理性质,判断其固态肯定不属于分子晶体的是( )
①溴化铝(无色晶体,熔点98 ℃,熔融态不导电)
②碳化铝(黄色晶体,熔点2 200 ℃,熔融态不导电)
③氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力)
④五氟化钒(无色晶体,熔点19.5 ℃,易溶于乙醇)
A.①② B.③④
C.②③ D.①④
C
解析 溴化铝的熔点98 ℃,熔融态不导电,说明溴化铝属于分子晶体,故①不选;碳化铝熔点2 200 ℃,熔融态不导电,应为共价晶体,故②选;氟化铝熔融时或溶于水时破坏了相同的作用力,说明破坏的是离子键,应为离子晶体,故③选;五氟化钒熔点19.5 ℃,易溶于乙醇,说明五氟化钒属于分子晶体,故④不选;故选C。
视角2 分子晶体的结构
2.C60分子和C60晶胞示意图如图所示。下列关于C60分子和晶体的说法不正确的是( )
A.C60晶体可能具有很高的熔、沸点
B.C60分子中含有90条C—C键
C.C60晶体的一个晶胞中含有的碳原子数为240
D.C60晶体中每个C60分子与12个C60分子紧邻
A
解析 构成C60晶体的基本微粒是C60分子,因此C60晶体是分子晶体,不可能具有很高的熔、沸点,A错误;根据C60分子结构示意图,可以看出每个碳原
考题点睛
【变式设问】
已知在简单多面体中,存在等量关系:顶点数+面数-棱数=2,该关系为欧拉公式。C60分子由五边形和六边形组成,试计算五边形和六边形个数。
提示 五边形有12个,六边形有20个。
设五边形个数为x,六边形个数为y。
C60分子中顶点数,即碳原子数为60;面数即五边形和六边形总数,为x+y;
棱数即C—C键数,为90,则60+(x+y)-90=2;
视角3 分子晶体熔、沸点的比较
3.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
解析 对结构和组成相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但HF、H2O分子之间都存在氢键,熔、沸点反常,所以A中应为HF>HI>HBr>HCl;B中应为I2>Br2>Cl2>F2;C中应为H2O>H2Te>H2Se>H2S; 只有D正确。
思维建模 解答有关分子晶体组成和性质问题的思维流程如下:
【变式设问】
(1)上题A项物质稳定性的排序如何
(2)上题A项、D项物质在水中的溶解性如何 溶解时化学键是否断裂
提示 HF>HCl>HBr>HI。物质稳定性与化学键的强弱有关。
提示 A项物质易溶于水,溶解时化学键断裂;D项物质难溶于水。
探究二 四类晶体比较
情境探究
钛和钛的合金大量用于航空工业,有“空间金属”之称;钛具有“亲生物”性,在人体内,能抵抗分泌物的腐蚀且无毒,对任何杀菌方法都适用,被广泛用于制医疗器械、人造关节、头盖骨等。
1.K、Ca、Sc、Ti为同周期相邻元素,原子半径相近,为什么单质的熔、沸点逐渐升高
提示 K、Ca、Sc、Ti均为金属晶体,原子半径相近,价电子数增多,金属键增强,因此单质的熔、沸点逐渐升高。
2.Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,为什么
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
提示 TiF4为离子化合物,熔点高;其他三种均为共价化合物,其组成和结构相似,随着相对分子质量增大,分子间作用力增大,熔点逐渐升高。
3.Ti的一种化合物碳化钛是一种灰色金属光泽的结晶固体,硬度仅次于金刚石,熔点3 140 ℃,沸点4 820 ℃,可用于制硬质合金,也用作弧光灯的电极和研磨剂。碳化钛的晶胞结构如图:
则碳化钛属于哪种晶体类型 试写出其化学式。
提示 碳化钛属于共价晶体,化学式为TiC。
方法突破
四类晶体结构与性质比较
类型 离子晶体 共价晶体 分子晶体 金属晶体
构成晶体的粒子 阴、阳离子 原子 分子 金属离子和自由电子
粒子间的作用 离子键 共价键 分子间作用力(范德华力或氢键) 金属离子和自由电子之间的强烈相互作用
确定作用力强弱的一般判断方法 离子电荷、半径 键长(原子半径) 组成结构相似时,比较相对分子质量 离子半径、外围电子数
类型 离子晶体 共价晶体 分子晶体 金属晶体
熔、沸点 较高 熔、沸点一般: 共价晶体>离子晶体>分子晶体 高 低 差别较大(汞常温下为液态,钨熔点为3 410 ℃)
硬度 略硬而脆 大 较小 差别较大
导电性 不良导体(熔化后或溶于水时导电) 不良导体(个别为半导体) 不良导体(部分溶于水电离后导电) 良导体
类型 离子晶体 共价晶体 分子晶体 金属晶体
溶解性 多数易溶于水 不溶于常见溶剂 相似相溶 相似相溶规则将在专题4中学习 一般不溶于水,少数与水反应
机械加工性能 不良 不良 不良 优良
延展性 差 差 差 优良
应用体验
视角1 四种晶体类型的判断
1.有下列几种晶体:A.水晶;B.冰醋酸;C.白磷;D.金刚石;E.晶体氩;F.干冰。
(1)属于分子晶体的是 ,直接由原子构成的分子晶体是 。
(2)属于共价晶体的化合物是 。
(3)直接由原子构成的晶体是 。
(4)受热熔化时,需克服共价键的是 。
答案 (1)B、C、E、F E (2)A (3)A、D、E (4)A、D
解析 (1)根据构成晶体的微粒不同,分子晶体仅由分子构成,大多数共价化合物、非金属单质可构成分子晶体。
(2)常见的共价晶体包括金刚石、晶体硅、SiC、SiO2等。共价晶体有A、D,但化合物只有A。
(3)共价晶体和单原子分子晶体都是由原子直接构成的。
(4)分子晶体熔化时,一般不破坏化学键;共价晶体熔化时,破坏共价键;稀有气体中没有化学键。
2.有关晶体的下列说法中正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.共价晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
B
解析 分子的稳定性与分子间作用力无关,与分子内的共价键有关,分子内共价键键能越大,分子越稳定,A错误;共价晶体熔化时,破坏共价键,因此共价键越强,熔点越高,B正确;冰中水分子间存在氢键,冰融化时断裂了氢键,共价键未发生变化,C错误;NaCl中Na+、Cl-之间存在离子键,NaCl熔化时一定破坏离子键,D错误。
视角2 晶体熔、沸点的判断
3.硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图(即轨道表示式)为 ,晶体硅和碳化硅熔点较高的是 (填化学式)。
(2)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如表所示。
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 。
物质 SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 202.7 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
答案 (1) SiC
(2)SiCl4 SiX4都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大
解析 (1)硅元素的原子序数为14,价电子排布式为3s23p2,则最外层电子的轨道表示式为 。
共价晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是共价晶体,碳原子的原子半径小于硅原子,非金属性强于硅原子,碳硅键的键能大于硅硅键、键长小于硅硅键,则碳硅键强于硅硅键,碳化硅的熔点高于晶体硅。
(2)由题给熔、沸点数据可知,0 ℃即273 K时,SiF4为气态,SiCl4为液态,SiBr4、SiI4为固态。SiX4都是结构相似的分子晶体,分子晶体的沸点取决于分子间作用力的大小,相对分子质量依次增大,分子间作用力依次增大,则SiF4、SiCl4、SiBr4、SiI4的沸点依次升高。
归纳总结 晶体熔、沸点的比较方法
一看晶体之类型:即先判断晶体类型,一般是:共价晶体>离子晶体>分子晶体;
二分类型看晶体:是指把同一类型的晶体放在一起比较,分子晶体比较分子间作用力(氢键和范德华力),共价晶体比较共价键强弱,离子晶体比较离子键强弱,金属晶体比较金属键强弱;
三看氢键特殊性:即在比较分子晶体时还要注意分子间氢键使熔、沸点升高,分子内氢键使熔、沸点降低。
4.下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-24.12 ℃,沸点136.2 ℃,所以TiCl4属于离子晶体
A
解析 C60、I2均为分子晶体,汽化或升华时均克服范德华力,A正确;乙酸分子可形成氢键,其熔、沸点比甲酸甲酯高,B错误;HCl溶于水时破坏的是共价键,C错误;TiCl4熔、沸点很低,属于分子晶体,D错误。
5.航天飞机表层的防热瓦曾成为航天飞机能否安全着陆的制约因素,防热瓦是以石墨材料为主要成分的十分疏松的泡沫陶瓷。下列有关说法合理的是( )
A.石墨成为该泡沫陶瓷主要成分的主要原因是石墨是共价晶体
B.石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C.石墨中碳碳键之间的夹角是109°28'
D.C60也可代替石墨用作航天飞机表层的防热瓦材料
B
解析 石墨为混合型晶体,碳碳键之间的夹角为120°,熔点高,可用作防热瓦材料,B正确,A、C错误;C60晶体为分子晶体,熔点低,不能用作防热瓦材料,D错误。
本 课 结 束
