4.1.2 分子的极性 手性分子课件(共46张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 4.1.2 分子的极性 手性分子课件(共46张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:57:53 | ||
图片预览









文档简介
(共46张PPT)
专题4 分子空间结构与物质性质
第一单元 第2课时 分子的极性 手性分子
素 养 目 标
1.能依据分子的空间结构和键的极性判断分子的极性,能根据分子的极性预测其溶解性,培养变化观念与平衡思想的化学核心素养。
2.能描述手性分子的结构特征和性质特点,认识手性分子在药物研究中的重要作用,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、分子的极性和手性分子
1.极性分子与非极性分子
(1)极性分子:正电荷重心和负电荷重心 的分子。
(2)非极性分子:正电荷重心和负电荷重心 的分子。
不相重合
相重合
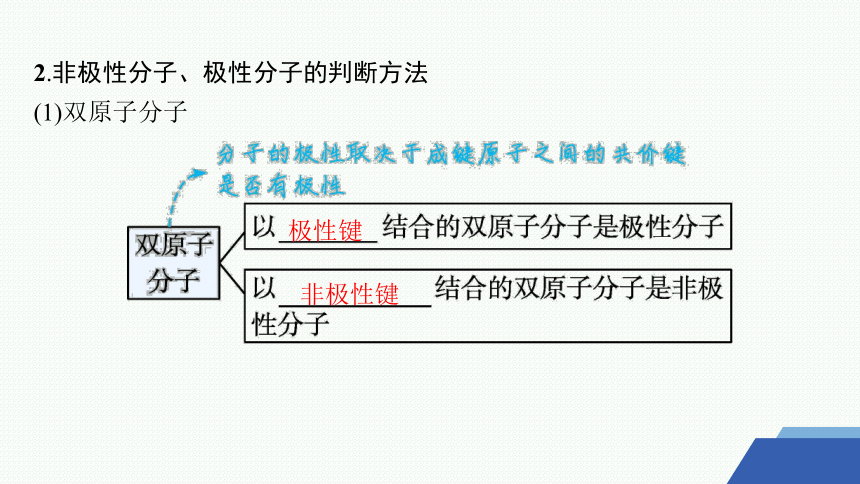
2.非极性分子、极性分子的判断方法
(1)双原子分子
极性键
非极性键
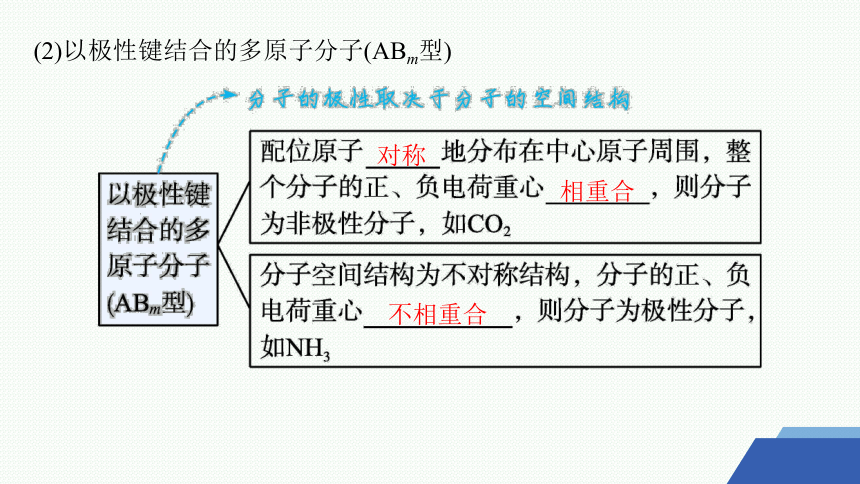
(2)以极性键结合的多原子分子(ABm型)
对称
相重合
不相重合
3.分子的极性对物质溶解性的影响——相似相溶规则
一般情况下,由非极性分子构成的物质易溶于 溶剂,由极性分子构成的物质易溶于 溶剂。
非极性
极性
教材阅读 想一想阅读教材“分子的极性对物质的熔点、沸点、溶解性等”一段。
思考:实验室中常用CCl4或苯萃取溴水中的溴、碘水中的碘,说明Br2、I2在水中溶解度较小,在苯、CCl4中溶解度较大。那么,Br2、I2、CCl4、苯和水是极性分子还是非极性分子
提示 Br2、I2、CCl4、苯是非极性分子,水是极性分子。
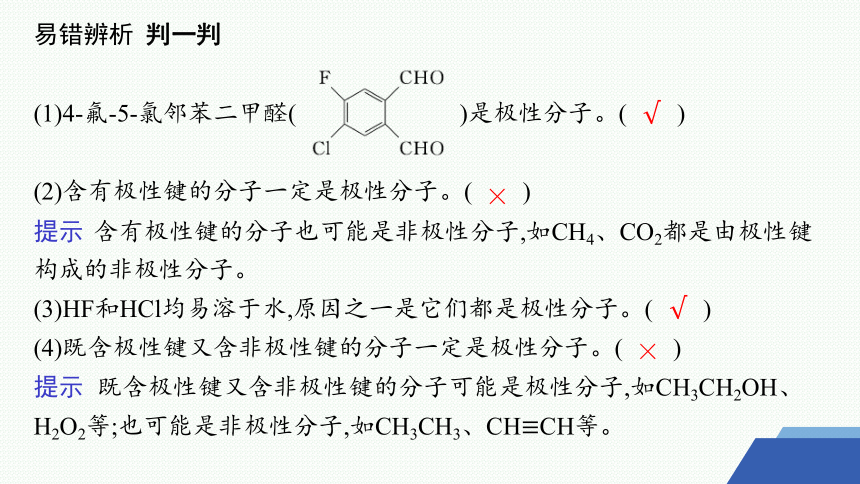
易错辨析 判一判
(1)4-氟-5-氯邻苯二甲醛( )是极性分子。( )
(2)含有极性键的分子一定是极性分子。( )
提示 含有极性键的分子也可能是非极性分子,如CH4、CO2都是由极性键构成的非极性分子。
(3)HF和HCl均易溶于水,原因之一是它们都是极性分子。( )
(4)既含极性键又含非极性键的分子一定是极性分子。( )
提示 既含极性键又含非极性键的分子可能是极性分子,如CH3CH2OH、H2O2等;也可能是非极性分子,如CH3CH3、CH≡CH等。
√
×
√
×
二、手性分子
1.手性异构体和手性分子
和 完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能 的一对分子互称手性异构体。含有手性异构体的分子称为手性分子。
2.手性碳原子
当四个不同的原子或基团连接在碳原子上时,形成的化合物存在
。其中,连接四个不同的原子或基团的 称为手性碳原子。
3.手性异构体的性质
一对手性异构体的物理性质(如熔点、沸点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
组成
原子的排列方式
重叠
手性异构体
碳原子
易错辨析 判一判
(3)手性碳原子一定是饱和碳原子,且碳原子是sp3杂化。( )
√
√
√
×
提示 用“*”标注的碳原子连接了两个相同的基团—CH2OH,因此不是手性碳原子。
重难探究·能力素养全提升
探究一 分子的极性
情境探究
PH3又称磷化氢,是一种剧毒、易燃的储存于钢瓶内的液化压缩气体。纯净的磷化氢气体是无色无味的,但在金属磷化物产生磷化氢气体时常带有大蒜味或腐鱼味。它的结构与NH3分子结构相似。如果遇到极少量其他磷的氢化物如乙磷化氢,会引起自燃。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
PH3分子及其空间结构
1.NH3和PH3分子的中心原子的杂化类型是什么 空间结构是什么
2.NH3分子中的N—H键、PH3分子中的P—H键是极性键还是非极性键 这两种分子是极性分子还是非极性分子
提示 根据杂化轨道的判断方法可知,NH3、PH3分子的中心原子的杂化类型均为sp3杂化;根据价层电子对互斥模型,由于氮、磷原子有1对孤电子对,所以它们的空间结构都是三角锥形。
提示 NH3分子中的N—H键、PH3分子中的P—H键都是极性键,NH3、PH3都是极性分子。
3.NH3在水中的溶解度远大于PH3,为什么
提示 NH3和PH3均为极性分子,但NH3分子极性大于PH3;而且NH3溶于水, NH3与H2O之间可形成氢键,因此NH3在水中的溶解度大于PH3。
方法突破
1.分子极性的判断方法
(1)从分子组成上看
(2)从形成的化学键看
2.判断ABn型分子极性的经验规律
(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,如CH4、SiCl4、BF3、SO3等;若不等则为极性分子,如H2O、NCl3、NO2等。
(2)若中心原子有孤电子对,则为极性分子,如NH3、H2O、PCl3等;若无孤电子对,则为非极性分子,如CS2、BF3、SO3。
3.常见分子的极性
分子类型 键的极性 分子空间结构 分子 极性 代表分子
双原子 分子 A2 非极性键 直线形(对称) 无 H2、Cl2、N2等
AB 极性键 直线形(对称) 有 CO、HF等
三原子 分子 AB2 直线形(对称) 无 CO2、CS2、BeCl2等
V形(不对称) 有 H2O、H2S、SO2等
四原子 分子 AB3 平面正三角形(对称) 无 BF3、BCl3、SO3等
三角锥形(不对称) 有 NH3、PCl3、NF3等
五原子 分子 AB4 正四面体形(对称) 无 CH4、SiF4等
ABnC4-n 四面体形(不对称) 有 CHCl3、CH2Cl2等
应用体验
视角1 分子的空间结构与极性的关系
1.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
C
【变式设问】
(1)该分子可能为正四面体吗 为什么
(2)该分子为平面四边形时是非极性分子的结构是什么
提示 该分子不可能为正四面体,主要原因是A与B之间形成的化学键的键长和A与C之间形成的化学键的键长不等长。
提示 若该分子是平面四边形,在分子完全对称的情况下是非极性分子,空
间结构是 。
归纳总结 (1)AB2C2型分子,若分子为平面四边形结构,则结构有两种,为
和 ,二者互为同分异构体;反之,AB2C2型分子若存在同分
异构体,说明该分子为平面四边形结构。
(2)AB4分子为正四面体形结构,则其二取代产物AB2C2只有一种;AB2C2型分子若不存在同分异构体,说明该分子为四面体形结构。
2.两种非金属元素A、B所形成的下列分子中一定属于极性分子的是( )
D
解析 A项为正四面体结构,结构对称,是非极性分子,不符合题意;B项为直线形结构,结构对称,是非极性分子,不符合题意;C项为平面正三角形结构,结构对称,是非极性分子,不符合题意;D项为三角锥形结构,结构不对称,正负电荷的重心不重合,是极性分子,符合题意。
3.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是( )
A.NCl3晶体为共价晶体
B.分子中N—Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子
D.N—Cl键键能大,故NCl3沸点高
C
解析 由信息可知,三氯化氮常温下为液体,则NCl3晶体为分子晶体,故A错误;不同非金属元素之间形成极性共价键,则分子中N—Cl键是极性共价键,故B错误;NCl3分子中存在N—Cl极性键,分子呈三角锥形,分子结构不对称,为极性分子,故C正确;分子晶体的沸点与分子间作用力有关,与N—Cl键键能无关,故D错误。
视角2 键的极性与分子的极性的关系
4.下列说法正确的是( )
A.由极性键构成的分子都是极性分子
B.含非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子一定是极性分子
D
解析 由极性键构成的分子若空间结构均匀对称,则分子是非极性分子,A项错误;含非极性键的分子也可能是极性分子,如CH3CH2OH等,B项错误;CO2是由极性键形成的非极性分子,C项错误;以极性键结合的双原子分子都是极性分子,D项正确。
5.下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是
( )
A.CO2和SO2 B.CH4和PCl3
C.BF3和NH3 D.HCl和HI
D
解析 题目所给各物质分子中均有极性键。CO2、CH4、BF3为非极性分子,SO2、PCl3、NH3、HCl、HI为极性分子,D正确。
6.[2023河北邢台高二期末]SO3和O3的混合气体经光解作用可生成一种新分子,结构简式如图所示,下列说法正确的是( )
A.O3的键角为120°
B.SO3与O3均为非极性分子
C.SO3的空间结构为平面三角形
D.SO3中心原子为sp3杂化
C
解析 O3分子中心原子价电子对数是 =3,存在1对孤电子对,空间结构为V形,键角小于120°,A错误;SO3分子中硫原子价电子对数是 =3,中心原子为sp2杂化,不存在孤电子对,气体SO3分子的空间结构为平面三角形,正、负电荷重心重合,为非极性分子,O3空间结构为V形,为极性分子,B、D错误,C正确。
思维建模 分子极性的判断方法:
7.北斗卫星导航系统是中国自行研制并开发的,其中第八颗和第九颗北斗卫星是被长征三号甲运载火箭送入太空预定转移轨道的。已知运送卫星的火箭所需燃料除液态过氧化氢外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,经分析发现该分子结构中只有单键。
(1)该氮氢化合物的结构式为 ,其中N原子采取 杂化方式,该分子是 (填“极性”或“非极性”)分子。
(2)若该物质与液态过氧化氢恰好完全反应,产生两种无毒又不污染环境的气态物质,该反应的反应物和生成物既含有极性键又含有非极性键的是
,只含有非极性键的是 ,只含有极性键的是 。
答案 (1) sp3 极性
(2)N2H4和H2O2 N2 H2O
解析 (1)由该物质的相对分子质量和氢元素的质量分数可知其分子式为N2H4,它的结构可看作是NH3分子中的一个H原子被—NH2取代后所得,分子的结构式为 ,分子中的键全部是单键,故N原子的杂化方式与NH3分子中的N原子杂化方式相同,也是sp3杂化,该分子为极性分子。
(2)两者反应后生成的物质无毒又不污染环境,故得到的是N2和H2O,反应的化学方程式为N2H4+2H2O2══N2+4H2O,两种反应物中都含有极性键和非极性键,在生成物H2O中只含有极性键,N2中只含有非极性键。
探究二 手性分子
情境探究
1.有人说“手性分子和镜像分子完全相同,能重合”,对吗 二者有什么关系
2.构成手性碳原子的条件是什么
提示 手性分子,是化学中结构上镜像对称而又不能完全重合的分子。这种情形像是镜子里和镜子外的物体那样,看上去互为镜像(对映异构)。由于是三维结构,它们不管怎样旋转都不会重合,就像左手和右手那样,这对分子互称手性异构体。含有手性异构体的分子称为手性分子。
提示 与碳原子连接的四个原子或基团均不相同。
3.上图中表示出乳酸的两种手性异构体,试写出乳酸的结构简式,并用“*”标注其中的手性碳原子。乳酸在一定条件下反应可生成丙烯酸(CH2═CHCOOH),丙烯酸中含有手性碳原子吗
提示 乳酸的结构简式和手性碳原子为 。丙烯酸中不含手性碳原子。
方法突破
应用体验
视角1 手性分子的判断
1.在有机物分子中,连有4个不同原子或基团的碳原子称为“手性碳原子”,具有手性碳原子的化合物具有光学活性。结构简式如图所示的有机物分子A中含有一个手性碳原子,该有机物具有光学活性。当该有机物发生下列化学变化时,生成的新有机物无光学活性的是( )
A.分子A中的—CHO转化为—COOH
B.—CH2OH与甲酸发生酯化反应生成
C.—CH2OH与金属钠发生反应生成—CH2ONa
D.分子A中的—CHO与H2发生加成反应生成—CH2OH
D
解析 有机物分子A中含有的手性碳原子(标“*”的碳原子)如图所示:
。若生成的新有机物为无光学活性的物质,则原有机物中的手性碳原子上至少有一个原子或基团发生转化使两个原子或基团具有相同的结构。A项反应后—CHO转化为—COOH,手性碳原子仍存在;B
项反应后—CH2OH转化为 ,手性碳原子仍存在;C项反应后—CH2OH 转化为—CH2ONa,手性碳原子仍存在;D项反应后—CHO转化为—CH2OH,与原有机物手性碳原子上的一个基团结构相同,不再存在手性碳原子。
归纳总结 判断手性碳原子的方法
(1)判断一种有机物是否具有手性碳原子,就看该有机物含有的碳原子是否
连有四个互不相同的原子或基团。如 :,R1、R2、R3、R4是互
不相同的原子或基团,中心碳原子为手性碳原子。
(2)在环状化合物中分析某一碳原子连接的基团是否相同,应依次分析所连接的碳原子及所连接的原子是否相同;若相同,则分析下一碳原子及所连接
的原子。如 中,带“*”号的碳原子,连接了—OH、—H和2个—
CH2—,由于有两个相同的—CH2—,则继续分析—CH2—所连接的基团。2个—CH2—分别连接—CH2—和—CHOH—,为两个结构不同的基团,则说明带“*”号的碳原子连接了4个不同的原子或基团,为手性碳原子。
【变式设问】
(1)有机物分子A能在酸性条件下发生水解,水解后生成的有机物是否存在对映异构体
(2)有机物分子A能在Cu作催化剂条件下被O2氧化,氧化产物是否具有旋光性
2.下列分子含有手性碳原子,属于手性分子的是( )
C
解析 A、D中碳原子连接双键,只连接三个原子或基团,不含手性碳原子;B中—CH2—连接两个相同的氢原子,—COOH中碳原子连接双键,也不是四个不同的原子或基团,不含手性碳原子;C中中间碳原子连接—H、—OH、
—CHO和—CH2OH,因此该碳原子为手性碳原子,该分子属于手性分子。
视角2 手性碳原子个数的计算
3.下列有机物中含有两个手性碳原子的是( )
B
解析 由有机物的结构可以看出,A、C、D三项中没有手性碳原子;B项中每个与氯原子相连的碳原子都是手性碳原子。
本 课 结 束
专题4 分子空间结构与物质性质
第一单元 第2课时 分子的极性 手性分子
素 养 目 标
1.能依据分子的空间结构和键的极性判断分子的极性,能根据分子的极性预测其溶解性,培养变化观念与平衡思想的化学核心素养。
2.能描述手性分子的结构特征和性质特点,认识手性分子在药物研究中的重要作用,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、分子的极性和手性分子
1.极性分子与非极性分子
(1)极性分子:正电荷重心和负电荷重心 的分子。
(2)非极性分子:正电荷重心和负电荷重心 的分子。
不相重合
相重合
2.非极性分子、极性分子的判断方法
(1)双原子分子
极性键
非极性键
(2)以极性键结合的多原子分子(ABm型)
对称
相重合
不相重合
3.分子的极性对物质溶解性的影响——相似相溶规则
一般情况下,由非极性分子构成的物质易溶于 溶剂,由极性分子构成的物质易溶于 溶剂。
非极性
极性
教材阅读 想一想阅读教材“分子的极性对物质的熔点、沸点、溶解性等”一段。
思考:实验室中常用CCl4或苯萃取溴水中的溴、碘水中的碘,说明Br2、I2在水中溶解度较小,在苯、CCl4中溶解度较大。那么,Br2、I2、CCl4、苯和水是极性分子还是非极性分子
提示 Br2、I2、CCl4、苯是非极性分子,水是极性分子。
易错辨析 判一判
(1)4-氟-5-氯邻苯二甲醛( )是极性分子。( )
(2)含有极性键的分子一定是极性分子。( )
提示 含有极性键的分子也可能是非极性分子,如CH4、CO2都是由极性键构成的非极性分子。
(3)HF和HCl均易溶于水,原因之一是它们都是极性分子。( )
(4)既含极性键又含非极性键的分子一定是极性分子。( )
提示 既含极性键又含非极性键的分子可能是极性分子,如CH3CH2OH、H2O2等;也可能是非极性分子,如CH3CH3、CH≡CH等。
√
×
√
×
二、手性分子
1.手性异构体和手性分子
和 完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能 的一对分子互称手性异构体。含有手性异构体的分子称为手性分子。
2.手性碳原子
当四个不同的原子或基团连接在碳原子上时,形成的化合物存在
。其中,连接四个不同的原子或基团的 称为手性碳原子。
3.手性异构体的性质
一对手性异构体的物理性质(如熔点、沸点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
组成
原子的排列方式
重叠
手性异构体
碳原子
易错辨析 判一判
(3)手性碳原子一定是饱和碳原子,且碳原子是sp3杂化。( )
√
√
√
×
提示 用“*”标注的碳原子连接了两个相同的基团—CH2OH,因此不是手性碳原子。
重难探究·能力素养全提升
探究一 分子的极性
情境探究
PH3又称磷化氢,是一种剧毒、易燃的储存于钢瓶内的液化压缩气体。纯净的磷化氢气体是无色无味的,但在金属磷化物产生磷化氢气体时常带有大蒜味或腐鱼味。它的结构与NH3分子结构相似。如果遇到极少量其他磷的氢化物如乙磷化氢,会引起自燃。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
PH3分子及其空间结构
1.NH3和PH3分子的中心原子的杂化类型是什么 空间结构是什么
2.NH3分子中的N—H键、PH3分子中的P—H键是极性键还是非极性键 这两种分子是极性分子还是非极性分子
提示 根据杂化轨道的判断方法可知,NH3、PH3分子的中心原子的杂化类型均为sp3杂化;根据价层电子对互斥模型,由于氮、磷原子有1对孤电子对,所以它们的空间结构都是三角锥形。
提示 NH3分子中的N—H键、PH3分子中的P—H键都是极性键,NH3、PH3都是极性分子。
3.NH3在水中的溶解度远大于PH3,为什么
提示 NH3和PH3均为极性分子,但NH3分子极性大于PH3;而且NH3溶于水, NH3与H2O之间可形成氢键,因此NH3在水中的溶解度大于PH3。
方法突破
1.分子极性的判断方法
(1)从分子组成上看
(2)从形成的化学键看
2.判断ABn型分子极性的经验规律
(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,如CH4、SiCl4、BF3、SO3等;若不等则为极性分子,如H2O、NCl3、NO2等。
(2)若中心原子有孤电子对,则为极性分子,如NH3、H2O、PCl3等;若无孤电子对,则为非极性分子,如CS2、BF3、SO3。
3.常见分子的极性
分子类型 键的极性 分子空间结构 分子 极性 代表分子
双原子 分子 A2 非极性键 直线形(对称) 无 H2、Cl2、N2等
AB 极性键 直线形(对称) 有 CO、HF等
三原子 分子 AB2 直线形(对称) 无 CO2、CS2、BeCl2等
V形(不对称) 有 H2O、H2S、SO2等
四原子 分子 AB3 平面正三角形(对称) 无 BF3、BCl3、SO3等
三角锥形(不对称) 有 NH3、PCl3、NF3等
五原子 分子 AB4 正四面体形(对称) 无 CH4、SiF4等
ABnC4-n 四面体形(不对称) 有 CHCl3、CH2Cl2等
应用体验
视角1 分子的空间结构与极性的关系
1.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
C
【变式设问】
(1)该分子可能为正四面体吗 为什么
(2)该分子为平面四边形时是非极性分子的结构是什么
提示 该分子不可能为正四面体,主要原因是A与B之间形成的化学键的键长和A与C之间形成的化学键的键长不等长。
提示 若该分子是平面四边形,在分子完全对称的情况下是非极性分子,空
间结构是 。
归纳总结 (1)AB2C2型分子,若分子为平面四边形结构,则结构有两种,为
和 ,二者互为同分异构体;反之,AB2C2型分子若存在同分
异构体,说明该分子为平面四边形结构。
(2)AB4分子为正四面体形结构,则其二取代产物AB2C2只有一种;AB2C2型分子若不存在同分异构体,说明该分子为四面体形结构。
2.两种非金属元素A、B所形成的下列分子中一定属于极性分子的是( )
D
解析 A项为正四面体结构,结构对称,是非极性分子,不符合题意;B项为直线形结构,结构对称,是非极性分子,不符合题意;C项为平面正三角形结构,结构对称,是非极性分子,不符合题意;D项为三角锥形结构,结构不对称,正负电荷的重心不重合,是极性分子,符合题意。
3.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是( )
A.NCl3晶体为共价晶体
B.分子中N—Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子
D.N—Cl键键能大,故NCl3沸点高
C
解析 由信息可知,三氯化氮常温下为液体,则NCl3晶体为分子晶体,故A错误;不同非金属元素之间形成极性共价键,则分子中N—Cl键是极性共价键,故B错误;NCl3分子中存在N—Cl极性键,分子呈三角锥形,分子结构不对称,为极性分子,故C正确;分子晶体的沸点与分子间作用力有关,与N—Cl键键能无关,故D错误。
视角2 键的极性与分子的极性的关系
4.下列说法正确的是( )
A.由极性键构成的分子都是极性分子
B.含非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子一定是极性分子
D
解析 由极性键构成的分子若空间结构均匀对称,则分子是非极性分子,A项错误;含非极性键的分子也可能是极性分子,如CH3CH2OH等,B项错误;CO2是由极性键形成的非极性分子,C项错误;以极性键结合的双原子分子都是极性分子,D项正确。
5.下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是
( )
A.CO2和SO2 B.CH4和PCl3
C.BF3和NH3 D.HCl和HI
D
解析 题目所给各物质分子中均有极性键。CO2、CH4、BF3为非极性分子,SO2、PCl3、NH3、HCl、HI为极性分子,D正确。
6.[2023河北邢台高二期末]SO3和O3的混合气体经光解作用可生成一种新分子,结构简式如图所示,下列说法正确的是( )
A.O3的键角为120°
B.SO3与O3均为非极性分子
C.SO3的空间结构为平面三角形
D.SO3中心原子为sp3杂化
C
解析 O3分子中心原子价电子对数是 =3,存在1对孤电子对,空间结构为V形,键角小于120°,A错误;SO3分子中硫原子价电子对数是 =3,中心原子为sp2杂化,不存在孤电子对,气体SO3分子的空间结构为平面三角形,正、负电荷重心重合,为非极性分子,O3空间结构为V形,为极性分子,B、D错误,C正确。
思维建模 分子极性的判断方法:
7.北斗卫星导航系统是中国自行研制并开发的,其中第八颗和第九颗北斗卫星是被长征三号甲运载火箭送入太空预定转移轨道的。已知运送卫星的火箭所需燃料除液态过氧化氢外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,经分析发现该分子结构中只有单键。
(1)该氮氢化合物的结构式为 ,其中N原子采取 杂化方式,该分子是 (填“极性”或“非极性”)分子。
(2)若该物质与液态过氧化氢恰好完全反应,产生两种无毒又不污染环境的气态物质,该反应的反应物和生成物既含有极性键又含有非极性键的是
,只含有非极性键的是 ,只含有极性键的是 。
答案 (1) sp3 极性
(2)N2H4和H2O2 N2 H2O
解析 (1)由该物质的相对分子质量和氢元素的质量分数可知其分子式为N2H4,它的结构可看作是NH3分子中的一个H原子被—NH2取代后所得,分子的结构式为 ,分子中的键全部是单键,故N原子的杂化方式与NH3分子中的N原子杂化方式相同,也是sp3杂化,该分子为极性分子。
(2)两者反应后生成的物质无毒又不污染环境,故得到的是N2和H2O,反应的化学方程式为N2H4+2H2O2══N2+4H2O,两种反应物中都含有极性键和非极性键,在生成物H2O中只含有极性键,N2中只含有非极性键。
探究二 手性分子
情境探究
1.有人说“手性分子和镜像分子完全相同,能重合”,对吗 二者有什么关系
2.构成手性碳原子的条件是什么
提示 手性分子,是化学中结构上镜像对称而又不能完全重合的分子。这种情形像是镜子里和镜子外的物体那样,看上去互为镜像(对映异构)。由于是三维结构,它们不管怎样旋转都不会重合,就像左手和右手那样,这对分子互称手性异构体。含有手性异构体的分子称为手性分子。
提示 与碳原子连接的四个原子或基团均不相同。
3.上图中表示出乳酸的两种手性异构体,试写出乳酸的结构简式,并用“*”标注其中的手性碳原子。乳酸在一定条件下反应可生成丙烯酸(CH2═CHCOOH),丙烯酸中含有手性碳原子吗
提示 乳酸的结构简式和手性碳原子为 。丙烯酸中不含手性碳原子。
方法突破
应用体验
视角1 手性分子的判断
1.在有机物分子中,连有4个不同原子或基团的碳原子称为“手性碳原子”,具有手性碳原子的化合物具有光学活性。结构简式如图所示的有机物分子A中含有一个手性碳原子,该有机物具有光学活性。当该有机物发生下列化学变化时,生成的新有机物无光学活性的是( )
A.分子A中的—CHO转化为—COOH
B.—CH2OH与甲酸发生酯化反应生成
C.—CH2OH与金属钠发生反应生成—CH2ONa
D.分子A中的—CHO与H2发生加成反应生成—CH2OH
D
解析 有机物分子A中含有的手性碳原子(标“*”的碳原子)如图所示:
。若生成的新有机物为无光学活性的物质,则原有机物中的手性碳原子上至少有一个原子或基团发生转化使两个原子或基团具有相同的结构。A项反应后—CHO转化为—COOH,手性碳原子仍存在;B
项反应后—CH2OH转化为 ,手性碳原子仍存在;C项反应后—CH2OH 转化为—CH2ONa,手性碳原子仍存在;D项反应后—CHO转化为—CH2OH,与原有机物手性碳原子上的一个基团结构相同,不再存在手性碳原子。
归纳总结 判断手性碳原子的方法
(1)判断一种有机物是否具有手性碳原子,就看该有机物含有的碳原子是否
连有四个互不相同的原子或基团。如 :,R1、R2、R3、R4是互
不相同的原子或基团,中心碳原子为手性碳原子。
(2)在环状化合物中分析某一碳原子连接的基团是否相同,应依次分析所连接的碳原子及所连接的原子是否相同;若相同,则分析下一碳原子及所连接
的原子。如 中,带“*”号的碳原子,连接了—OH、—H和2个—
CH2—,由于有两个相同的—CH2—,则继续分析—CH2—所连接的基团。2个—CH2—分别连接—CH2—和—CHOH—,为两个结构不同的基团,则说明带“*”号的碳原子连接了4个不同的原子或基团,为手性碳原子。
【变式设问】
(1)有机物分子A能在酸性条件下发生水解,水解后生成的有机物是否存在对映异构体
(2)有机物分子A能在Cu作催化剂条件下被O2氧化,氧化产物是否具有旋光性
2.下列分子含有手性碳原子,属于手性分子的是( )
C
解析 A、D中碳原子连接双键,只连接三个原子或基团,不含手性碳原子;B中—CH2—连接两个相同的氢原子,—COOH中碳原子连接双键,也不是四个不同的原子或基团,不含手性碳原子;C中中间碳原子连接—H、—OH、
—CHO和—CH2OH,因此该碳原子为手性碳原子,该分子属于手性分子。
视角2 手性碳原子个数的计算
3.下列有机物中含有两个手性碳原子的是( )
B
解析 由有机物的结构可以看出,A、C、D三项中没有手性碳原子;B项中每个与氯原子相连的碳原子都是手性碳原子。
本 课 结 束
