4.2.2 配合物的形成 课件(共34张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 4.2.2 配合物的形成 课件(共34张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览









文档简介
(共34张PPT)
专题4 分子空间结构与物质性质
第二单元 第1课时 配合物的形成
素 养 目 标
1.认识简单配位化合物的成键特征;能正确运用化学符号描述配合物的组成,培养宏观辨识与微观探析的化学核心素养。
2.学会简单配合物的实验制备;能联系配合物的组成和结构解释相关的实验现象,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
配合物的形成
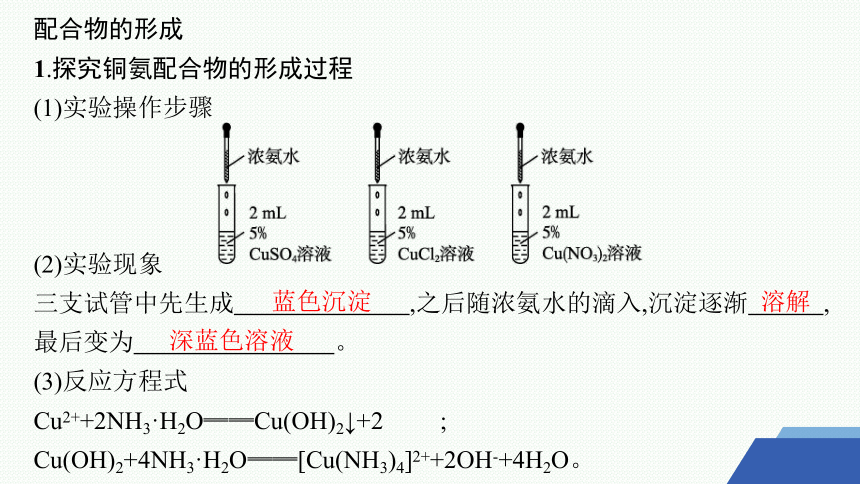
1.探究铜氨配合物的形成过程
(1)实验操作步骤
(2)实验现象
三支试管中先生成 ,之后随浓氨水的滴入,沉淀逐渐 ,最后变为 。
(3)反应方程式
Cu2++2NH3·H2O══Cu(OH)2↓+2 ;
Cu(OH)2+4NH3·H2O══[Cu(NH3)4]2++2OH-+4H2O。
蓝色沉淀
溶解
深蓝色溶液
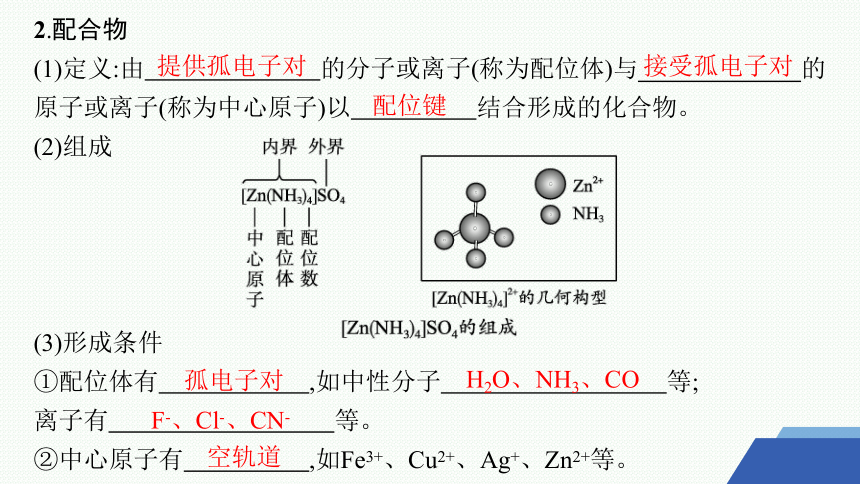
2.配合物
(1)定义:由 的分子或离子(称为配位体)与 的原子或离子(称为中心原子)以 结合形成的化合物。
(2)组成
(3)形成条件
①配位体有 ,如中性分子 等;
离子有 等。
②中心原子有 ,如Fe3+、Cu2+、Ag+、Zn2+等。
提供孤电子对
接受孤电子对
配位键
孤电子对
H2O、NH3、CO
F-、Cl-、CN-
空轨道
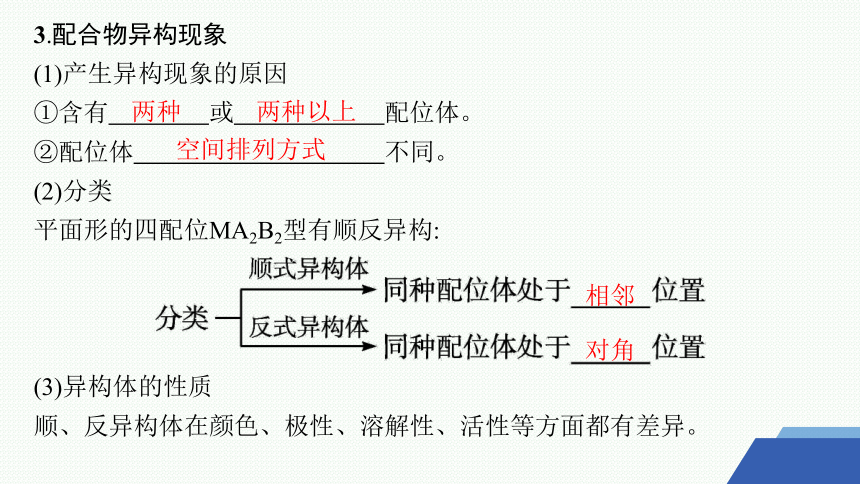
3.配合物异构现象
(1)产生异构现象的原因
①含有 或 配位体。
②配位体 不同。
(2)分类
平面形的四配位MA2B2型有顺反异构:
(3)异构体的性质
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。
两种
两种以上
空间排列方式
相邻
对角
教材阅读 想一想阅读教材“基础实验”。
思考:硫酸铜溶于水可生成[Cu(H2O)4]2+,在[Cu(H2O)4]2+中哪种微粒提供孤电子对,哪种微粒提供空轨道
提示 在[Cu(H2O)4]2+中H2O提供孤电子对,Cu2+提供空轨道。
易错辨析 判一判
(1)配位键的形成过程与共价键完全相同。( )
提示 形成配位键的共用电子对是由一方提供而不是由双方共同提供的,配位键的形成过程与共价键不同,但是一旦形成之后与共价键没有区别。
(2)含有配位键的化合物中一定含过渡元素。( )
提示 含配位键的化合物不一定含过渡元素,如NH4Cl、Na3[AlF6]等。
(3)配合物[Cu(H2O)4]SO4中,配位体是H2O,配位数是4。( )
(4)在[Cu(NH3)4]2+中含有配位键、共价键和离子键。( )
提示 在[Cu(NH3)4]2+中含有配位键、共价键,不含离子键。
×
×
√
×
重难探究·能力素养全提升
探究 配位键与配合物
情境探究
向CuSO4溶液中滴入氨水,现象:生成蓝色沉淀,随氨水的增加,沉淀逐渐溶解,生成了深蓝色溶液。
1.整个过程中发生了哪些反应
提示 Cu2++2NH3·H2O══Cu(OH)2↓+2 ,
Cu(OH)2+4NH3·H2O══[Cu(NH3)4]2++2OH-+4H2O。
2.利用化学平衡移动原理解释配离子是如何形成的
3.不考虑空间结构,请绘制[Cu(NH3)4]2+的结构示意图,并计算1 mol该离子含有σ键的个数。设NA为阿伏加德罗常数的值。
提示 Cu(OH)2水溶液中存在Cu(OH)2(s)══Cu2+(aq)+2OH-(aq)平衡,继续滴入氨水时,NH3分子与Cu2+形成[Cu(NH3)4]2+配离子,配离子很稳定,促使以上平衡右移,Cu(OH)2逐渐溶解。
提示 结构示意图为 ,
1 mol [Cu(NH3)4]2+含σ键物质的量3 mol×4+4 mol=16 mol,个数为16NA。
方法突破
1.配位键
2.配合物
(1)组成
不是含有配位键的化合物就是配合物,如NH4Cl含有配位键但不是配合物
配合物的组成包含中心原子、配位体、配位数、内界和外界等概念。以[Cu(NH3)4]SO4为例说明如下。
(2)电离
不是所有的配合物都有外界,如配合物[Ni(CO)4]只有内界没有外界
配合物的内界和外界之间多是以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。如[Co(NH3)5Cl]Cl2══[Co(NH3)5Cl]2++2Cl-。
3.配合物的空间结构
配合物的空间结构指的是配位体围绕着中心原子排布的几何构型。配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间结构的配合物。
应用体验
视角1 配位键的形成
1.以下微粒含配位键的是( )
⑧[Ag(NH3)2]OH
A.①④⑤⑥⑦⑧ B.①②④⑧
C.③⑤⑥⑦ D.全部
A
⑤Fe(CO)5中配位体CO与中心原子Fe之间形成配位键;
⑥Fe(SCN)3中配位体SCN-与Fe3+间形成配位键;
⑦H3O+中有1个H+与O原子间形成配位键;
⑧[Ag(NH3)2]OH中配位体NH3与Ag+间形成配位键。
综合以上分析,①④⑤⑥⑦⑧中都存在配位键。
思维建模 解答有关配位键的理解和判断问题的思维流程如下:
【变式设问】
(2)[Ag(NH3)2]OH是强碱还是弱碱
提示 强碱。
提示 [ ]+
2.配位键是一种常见的化学键,按要求回答下列问题:
(1)含Ti3+的一种配合物的化学式为[Ti(H2O)5Cl]Cl2·H2O,其配离子中含有的化学键类型有 。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为 。
(3)铁是生活中常用的一种金属,其常见的离子有Fe2+、Fe3+,其中Fe2+可用K3[Fe(CN)6](赤血盐)溶液检验。
①铁单质中化学键为 (填名称)。
②K3[Fe(CN)6]晶体中各种微粒的作用力有 (填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
(4)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为 。
解析 (1)题给物质的配离子为[Ti(H2O)5Cl]2+,含有配位键与极性共价键(或共价键)。
(2)N原子的孤电子对与B原子的空轨道形成配位键。
(3)①铁单质中含金属键。
②K3[Fe(CN)6]属于配位化合物又属于离子化合物,含配位键、离子键,CN-中含有共价键。
(4)在蒸气状态下FeCl3以双聚分子存在,即分子式为Fe2Cl6。
视角2 配位键和共价键的异同
3.下列说法中错误的是( )
A.配位键是一种特殊的共价键
B.NH4NO3、Pt(NH3)2Cl2都含有配位键
C.共价键的形成条件是成键原子必须有未成对电子
D.形成配位键的条件是一方有空轨道,一方有孤电子对
C
解析 NH4NO3中的 含有配位键,Pt(NH3)2Cl2为配合物,含有配位键,B正确;配位键是一种特殊的共价键,成键的两个原子一方提供孤电子对,另一方有空轨道,可接受孤电子对,A、D正确,C错误。
视角3 配合物
4.配合物CrCl3·6H2O的中心原子Cr3+的配位数为6,H2O和Cl-均可作配位体,H2O、Cl-和Cr3+有三种不同的连接方式,形成三种物质:一种呈紫罗兰色、一种呈暗绿色、一种呈亮绿色。将它们配成相同物质的量浓度的溶液,各取相同体积,向其中分别加入过量的AgNO3溶液,完全反应后,所得沉淀的物质的量之比为3∶2∶1。
(1)请推断出三种配合物的内界,并简单说明理由。
(2)写出三种配合物的电离方程式。
(3)配合物CrCl3·6H2O的内界离子属于哪种空间结构
答案 (1)紫罗兰色配合物的内界:[Cr(H2O)6]3+,暗绿色配合物的内界:[Cr(H2O)5Cl]2+,亮绿色配合物的内界:[Cr(H2O)4Cl2]+。根据它们与过量AgNO3溶液反应时生成沉淀的物质的量之比为3∶2∶1,可知分别有3个Cl-、2个Cl-、1个Cl-在外界。
(2)[Cr(H2O)6]Cl3══[Cr(H2O)6]3++3Cl-
[Cr(H2O)5Cl]Cl2·H2O══[Cr(H2O)5Cl]2++2Cl-+H2O
[Cr(H2O)4Cl2]Cl·2H2O══[Cr(H2O)4Cl2]++Cl-+2H2O
(3)八面体
解析 CrCl3·6H2O的中心原子Cr3+的配位数为6,H2O和Cl-均可作配位体,则其化学式可表示为[Cr(H2O)6-nCln]Cl3-n·nH2O,当其与AgNO3溶液反应时,只有外界的Cl-可形成AgCl沉淀,再根据它们与AgNO3溶液反应时生成AgCl沉淀的物质的量之比为3∶2∶1,可知分别有3个Cl-、2个Cl-、1个Cl-在外界,进而可确定配位体分别为6分子H2O、5分子H2O和1个Cl-、4分子H2O和2个Cl-,则可确定各配合物的内界。三种配合物的化学式:紫罗兰色配合物为[Cr(H2O)6]Cl3,暗绿色配合物为[Cr(H2O)5Cl]Cl2·H2O,亮绿色配合物为[Cr(H2O)4Cl2]Cl·2H2O。由于配合物CrCl3·6H2O的内界配位数均为6,故配合物为八面体构型。
归纳总结 题中配合物CrCl3·6H2O的中心原子Cr3+的配位数为6,根据它们与过量AgNO3溶液反应生成AgCl沉淀的物质的量之比,可推断其外界的Cl-数,也就知道其内界的Cl-数,再由配位数为6推断内界和外界的水分子数,进而确定各自的化学式。
5.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而NH3分子不配位
C
解析 在PtCl4·2NH3水溶液中加入AgNO3溶液无沉淀生成,以强碱处理无NH3放出,说明Cl-、NH3均处于内界,故该配合物中中心原子的配位数为6,电荷数为4,Cl-和NH3分子均与Pt4+配位,A、D错误,C正确;Pt4+配位数为6,则配合物的空间结构为八面体形,B错误。
6.[2023河北秦皇岛高二期末]三氯化六氨合钴[Co(NH3)6]Cl3是重要的化工原料,可用反应2[Co(H2O)6]Cl2+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+14H2O制备,若没有活性炭催化,则生成[Co(NH3)5Cl]Cl2。下列说法错误的是( )
A.[Co(H2O)6]Cl2和[Co(NH3)6]Cl3中Co的化合价不同
B.[Co(NH3)6]Cl3的配体为NH3,中心离子的配位数为6
C.用1 mol [Co(NH3)5Cl]Cl2与足量AgNO3溶液反应,得到沉淀的物质的量为3 mol
D.1 mol [Co(NH3)5Cl]Cl2中含有21 mol σ键
C
解析 [Co(H2O)6]Cl2中Co为+2价,[Co(NH3)6]Cl3中Co为+3价,故A正确;
[Co(NH3)6]Cl3的配体为NH3,个数为6,中心离子的配位数为6,故B正确;
[Co(NH3)5Cl]Cl2的电离方程式为[Co(NH3)5Cl]Cl2══ [Co(NH3)5Cl]2++2Cl-,故和足量AgNO3溶液反应,得到沉淀的物质的量为2 mol,故C错误;
1 mol [Co(NH3)5Cl]Cl2中含有6 mol配位键,1 mol NH3中含有3 mol σ键,共含有21 mol σ键,故D正确。
7.下列关于配合物的说法正确的是( )
A.配合物的外界是指配合物中的阴离子
B.只有过渡金属元素能形成配合物
C.化学式为Pt(NH3)2Cl2的物质只有一种
D.Na3[AlF6]的中心原子的配位数为6
D
解析 配合物的外界可以是阳离子(如Na3[AlF6]),也可以是阴离子(如[Cu(NH3)4]SO4),A错误;不仅仅是过渡金属元素能形成配合物,部分主族元素也可以,如Na3[AlF6],B错误;Pt(NH3)2Cl2存在顺反异构体,C错误;Na3[AlF6]的中心原子是Al3+,配位体是F-,其配位数是6,D正确。
本 课 结 束
专题4 分子空间结构与物质性质
第二单元 第1课时 配合物的形成
素 养 目 标
1.认识简单配位化合物的成键特征;能正确运用化学符号描述配合物的组成,培养宏观辨识与微观探析的化学核心素养。
2.学会简单配合物的实验制备;能联系配合物的组成和结构解释相关的实验现象,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
配合物的形成
1.探究铜氨配合物的形成过程
(1)实验操作步骤
(2)实验现象
三支试管中先生成 ,之后随浓氨水的滴入,沉淀逐渐 ,最后变为 。
(3)反应方程式
Cu2++2NH3·H2O══Cu(OH)2↓+2 ;
Cu(OH)2+4NH3·H2O══[Cu(NH3)4]2++2OH-+4H2O。
蓝色沉淀
溶解
深蓝色溶液
2.配合物
(1)定义:由 的分子或离子(称为配位体)与 的原子或离子(称为中心原子)以 结合形成的化合物。
(2)组成
(3)形成条件
①配位体有 ,如中性分子 等;
离子有 等。
②中心原子有 ,如Fe3+、Cu2+、Ag+、Zn2+等。
提供孤电子对
接受孤电子对
配位键
孤电子对
H2O、NH3、CO
F-、Cl-、CN-
空轨道
3.配合物异构现象
(1)产生异构现象的原因
①含有 或 配位体。
②配位体 不同。
(2)分类
平面形的四配位MA2B2型有顺反异构:
(3)异构体的性质
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。
两种
两种以上
空间排列方式
相邻
对角
教材阅读 想一想阅读教材“基础实验”。
思考:硫酸铜溶于水可生成[Cu(H2O)4]2+,在[Cu(H2O)4]2+中哪种微粒提供孤电子对,哪种微粒提供空轨道
提示 在[Cu(H2O)4]2+中H2O提供孤电子对,Cu2+提供空轨道。
易错辨析 判一判
(1)配位键的形成过程与共价键完全相同。( )
提示 形成配位键的共用电子对是由一方提供而不是由双方共同提供的,配位键的形成过程与共价键不同,但是一旦形成之后与共价键没有区别。
(2)含有配位键的化合物中一定含过渡元素。( )
提示 含配位键的化合物不一定含过渡元素,如NH4Cl、Na3[AlF6]等。
(3)配合物[Cu(H2O)4]SO4中,配位体是H2O,配位数是4。( )
(4)在[Cu(NH3)4]2+中含有配位键、共价键和离子键。( )
提示 在[Cu(NH3)4]2+中含有配位键、共价键,不含离子键。
×
×
√
×
重难探究·能力素养全提升
探究 配位键与配合物
情境探究
向CuSO4溶液中滴入氨水,现象:生成蓝色沉淀,随氨水的增加,沉淀逐渐溶解,生成了深蓝色溶液。
1.整个过程中发生了哪些反应
提示 Cu2++2NH3·H2O══Cu(OH)2↓+2 ,
Cu(OH)2+4NH3·H2O══[Cu(NH3)4]2++2OH-+4H2O。
2.利用化学平衡移动原理解释配离子是如何形成的
3.不考虑空间结构,请绘制[Cu(NH3)4]2+的结构示意图,并计算1 mol该离子含有σ键的个数。设NA为阿伏加德罗常数的值。
提示 Cu(OH)2水溶液中存在Cu(OH)2(s)══Cu2+(aq)+2OH-(aq)平衡,继续滴入氨水时,NH3分子与Cu2+形成[Cu(NH3)4]2+配离子,配离子很稳定,促使以上平衡右移,Cu(OH)2逐渐溶解。
提示 结构示意图为 ,
1 mol [Cu(NH3)4]2+含σ键物质的量3 mol×4+4 mol=16 mol,个数为16NA。
方法突破
1.配位键
2.配合物
(1)组成
不是含有配位键的化合物就是配合物,如NH4Cl含有配位键但不是配合物
配合物的组成包含中心原子、配位体、配位数、内界和外界等概念。以[Cu(NH3)4]SO4为例说明如下。
(2)电离
不是所有的配合物都有外界,如配合物[Ni(CO)4]只有内界没有外界
配合物的内界和外界之间多是以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。如[Co(NH3)5Cl]Cl2══[Co(NH3)5Cl]2++2Cl-。
3.配合物的空间结构
配合物的空间结构指的是配位体围绕着中心原子排布的几何构型。配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间结构的配合物。
应用体验
视角1 配位键的形成
1.以下微粒含配位键的是( )
⑧[Ag(NH3)2]OH
A.①④⑤⑥⑦⑧ B.①②④⑧
C.③⑤⑥⑦ D.全部
A
⑤Fe(CO)5中配位体CO与中心原子Fe之间形成配位键;
⑥Fe(SCN)3中配位体SCN-与Fe3+间形成配位键;
⑦H3O+中有1个H+与O原子间形成配位键;
⑧[Ag(NH3)2]OH中配位体NH3与Ag+间形成配位键。
综合以上分析,①④⑤⑥⑦⑧中都存在配位键。
思维建模 解答有关配位键的理解和判断问题的思维流程如下:
【变式设问】
(2)[Ag(NH3)2]OH是强碱还是弱碱
提示 强碱。
提示 [ ]+
2.配位键是一种常见的化学键,按要求回答下列问题:
(1)含Ti3+的一种配合物的化学式为[Ti(H2O)5Cl]Cl2·H2O,其配离子中含有的化学键类型有 。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为 。
(3)铁是生活中常用的一种金属,其常见的离子有Fe2+、Fe3+,其中Fe2+可用K3[Fe(CN)6](赤血盐)溶液检验。
①铁单质中化学键为 (填名称)。
②K3[Fe(CN)6]晶体中各种微粒的作用力有 (填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
(4)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为 。
解析 (1)题给物质的配离子为[Ti(H2O)5Cl]2+,含有配位键与极性共价键(或共价键)。
(2)N原子的孤电子对与B原子的空轨道形成配位键。
(3)①铁单质中含金属键。
②K3[Fe(CN)6]属于配位化合物又属于离子化合物,含配位键、离子键,CN-中含有共价键。
(4)在蒸气状态下FeCl3以双聚分子存在,即分子式为Fe2Cl6。
视角2 配位键和共价键的异同
3.下列说法中错误的是( )
A.配位键是一种特殊的共价键
B.NH4NO3、Pt(NH3)2Cl2都含有配位键
C.共价键的形成条件是成键原子必须有未成对电子
D.形成配位键的条件是一方有空轨道,一方有孤电子对
C
解析 NH4NO3中的 含有配位键,Pt(NH3)2Cl2为配合物,含有配位键,B正确;配位键是一种特殊的共价键,成键的两个原子一方提供孤电子对,另一方有空轨道,可接受孤电子对,A、D正确,C错误。
视角3 配合物
4.配合物CrCl3·6H2O的中心原子Cr3+的配位数为6,H2O和Cl-均可作配位体,H2O、Cl-和Cr3+有三种不同的连接方式,形成三种物质:一种呈紫罗兰色、一种呈暗绿色、一种呈亮绿色。将它们配成相同物质的量浓度的溶液,各取相同体积,向其中分别加入过量的AgNO3溶液,完全反应后,所得沉淀的物质的量之比为3∶2∶1。
(1)请推断出三种配合物的内界,并简单说明理由。
(2)写出三种配合物的电离方程式。
(3)配合物CrCl3·6H2O的内界离子属于哪种空间结构
答案 (1)紫罗兰色配合物的内界:[Cr(H2O)6]3+,暗绿色配合物的内界:[Cr(H2O)5Cl]2+,亮绿色配合物的内界:[Cr(H2O)4Cl2]+。根据它们与过量AgNO3溶液反应时生成沉淀的物质的量之比为3∶2∶1,可知分别有3个Cl-、2个Cl-、1个Cl-在外界。
(2)[Cr(H2O)6]Cl3══[Cr(H2O)6]3++3Cl-
[Cr(H2O)5Cl]Cl2·H2O══[Cr(H2O)5Cl]2++2Cl-+H2O
[Cr(H2O)4Cl2]Cl·2H2O══[Cr(H2O)4Cl2]++Cl-+2H2O
(3)八面体
解析 CrCl3·6H2O的中心原子Cr3+的配位数为6,H2O和Cl-均可作配位体,则其化学式可表示为[Cr(H2O)6-nCln]Cl3-n·nH2O,当其与AgNO3溶液反应时,只有外界的Cl-可形成AgCl沉淀,再根据它们与AgNO3溶液反应时生成AgCl沉淀的物质的量之比为3∶2∶1,可知分别有3个Cl-、2个Cl-、1个Cl-在外界,进而可确定配位体分别为6分子H2O、5分子H2O和1个Cl-、4分子H2O和2个Cl-,则可确定各配合物的内界。三种配合物的化学式:紫罗兰色配合物为[Cr(H2O)6]Cl3,暗绿色配合物为[Cr(H2O)5Cl]Cl2·H2O,亮绿色配合物为[Cr(H2O)4Cl2]Cl·2H2O。由于配合物CrCl3·6H2O的内界配位数均为6,故配合物为八面体构型。
归纳总结 题中配合物CrCl3·6H2O的中心原子Cr3+的配位数为6,根据它们与过量AgNO3溶液反应生成AgCl沉淀的物质的量之比,可推断其外界的Cl-数,也就知道其内界的Cl-数,再由配位数为6推断内界和外界的水分子数,进而确定各自的化学式。
5.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而NH3分子不配位
C
解析 在PtCl4·2NH3水溶液中加入AgNO3溶液无沉淀生成,以强碱处理无NH3放出,说明Cl-、NH3均处于内界,故该配合物中中心原子的配位数为6,电荷数为4,Cl-和NH3分子均与Pt4+配位,A、D错误,C正确;Pt4+配位数为6,则配合物的空间结构为八面体形,B错误。
6.[2023河北秦皇岛高二期末]三氯化六氨合钴[Co(NH3)6]Cl3是重要的化工原料,可用反应2[Co(H2O)6]Cl2+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+14H2O制备,若没有活性炭催化,则生成[Co(NH3)5Cl]Cl2。下列说法错误的是( )
A.[Co(H2O)6]Cl2和[Co(NH3)6]Cl3中Co的化合价不同
B.[Co(NH3)6]Cl3的配体为NH3,中心离子的配位数为6
C.用1 mol [Co(NH3)5Cl]Cl2与足量AgNO3溶液反应,得到沉淀的物质的量为3 mol
D.1 mol [Co(NH3)5Cl]Cl2中含有21 mol σ键
C
解析 [Co(H2O)6]Cl2中Co为+2价,[Co(NH3)6]Cl3中Co为+3价,故A正确;
[Co(NH3)6]Cl3的配体为NH3,个数为6,中心离子的配位数为6,故B正确;
[Co(NH3)5Cl]Cl2的电离方程式为[Co(NH3)5Cl]Cl2══ [Co(NH3)5Cl]2++2Cl-,故和足量AgNO3溶液反应,得到沉淀的物质的量为2 mol,故C错误;
1 mol [Co(NH3)5Cl]Cl2中含有6 mol配位键,1 mol NH3中含有3 mol σ键,共含有21 mol σ键,故D正确。
7.下列关于配合物的说法正确的是( )
A.配合物的外界是指配合物中的阴离子
B.只有过渡金属元素能形成配合物
C.化学式为Pt(NH3)2Cl2的物质只有一种
D.Na3[AlF6]的中心原子的配位数为6
D
解析 配合物的外界可以是阳离子(如Na3[AlF6]),也可以是阴离子(如[Cu(NH3)4]SO4),A错误;不仅仅是过渡金属元素能形成配合物,部分主族元素也可以,如Na3[AlF6],B错误;Pt(NH3)2Cl2存在顺反异构体,C错误;Na3[AlF6]的中心原子是Al3+,配位体是F-,其配位数是6,D正确。
本 课 结 束
