4.2.2 配合物的应用 课件 (共28张PPT)2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 4.2.2 配合物的应用 课件 (共28张PPT)2023-2024学年高二化学苏教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:59:12 | ||
图片预览







文档简介
(共28张PPT)
专题4 分子空间结构与物质性质
第二单元 第2课时 配合物的应用
素 养 目 标
1.知道可以利用配合物进行物质的检验、分离提纯、定量测定等用途,体会配合物的使用价值,培养证据推理与模型认知、科学态度与社会责任的化学核心素养。
2.认识生命体中配位化合物的功能,列举配合物在药物开发和催化剂研制等领域的重要应用,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
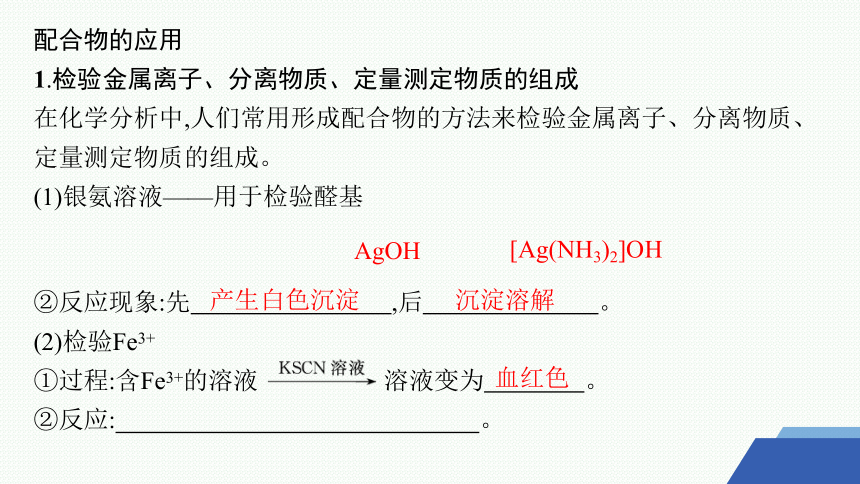
配合物的应用
1.检验金属离子、分离物质、定量测定物质的组成
在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
(1)银氨溶液——用于检验醛基
②反应现象:先 ,后 。
(2)检验Fe3+
①过程:含Fe3+的溶液 溶液变为 。
②反应: 。
AgOH
[Ag(NH3)2]OH
产生白色沉淀
沉淀溶解
血红色
2.在生产中的应用:配合物被广泛应用于染色、电镀、硬水软化、金属冶炼等领域。
3.在尖端研究领域中的应用:抗癌药物、催化剂研制、激光材料、超导材料等。
4.在生命体中的应用:在生命体中,酶的作用、生物体中能量的转换、生物固氮等都与配合物中的金属离子有关。
教材阅读 想一想阅读教材“批判性思维”。
思考:1965年罗森伯格(B.Rosenborg)等发现顺式Pt(NH3)2Cl2(简称顺铂)对细菌的分裂具有强烈的抑制作用。1969年罗森伯格等又首次报道了顺铂具有很强的抗癌活性。这些发现开创了金属配合物抗癌药物研究的新领
域。顺铂的结构可表示为 。
试写出反式Pt(NH3)2Cl2的结构示意图,两种Pt(NH3)2Cl2在水中溶解度较大的是哪一种
提示 反式Pt(NH3)2Cl2的结构示意图为 。
顺式Pt(NH3)2Cl2在水中溶解度较大。
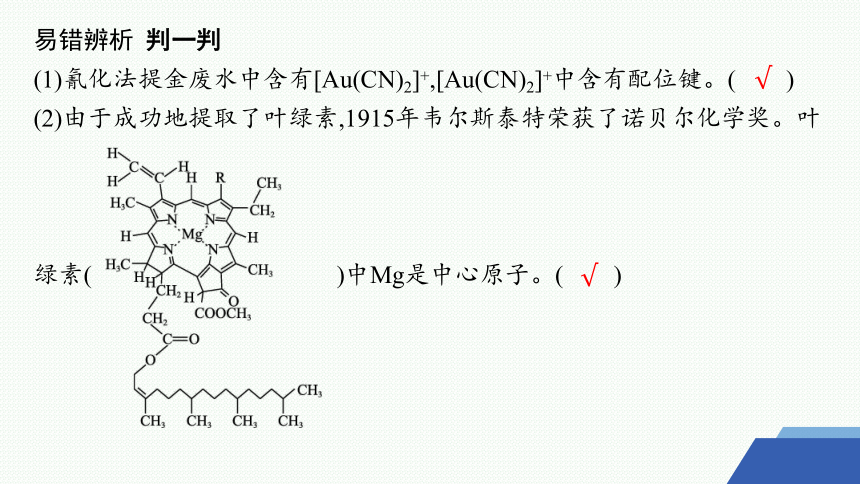
易错辨析 判一判
(1)氰化法提金废水中含有[Au(CN)2]+,[Au(CN)2]+中含有配位键。( )
(2)由于成功地提取了叶绿素,1915年韦尔斯泰特荣获了诺贝尔化学奖。叶
绿素( )中Mg是中心原子。( )
√
√
(3)据说18世纪初德国的一个染料工人把草木灰和牛血混合在一起进行焙烧,再用水浸取焙烧后的物质,过滤掉不溶的物质后,向滤液中加入氯化铁溶液得到了一种颜色很鲜艳的蓝色沉淀,该蓝色沉淀是普鲁士蓝{Fe4[Fe(CN)6]3},普鲁士蓝中含有离子键和配位键。( )
√
重难探究·能力素养全提升
探究 配合物的应用
情境探究
在血液中氧气的输送是由血红蛋白来完成的。载氧前,血红蛋白中Fe2+与卟啉环中的氮原子通过配位键相连形成血红素,血红素的结构简式如图。此时,Fe2+没有嵌入卟啉环平面,而是位于其下方约0.08 nm处。载氧后,氧分子通过配位键与Fe2+连接,使Fe2+滑入卟啉环中。一氧化碳分子也能通过配位键与血红蛋白中的Fe2+结合,并且其结合能力比氧气分子与Fe2+的结合能力强得多,因而会导致血红蛋白与一氧化碳结合失去载氧能力。当一氧化碳的浓度超过一定量时,会导致人体因缺氧而中毒。
血红素的结
构示意图
1.在血红素中,Fe2+形成几个配位键
2.在血红素中,N原子是什么杂化方式 为什么Fe2+没有嵌入卟啉环平面
提示 4个配位键。
提示 在血红素中,有两个氮原子形成3个单键,则这两个氮原子上还有1对孤电子对,因此这两个氮原子为sp3杂化;还有两个氮原子形成2个单键和1个双键,这两个氮原子上没有孤电子对,为sp2杂化。
Fe2+与4个氮原子形成配位键时,由于有2个氮原子为sp3杂化,空间结构为三角锥形,导致Fe2+不在卟啉环平面内。
3.一氧化碳分子通过配位键与血红蛋白中的Fe2+结合时,配位原子是碳原子还是氧原子
提示 碳原子。CO与N2互为等电子体,分子结构式为C≡O,三键中有一个是氧原子提供电子形成的,使碳原子电子云密度增大;碳的电负性小于氧,形成配位键时更容易给出电子,因此配位原子是碳原子。
方法突破
配合物在许多方面有着广泛的应用。在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成;在生产中,配合物也发挥着重大的作用。
应用体验
视角1 配合物的组成与结构
1.下列关于配位化合物的叙述不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在生命科学、抗癌药物、催化反应和材料化学等领域都有广泛的应用
B
解析 配合物中一定含有配位键,也可以含有一般的共价键、离子键等,如[Cu(NH3)4]SO4中除了Cu2+与NH3之间的配位键外,氮氢键为普通共价键, [Cu(NH3)4]2+与 之间还有离子键,B说法错误。
2.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)Co2+基态核外电子排布式为 。
(3)bte的分子式为C6H8N6,其结构简式如图所示。
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是 和
(填元素符号)。
②C、H、N的电负性从大到小顺序为 。
③bte分子中碳原子轨道杂化类型为 和 。
④1 mol bte分子中含σ键的数目为 mol。
答案 (1)[Ar]3d7或1s22s22p63s23p63d7
(2)平面三角形
(3)①N O ②N>C>H ③sp2 sp3 ④21
解析 (1)Co是27号元素,Co2+核外有25个电子,基态核外电子排布式为[Ar]3d7或1s22s22p63s23p63d7。
N原子属于sp2杂化,离子空间结构是平面三角形。
(3)①Co2+含有空轨道,bte中N原子、H2O中O原子均可提供孤电子对,形成配位键。
②同周期主族元素自左向右电负性增大,C、N的氢化物中均表现负化合价,说明它们的电负性都大于氢元素,故电负性由大到小顺序为N>C>H。
③bte分子中环上碳原子形成3个σ键,亚甲基中碳原子形成4个σ键,杂化轨道数目分别为3、4,碳原子分别采取sp2、sp3杂化。
④单键为σ键,双键中含有1个σ键,bte的分子含有21个σ键,1 mol bte分子中含σ键的数目为21 mol。
视角2 配合物的应用
3.缺铁性贫血是当前主要的营养缺乏病之一,而食用“铁强化酱油”是补铁的一条重要途径。在酱油中加入的是EDTA[ ]铁钠盐,即乙二胺四乙酸铁钠盐,结构如图所示。
下列说法正确的是( )
A.EDTA铁钠盐易溶于水,性质稳定,
易被氧化和分解
B.EDTA铁钠盐中只有氮原子是配位原子
C.EDTA分子中羧基上的碳原子采取sp2杂化
D.乙二胺四乙酸铁钠盐中氮原子最外层电子未全部参与形成化学键
C
解析 由于EDTA铁钠盐是加入酱油中的,故该铁钠盐易溶于水,而且难被氧化,A选项错误;EDTA铁钠盐中两个氮原子和四个氧原子都参与配位,B选项错误;—COOH 上的碳原子的2s轨道与三个2p轨道中的两个参与杂化而形成sp2杂化轨道,C选项正确;根据图示知一个氮原子与三个碳原子形成三个共价键,氮原子上的一对孤电子对与Fe3+形成配位键,氮原子最外层电子全部参与形成化学键,D选项错误。
【变式设问】
(1)在EDTA铁钠盐中,Fe2+形成几个配位键 配位数是多少
(2)在EDTA铁钠盐中,氮原子是什么杂化方式
提示 形成6个配位键,配位数为6。
提示 氮原子形成4个σ键,氮原子上没有孤电子对,因此氮原子为sp3杂化。
归纳总结 多齿配体和螯合物
EDTA—2Na溶液中,每个EDTA2-可以电离出2个H+,生成EDTA4-,然后与金属离子配位。EDTA4-中的2个N、4个O都可以与金属离子结合,这类配体称为多齿配体,如EDTA属于六齿配体,形成的配合物称为螯合物。
4.丁二酮肟镍是丁二酮肟在氨性溶液(pH=8~9)中与Ni2+发生反应生成的沉淀,该反应常用作实验室中检验镍离子。其结构如图所示,下列对该物质的分析与判断正确的是( )
A.该物质中Ni2+具有空轨道,是配合物的配位体
B.该物质中氧原子的杂化类型为sp杂化
C.该物质中氮原子的杂化类型为sp2杂化
D.该物质中的C、N、O均存在孤电子对
C
解析 由丁二酮肟镍结构可知,Ni2+提供空轨道,氮原子有孤电子对,二者形成配位键,故A错误;氧有2个σ键,2对孤电子对,价电子对数为4,属于sp3杂化,故B错误;氮原子形成1个双键和1个单键,还有1对孤电子对,所以氮原子价电子对数为3,为sp2杂化,故C正确;由丁二酮肟镍结构可知,碳原子都形成4个共价键,不存在孤电子对,故D错误。
5.离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1-乙基-3-甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是
( )
A.该离子液体中C、N杂化方式均有sp2和sp3两种
B.阴离子呈正四面体形
C.该离子液体中存在共价键和配位键
D.阳离子中σ键数目是π键数目的10倍
D
解析 该离子液体中,连接1个双键的C原子采用的是sp2杂化,连接四个单键的碳原子采用的是sp3杂化,连接1个双键的N原子是sp2杂化,连接3个单键的N原子是sp3杂化,故A正确;阴离子 中的B原子采用sp3杂化,其空间结构是正四面体形,故B正确;根据杂化轨道理论判断B原子中有空轨道,F-有孤电子对,故 中含有配位键,故C正确;根据单键是σ键,双键中有一个是π键判断,阳离子中含有σ键19个,π键2个,σ键数目不是π键数目的10倍,故D错误。
6.如图所示是卟啉配合物叶绿素的结构示意图(部分),
下列有关叙述正确的是( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心原子是Mg2+
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
解析 该化合物还含有O元素和N元素,A错误;该化合物中Mg2+与4个N原子形成配位键,属于配合物,不是高分子化合物,中心原子为Mg2+,配位原子为N原子,配位体为去掉Mg2+后的有机分子,B正确,C、D错误。
本 课 结 束
专题4 分子空间结构与物质性质
第二单元 第2课时 配合物的应用
素 养 目 标
1.知道可以利用配合物进行物质的检验、分离提纯、定量测定等用途,体会配合物的使用价值,培养证据推理与模型认知、科学态度与社会责任的化学核心素养。
2.认识生命体中配位化合物的功能,列举配合物在药物开发和催化剂研制等领域的重要应用,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
配合物的应用
1.检验金属离子、分离物质、定量测定物质的组成
在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
(1)银氨溶液——用于检验醛基
②反应现象:先 ,后 。
(2)检验Fe3+
①过程:含Fe3+的溶液 溶液变为 。
②反应: 。
AgOH
[Ag(NH3)2]OH
产生白色沉淀
沉淀溶解
血红色
2.在生产中的应用:配合物被广泛应用于染色、电镀、硬水软化、金属冶炼等领域。
3.在尖端研究领域中的应用:抗癌药物、催化剂研制、激光材料、超导材料等。
4.在生命体中的应用:在生命体中,酶的作用、生物体中能量的转换、生物固氮等都与配合物中的金属离子有关。
教材阅读 想一想阅读教材“批判性思维”。
思考:1965年罗森伯格(B.Rosenborg)等发现顺式Pt(NH3)2Cl2(简称顺铂)对细菌的分裂具有强烈的抑制作用。1969年罗森伯格等又首次报道了顺铂具有很强的抗癌活性。这些发现开创了金属配合物抗癌药物研究的新领
域。顺铂的结构可表示为 。
试写出反式Pt(NH3)2Cl2的结构示意图,两种Pt(NH3)2Cl2在水中溶解度较大的是哪一种
提示 反式Pt(NH3)2Cl2的结构示意图为 。
顺式Pt(NH3)2Cl2在水中溶解度较大。
易错辨析 判一判
(1)氰化法提金废水中含有[Au(CN)2]+,[Au(CN)2]+中含有配位键。( )
(2)由于成功地提取了叶绿素,1915年韦尔斯泰特荣获了诺贝尔化学奖。叶
绿素( )中Mg是中心原子。( )
√
√
(3)据说18世纪初德国的一个染料工人把草木灰和牛血混合在一起进行焙烧,再用水浸取焙烧后的物质,过滤掉不溶的物质后,向滤液中加入氯化铁溶液得到了一种颜色很鲜艳的蓝色沉淀,该蓝色沉淀是普鲁士蓝{Fe4[Fe(CN)6]3},普鲁士蓝中含有离子键和配位键。( )
√
重难探究·能力素养全提升
探究 配合物的应用
情境探究
在血液中氧气的输送是由血红蛋白来完成的。载氧前,血红蛋白中Fe2+与卟啉环中的氮原子通过配位键相连形成血红素,血红素的结构简式如图。此时,Fe2+没有嵌入卟啉环平面,而是位于其下方约0.08 nm处。载氧后,氧分子通过配位键与Fe2+连接,使Fe2+滑入卟啉环中。一氧化碳分子也能通过配位键与血红蛋白中的Fe2+结合,并且其结合能力比氧气分子与Fe2+的结合能力强得多,因而会导致血红蛋白与一氧化碳结合失去载氧能力。当一氧化碳的浓度超过一定量时,会导致人体因缺氧而中毒。
血红素的结
构示意图
1.在血红素中,Fe2+形成几个配位键
2.在血红素中,N原子是什么杂化方式 为什么Fe2+没有嵌入卟啉环平面
提示 4个配位键。
提示 在血红素中,有两个氮原子形成3个单键,则这两个氮原子上还有1对孤电子对,因此这两个氮原子为sp3杂化;还有两个氮原子形成2个单键和1个双键,这两个氮原子上没有孤电子对,为sp2杂化。
Fe2+与4个氮原子形成配位键时,由于有2个氮原子为sp3杂化,空间结构为三角锥形,导致Fe2+不在卟啉环平面内。
3.一氧化碳分子通过配位键与血红蛋白中的Fe2+结合时,配位原子是碳原子还是氧原子
提示 碳原子。CO与N2互为等电子体,分子结构式为C≡O,三键中有一个是氧原子提供电子形成的,使碳原子电子云密度增大;碳的电负性小于氧,形成配位键时更容易给出电子,因此配位原子是碳原子。
方法突破
配合物在许多方面有着广泛的应用。在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成;在生产中,配合物也发挥着重大的作用。
应用体验
视角1 配合物的组成与结构
1.下列关于配位化合物的叙述不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在生命科学、抗癌药物、催化反应和材料化学等领域都有广泛的应用
B
解析 配合物中一定含有配位键,也可以含有一般的共价键、离子键等,如[Cu(NH3)4]SO4中除了Cu2+与NH3之间的配位键外,氮氢键为普通共价键, [Cu(NH3)4]2+与 之间还有离子键,B说法错误。
2.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)Co2+基态核外电子排布式为 。
(3)bte的分子式为C6H8N6,其结构简式如图所示。
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是 和
(填元素符号)。
②C、H、N的电负性从大到小顺序为 。
③bte分子中碳原子轨道杂化类型为 和 。
④1 mol bte分子中含σ键的数目为 mol。
答案 (1)[Ar]3d7或1s22s22p63s23p63d7
(2)平面三角形
(3)①N O ②N>C>H ③sp2 sp3 ④21
解析 (1)Co是27号元素,Co2+核外有25个电子,基态核外电子排布式为[Ar]3d7或1s22s22p63s23p63d7。
N原子属于sp2杂化,离子空间结构是平面三角形。
(3)①Co2+含有空轨道,bte中N原子、H2O中O原子均可提供孤电子对,形成配位键。
②同周期主族元素自左向右电负性增大,C、N的氢化物中均表现负化合价,说明它们的电负性都大于氢元素,故电负性由大到小顺序为N>C>H。
③bte分子中环上碳原子形成3个σ键,亚甲基中碳原子形成4个σ键,杂化轨道数目分别为3、4,碳原子分别采取sp2、sp3杂化。
④单键为σ键,双键中含有1个σ键,bte的分子含有21个σ键,1 mol bte分子中含σ键的数目为21 mol。
视角2 配合物的应用
3.缺铁性贫血是当前主要的营养缺乏病之一,而食用“铁强化酱油”是补铁的一条重要途径。在酱油中加入的是EDTA[ ]铁钠盐,即乙二胺四乙酸铁钠盐,结构如图所示。
下列说法正确的是( )
A.EDTA铁钠盐易溶于水,性质稳定,
易被氧化和分解
B.EDTA铁钠盐中只有氮原子是配位原子
C.EDTA分子中羧基上的碳原子采取sp2杂化
D.乙二胺四乙酸铁钠盐中氮原子最外层电子未全部参与形成化学键
C
解析 由于EDTA铁钠盐是加入酱油中的,故该铁钠盐易溶于水,而且难被氧化,A选项错误;EDTA铁钠盐中两个氮原子和四个氧原子都参与配位,B选项错误;—COOH 上的碳原子的2s轨道与三个2p轨道中的两个参与杂化而形成sp2杂化轨道,C选项正确;根据图示知一个氮原子与三个碳原子形成三个共价键,氮原子上的一对孤电子对与Fe3+形成配位键,氮原子最外层电子全部参与形成化学键,D选项错误。
【变式设问】
(1)在EDTA铁钠盐中,Fe2+形成几个配位键 配位数是多少
(2)在EDTA铁钠盐中,氮原子是什么杂化方式
提示 形成6个配位键,配位数为6。
提示 氮原子形成4个σ键,氮原子上没有孤电子对,因此氮原子为sp3杂化。
归纳总结 多齿配体和螯合物
EDTA—2Na溶液中,每个EDTA2-可以电离出2个H+,生成EDTA4-,然后与金属离子配位。EDTA4-中的2个N、4个O都可以与金属离子结合,这类配体称为多齿配体,如EDTA属于六齿配体,形成的配合物称为螯合物。
4.丁二酮肟镍是丁二酮肟在氨性溶液(pH=8~9)中与Ni2+发生反应生成的沉淀,该反应常用作实验室中检验镍离子。其结构如图所示,下列对该物质的分析与判断正确的是( )
A.该物质中Ni2+具有空轨道,是配合物的配位体
B.该物质中氧原子的杂化类型为sp杂化
C.该物质中氮原子的杂化类型为sp2杂化
D.该物质中的C、N、O均存在孤电子对
C
解析 由丁二酮肟镍结构可知,Ni2+提供空轨道,氮原子有孤电子对,二者形成配位键,故A错误;氧有2个σ键,2对孤电子对,价电子对数为4,属于sp3杂化,故B错误;氮原子形成1个双键和1个单键,还有1对孤电子对,所以氮原子价电子对数为3,为sp2杂化,故C正确;由丁二酮肟镍结构可知,碳原子都形成4个共价键,不存在孤电子对,故D错误。
5.离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1-乙基-3-甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是
( )
A.该离子液体中C、N杂化方式均有sp2和sp3两种
B.阴离子呈正四面体形
C.该离子液体中存在共价键和配位键
D.阳离子中σ键数目是π键数目的10倍
D
解析 该离子液体中,连接1个双键的C原子采用的是sp2杂化,连接四个单键的碳原子采用的是sp3杂化,连接1个双键的N原子是sp2杂化,连接3个单键的N原子是sp3杂化,故A正确;阴离子 中的B原子采用sp3杂化,其空间结构是正四面体形,故B正确;根据杂化轨道理论判断B原子中有空轨道,F-有孤电子对,故 中含有配位键,故C正确;根据单键是σ键,双键中有一个是π键判断,阳离子中含有σ键19个,π键2个,σ键数目不是π键数目的10倍,故D错误。
6.如图所示是卟啉配合物叶绿素的结构示意图(部分),
下列有关叙述正确的是( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心原子是Mg2+
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
解析 该化合物还含有O元素和N元素,A错误;该化合物中Mg2+与4个N原子形成配位键,属于配合物,不是高分子化合物,中心原子为Mg2+,配位原子为N原子,配位体为去掉Mg2+后的有机分子,B正确,C、D错误。
本 课 结 束
