微专题1 根据元素性质的周期性变化进行元素推断课件(共20张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 微专题1 根据元素性质的周期性变化进行元素推断课件(共20张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:59:51 | ||
图片预览




文档简介
(共20张PPT)
微专题1 根据元素性质的周期性变化进行元素推断
专题阐释
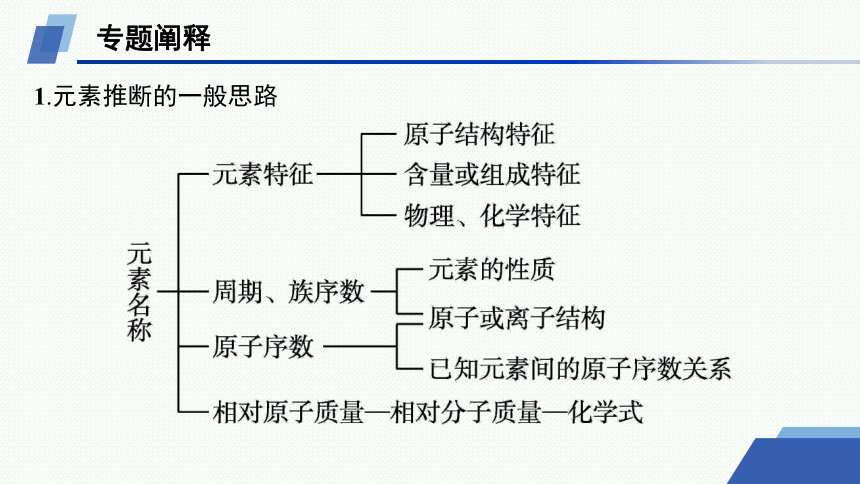
1.元素推断的一般思路
2.推断元素的常用方法
(1)利用稀有气体元素原子结构的特殊性。
(2)利用常见元素及其化合物的特征性质。
3.由基态原子的外围电子排布确定元素在元素周期表中的位置
(1)周期序数=电子层数=最高能层序数
(2)主族元素的族序数=外围电子数
(3)ⅢB族~ⅦB族的外围电子排布为(n-1)d1~5ns1~2(镧系、锕系除外),族序数=外围电子数。如锰的外围电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)ⅠB族和ⅡB族的外围电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
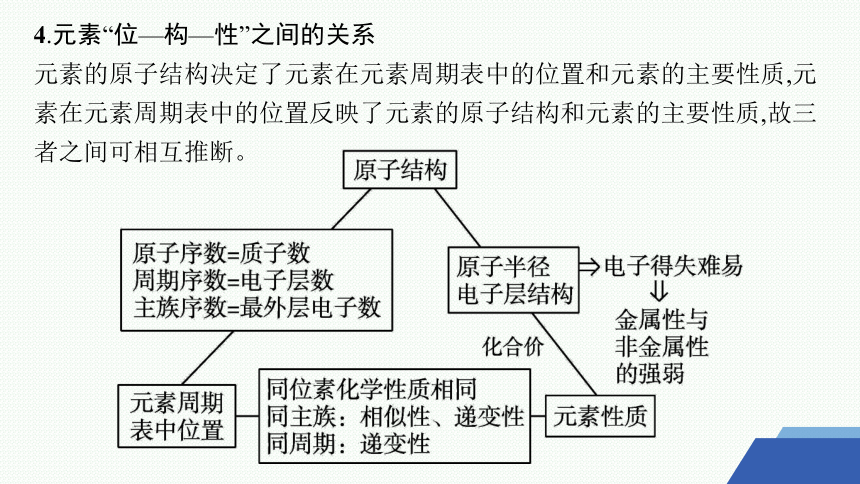
4.元素“位—构—性”之间的关系
元素的原子结构决定了元素在元素周期表中的位置和元素的主要性质,元素在元素周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
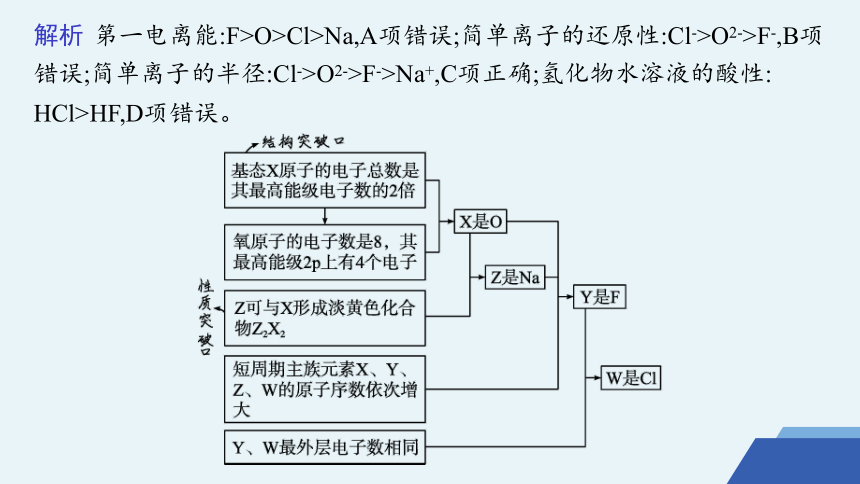
例1 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
C
解析 第一电离能:F>O>Cl>Na,A项错误;简单离子的还原性:Cl->O2->F-,B项错误;简单离子的半径:Cl->O2->F->Na+,C项正确;氢化物水溶液的酸性: HCl>HF,D项错误。
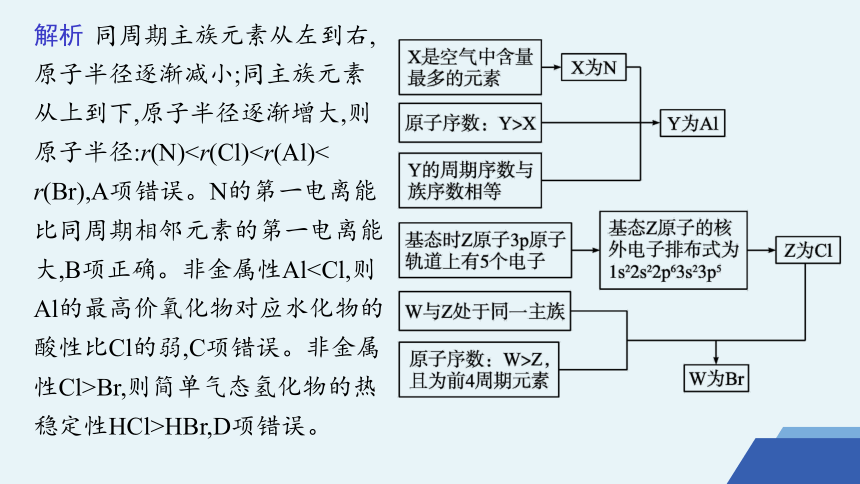
例2 [2021江苏学业水平选择性考试]前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是( )
A.原子半径:r(X)B.X的第一电离能比同周期相邻元素的大
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
B
解析 同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大,则原子半径:r(N)Br,则简单气态氢化物的热稳定性HCl>HBr,D项错误。
专题精练
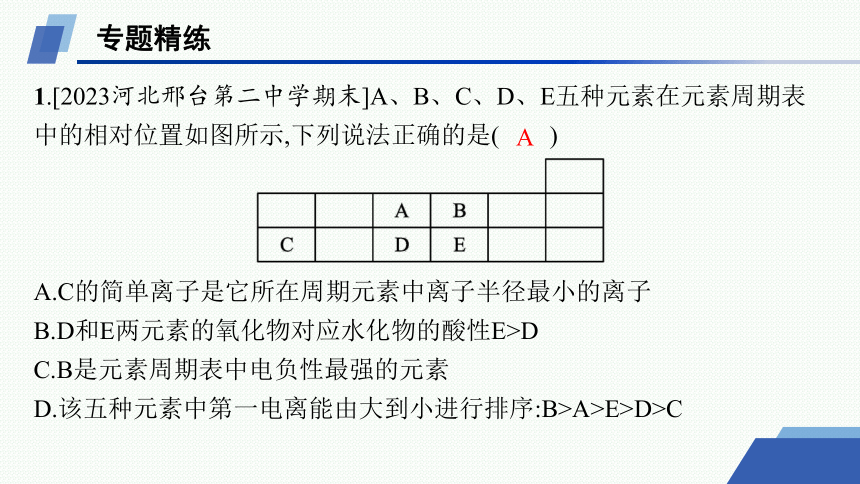
1.[2023河北邢台第二中学期末]A、B、C、D、E五种元素在元素周期表中的相对位置如图所示,下列说法正确的是( )
A.C的简单离子是它所在周期元素中离子半径最小的离子
B.D和E两元素的氧化物对应水化物的酸性E>D
C.B是元素周期表中电负性最强的元素
D.该五种元素中第一电离能由大到小进行排序:B>A>E>D>C
A
解析 由元素周期表结构可知A为N,B为O,C为Al,D为P,E为S。A.同周期元素中非金属元素简单离子半径比金属元素简单离子半径大,从左往右,金属元素简单离子半径逐渐减小,C为Al,是第三周期最右边的金属元素,故C的简单离子是它所在周期元素中离子半径最小的离子,A正确;B.D为P,E为S,D和E两元素的最高价氧化物对应水化物的酸性E>D,但氧化物对应水化物的酸性无法比较,如H3PO4>H2SO3,B错误;C.B为O,O不是元素周期表中电负性最强的元素,F是元素周期表中电负性最强的元素,C错误;D.同主族从上到下元素第一电离能减小,同周期从左往右元素第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能大于同周期相邻元素,故该五种元素中第一电离能由大到小进行排序:A>B>D>E>C,D错误。
2.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主族元素的基态原子中第一电离能最大。下列说法正确的是( )
A.Z元素基态原子最外层电子的原子轨道是纺锤形
B.X、Y、Z、W均位于元素周期表的p区
C.X、Y、Z、W中电负性最大的是Y
D.X、Y、Z、W中原子半径最大的是W
C
解析 由题可知,短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W分别位于不同周期,W在同周期主族元素的基态原子中第一电离能最大,则W为Cl元素;Y与W位于同一主族,则Y为F元素;X与Y位于不同周期,则X为H元素;Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,则Z为P元素。磷原子的外围电子排布式为3s23p3,则基态原子最外层电子的原子轨道是球形和纺锤形,故A错误;氢元素位于元素周期表的s区,故B错误;元素的非金属性越强,电负性越大,四种元素中氟元素的非金属性最强,电负性最大,故C正确;同周期主族元素从左到右,原子半径依次减小,一般原子核外电子层数越多,原子半径越大,则磷原子的原子半径最大,故D错误。
3.X、Y、Z、W为短周期主族元素,其原子序数依次增大,Y、Z、W位于第2周期,基态W原子最外层电子数是基态Y原子最高能级电子数的3倍,它们形成的某阴离子的结构如图所示。
下列说法错误的是( )
A.离子半径:X->Li+
B.第一电离能:Z>W>Y
C.X、Y、W三种元素可以形成一元酸,也可以形成二元酸
D.由X、Y、Z、W四种元素形成的化合物的水溶液均显碱性
D
解析 X、Y、Z、W为短周期主族元素,其原子序数依次增大,Y、Z、W位于第2周期,它们可形成如图所示的阴离子,Y形成4个共价键,W可形成2个共价键,由基态W原子最外层电子数是基态Y原子最高能级电子数的3倍可知,W、Y原子核外电子排布式分别为1s22s22p4、1s22s22p2,则Y为C,W为O;X形成1个共价键,其原子序数小于C,则X为H;Z形成3个共价键,且介于C、O之间,则Z为N。X-为H-,电子层结构相同时,核电荷数越大,离子半径越小,则离子半径:X->Li+,A正确;Y为C、Z为N、W为O,同周期主族元素从左向右,第一电离能呈增大趋势,但N的2p能级处于半充满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:N>O>C,即Z>W>Y,B正确;
X、Y、W三种元素分别为H、C、O,它们可以形成一元酸,如甲酸、乙酸等,也可以形成二元酸,如碳酸、草酸、乙二酸等,C正确;X、Y、Z、W四种元素分别为H、C、N、O,它们形成的化合物的水溶液不一定显碱性,如草酸氢铵溶液显酸性,乙酸铵溶液呈中性,D错误。
4.[2023河北石家庄部分学校开学考试]X、Y、Z、W是原子半径依次增大的短周期主族元素,其中X元素与其他元素不在同一周期,Y的一种核素常用于测定文物年代,基态Z原子中s能级与p能级上的电子总数相等。下列说法错误的是( )
A.W单质可以与水反应生成气体
B.Z、W所在周期内,Z、W元素第一电离能大小相邻
C.X与Y组成的化合物沸点可能比水的高
D.X、Y、Z、W的单质均可以在空气中燃烧
B
解析 X元素与其他元素不在同一周期,则X为H元素,Y的一种核素常用于测定文物年代,则Y为C元素,基态Z原子中s能级与p能级上的电子总数相等,则Z为Mg元素,X、Y、Z、W是原子半径依次增大的短周期主族元素,则W为Na元素。钠与水反应生成H2,故A正确;Z、W所在周期是第三周期,同周期元素从左到右第一电离能呈增大趋势,但ⅡA族>ⅢA族,ⅤA族>ⅥA族,所以Mg第一电离能大于Al,Na、Mg元素第一电离能大小不相邻,故B错误; C与H可以形成高分子化合物,沸点可能高于水,故C正确;H2、C、Na、Mg均可以在空气中燃烧,故D正确。
5.m、n、p、q、w五种元素,其核电荷数依次增大。m元素基态原子核外只有三个能级,且各能级电子数相等,p、q元素位于同一族,且两者核电荷数之和为24,w元素原子核外有4个电子层,最外层只有1个电子,其余各层均排满电子。下列说法错误的是( )
A.m、n、p元素第一电离能依次增大
B.基态n元素原子的轨道表示式为
C.w元素原子的外围电子排布式为3d104s1
D.w单质分别与p、q单质反应,产物中w的化合价不同
A
解析 m、n、p、q、w五种元素,其核电荷数依次增大。m元素基态原子核外只有三个能级,且各能级电子数相等,原子核外电子排布式为1s22s22p2,故m为C元素;w元素原子核外有4个电子层,最外层只有1个电子,其余各层均排满电子,原子核外电子数为2+8+18+1=29,故w为Cu元素;p、q元素位于同一族,它们的原子序数大于碳而小于Cu,且两者核电荷数之和为24,可推知p为O元素、q为S元素;n的原子序数介于C、O之间,故n为N元素。同周期元素随原子序数增大第一电离能呈增大趋势,但N元素原子2p轨道为半充满稳定状态,第一电离能高于相邻元素,故第一电离能:C本 课 结 束
微专题1 根据元素性质的周期性变化进行元素推断
专题阐释
1.元素推断的一般思路
2.推断元素的常用方法
(1)利用稀有气体元素原子结构的特殊性。
(2)利用常见元素及其化合物的特征性质。
3.由基态原子的外围电子排布确定元素在元素周期表中的位置
(1)周期序数=电子层数=最高能层序数
(2)主族元素的族序数=外围电子数
(3)ⅢB族~ⅦB族的外围电子排布为(n-1)d1~5ns1~2(镧系、锕系除外),族序数=外围电子数。如锰的外围电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)ⅠB族和ⅡB族的外围电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
4.元素“位—构—性”之间的关系
元素的原子结构决定了元素在元素周期表中的位置和元素的主要性质,元素在元素周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
例1 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
C
解析 第一电离能:F>O>Cl>Na,A项错误;简单离子的还原性:Cl->O2->F-,B项错误;简单离子的半径:Cl->O2->F->Na+,C项正确;氢化物水溶液的酸性: HCl>HF,D项错误。
例2 [2021江苏学业水平选择性考试]前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是( )
A.原子半径:r(X)
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
B
解析 同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大,则原子半径:r(N)
专题精练
1.[2023河北邢台第二中学期末]A、B、C、D、E五种元素在元素周期表中的相对位置如图所示,下列说法正确的是( )
A.C的简单离子是它所在周期元素中离子半径最小的离子
B.D和E两元素的氧化物对应水化物的酸性E>D
C.B是元素周期表中电负性最强的元素
D.该五种元素中第一电离能由大到小进行排序:B>A>E>D>C
A
解析 由元素周期表结构可知A为N,B为O,C为Al,D为P,E为S。A.同周期元素中非金属元素简单离子半径比金属元素简单离子半径大,从左往右,金属元素简单离子半径逐渐减小,C为Al,是第三周期最右边的金属元素,故C的简单离子是它所在周期元素中离子半径最小的离子,A正确;B.D为P,E为S,D和E两元素的最高价氧化物对应水化物的酸性E>D,但氧化物对应水化物的酸性无法比较,如H3PO4>H2SO3,B错误;C.B为O,O不是元素周期表中电负性最强的元素,F是元素周期表中电负性最强的元素,C错误;D.同主族从上到下元素第一电离能减小,同周期从左往右元素第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能大于同周期相邻元素,故该五种元素中第一电离能由大到小进行排序:A>B>D>E>C,D错误。
2.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主族元素的基态原子中第一电离能最大。下列说法正确的是( )
A.Z元素基态原子最外层电子的原子轨道是纺锤形
B.X、Y、Z、W均位于元素周期表的p区
C.X、Y、Z、W中电负性最大的是Y
D.X、Y、Z、W中原子半径最大的是W
C
解析 由题可知,短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W分别位于不同周期,W在同周期主族元素的基态原子中第一电离能最大,则W为Cl元素;Y与W位于同一主族,则Y为F元素;X与Y位于不同周期,则X为H元素;Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,则Z为P元素。磷原子的外围电子排布式为3s23p3,则基态原子最外层电子的原子轨道是球形和纺锤形,故A错误;氢元素位于元素周期表的s区,故B错误;元素的非金属性越强,电负性越大,四种元素中氟元素的非金属性最强,电负性最大,故C正确;同周期主族元素从左到右,原子半径依次减小,一般原子核外电子层数越多,原子半径越大,则磷原子的原子半径最大,故D错误。
3.X、Y、Z、W为短周期主族元素,其原子序数依次增大,Y、Z、W位于第2周期,基态W原子最外层电子数是基态Y原子最高能级电子数的3倍,它们形成的某阴离子的结构如图所示。
下列说法错误的是( )
A.离子半径:X->Li+
B.第一电离能:Z>W>Y
C.X、Y、W三种元素可以形成一元酸,也可以形成二元酸
D.由X、Y、Z、W四种元素形成的化合物的水溶液均显碱性
D
解析 X、Y、Z、W为短周期主族元素,其原子序数依次增大,Y、Z、W位于第2周期,它们可形成如图所示的阴离子,Y形成4个共价键,W可形成2个共价键,由基态W原子最外层电子数是基态Y原子最高能级电子数的3倍可知,W、Y原子核外电子排布式分别为1s22s22p4、1s22s22p2,则Y为C,W为O;X形成1个共价键,其原子序数小于C,则X为H;Z形成3个共价键,且介于C、O之间,则Z为N。X-为H-,电子层结构相同时,核电荷数越大,离子半径越小,则离子半径:X->Li+,A正确;Y为C、Z为N、W为O,同周期主族元素从左向右,第一电离能呈增大趋势,但N的2p能级处于半充满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:N>O>C,即Z>W>Y,B正确;
X、Y、W三种元素分别为H、C、O,它们可以形成一元酸,如甲酸、乙酸等,也可以形成二元酸,如碳酸、草酸、乙二酸等,C正确;X、Y、Z、W四种元素分别为H、C、N、O,它们形成的化合物的水溶液不一定显碱性,如草酸氢铵溶液显酸性,乙酸铵溶液呈中性,D错误。
4.[2023河北石家庄部分学校开学考试]X、Y、Z、W是原子半径依次增大的短周期主族元素,其中X元素与其他元素不在同一周期,Y的一种核素常用于测定文物年代,基态Z原子中s能级与p能级上的电子总数相等。下列说法错误的是( )
A.W单质可以与水反应生成气体
B.Z、W所在周期内,Z、W元素第一电离能大小相邻
C.X与Y组成的化合物沸点可能比水的高
D.X、Y、Z、W的单质均可以在空气中燃烧
B
解析 X元素与其他元素不在同一周期,则X为H元素,Y的一种核素常用于测定文物年代,则Y为C元素,基态Z原子中s能级与p能级上的电子总数相等,则Z为Mg元素,X、Y、Z、W是原子半径依次增大的短周期主族元素,则W为Na元素。钠与水反应生成H2,故A正确;Z、W所在周期是第三周期,同周期元素从左到右第一电离能呈增大趋势,但ⅡA族>ⅢA族,ⅤA族>ⅥA族,所以Mg第一电离能大于Al,Na、Mg元素第一电离能大小不相邻,故B错误; C与H可以形成高分子化合物,沸点可能高于水,故C正确;H2、C、Na、Mg均可以在空气中燃烧,故D正确。
5.m、n、p、q、w五种元素,其核电荷数依次增大。m元素基态原子核外只有三个能级,且各能级电子数相等,p、q元素位于同一族,且两者核电荷数之和为24,w元素原子核外有4个电子层,最外层只有1个电子,其余各层均排满电子。下列说法错误的是( )
A.m、n、p元素第一电离能依次增大
B.基态n元素原子的轨道表示式为
C.w元素原子的外围电子排布式为3d104s1
D.w单质分别与p、q单质反应,产物中w的化合价不同
A
解析 m、n、p、q、w五种元素,其核电荷数依次增大。m元素基态原子核外只有三个能级,且各能级电子数相等,原子核外电子排布式为1s22s22p2,故m为C元素;w元素原子核外有4个电子层,最外层只有1个电子,其余各层均排满电子,原子核外电子数为2+8+18+1=29,故w为Cu元素;p、q元素位于同一族,它们的原子序数大于碳而小于Cu,且两者核电荷数之和为24,可推知p为O元素、q为S元素;n的原子序数介于C、O之间,故n为N元素。同周期元素随原子序数增大第一电离能呈增大趋势,但N元素原子2p轨道为半充满稳定状态,第一电离能高于相邻元素,故第一电离能:C
