微专题3 分子(或离子)空间结构与杂化轨道理论课件(共28张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 微专题3 分子(或离子)空间结构与杂化轨道理论课件(共28张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
微专题3 分子(或离子)空间结构与杂化轨道理论
专题阐释
1.分子(或离子)空间结构的判断
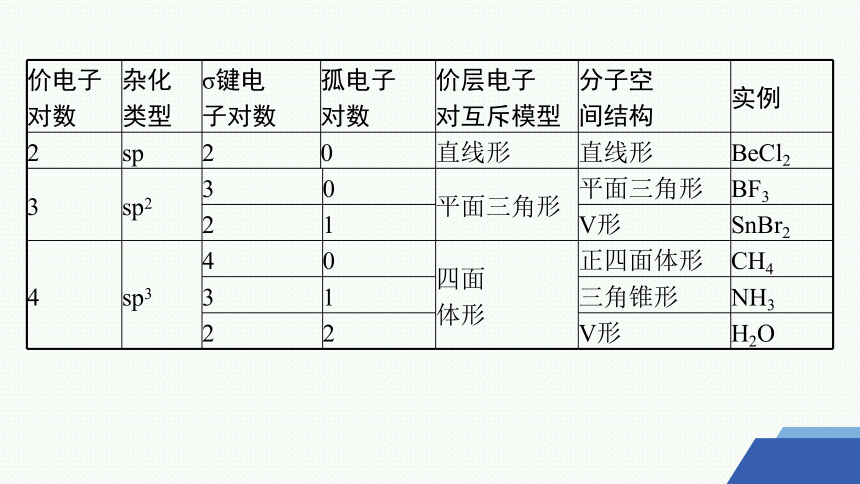
判断分子(或离子)的空间结构时,要能够正确计算价电子对数:一是运用计算式推导出价电子对数;二是看σ键电子对数。如表:
价电子 对数 杂化 类型 σ键电 子对数 孤电子 对数 价层电子 对互斥模型 分子空 间结构 实例
2 sp 2 0 直线形 直线形 BeCl2
3 sp2 3 0 平面三角形 平面三角形 BF3
2 1 V形 SnBr2
4 sp3 4 0 四面 体形 正四面体形 CH4
3 1 三角锥形 NH3
2 2 V形 H2O
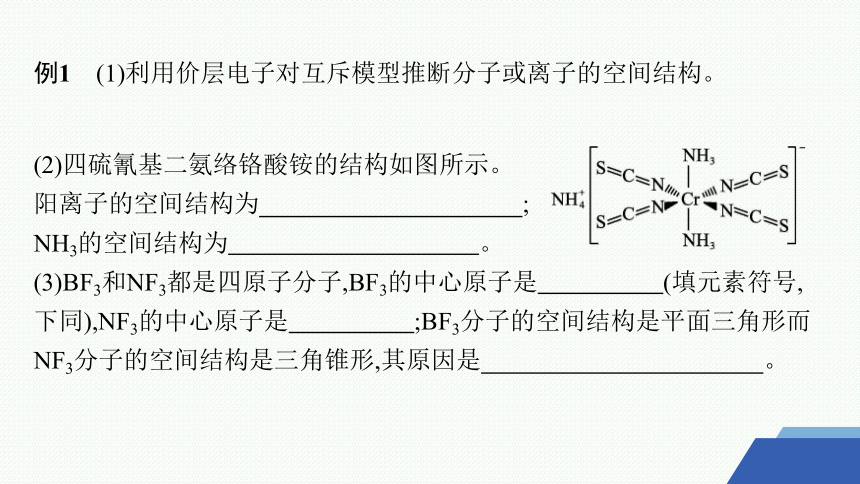
例1 (1)利用价层电子对互斥模型推断分子或离子的空间结构。
(2)四硫氰基二氨络铬酸铵的结构如图所示。
阳离子的空间结构为 ;
NH3的空间结构为 。
(3)BF3和NF3都是四原子分子,BF3的中心原子是 (填元素符号,下同),NF3的中心原子是 ;BF3分子的空间结构是平面三角形而NF3分子的空间结构是三角锥形,其原因是 。
答案 (1)正四面体形 直线形 平面三角形
(2)正四面体形 三角锥形
(3)B N BF3分子中B原子的3个价电子都与F原子形成共价键,无孤电子对,呈平面三角形,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对未成键的孤电子对,占据了N原子周围的空间,与成键电子对相互排斥,形成三角锥形结构
(3)BF3分子的中心原子B原子的3个价电子都与F原子形成共价键,无孤电子对,呈平面三角形;而NF3分子的中心原子N原子的3个价电子与F原子形成共价键,还有一对未成键的孤电子对,占据了N原子周围的空间,与成键电子对相互排斥,形成三角锥形结构。
2.键角的判断与比较
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间结构的主要因素之一。在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化轨道类型;二是中心原子的孤电子对数;三是中心原子的电负性大小。
(1)一般情况下,应该先从中心原子的杂化轨道类型入手。
中心原子杂化轨道类型不同的粒子,键角大小为sp杂化>sp2杂化>sp3杂化,如键角:CH≡CH>CH2═CH2>CH4。
(2)中心原子杂化方式相同的粒子,由于斥力:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间,孤电子对数越多,对成键电子对的斥力越大,键角越小。如键角:CH4>NH3>H2O。
(3)中心原子杂化方式相同且孤电子对数目也相同,利用中心原子的电负性大小比较键角大小。如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为V形,由于电负性:O>S,吸引电子的能力:O>S,且键长:O—HH2S(92°18')。
(4)同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键
间,则键角大小不同。如甲醛中 :,键角:α>β。
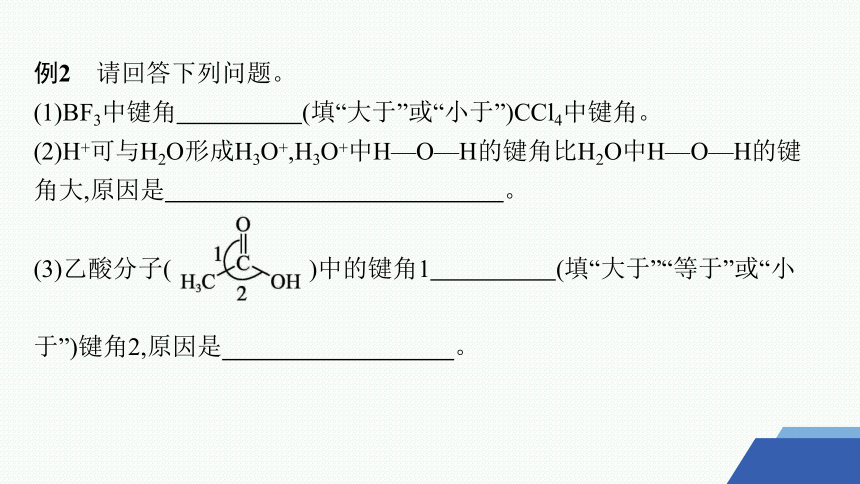
例2 请回答下列问题。
(1)BF3中键角 (填“大于”或“小于”)CCl4中键角。
(2)H+可与H2O形成H3O+,H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是 。
(3)乙酸分子( )中的键角1 (填“大于”“等于”或“小
于”)键角2,原因是 。
答案 (1)大于
(2)H2O中氧原子上有两对孤电子对,H3O+中氧原子上有一对孤电子对,H2O中孤电子对对成键电子对的排斥力大于H3O+中孤电子对对成键电子对的排斥力
(3)大于 C═O对C—C的斥力大于C—O对C—C的斥力
解析 (1)BF3分子的空间结构为平面三角形,键角为120°;CCl4分子的空间结构为正四面体形,键角为109°28'。(2)H3O+、H2O的中心原子的杂化轨道类型均为sp3,H2O中O原子上有两对孤电子对,H3O+中O原子上有一对孤电子对,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,故H3O+中H—O—H的键角比H2O中H—O—H的键角大。(3)由于双键对单键的斥力大于单键对单键的斥力,故乙酸分子中的键角1大于键角2。
3.【高考延伸】 spd杂化
(1)简介
有些元素原子在形成化合物时,除了ns、np轨道发生杂化外,(n-1)d、nd轨道也参与杂化。常见的杂化方式有dsp2、sp3d、sp3d2等,通常存在于过渡元素形成的化合物中。
(2)判断方法
先计算出中心原子的价电子对数,若大于4,一般有d轨道参与杂化,并有相应的空间结构:
价电子对数 4 5 6
杂化类型 dsp2 sp3d sp3d2
几何构型 平面正方形 三角双锥形 八面体形
【注意】 不是所有的元素原子均能发生d轨道参与的杂化,例如,由于第二周期元素原子的第二能层不存在d轨道,N与Cl只能通过sp3杂化形成NCl3;而P与Cl既可以通过sp3杂化形成PCl3,也可以通过sp3d杂化形成PCl5。
例3 (1)[2021全国甲卷]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)[2021山东等级考节选]O、F、Cl电负性由大到小的顺序为 ;
Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价电子对数为 ,下列对XeF2中心原子杂化方式推断合理的是 (填字母)。
A.sp B.sp2
C.sp3 D.sp3d
答案 (1)sp3 ②
(2)F>O>Cl 5 D
解析 (1)由SiCl4的结构式可知,Si的价电子对数为4,故Si采取sp3杂化;由SiCl4(H2O)的结构式可知,Si的价电子对数为5,故SiCl4(H2O)中Si采取sp3d杂化。
(2)电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为F、O、Cl,所以电负性大小顺序为F>O>Cl; XeF2中心原子的价电子对数为 =5,其中心原子的杂化方式应为sp3d。
专题精练
情境探究
1.写出符合下列条件的相应的分子或离子的化学式。
(1)氧原子以sp3杂化轨道形成两个σ键: 。
(2)氧原子形成一个π键: 。
(3)硼原子以sp2杂化轨道形成三个σ键: 。
(4)氮原子形成四个σ键: ;氮原子形成两个π键: 。
答案 (1)H2O (2)O2 (3)BF3 (4) N2
解析 形成π键时可以有双键或三键,σ键全为单键;sp3杂化结构为四面体形,sp2杂化结构为平面三角形。根据以上两点可解此题,答案合理即可。
2.(1)P4S3可用于制造火柴,其分子结构如图所示。
①电负性:磷 (填“>”“<”或“=”)硫。
②P4S3分子中硫原子的杂化轨道类型为 。
③设NA为阿伏加德罗常数的值。
1 mol P4S3分子中孤电子对的数目为 。
④∠S—P—S (填“>”“<”或“=”)109°28'。
(2)气态SO3分子的空间结构为 ;将纯液态SO3冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是 。
答案 (1)①< ②sp3 ③10NA ④<
(2)平面三角形 sp3
解析 (1)①同周期元素的电负性从左往右增强,故电负性:磷<硫;②从P4S3分子结构图中得知,硫原子有2个σ键和2对孤电子对,其杂化轨道类型为sp3杂化;③从P4S3分子结构图中得知,每个S原子有2对孤电子对,每个P原子有1对孤电子对,则1 mol P4S3分子中孤电子对的数目为10NA;④从P4S3分子结构图中得知,P原子有1对孤电子对,孤电子对与成键电子对之间的排斥力大于成键电子对与成键电子对之间的排斥力,故∠S—P—S小于正四面体的夹角,即∠S—P—S<109°28'。
(2)SO3中价电子对数为3,没有孤电子对,空间结构为平面三角形;题图中固态SO3中S原子形成4个共价单键,其杂化轨道类型是sp3杂化。
3.已知:①红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5;氮与氢也可形成两种化合物:NH3和NH5。②PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形
( )。
(1)NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8的是
(填分子式),该分子的空间结构是 。
(2)有同学认为,NH5与PCl5类似,N原子的1个2s轨道、3个2p轨道和1个2d轨道可能发生sp3d杂化。请你对该同学的观点进行评价: 。
(3)经测定,NH5中存在离子键,N原子的最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5的电子式是 。
答案 (1)PCl3 三角锥形
(2)不对,因为N原子没有2d轨道
(3)
解析 (1)写出NH3、PCl3和PCl5分子的电子式不难发现,氢原子是2e-稳定,氯原子是8e-稳定。在PCl3中磷原子外围是8e-,PCl5中磷原子外围是10e-,所有原子的最外层电子数都是8的只有PCl3;联想到氨分子的空间结构,PCl3分子的空间结构是三角锥形。(3)要满足N原子的最外层电子数是8,所有
氢原子的最外层电子数都是2,则NH5的电子式应是 。
4.回答下列问题:
(1)下列微粒中按键角由大到小的顺序排列为 (填编号)。
(2)在BF3分子中,F—B—F的键角大小是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子的杂化轨道类型是 ,N2H4分子中的六个原子 (填“在”或“不在”)同一个平面上。
答案 (1)①④②⑤③
(2)120°
(3)sp3 不在
解析 (1)①HCN中的C原子采取sp杂化,键角为180°;②SiF4中Si原子杂化轨道数为4,采取sp3杂化,键角为109°28';③SCl2中S原子杂化轨道数为4,采取sp3杂化,含有2对孤电子对,分子为V形结构,键角约为105°;④ 中C原子的杂化轨道数为3,所以C原子采取sp2杂化,分子为平面三角形结构,键角为120°;⑤H3O+中O原子的杂化轨道数为4,所以O原子采取sp3杂化,O原子上含有1对孤电子对,分子为三角锥形结构,键角约为107°。所以各微粒按键角由大到小的顺序排列为①④②⑤③。
(2)在BF3分子中,中心原子B原子价电子对数为3,是sp2杂化,分子呈平面三角形结构,F—B—F的键角大小是120°。
(3)N2H4分子中,每个N原子形成3个σ键,N原子上有1对孤电子对,故N原子采取sp3杂化;1个N原子和与其相连的2个H原子及另外1个N原子形成类似NH3的三角锥形结构,故六个原子不可能共面。
5.(1)钒(V)固氮酶种类众多,其中一种结构如图甲所示:
①配体CH3CN中碳的杂化类型为 ,
所含σ键与π键数目之比为 。
②该物质中V的杂化方式最可能为 (填字母)。
A.sp2杂化
B.sp3杂化
C.sp3d杂化
D.sp3d2杂化
甲
(2)[N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图乙所示,其中阳离子中N原子的杂化轨道类型为 ,阴离子中As的杂化方式为 。
答案 (1)①sp3、sp 5∶2 ②D
(2)sp、sp2 sp3d2
解析 (1)①—CH3中C原子的杂化类型为sp3,—CN中C原子的杂化类型为sp;成键原子间只能形成一个σ键,1 mol CH3CN中含有σ键物质的量为5 mol,1 mol —C≡N键中含有π键的物质的量为2 mol,σ键和π键物质的量之比为5∶2。
②由题图甲知,V与周围6个原子形成6个σ键,成键原子间只能形成1个σ键,且杂化轨道数等于价电子对数,V的价电子对数为6,因此V的杂化类型为sp3d2杂化,故D正确。
(2)由题图乙知,形成一个双键的N原子除形成σ键、π键外,还存在孤电子对,采用sp2杂化;形成三键的氮原子和形成两个双键的氮原子,采取sp杂化,故N原子的杂化轨道类型为sp、sp2。阴离子中As的价电子对数为6,所以杂化方式为sp3d2。
本 课 结 束
微专题3 分子(或离子)空间结构与杂化轨道理论
专题阐释
1.分子(或离子)空间结构的判断
判断分子(或离子)的空间结构时,要能够正确计算价电子对数:一是运用计算式推导出价电子对数;二是看σ键电子对数。如表:
价电子 对数 杂化 类型 σ键电 子对数 孤电子 对数 价层电子 对互斥模型 分子空 间结构 实例
2 sp 2 0 直线形 直线形 BeCl2
3 sp2 3 0 平面三角形 平面三角形 BF3
2 1 V形 SnBr2
4 sp3 4 0 四面 体形 正四面体形 CH4
3 1 三角锥形 NH3
2 2 V形 H2O
例1 (1)利用价层电子对互斥模型推断分子或离子的空间结构。
(2)四硫氰基二氨络铬酸铵的结构如图所示。
阳离子的空间结构为 ;
NH3的空间结构为 。
(3)BF3和NF3都是四原子分子,BF3的中心原子是 (填元素符号,下同),NF3的中心原子是 ;BF3分子的空间结构是平面三角形而NF3分子的空间结构是三角锥形,其原因是 。
答案 (1)正四面体形 直线形 平面三角形
(2)正四面体形 三角锥形
(3)B N BF3分子中B原子的3个价电子都与F原子形成共价键,无孤电子对,呈平面三角形,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对未成键的孤电子对,占据了N原子周围的空间,与成键电子对相互排斥,形成三角锥形结构
(3)BF3分子的中心原子B原子的3个价电子都与F原子形成共价键,无孤电子对,呈平面三角形;而NF3分子的中心原子N原子的3个价电子与F原子形成共价键,还有一对未成键的孤电子对,占据了N原子周围的空间,与成键电子对相互排斥,形成三角锥形结构。
2.键角的判断与比较
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间结构的主要因素之一。在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化轨道类型;二是中心原子的孤电子对数;三是中心原子的电负性大小。
(1)一般情况下,应该先从中心原子的杂化轨道类型入手。
中心原子杂化轨道类型不同的粒子,键角大小为sp杂化>sp2杂化>sp3杂化,如键角:CH≡CH>CH2═CH2>CH4。
(2)中心原子杂化方式相同的粒子,由于斥力:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间,孤电子对数越多,对成键电子对的斥力越大,键角越小。如键角:CH4>NH3>H2O。
(3)中心原子杂化方式相同且孤电子对数目也相同,利用中心原子的电负性大小比较键角大小。如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为V形,由于电负性:O>S,吸引电子的能力:O>S,且键长:O—H
(4)同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键
间,则键角大小不同。如甲醛中 :,键角:α>β。
例2 请回答下列问题。
(1)BF3中键角 (填“大于”或“小于”)CCl4中键角。
(2)H+可与H2O形成H3O+,H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是 。
(3)乙酸分子( )中的键角1 (填“大于”“等于”或“小
于”)键角2,原因是 。
答案 (1)大于
(2)H2O中氧原子上有两对孤电子对,H3O+中氧原子上有一对孤电子对,H2O中孤电子对对成键电子对的排斥力大于H3O+中孤电子对对成键电子对的排斥力
(3)大于 C═O对C—C的斥力大于C—O对C—C的斥力
解析 (1)BF3分子的空间结构为平面三角形,键角为120°;CCl4分子的空间结构为正四面体形,键角为109°28'。(2)H3O+、H2O的中心原子的杂化轨道类型均为sp3,H2O中O原子上有两对孤电子对,H3O+中O原子上有一对孤电子对,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,故H3O+中H—O—H的键角比H2O中H—O—H的键角大。(3)由于双键对单键的斥力大于单键对单键的斥力,故乙酸分子中的键角1大于键角2。
3.【高考延伸】 spd杂化
(1)简介
有些元素原子在形成化合物时,除了ns、np轨道发生杂化外,(n-1)d、nd轨道也参与杂化。常见的杂化方式有dsp2、sp3d、sp3d2等,通常存在于过渡元素形成的化合物中。
(2)判断方法
先计算出中心原子的价电子对数,若大于4,一般有d轨道参与杂化,并有相应的空间结构:
价电子对数 4 5 6
杂化类型 dsp2 sp3d sp3d2
几何构型 平面正方形 三角双锥形 八面体形
【注意】 不是所有的元素原子均能发生d轨道参与的杂化,例如,由于第二周期元素原子的第二能层不存在d轨道,N与Cl只能通过sp3杂化形成NCl3;而P与Cl既可以通过sp3杂化形成PCl3,也可以通过sp3d杂化形成PCl5。
例3 (1)[2021全国甲卷]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)[2021山东等级考节选]O、F、Cl电负性由大到小的顺序为 ;
Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价电子对数为 ,下列对XeF2中心原子杂化方式推断合理的是 (填字母)。
A.sp B.sp2
C.sp3 D.sp3d
答案 (1)sp3 ②
(2)F>O>Cl 5 D
解析 (1)由SiCl4的结构式可知,Si的价电子对数为4,故Si采取sp3杂化;由SiCl4(H2O)的结构式可知,Si的价电子对数为5,故SiCl4(H2O)中Si采取sp3d杂化。
(2)电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为F、O、Cl,所以电负性大小顺序为F>O>Cl; XeF2中心原子的价电子对数为 =5,其中心原子的杂化方式应为sp3d。
专题精练
情境探究
1.写出符合下列条件的相应的分子或离子的化学式。
(1)氧原子以sp3杂化轨道形成两个σ键: 。
(2)氧原子形成一个π键: 。
(3)硼原子以sp2杂化轨道形成三个σ键: 。
(4)氮原子形成四个σ键: ;氮原子形成两个π键: 。
答案 (1)H2O (2)O2 (3)BF3 (4) N2
解析 形成π键时可以有双键或三键,σ键全为单键;sp3杂化结构为四面体形,sp2杂化结构为平面三角形。根据以上两点可解此题,答案合理即可。
2.(1)P4S3可用于制造火柴,其分子结构如图所示。
①电负性:磷 (填“>”“<”或“=”)硫。
②P4S3分子中硫原子的杂化轨道类型为 。
③设NA为阿伏加德罗常数的值。
1 mol P4S3分子中孤电子对的数目为 。
④∠S—P—S (填“>”“<”或“=”)109°28'。
(2)气态SO3分子的空间结构为 ;将纯液态SO3冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是 。
答案 (1)①< ②sp3 ③10NA ④<
(2)平面三角形 sp3
解析 (1)①同周期元素的电负性从左往右增强,故电负性:磷<硫;②从P4S3分子结构图中得知,硫原子有2个σ键和2对孤电子对,其杂化轨道类型为sp3杂化;③从P4S3分子结构图中得知,每个S原子有2对孤电子对,每个P原子有1对孤电子对,则1 mol P4S3分子中孤电子对的数目为10NA;④从P4S3分子结构图中得知,P原子有1对孤电子对,孤电子对与成键电子对之间的排斥力大于成键电子对与成键电子对之间的排斥力,故∠S—P—S小于正四面体的夹角,即∠S—P—S<109°28'。
(2)SO3中价电子对数为3,没有孤电子对,空间结构为平面三角形;题图中固态SO3中S原子形成4个共价单键,其杂化轨道类型是sp3杂化。
3.已知:①红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5;氮与氢也可形成两种化合物:NH3和NH5。②PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形
( )。
(1)NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8的是
(填分子式),该分子的空间结构是 。
(2)有同学认为,NH5与PCl5类似,N原子的1个2s轨道、3个2p轨道和1个2d轨道可能发生sp3d杂化。请你对该同学的观点进行评价: 。
(3)经测定,NH5中存在离子键,N原子的最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5的电子式是 。
答案 (1)PCl3 三角锥形
(2)不对,因为N原子没有2d轨道
(3)
解析 (1)写出NH3、PCl3和PCl5分子的电子式不难发现,氢原子是2e-稳定,氯原子是8e-稳定。在PCl3中磷原子外围是8e-,PCl5中磷原子外围是10e-,所有原子的最外层电子数都是8的只有PCl3;联想到氨分子的空间结构,PCl3分子的空间结构是三角锥形。(3)要满足N原子的最外层电子数是8,所有
氢原子的最外层电子数都是2,则NH5的电子式应是 。
4.回答下列问题:
(1)下列微粒中按键角由大到小的顺序排列为 (填编号)。
(2)在BF3分子中,F—B—F的键角大小是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子的杂化轨道类型是 ,N2H4分子中的六个原子 (填“在”或“不在”)同一个平面上。
答案 (1)①④②⑤③
(2)120°
(3)sp3 不在
解析 (1)①HCN中的C原子采取sp杂化,键角为180°;②SiF4中Si原子杂化轨道数为4,采取sp3杂化,键角为109°28';③SCl2中S原子杂化轨道数为4,采取sp3杂化,含有2对孤电子对,分子为V形结构,键角约为105°;④ 中C原子的杂化轨道数为3,所以C原子采取sp2杂化,分子为平面三角形结构,键角为120°;⑤H3O+中O原子的杂化轨道数为4,所以O原子采取sp3杂化,O原子上含有1对孤电子对,分子为三角锥形结构,键角约为107°。所以各微粒按键角由大到小的顺序排列为①④②⑤③。
(2)在BF3分子中,中心原子B原子价电子对数为3,是sp2杂化,分子呈平面三角形结构,F—B—F的键角大小是120°。
(3)N2H4分子中,每个N原子形成3个σ键,N原子上有1对孤电子对,故N原子采取sp3杂化;1个N原子和与其相连的2个H原子及另外1个N原子形成类似NH3的三角锥形结构,故六个原子不可能共面。
5.(1)钒(V)固氮酶种类众多,其中一种结构如图甲所示:
①配体CH3CN中碳的杂化类型为 ,
所含σ键与π键数目之比为 。
②该物质中V的杂化方式最可能为 (填字母)。
A.sp2杂化
B.sp3杂化
C.sp3d杂化
D.sp3d2杂化
甲
(2)[N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图乙所示,其中阳离子中N原子的杂化轨道类型为 ,阴离子中As的杂化方式为 。
答案 (1)①sp3、sp 5∶2 ②D
(2)sp、sp2 sp3d2
解析 (1)①—CH3中C原子的杂化类型为sp3,—CN中C原子的杂化类型为sp;成键原子间只能形成一个σ键,1 mol CH3CN中含有σ键物质的量为5 mol,1 mol —C≡N键中含有π键的物质的量为2 mol,σ键和π键物质的量之比为5∶2。
②由题图甲知,V与周围6个原子形成6个σ键,成键原子间只能形成1个σ键,且杂化轨道数等于价电子对数,V的价电子对数为6,因此V的杂化类型为sp3d2杂化,故D正确。
(2)由题图乙知,形成一个双键的N原子除形成σ键、π键外,还存在孤电子对,采用sp2杂化;形成三键的氮原子和形成两个双键的氮原子,采取sp杂化,故N原子的杂化轨道类型为sp、sp2。阴离子中As的价电子对数为6,所以杂化方式为sp3d2。
本 课 结 束
