专题4复习课件(共26张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 专题4复习课件(共26张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 13:00:53 | ||
图片预览







文档简介
(共26张PPT)
专题4复习课
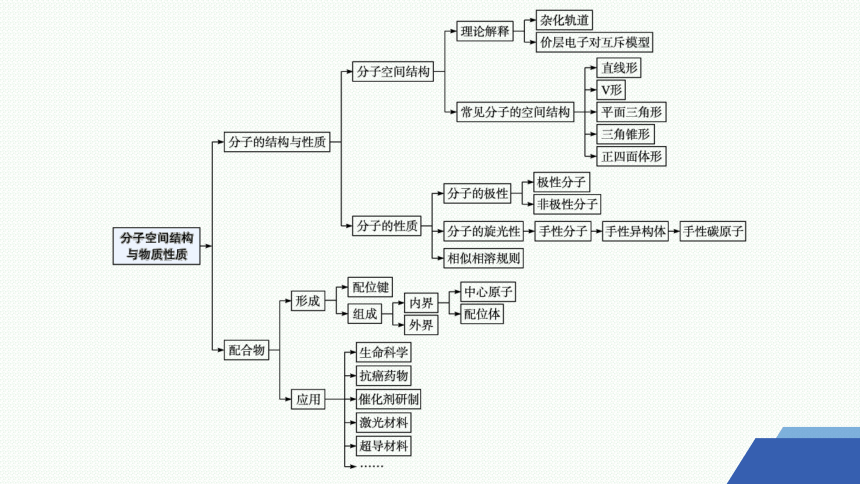
专题·知识网络
考点·专项突破
目 录 索 引
专题·知识网络
考点·专项突破
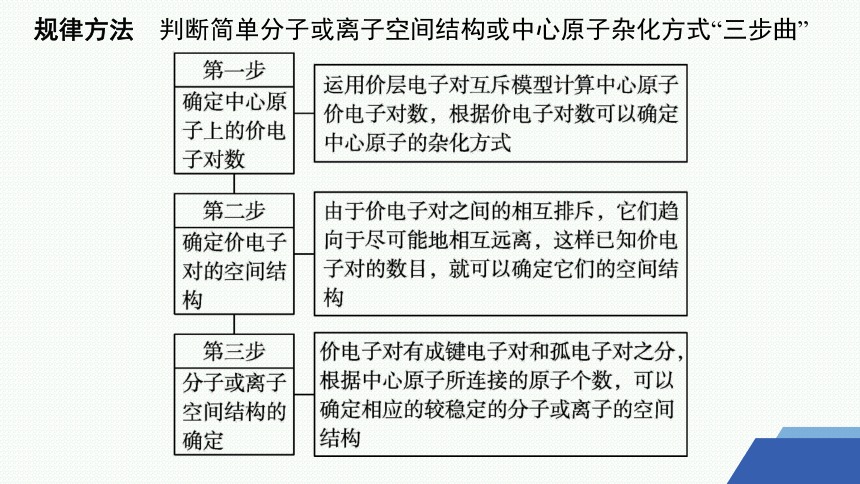
考点一 简单分子或离子的空间结构及其中心原子的杂化方式判断
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间结构相同
C
规律方法 判断简单分子或离子空间结构或中心原子杂化方式“三步曲”
【针对训练1】
A
【针对训练2】
(1)CS2分子中,C原子的杂化轨道类型是 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子空间结构为 ,其中氧原子的杂化方式为 。
(3)CH3COOH中C原子的杂化轨道类型为 。
答案 (1)sp
(2)V形 sp3
(3)sp3、sp2
中心原子有2对孤电子对,故分子的空间结构为V形,氧原子的杂化方式为sp3。
(3)CH3COOH中C原子有两种,甲基中的碳原子与相邻原子形成4对共用电子对,没有孤电子对,故其杂化轨道类型为sp3;羧基中的碳原子与氧原子形成双键,还分别与甲基上的碳原子、羟基中的氧原子各形成1对共用电子对,没有孤电子对,故其杂化轨道类型为sp2。
考点二 复杂分子中原子的杂化方式判断
例2 关于如图结构的说法不正确的是( )
A.分子中既有σ键又有π键
B.碳原子有sp2、sp3两种杂化方式
C.C—H键的极性强于O—H键的极性
D.羟基中氧原子采取sp3杂化,价层电子对互斥模型为四面体形
C
解析 分子中单键都是σ键,苯环、双键或三键既有σ键又有π键,因此该有机物中既有σ键又有π键,A项正确;以4个单键相连的C原子采用sp3杂化方式,苯环和碳碳双键的C原子采用sp2杂化,无sp杂化的C原子,B项正确;电负性: O>C,则O—H键的极性强于C—H键的极性,C项错误;羟基中氧原子成键电子对数为2,孤电子对数为2,则采取sp3杂化,其价层电子对互斥模型为四面体形,D项正确。
归纳总结 判断分子的中心原子杂化方式的方法
1.根据杂化轨道的空间分布构型判断
空间结构 杂化类型
若杂化轨道在空间的分布为正四面体形 分子的中心原子发生sp3杂化
若杂化轨道在空间的分布呈平面三角形 分子的中心原子发生sp2杂化
若杂化轨道在空间的分布呈直线形 分子的中心原子发生sp杂化
2.根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28',则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
3.根据中心原子的电子对数判断
如中心原子的电子对数为4,是sp3杂化;若为3,是sp2杂化;若为2,是sp杂化。
4.根据碳原子所连共价键中有无π键及π键数目判断
如没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp杂化。
【针对训练3】
(1)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。
(2)NH4H2PO4中,P的 杂化轨道与O的2p轨道形成 键。
答案 (1)sp3 sp3
(2)sp3 σ
(3)V形 sp3
解析 (1)乙二胺分子中,氮原子核外孤电子对数为1,σ键数目为3,则杂化轨道数目为4,故氮原子采取sp3杂化;碳原子核外孤电子对数为0,σ键数目为4,则杂化轨道数目为4,故碳原子采取sp3杂化。
(2)NH4H2PO4中P的价电子对数为4,故为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。
考点三 配合物的组成和结构
例3 配合物Na3[Fe(CN)6]可用于离子检验,设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键、非极性键
B.[Fe(CN)6]3-的中心原子为Fe3+,配位数为6
C.1 mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离得到阴、阳离子的数目约为4NA
A
解析 Na+与[Fe(CN)6]3-之间存在离子键,CN-与Fe3+之间存在配位键,CN-中碳原子与氮原子之间存在极性键,不存在非极性键,A错误;配合物Na3[Fe(CN)6]中,[Fe(CN)6]3-的中心原子为Fe3+,配位数为6,B正确;1 mol配合物Na3[Fe(CN)6]中σ键数目为12NA,C正确;该配合物为离子化合物,易电离,其电离方程式为Na3[Fe(CN)6]══ 3Na++[Fe(CN)6]3-,[Fe(CN)6]3-难以电离,1 mol配合物电离得到阴、阳离子的数目约为4NA,D正确。
归纳总结 配合物的组成和结构
配合物[Cu(NH3)4]SO4的组成如图所示。
(1)中心原子:提供空轨道能接受孤电子对的原子或金属阳离子。配合物的中心原子一般是带正电荷的阳离子,最常见的是过渡金属的原子或离子。
(2)配位体:含有孤电子对的原子、分子或阴离子。
①阴离子:如X-(卤素离子)、OH-、SCN-、CN-、RCOO-等。
②分子:如H2O、NH3、CO、醇、胺等。
(3)配位数:直接同中心原子配位的原子或离子的数目叫中心原子的配位数,如[Fe(CN)6]4-中Fe2+的配位数为6,[Cu(NH3)4]Cl2中Cu2+的配位数为4;注意
多齿配体的情况,如Fe2+与邻二氮菲(phen, )形成的配离子可表示为[Fe(phen)3]2+,配位数为6。
(4)配合物离子的电荷数等于中心原子或离子与配位体总电荷数的代数和。如[Co(NH3)5Cl]n+中,中心原子为Co3+,n=2。
【针对训练4】
若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是离子
B.若X提供空轨道,则配位键表示为X→Y
C.X、Y分别为Ag+、NH3时形成配位键,Ag+作配体
D.若X提供空轨道,则Y至少要提供一对孤电子对
D
解析 形成配位键可以是离子,也可以是分子或原子,故A错误;若X提供空轨道,则应该是提供孤电子对的粒子指向提供空轨道的粒子,因此配位键表示为Y→X,故B错误;X、Y分别为Ag+、NH3时形成配位键,含有孤电子对的离子或分子作配体,因此NH3作配体,故C错误;若X提供空轨道,则Y至少要提供一对孤电子对,故D正确。
【针对训练5】
为照相业的定影剂,反应的化学方程式为AgBr+2Na2S2O3══Na3[Ag(S2O3)2]+NaBr。下列说法正确的是( )
A.基态Br原子中电子的空间运动状态有35种
B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C. 中心原子S的杂化方式为sp3
D.非金属元素S、O、Br中电负性最大的是S
C
解析 Br为35号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p5,所以共有18种空间运动状态的电子,A项错误;
本 课 结 束
专题4复习课
专题·知识网络
考点·专项突破
目 录 索 引
专题·知识网络
考点·专项突破
考点一 简单分子或离子的空间结构及其中心原子的杂化方式判断
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间结构相同
C
规律方法 判断简单分子或离子空间结构或中心原子杂化方式“三步曲”
【针对训练1】
A
【针对训练2】
(1)CS2分子中,C原子的杂化轨道类型是 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子空间结构为 ,其中氧原子的杂化方式为 。
(3)CH3COOH中C原子的杂化轨道类型为 。
答案 (1)sp
(2)V形 sp3
(3)sp3、sp2
中心原子有2对孤电子对,故分子的空间结构为V形,氧原子的杂化方式为sp3。
(3)CH3COOH中C原子有两种,甲基中的碳原子与相邻原子形成4对共用电子对,没有孤电子对,故其杂化轨道类型为sp3;羧基中的碳原子与氧原子形成双键,还分别与甲基上的碳原子、羟基中的氧原子各形成1对共用电子对,没有孤电子对,故其杂化轨道类型为sp2。
考点二 复杂分子中原子的杂化方式判断
例2 关于如图结构的说法不正确的是( )
A.分子中既有σ键又有π键
B.碳原子有sp2、sp3两种杂化方式
C.C—H键的极性强于O—H键的极性
D.羟基中氧原子采取sp3杂化,价层电子对互斥模型为四面体形
C
解析 分子中单键都是σ键,苯环、双键或三键既有σ键又有π键,因此该有机物中既有σ键又有π键,A项正确;以4个单键相连的C原子采用sp3杂化方式,苯环和碳碳双键的C原子采用sp2杂化,无sp杂化的C原子,B项正确;电负性: O>C,则O—H键的极性强于C—H键的极性,C项错误;羟基中氧原子成键电子对数为2,孤电子对数为2,则采取sp3杂化,其价层电子对互斥模型为四面体形,D项正确。
归纳总结 判断分子的中心原子杂化方式的方法
1.根据杂化轨道的空间分布构型判断
空间结构 杂化类型
若杂化轨道在空间的分布为正四面体形 分子的中心原子发生sp3杂化
若杂化轨道在空间的分布呈平面三角形 分子的中心原子发生sp2杂化
若杂化轨道在空间的分布呈直线形 分子的中心原子发生sp杂化
2.根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28',则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
3.根据中心原子的电子对数判断
如中心原子的电子对数为4,是sp3杂化;若为3,是sp2杂化;若为2,是sp杂化。
4.根据碳原子所连共价键中有无π键及π键数目判断
如没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp杂化。
【针对训练3】
(1)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。
(2)NH4H2PO4中,P的 杂化轨道与O的2p轨道形成 键。
答案 (1)sp3 sp3
(2)sp3 σ
(3)V形 sp3
解析 (1)乙二胺分子中,氮原子核外孤电子对数为1,σ键数目为3,则杂化轨道数目为4,故氮原子采取sp3杂化;碳原子核外孤电子对数为0,σ键数目为4,则杂化轨道数目为4,故碳原子采取sp3杂化。
(2)NH4H2PO4中P的价电子对数为4,故为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。
考点三 配合物的组成和结构
例3 配合物Na3[Fe(CN)6]可用于离子检验,设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键、非极性键
B.[Fe(CN)6]3-的中心原子为Fe3+,配位数为6
C.1 mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离得到阴、阳离子的数目约为4NA
A
解析 Na+与[Fe(CN)6]3-之间存在离子键,CN-与Fe3+之间存在配位键,CN-中碳原子与氮原子之间存在极性键,不存在非极性键,A错误;配合物Na3[Fe(CN)6]中,[Fe(CN)6]3-的中心原子为Fe3+,配位数为6,B正确;1 mol配合物Na3[Fe(CN)6]中σ键数目为12NA,C正确;该配合物为离子化合物,易电离,其电离方程式为Na3[Fe(CN)6]══ 3Na++[Fe(CN)6]3-,[Fe(CN)6]3-难以电离,1 mol配合物电离得到阴、阳离子的数目约为4NA,D正确。
归纳总结 配合物的组成和结构
配合物[Cu(NH3)4]SO4的组成如图所示。
(1)中心原子:提供空轨道能接受孤电子对的原子或金属阳离子。配合物的中心原子一般是带正电荷的阳离子,最常见的是过渡金属的原子或离子。
(2)配位体:含有孤电子对的原子、分子或阴离子。
①阴离子:如X-(卤素离子)、OH-、SCN-、CN-、RCOO-等。
②分子:如H2O、NH3、CO、醇、胺等。
(3)配位数:直接同中心原子配位的原子或离子的数目叫中心原子的配位数,如[Fe(CN)6]4-中Fe2+的配位数为6,[Cu(NH3)4]Cl2中Cu2+的配位数为4;注意
多齿配体的情况,如Fe2+与邻二氮菲(phen, )形成的配离子可表示为[Fe(phen)3]2+,配位数为6。
(4)配合物离子的电荷数等于中心原子或离子与配位体总电荷数的代数和。如[Co(NH3)5Cl]n+中,中心原子为Co3+,n=2。
【针对训练4】
若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是离子
B.若X提供空轨道,则配位键表示为X→Y
C.X、Y分别为Ag+、NH3时形成配位键,Ag+作配体
D.若X提供空轨道,则Y至少要提供一对孤电子对
D
解析 形成配位键可以是离子,也可以是分子或原子,故A错误;若X提供空轨道,则应该是提供孤电子对的粒子指向提供空轨道的粒子,因此配位键表示为Y→X,故B错误;X、Y分别为Ag+、NH3时形成配位键,含有孤电子对的离子或分子作配体,因此NH3作配体,故C错误;若X提供空轨道,则Y至少要提供一对孤电子对,故D正确。
【针对训练5】
为照相业的定影剂,反应的化学方程式为AgBr+2Na2S2O3══Na3[Ag(S2O3)2]+NaBr。下列说法正确的是( )
A.基态Br原子中电子的空间运动状态有35种
B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C. 中心原子S的杂化方式为sp3
D.非金属元素S、O、Br中电负性最大的是S
C
解析 Br为35号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p5,所以共有18种空间运动状态的电子,A项错误;
本 课 结 束
