1.2.1 有机化合物的分离、提纯 有机化合物组成的研究课件 (共42张PPT)2023-2024学年高二化学苏教版选择性必修3
文档属性
| 名称 | 1.2.1 有机化合物的分离、提纯 有机化合物组成的研究课件 (共42张PPT)2023-2024学年高二化学苏教版选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 00:00:00 | ||
图片预览










文档简介
(共42张PPT)
专题1
第二单元 第1课时 有机化合物的分离、提纯 有机化合物组成的研究
素养 目标
1.通过对蒸馏法、萃取法的实验原理和基本操作的学习,初步学会分离、提纯有机物的常规方法,培养科学探究与创新意识的化学核心素养。
2.认识科学探究过程的步骤,学会设计科学探究方案,知道如何确定有机化合物的最简式,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、有机化合物的分离、提纯
1.有机化合物
(1)组成特点:有机化合物是指含有 元素的化合物,其中绝大多数含有
元素,很多有机化合物还含有 元素、 元素、 元素、
元素和 元素等。
(2)性质特点:有机物与无机物除了组成上存在差异外,在结构和性质上也有明显的不同。有机化合物的组成和结构特点,决定了大多数有机物与无机物具有 的性质。例如,多数有机物易溶于极性较 的溶剂,熔点、沸点较 ,容易燃烧,受热易 ,发生化学反应时其反应速率通常较 ,副反应较 。
碳
氢
氧
氮
卤族
硫
磷
不同
小
低
分解
小
多
(3)研究经历:
①从天然的动植物中提取、分离出一些 。
②研究有机化合物的组成、 、 和应用。
③根据需要对有机化合物分子进行 和 。
纯净物
结构
性质
设计
合成
2.有机化合物的分离、提纯
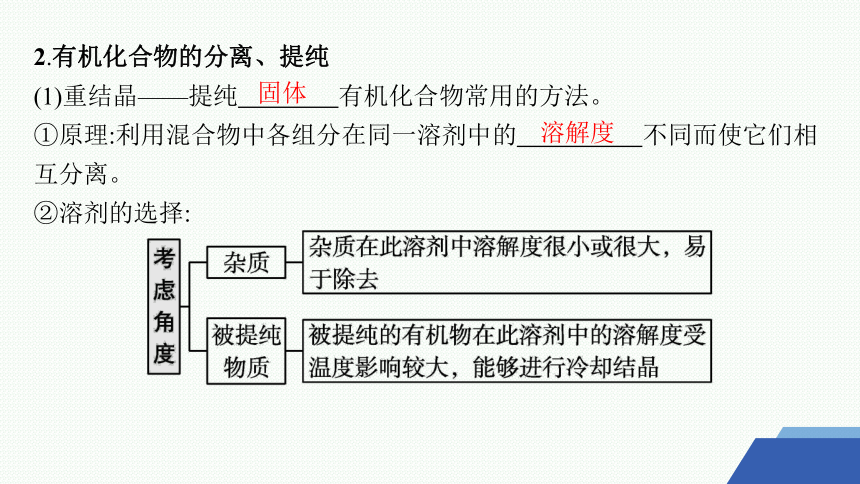
(1)重结晶——提纯 有机化合物常用的方法。
①原理:利用混合物中各组分在同一溶剂中的 不同而使它们相互分离。
②溶剂的选择:
固体
溶解度
(2)萃取——分为 萃取和 萃取。
①萃取的原理:
a.萃取是利用混合物中各组分在萃取剂中的 不同而使它们相互分离的操作。
b.液-液萃取。
原理 液-液萃取是向待分离溶液中加入与之 (或 互溶)的萃取剂,形成共存的两个液相,一般是用 从水中萃取某种组分
实例 四氯化碳萃取溶解在水中的碘,几乎所有的碘都溶解到____________ 中,碘得以与大量的水分离
液-液
固-液
溶解度
不互溶
部分
有机溶剂
四氯化碳
c.固-液萃取。
原理 固-液萃取是利用溶剂使固体物料中的 物质溶解于其中而加以分离的操作,又称浸取
实例 从植物种子中提取食用油,从甜菜中提取糖
②萃取剂:萃取用的溶剂称为萃取剂。
常用的萃取剂有: 、 、二氯甲烷等。
可溶性
乙醚
石油醚
③仪器和装置:
液-液萃取常用的操作仪器为 。
④分液:将萃取后的两层液体分开的操作叫做 。
分液漏斗
分液漏斗
分液
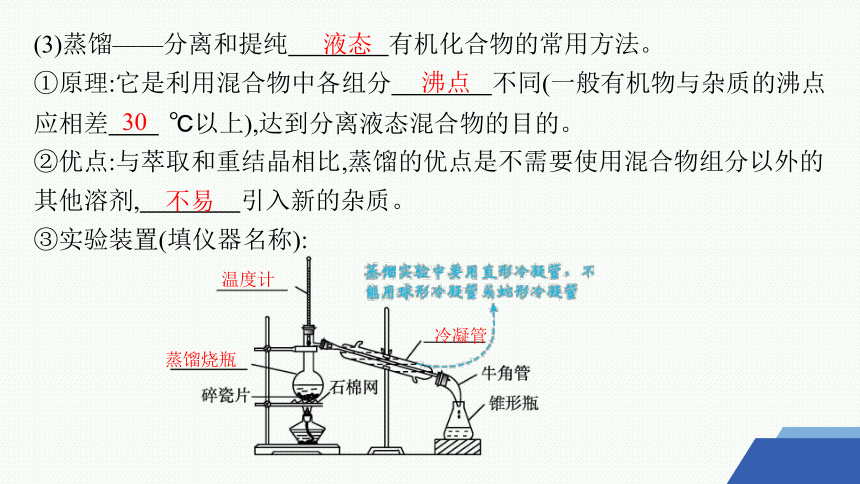
(3)蒸馏——分离和提纯 有机化合物的常用方法。
①原理:它是利用混合物中各组分 不同(一般有机物与杂质的沸点应相差 ℃以上),达到分离液态混合物的目的。
②优点:与萃取和重结晶相比,蒸馏的优点是不需要使用混合物组分以外的其他溶剂, 引入新的杂质。
③实验装置(填仪器名称):
液态
沸点
30
不易
蒸馏烧瓶
温度计
冷凝管
注意事项:
a.温度计水银球位于 。
b.碎瓷片的作用: 。
c.冷凝管中水流的方向是 口进入, 口流出。
蒸馏烧瓶支管口处
使液体平稳沸腾,防止暴沸
下
上
易错辨析判一判
(1)直接蒸馏含水10%的酒精可得到无水乙醇。( )
(2)碘在水中的溶解度很小,但易溶于有机溶剂,所以可用酒精萃取碘水中的碘单质。( )
(3)在重结晶的实验中,使用玻璃漏斗趁热过滤是为了减少被提纯物质的损失。( )
(4)用苯萃取碘水中的碘单质,分液后,可将苯蒸馏出去得到被提纯的碘,加热时温度不能太高,否则碘会升华。( )
×
提示 酒精和水的沸点差别不大,而且乙醇和水还可以形成共沸溶液,因此直接蒸馏含水10%的酒精无法制得无水乙醇。
提示 酒精与水互溶,碘水中加入酒精会形成均一溶液,无法分离。
×
√
√
二、有机化合物组成的研究
1.最简式
又称为实验式,指有机化合物所含各元素原子个数的 。
2.确定有机化合物元素组成的方法
(1)李比希元素分析法:
最简整数比
(2)钠熔法:可定性确定有机物中是否含有 等元素。
(3)铜丝燃烧法:可定性确定有机物中是否存在 ,红热铜丝蘸上试样,灼烧、火焰为 色,则存在卤素。
氮、氯、溴、硫
卤素
绿
3.元素分析仪
(1)工作原理:在不断通入 流的条件下,把样品加热到950~1 200 ℃,使之充分燃烧,再对燃烧产物进行自动分析。
(2)特点:
①自动化程度 。
②所需样品量 。
③分析速度 。
④可同时对碳、氢、氧、硫等多种元素进行分析。
氧气
高
小
快
教材阅读想一想1.6 g 某气态有机物在氧气中充分燃烧,生成4.4 g CO2和3.6 g H2O,试推断该有机物的最简式。能否推断该有机物的分子式 若能,写出其分子式。
提示 最简式为CH4,分子式为CH4。
由于m(C)+m(H)=1.6 g,说明有机物中不含氧原子。
由于n(C)∶n(H)=1∶4,因此有机物的最简式为CH4。
由于最简式CH4符合烷烃的通式,说明氢原子数已经达到饱和,因此该最简式就是分子式。
易错辨析判一判
(1)某有机物燃烧后只生成CO2和H2O,则该有机物一定只含有碳、氢两种元素。( )
(2)确定有机物的实验式就能直接得出该有机物的分子式。( )
(3)不同的有机物,其实验式、分子式一定不同。( )
提示 同分异构体分子式相同,实验式相同,如葡萄糖和果糖,分子式均为C6H12O6,实验式均为CH2O。还有些有机物分子式不同,但实验式相同,如乙烯和丙烯,分子式分别为C2H4和C3H6,但实验式均为CH2。
提示 确定有机物的实验式,一般不能直接得出该有机物的分子式,如最简式为CH2的有机物可为单烯烃或环烷烃。
提示 该有机物中一定含有碳、氢元素,可能含有氧元素等。
×
×
×
重难探究·能力素养全提升
探究一 有机化合物分离、提纯的方法
情境探究
已知:苯甲醛在空气中易被氧化;苯甲醇的沸点为205.7 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,在水中的溶解度为0.34 g (25 ℃);乙醚的沸点为34.8 ℃,微溶于水。实验室制备苯甲醇和苯甲酸的化学原理:
制备苯甲醇和苯甲酸的主要过程如下图所示:
1.操作Ⅰ的名称是什么 乙醚溶液中所溶解的主要成分是什么
提示 由所给信息可知,白色糊状物主要成分为苯甲醇和苯甲酸钾,加入水和乙醚后,根据“相似相溶”原理,乙醚中主要溶有苯甲醇,水中主要溶有苯甲酸钾,两种液体可用分液法分离,操作Ⅰ的名称为分液。
2.操作Ⅱ的名称是什么 有什么判断依据 产品甲是什么
3.操作Ⅲ的名称是什么 有什么判断依据 产品乙是什么
提示 溶解在乙醚中的苯甲醇的沸点与乙醚的沸点相差较大,可采用蒸馏法分离二者,所以操作Ⅱ是蒸馏,产品甲是苯甲醇。
提示 水溶液中含有苯甲酸钾,加入盐酸后生成的苯甲酸为微溶于水的晶体,可过滤分离,所以操作Ⅲ是过滤,产品乙是苯甲酸。
方法突破
1.常见分离、提纯方法的选择
2.分离提纯物质的“四原则”
应用体验
视角1有机化合物分离、提纯方法的选择
1.现有3组混合物:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液。分离以上各组混合物的正确方法依次是( )
A.分液法、萃取法、蒸馏法
B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法
D.蒸馏法、萃取法、分液法
C
解析 乙酸乙酯和乙酸钠溶液不互溶,可以用分液的方法将它们分离;乙醇和丁醇互溶但沸点不同,可用蒸馏的方法将它们分离;单质溴易溶于有机溶剂,溴化钠不溶于有机溶剂,可用萃取的方法将它们分离。
归纳总结 物质的性质与分离、提纯方法的选择
(1)根据物质的溶解性差异,可选用结晶、过滤的方法将混合物分离。
(2)根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。
(3)根据物质在不同溶剂中溶解性的差异,用萃取的方法把溶质从溶解性较小的溶剂中转移到溶解性较大的溶剂中。
(4)根据混合物中各组分的性质不同,可采用加热、调节pH、加适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。
2.咖啡因是弱碱性化合物,易溶于氯仿、乙醇、丙酮及热苯等,微溶于水、石油醚。含有结晶水的咖啡因是无色针状晶体,味苦,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。它的结构简式
在步骤1加入酒精进行浸泡,过滤得到提取液,步骤2、步骤3、步骤4所进行的操作或方法分别是( )
A.加热、结晶(或蒸发)、升华
B.过滤、洗涤、干燥
C.萃取、分液、升华
D.加热、蒸馏、蒸馏
A
解析 在步骤1中加入了酒精,下面要分离咖啡因和乙醇,可进行加热蒸发得到浓缩液再结晶得到粗产品,因咖啡因易升华,为进一步得到较为纯净的咖啡因,可进行升华。
视角2有机化合物分离、提纯实验具体操作
3.下列关于物质的分离、提纯、鉴别的实验中的一些操作或做法,正确的是( )
①在组装蒸馏装置时,温度计的水银球应伸入液面以下;
②用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏;
③溴水能鉴别出乙醇、甲苯、四氯化碳、环己烯;
④在苯甲酸重结晶实验中,待粗苯甲酸完全溶解,冷却到常温后过滤。
A.①② B.③④ C.①④ D.②③
D
解析 ①在组装蒸馏装置时,应该将温度计的水银球放在蒸馏烧瓶支管口处,错误;②酒精中含有少量的水,一般加入CaO(生石灰)来除去酒精中少量的水,CaO与水反应生成Ca(OH)2,氢氧化钙是离子化合物,沸点较高,利用此性质蒸馏将乙醇蒸出,正确;③乙醇、甲苯、四氯化碳、环己烯中加入溴水,现象分别为互溶、不分层不褪色,分层、上层为橙黄色,分层、下层为橙黄色,褪色,现象各不相同,能鉴别出来,正确;④在苯甲酸重结晶实验中,为了减少苯甲酸的损耗,待粗苯甲酸完全溶解后要趁热过滤,错误。
探究二 确定有机物实验式的方法
情境探究
从沙棘中提取的沙棘油中含有206种对人体有益的活性物质,其中有46种活性物质含有大量的维生素E、维生素A、黄酮等。沙棘油具有降低血浆胆固醇含量、血管壁中胆固醇含量的作用,能防治高脂血症和动脉粥样硬化症,并有促进伤口愈合的作用。
1.提取出来的某沙棘油只含有C、H、O三种元素,如何测定各元素的含量
提示
2.6.4 g 某有机物A,完全燃烧测得生成8.8 g CO2和7.2 g H2O,无其他物质生成。你能确定该有机物中是否含有氧元素吗
3.根据上面有机物A燃烧的实验数据,推断A的最简式。
方法突破
燃烧法测定有机物中氧元素质量分数
若将有机物完全燃烧,生成物只有H2O(使无水CuSO4变蓝)和CO2(使澄清石灰水变浑浊),则该有机物中一定含有的元素是C、H,可能含有的元素是O。
应用体验
视角燃烧法确定有机物组成的实验
1.实验室用燃烧法测定某种氨基酸(CxHyOzNm)的实验式,取W g 该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,按如图所示装置进行实验。
下列说法错误的是( )
A.实验开始时,首先通入一段时间的氧气,其目的是将装置中的N2排净
B.操作时应先点燃D处的酒精灯
C.D装置的作用是吸收未反应的氧气,保证最终收集的气体为N2
D.实验测得N2的体积(标准状况下)、二氧化碳和水的质量,便可确定此氨基酸的分子式
D
解析 空气中含有N2,影响生成氮气的体积测定,需将装置中的N2排净,A正确;氨基酸和氧气的反应,以及铜网和氧气的反应都需要加热,应先点燃D处的酒精灯,吸收未反应的氧气,保证最终收集的气体为N2,B正确,C正确;测出该种氨基酸最简式需要二氧化碳、水的质量以及氮气的体积,并计算氧元素的质量,确定分子中元素原子个数比,而分子式需再结合氨基酸的相对分子质量确定,D错误。
归纳总结 燃烧法测定有机物最简式(实验式)的注意事项
(1)实验中O2过量,保证有机物能充分被氧化生成CO2和H2O,为保证有机物充分被氧化,常把得到的气体化合物再通过灼热CuO把CO转化为CO2。
(2)先吸收H2O(g),再吸收CO2。吸收H2O(g)常用高氯酸镁、浓硫酸、无水氯化钙等,吸收CO2可用烧碱石棉剂、碱石灰等。
(3)测定数据包括实验开始时样品的质量、干燥装置实验前后质量、CO2吸收装置实验前后质量;有机物中如含有氮元素,还需测定产生的N2的体积。
2.[2023河北邯郸高二期中]a g某常见有机物X在足量的氧气中充分燃烧,生成4.4 g CO2和3.6 g H2O,下列说法正确的是( )
A.X不可能是甲烷
B.若X含有三种元素,则a可能为3.2
C.X完全燃烧时,消耗的n(X)∶n(O2)=1∶2
D.X最多存在两种同分异构体
B
本 课 结 束
专题1
第二单元 第1课时 有机化合物的分离、提纯 有机化合物组成的研究
素养 目标
1.通过对蒸馏法、萃取法的实验原理和基本操作的学习,初步学会分离、提纯有机物的常规方法,培养科学探究与创新意识的化学核心素养。
2.认识科学探究过程的步骤,学会设计科学探究方案,知道如何确定有机化合物的最简式,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、有机化合物的分离、提纯
1.有机化合物
(1)组成特点:有机化合物是指含有 元素的化合物,其中绝大多数含有
元素,很多有机化合物还含有 元素、 元素、 元素、
元素和 元素等。
(2)性质特点:有机物与无机物除了组成上存在差异外,在结构和性质上也有明显的不同。有机化合物的组成和结构特点,决定了大多数有机物与无机物具有 的性质。例如,多数有机物易溶于极性较 的溶剂,熔点、沸点较 ,容易燃烧,受热易 ,发生化学反应时其反应速率通常较 ,副反应较 。
碳
氢
氧
氮
卤族
硫
磷
不同
小
低
分解
小
多
(3)研究经历:
①从天然的动植物中提取、分离出一些 。
②研究有机化合物的组成、 、 和应用。
③根据需要对有机化合物分子进行 和 。
纯净物
结构
性质
设计
合成
2.有机化合物的分离、提纯
(1)重结晶——提纯 有机化合物常用的方法。
①原理:利用混合物中各组分在同一溶剂中的 不同而使它们相互分离。
②溶剂的选择:
固体
溶解度
(2)萃取——分为 萃取和 萃取。
①萃取的原理:
a.萃取是利用混合物中各组分在萃取剂中的 不同而使它们相互分离的操作。
b.液-液萃取。
原理 液-液萃取是向待分离溶液中加入与之 (或 互溶)的萃取剂,形成共存的两个液相,一般是用 从水中萃取某种组分
实例 四氯化碳萃取溶解在水中的碘,几乎所有的碘都溶解到____________ 中,碘得以与大量的水分离
液-液
固-液
溶解度
不互溶
部分
有机溶剂
四氯化碳
c.固-液萃取。
原理 固-液萃取是利用溶剂使固体物料中的 物质溶解于其中而加以分离的操作,又称浸取
实例 从植物种子中提取食用油,从甜菜中提取糖
②萃取剂:萃取用的溶剂称为萃取剂。
常用的萃取剂有: 、 、二氯甲烷等。
可溶性
乙醚
石油醚
③仪器和装置:
液-液萃取常用的操作仪器为 。
④分液:将萃取后的两层液体分开的操作叫做 。
分液漏斗
分液漏斗
分液
(3)蒸馏——分离和提纯 有机化合物的常用方法。
①原理:它是利用混合物中各组分 不同(一般有机物与杂质的沸点应相差 ℃以上),达到分离液态混合物的目的。
②优点:与萃取和重结晶相比,蒸馏的优点是不需要使用混合物组分以外的其他溶剂, 引入新的杂质。
③实验装置(填仪器名称):
液态
沸点
30
不易
蒸馏烧瓶
温度计
冷凝管
注意事项:
a.温度计水银球位于 。
b.碎瓷片的作用: 。
c.冷凝管中水流的方向是 口进入, 口流出。
蒸馏烧瓶支管口处
使液体平稳沸腾,防止暴沸
下
上
易错辨析判一判
(1)直接蒸馏含水10%的酒精可得到无水乙醇。( )
(2)碘在水中的溶解度很小,但易溶于有机溶剂,所以可用酒精萃取碘水中的碘单质。( )
(3)在重结晶的实验中,使用玻璃漏斗趁热过滤是为了减少被提纯物质的损失。( )
(4)用苯萃取碘水中的碘单质,分液后,可将苯蒸馏出去得到被提纯的碘,加热时温度不能太高,否则碘会升华。( )
×
提示 酒精和水的沸点差别不大,而且乙醇和水还可以形成共沸溶液,因此直接蒸馏含水10%的酒精无法制得无水乙醇。
提示 酒精与水互溶,碘水中加入酒精会形成均一溶液,无法分离。
×
√
√
二、有机化合物组成的研究
1.最简式
又称为实验式,指有机化合物所含各元素原子个数的 。
2.确定有机化合物元素组成的方法
(1)李比希元素分析法:
最简整数比
(2)钠熔法:可定性确定有机物中是否含有 等元素。
(3)铜丝燃烧法:可定性确定有机物中是否存在 ,红热铜丝蘸上试样,灼烧、火焰为 色,则存在卤素。
氮、氯、溴、硫
卤素
绿
3.元素分析仪
(1)工作原理:在不断通入 流的条件下,把样品加热到950~1 200 ℃,使之充分燃烧,再对燃烧产物进行自动分析。
(2)特点:
①自动化程度 。
②所需样品量 。
③分析速度 。
④可同时对碳、氢、氧、硫等多种元素进行分析。
氧气
高
小
快
教材阅读想一想1.6 g 某气态有机物在氧气中充分燃烧,生成4.4 g CO2和3.6 g H2O,试推断该有机物的最简式。能否推断该有机物的分子式 若能,写出其分子式。
提示 最简式为CH4,分子式为CH4。
由于m(C)+m(H)=1.6 g,说明有机物中不含氧原子。
由于n(C)∶n(H)=1∶4,因此有机物的最简式为CH4。
由于最简式CH4符合烷烃的通式,说明氢原子数已经达到饱和,因此该最简式就是分子式。
易错辨析判一判
(1)某有机物燃烧后只生成CO2和H2O,则该有机物一定只含有碳、氢两种元素。( )
(2)确定有机物的实验式就能直接得出该有机物的分子式。( )
(3)不同的有机物,其实验式、分子式一定不同。( )
提示 同分异构体分子式相同,实验式相同,如葡萄糖和果糖,分子式均为C6H12O6,实验式均为CH2O。还有些有机物分子式不同,但实验式相同,如乙烯和丙烯,分子式分别为C2H4和C3H6,但实验式均为CH2。
提示 确定有机物的实验式,一般不能直接得出该有机物的分子式,如最简式为CH2的有机物可为单烯烃或环烷烃。
提示 该有机物中一定含有碳、氢元素,可能含有氧元素等。
×
×
×
重难探究·能力素养全提升
探究一 有机化合物分离、提纯的方法
情境探究
已知:苯甲醛在空气中易被氧化;苯甲醇的沸点为205.7 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,在水中的溶解度为0.34 g (25 ℃);乙醚的沸点为34.8 ℃,微溶于水。实验室制备苯甲醇和苯甲酸的化学原理:
制备苯甲醇和苯甲酸的主要过程如下图所示:
1.操作Ⅰ的名称是什么 乙醚溶液中所溶解的主要成分是什么
提示 由所给信息可知,白色糊状物主要成分为苯甲醇和苯甲酸钾,加入水和乙醚后,根据“相似相溶”原理,乙醚中主要溶有苯甲醇,水中主要溶有苯甲酸钾,两种液体可用分液法分离,操作Ⅰ的名称为分液。
2.操作Ⅱ的名称是什么 有什么判断依据 产品甲是什么
3.操作Ⅲ的名称是什么 有什么判断依据 产品乙是什么
提示 溶解在乙醚中的苯甲醇的沸点与乙醚的沸点相差较大,可采用蒸馏法分离二者,所以操作Ⅱ是蒸馏,产品甲是苯甲醇。
提示 水溶液中含有苯甲酸钾,加入盐酸后生成的苯甲酸为微溶于水的晶体,可过滤分离,所以操作Ⅲ是过滤,产品乙是苯甲酸。
方法突破
1.常见分离、提纯方法的选择
2.分离提纯物质的“四原则”
应用体验
视角1有机化合物分离、提纯方法的选择
1.现有3组混合物:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液。分离以上各组混合物的正确方法依次是( )
A.分液法、萃取法、蒸馏法
B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法
D.蒸馏法、萃取法、分液法
C
解析 乙酸乙酯和乙酸钠溶液不互溶,可以用分液的方法将它们分离;乙醇和丁醇互溶但沸点不同,可用蒸馏的方法将它们分离;单质溴易溶于有机溶剂,溴化钠不溶于有机溶剂,可用萃取的方法将它们分离。
归纳总结 物质的性质与分离、提纯方法的选择
(1)根据物质的溶解性差异,可选用结晶、过滤的方法将混合物分离。
(2)根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。
(3)根据物质在不同溶剂中溶解性的差异,用萃取的方法把溶质从溶解性较小的溶剂中转移到溶解性较大的溶剂中。
(4)根据混合物中各组分的性质不同,可采用加热、调节pH、加适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。
2.咖啡因是弱碱性化合物,易溶于氯仿、乙醇、丙酮及热苯等,微溶于水、石油醚。含有结晶水的咖啡因是无色针状晶体,味苦,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。它的结构简式
在步骤1加入酒精进行浸泡,过滤得到提取液,步骤2、步骤3、步骤4所进行的操作或方法分别是( )
A.加热、结晶(或蒸发)、升华
B.过滤、洗涤、干燥
C.萃取、分液、升华
D.加热、蒸馏、蒸馏
A
解析 在步骤1中加入了酒精,下面要分离咖啡因和乙醇,可进行加热蒸发得到浓缩液再结晶得到粗产品,因咖啡因易升华,为进一步得到较为纯净的咖啡因,可进行升华。
视角2有机化合物分离、提纯实验具体操作
3.下列关于物质的分离、提纯、鉴别的实验中的一些操作或做法,正确的是( )
①在组装蒸馏装置时,温度计的水银球应伸入液面以下;
②用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏;
③溴水能鉴别出乙醇、甲苯、四氯化碳、环己烯;
④在苯甲酸重结晶实验中,待粗苯甲酸完全溶解,冷却到常温后过滤。
A.①② B.③④ C.①④ D.②③
D
解析 ①在组装蒸馏装置时,应该将温度计的水银球放在蒸馏烧瓶支管口处,错误;②酒精中含有少量的水,一般加入CaO(生石灰)来除去酒精中少量的水,CaO与水反应生成Ca(OH)2,氢氧化钙是离子化合物,沸点较高,利用此性质蒸馏将乙醇蒸出,正确;③乙醇、甲苯、四氯化碳、环己烯中加入溴水,现象分别为互溶、不分层不褪色,分层、上层为橙黄色,分层、下层为橙黄色,褪色,现象各不相同,能鉴别出来,正确;④在苯甲酸重结晶实验中,为了减少苯甲酸的损耗,待粗苯甲酸完全溶解后要趁热过滤,错误。
探究二 确定有机物实验式的方法
情境探究
从沙棘中提取的沙棘油中含有206种对人体有益的活性物质,其中有46种活性物质含有大量的维生素E、维生素A、黄酮等。沙棘油具有降低血浆胆固醇含量、血管壁中胆固醇含量的作用,能防治高脂血症和动脉粥样硬化症,并有促进伤口愈合的作用。
1.提取出来的某沙棘油只含有C、H、O三种元素,如何测定各元素的含量
提示
2.6.4 g 某有机物A,完全燃烧测得生成8.8 g CO2和7.2 g H2O,无其他物质生成。你能确定该有机物中是否含有氧元素吗
3.根据上面有机物A燃烧的实验数据,推断A的最简式。
方法突破
燃烧法测定有机物中氧元素质量分数
若将有机物完全燃烧,生成物只有H2O(使无水CuSO4变蓝)和CO2(使澄清石灰水变浑浊),则该有机物中一定含有的元素是C、H,可能含有的元素是O。
应用体验
视角燃烧法确定有机物组成的实验
1.实验室用燃烧法测定某种氨基酸(CxHyOzNm)的实验式,取W g 该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,按如图所示装置进行实验。
下列说法错误的是( )
A.实验开始时,首先通入一段时间的氧气,其目的是将装置中的N2排净
B.操作时应先点燃D处的酒精灯
C.D装置的作用是吸收未反应的氧气,保证最终收集的气体为N2
D.实验测得N2的体积(标准状况下)、二氧化碳和水的质量,便可确定此氨基酸的分子式
D
解析 空气中含有N2,影响生成氮气的体积测定,需将装置中的N2排净,A正确;氨基酸和氧气的反应,以及铜网和氧气的反应都需要加热,应先点燃D处的酒精灯,吸收未反应的氧气,保证最终收集的气体为N2,B正确,C正确;测出该种氨基酸最简式需要二氧化碳、水的质量以及氮气的体积,并计算氧元素的质量,确定分子中元素原子个数比,而分子式需再结合氨基酸的相对分子质量确定,D错误。
归纳总结 燃烧法测定有机物最简式(实验式)的注意事项
(1)实验中O2过量,保证有机物能充分被氧化生成CO2和H2O,为保证有机物充分被氧化,常把得到的气体化合物再通过灼热CuO把CO转化为CO2。
(2)先吸收H2O(g),再吸收CO2。吸收H2O(g)常用高氯酸镁、浓硫酸、无水氯化钙等,吸收CO2可用烧碱石棉剂、碱石灰等。
(3)测定数据包括实验开始时样品的质量、干燥装置实验前后质量、CO2吸收装置实验前后质量;有机物中如含有氮元素,还需测定产生的N2的体积。
2.[2023河北邯郸高二期中]a g某常见有机物X在足量的氧气中充分燃烧,生成4.4 g CO2和3.6 g H2O,下列说法正确的是( )
A.X不可能是甲烷
B.若X含有三种元素,则a可能为3.2
C.X完全燃烧时,消耗的n(X)∶n(O2)=1∶2
D.X最多存在两种同分异构体
B
本 课 结 束
