3.1.1 烃的分类 烷烃的性质课件 (共34张PPT)2023-2024学年高二化学苏教版选择性必修3
文档属性
| 名称 | 3.1.1 烃的分类 烷烃的性质课件 (共34张PPT)2023-2024学年高二化学苏教版选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 13:08:45 | ||
图片预览









文档简介
(共34张PPT)
专题3
第一单元 第1课时 烃的分类 烷烃的性质
素养 目标
1.认识烷烃的组成和结构特点,培养宏观辨识与微观探析的化学核心素养。
2.通过烷烃的化学性质认识取代反应的特点和规律,通过分子中化学键的变化,分析反应机理,建立认知模型,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
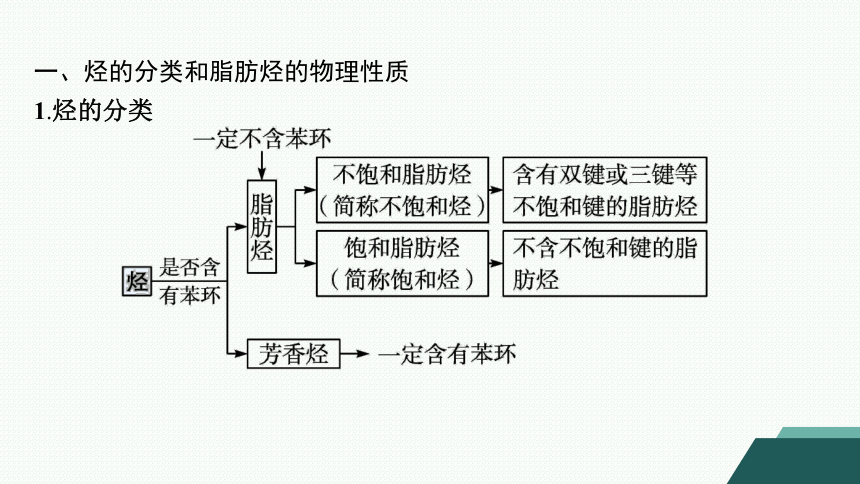
一、烃的分类和脂肪烃的物理性质
1.烃的分类
2.脂肪烃的物理性质
(1)烷烃的物理性质。
物理性质 变化规律
状态 随碳原子数的增加,常温下存在的状态由 态逐渐过渡到
态、 态。当碳原子数小于或等于 时,烷烃在常温下呈气态
溶解性 都难溶于 ,易溶于
熔、沸点 随碳原子数的增加,熔、沸点逐渐 。同种烷烃的
中,支链越多,熔、沸点越
密度 随碳原子数的增加,密度逐渐 ,但比水的
(2)烯烃、炔烃的物理性质。
烯烃、炔烃的物理性质和烷烃相似。
气
液
固
4
水
有机溶剂
升高
不同异构体
低
增大
小
易错辨析判一判
(1)烷烃、烯烃、炔烃和苯的同系物都属于脂肪烃。( )
(2)分子中含有苯环的烃一定属于芳香烃。( )
(3)碳原子数小于4的烷烃常温下一定是气体。( )
(4)1-戊烯比2-甲基-1-戊烯的沸点高。( )
×
提示 苯的同系物含有苯环,属于芳香烃。
提示 1-戊烯和2-甲基-1-戊烯主链碳原子数相同,后者增加了一个碳原子,因此后者沸点高。
√
√
×
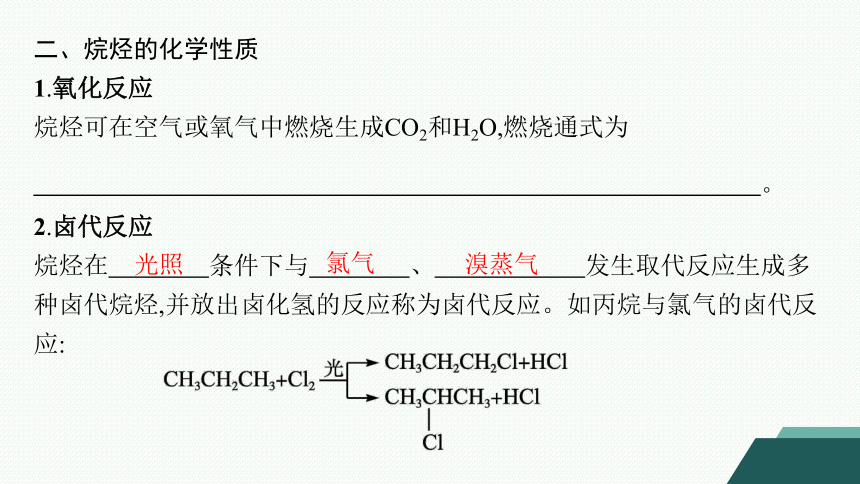
二、烷烃的化学性质
1.氧化反应
烷烃可在空气或氧气中燃烧生成CO2和H2O,燃烧通式为
。
2.卤代反应
烷烃在 条件下与 、 发生取代反应生成多种卤代烷烃,并放出卤化氢的反应称为卤代反应。如丙烷与氯气的卤代反应:
光照
氯气
溴蒸气
教材阅读想一想己烷能不能和溴水在光照下发生卤代反应 如果把己烷和溴水混合在一起振荡后有什么现象
提示 不能。卤素单质的水溶液不能和烷烃发生卤代反应。如果把己烷和溴水混合,己烷能把溴单质从溴水中萃取出来,所以现象是液体分层,上层溶液为橙红色,下层近无色。
易错辨析判一判
(1)甲烷、乙烷和丙烷具有相似的化学性质。( )
(2)烷烃性质很稳定,常温下不发生任何化学反应。( )
(3)乙烷能与溴水发生卤代反应而褪色。( )
(4)乙烷与Cl2在光照条件下反应可生成两种二氯代物。( )
提示 烷烃化学性质稳定,但在光照条件下可与卤素单质发生取代反应。
提示 乙烷与溴蒸气发生卤代反应,不能与溴水反应。
√
×
×
√
重难探究·能力素养全提升
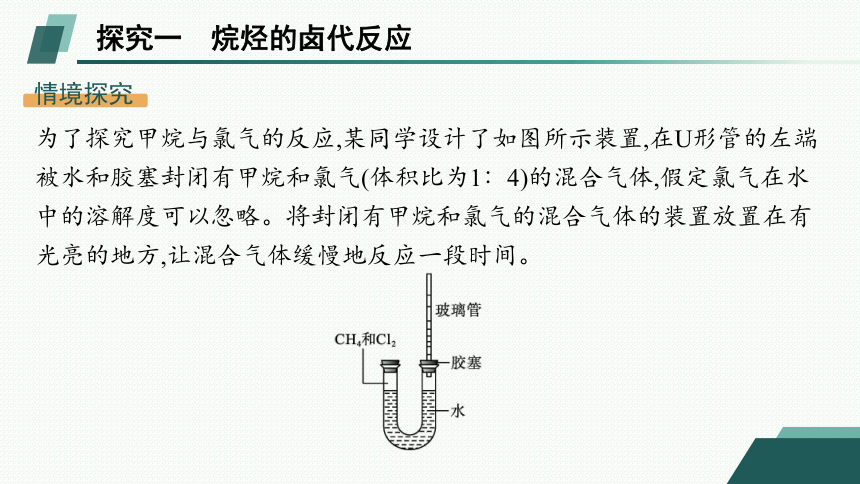
探究一 烷烃的卤代反应
情境探究
为了探究甲烷与氯气的反应,某同学设计了如图所示装置,在U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
1.假设甲烷与氯气反应充分,且只产生一种有机物,其应为哪种有机物 试写出反应的化学方程式。
2.经过几个小时的反应后,U形管左端的气柱体积怎样变化
3.若水中含有Na2SiO3,在U形管的左端会观察到什么现象
提示 四氯化碳。CH4+4Cl2 CCl4+4HCl。
提示 体积减小。由于反应产物中的氯化氢易溶于水,CH2Cl2、CHCl3、CCl4是液体,气体体积减小。
提示 有白色沉淀生成,由于甲烷与Cl2反应生成了HCl,故能与Na2SiO3发生反应:Na2SiO3+2HCl===2NaCl+H2SiO3↓,生成的白色沉淀为H2SiO3。
方法突破
烷烃卤代反应需注意的5个方面
(1)反应的条件——光照。
(2)反应物状态——纯净的卤素单质(F2、Cl2、Br2、I2),而不是其水溶液。
(3)反应特点——氢原子被卤素原子逐步取代,多步反应同时进行。
(4)反应产物——混合物(多种卤代烃和卤化氢),不适宜用于制备卤代烃。
(5)定量关系——n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+…=n(HX)。
反应中X2一分为二,卤素原子一半进入卤代烃,一半生成HX
应用体验
视角1烷烃的结构与性质
1.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关说法不正确的是( )
A.甲烷与丙烷互为同系物
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.甲烷、乙烷、丙烷中的化学键都是极性共价键
D.乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃
C
解析 甲烷与丙烷结构相似,在分子组成上相差2个“CH2”原子团,互为同系物,A正确;甲烷是烃类物质中氢的质量分数最高的化合物,B正确;甲烷中只有碳氢键,只含极性共价键,乙烷、丙烷中既有碳氢键,也有碳碳单键,所以既有极性共价键,也有非极性共价键,C错误;乙烷和氯气在光照的条件下可以发生取代反应,生成一氯乙烷、二氯乙烷、三氯乙烷等多种氯代烃,D正确。
2.下列说法正确的是( )
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量分数逐渐减小
C.分子通式为CnH2n+2的烃一定是烷烃
D.异戊烷与2-甲基丁烷互为同系物
C
视角2烷烃卤代反应产物结构的分析
3.分子式为C4H8Cl2的有机物(不考虑立体异构)有( )
A.7种 B.8种
C.9种 D.10种
C
解析 C4H8Cl2可以看作C4H10中2个H原子被2个Cl原子取代,C4H10有CH3CH2CH2CH3、CH3CH(CH3)2两种,这两种异构体中均含有2种氢原子。
思维点拨 判断有机物二元取代产物异构体数目可用定一动一法。首先确定有机物中可被取代的氢原子有几种,据此确定第一个取代基可连接的位置;判断有机物连接第一个取代基后有几类氢原子,确定第二个取代基可连接的位置。注意如果两个取代基相同,还应注意不要出现重复。
4.2-甲基丁烷( )的二氯取代产物有(不考虑立体异构)( )
A.3种 B.9种 C.10种 D.6种
C
所以共10种,答案选C。
探究二 烃的燃烧规律
情境探究
天然气的主要成分是甲烷,是一种十分重要的“清洁能源”,与液化石油气(主要成分是丙烷、丁烷)一样都是常用的家用燃气。随着现代社会对环境保护要求的提高,液化石油气正逐渐被天然气所取代。居民家庭中在将液化石油气更换为天然气时,通常需要更换燃气灶具或调整进气量。
1.相同状况下等体积的液化石油气和天然气,完全燃烧时哪种气体的耗氧量大
根据以上方程式可知相同状况下等体积(即等物质的量)的液化石油气耗氧量大。
2.居民家庭中将液化石油气改为天然气时,如何调整燃气灶的进气量
3.在120 ℃时,1 L CH4与C2H4的混合气体与10 L O2混合通以电火花不断引燃,充分反应,恢复到原温度和压强。反应后的气体体积是多少
提示 增大天然气进气量或减小空气进气量。
提示 11 L。根据反应CH4+2O2 CO2+2H2O和C2H4+3O2 2CO2+2H2O,在120 ℃时,水为气态,则两反应中反应前后气体体积不变,因此反应后气体体积为1 L+10 L=11 L。
方法突破
1.有机物完全燃烧耗氧量与生成CO2和H2O的规律
2.同温同压下,气态烃(CxHy)完全燃烧前后气体体积变化规律
(1)燃烧后温度高于100 ℃时,水为气态。
反应前后气 体体积变化 V前=V后 V前>V后 V前x、y满足 的条件 y=4 y<4 y>4
(2)燃烧后温度低于100 ℃时,水为液态,反应后气体体积减小。
应用体验
视角1烃的燃烧规律
1.下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓硫酸,减小的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100 ℃),则y=4;若体积减小,则y>4;否则y<4
D.相同质量的烃完全燃烧,消耗的O2越多,烃中含氢元素的质量分数就越高
D
解析 由题意可知有机物燃烧后产物只有CO2和H2O,依据原子守恒可知该物质中一定含有碳、氢元素,氧元素不能确定,故A错误。一种烃在足量的氧气中燃烧并通过浓硫酸只能说产物的体积减小的部分是生成水蒸气的
y<4,反之则y>4,故C错误。因为1 mol C消耗1 mol O2,1 mol C的质量为12 g,12 g H物质的量为12 mol,12 mol H消耗3 mol O2,因此相同质量的碳和氢,氢元素耗氧量大,所以相同质量的烃完全燃烧,氢元素的质量分数越高,消耗的O2越多,故D正确。
易错提醒 利用烃类燃烧通式计算问题时的注意事项
(1)注意水的状态是液态还是气态。
(2)气态烃完全燃烧前后,气体体积变化只与烃分子中氢原子个数有关。
(3)注意烃是否完全燃烧,也就是O2是否足量。
视角2通过烃燃烧的耗氧量分析烃的组成
2.1 mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑立体异构)有( )
A.3种 B.6种
C.5种 D.7种
C
3.两种气态烃以任意比例混合,在200 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中符合此条件的是( )
A.CH4、C2H4 B.CH4、C3H6
C.C2H4、C3H6 D.C2H2、C4H8
A
解析 根据1 mol气态烃耗氧量最多的C4H8分析,1 mol C4H8消耗6 mol O2,则1 L该混合烃与9 L氧气混合充分燃烧,O2过量,烃可完全燃烧。
由于两种气态烃以任意比例混合,则混合烃中各组分分子式中H原子数目为4符合题意,故A正确。
本 课 结 束
专题3
第一单元 第1课时 烃的分类 烷烃的性质
素养 目标
1.认识烷烃的组成和结构特点,培养宏观辨识与微观探析的化学核心素养。
2.通过烷烃的化学性质认识取代反应的特点和规律,通过分子中化学键的变化,分析反应机理,建立认知模型,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、烃的分类和脂肪烃的物理性质
1.烃的分类
2.脂肪烃的物理性质
(1)烷烃的物理性质。
物理性质 变化规律
状态 随碳原子数的增加,常温下存在的状态由 态逐渐过渡到
态、 态。当碳原子数小于或等于 时,烷烃在常温下呈气态
溶解性 都难溶于 ,易溶于
熔、沸点 随碳原子数的增加,熔、沸点逐渐 。同种烷烃的
中,支链越多,熔、沸点越
密度 随碳原子数的增加,密度逐渐 ,但比水的
(2)烯烃、炔烃的物理性质。
烯烃、炔烃的物理性质和烷烃相似。
气
液
固
4
水
有机溶剂
升高
不同异构体
低
增大
小
易错辨析判一判
(1)烷烃、烯烃、炔烃和苯的同系物都属于脂肪烃。( )
(2)分子中含有苯环的烃一定属于芳香烃。( )
(3)碳原子数小于4的烷烃常温下一定是气体。( )
(4)1-戊烯比2-甲基-1-戊烯的沸点高。( )
×
提示 苯的同系物含有苯环,属于芳香烃。
提示 1-戊烯和2-甲基-1-戊烯主链碳原子数相同,后者增加了一个碳原子,因此后者沸点高。
√
√
×
二、烷烃的化学性质
1.氧化反应
烷烃可在空气或氧气中燃烧生成CO2和H2O,燃烧通式为
。
2.卤代反应
烷烃在 条件下与 、 发生取代反应生成多种卤代烷烃,并放出卤化氢的反应称为卤代反应。如丙烷与氯气的卤代反应:
光照
氯气
溴蒸气
教材阅读想一想己烷能不能和溴水在光照下发生卤代反应 如果把己烷和溴水混合在一起振荡后有什么现象
提示 不能。卤素单质的水溶液不能和烷烃发生卤代反应。如果把己烷和溴水混合,己烷能把溴单质从溴水中萃取出来,所以现象是液体分层,上层溶液为橙红色,下层近无色。
易错辨析判一判
(1)甲烷、乙烷和丙烷具有相似的化学性质。( )
(2)烷烃性质很稳定,常温下不发生任何化学反应。( )
(3)乙烷能与溴水发生卤代反应而褪色。( )
(4)乙烷与Cl2在光照条件下反应可生成两种二氯代物。( )
提示 烷烃化学性质稳定,但在光照条件下可与卤素单质发生取代反应。
提示 乙烷与溴蒸气发生卤代反应,不能与溴水反应。
√
×
×
√
重难探究·能力素养全提升
探究一 烷烃的卤代反应
情境探究
为了探究甲烷与氯气的反应,某同学设计了如图所示装置,在U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
1.假设甲烷与氯气反应充分,且只产生一种有机物,其应为哪种有机物 试写出反应的化学方程式。
2.经过几个小时的反应后,U形管左端的气柱体积怎样变化
3.若水中含有Na2SiO3,在U形管的左端会观察到什么现象
提示 四氯化碳。CH4+4Cl2 CCl4+4HCl。
提示 体积减小。由于反应产物中的氯化氢易溶于水,CH2Cl2、CHCl3、CCl4是液体,气体体积减小。
提示 有白色沉淀生成,由于甲烷与Cl2反应生成了HCl,故能与Na2SiO3发生反应:Na2SiO3+2HCl===2NaCl+H2SiO3↓,生成的白色沉淀为H2SiO3。
方法突破
烷烃卤代反应需注意的5个方面
(1)反应的条件——光照。
(2)反应物状态——纯净的卤素单质(F2、Cl2、Br2、I2),而不是其水溶液。
(3)反应特点——氢原子被卤素原子逐步取代,多步反应同时进行。
(4)反应产物——混合物(多种卤代烃和卤化氢),不适宜用于制备卤代烃。
(5)定量关系——n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+…=n(HX)。
反应中X2一分为二,卤素原子一半进入卤代烃,一半生成HX
应用体验
视角1烷烃的结构与性质
1.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体。下列有关说法不正确的是( )
A.甲烷与丙烷互为同系物
B.甲烷是烃类物质中氢的质量分数最高的化合物
C.甲烷、乙烷、丙烷中的化学键都是极性共价键
D.乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃
C
解析 甲烷与丙烷结构相似,在分子组成上相差2个“CH2”原子团,互为同系物,A正确;甲烷是烃类物质中氢的质量分数最高的化合物,B正确;甲烷中只有碳氢键,只含极性共价键,乙烷、丙烷中既有碳氢键,也有碳碳单键,所以既有极性共价键,也有非极性共价键,C错误;乙烷和氯气在光照的条件下可以发生取代反应,生成一氯乙烷、二氯乙烷、三氯乙烷等多种氯代烃,D正确。
2.下列说法正确的是( )
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量分数逐渐减小
C.分子通式为CnH2n+2的烃一定是烷烃
D.异戊烷与2-甲基丁烷互为同系物
C
视角2烷烃卤代反应产物结构的分析
3.分子式为C4H8Cl2的有机物(不考虑立体异构)有( )
A.7种 B.8种
C.9种 D.10种
C
解析 C4H8Cl2可以看作C4H10中2个H原子被2个Cl原子取代,C4H10有CH3CH2CH2CH3、CH3CH(CH3)2两种,这两种异构体中均含有2种氢原子。
思维点拨 判断有机物二元取代产物异构体数目可用定一动一法。首先确定有机物中可被取代的氢原子有几种,据此确定第一个取代基可连接的位置;判断有机物连接第一个取代基后有几类氢原子,确定第二个取代基可连接的位置。注意如果两个取代基相同,还应注意不要出现重复。
4.2-甲基丁烷( )的二氯取代产物有(不考虑立体异构)( )
A.3种 B.9种 C.10种 D.6种
C
所以共10种,答案选C。
探究二 烃的燃烧规律
情境探究
天然气的主要成分是甲烷,是一种十分重要的“清洁能源”,与液化石油气(主要成分是丙烷、丁烷)一样都是常用的家用燃气。随着现代社会对环境保护要求的提高,液化石油气正逐渐被天然气所取代。居民家庭中在将液化石油气更换为天然气时,通常需要更换燃气灶具或调整进气量。
1.相同状况下等体积的液化石油气和天然气,完全燃烧时哪种气体的耗氧量大
根据以上方程式可知相同状况下等体积(即等物质的量)的液化石油气耗氧量大。
2.居民家庭中将液化石油气改为天然气时,如何调整燃气灶的进气量
3.在120 ℃时,1 L CH4与C2H4的混合气体与10 L O2混合通以电火花不断引燃,充分反应,恢复到原温度和压强。反应后的气体体积是多少
提示 增大天然气进气量或减小空气进气量。
提示 11 L。根据反应CH4+2O2 CO2+2H2O和C2H4+3O2 2CO2+2H2O,在120 ℃时,水为气态,则两反应中反应前后气体体积不变,因此反应后气体体积为1 L+10 L=11 L。
方法突破
1.有机物完全燃烧耗氧量与生成CO2和H2O的规律
2.同温同压下,气态烃(CxHy)完全燃烧前后气体体积变化规律
(1)燃烧后温度高于100 ℃时,水为气态。
反应前后气 体体积变化 V前=V后 V前>V后 V前
(2)燃烧后温度低于100 ℃时,水为液态,反应后气体体积减小。
应用体验
视角1烃的燃烧规律
1.下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓硫酸,减小的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100 ℃),则y=4;若体积减小,则y>4;否则y<4
D.相同质量的烃完全燃烧,消耗的O2越多,烃中含氢元素的质量分数就越高
D
解析 由题意可知有机物燃烧后产物只有CO2和H2O,依据原子守恒可知该物质中一定含有碳、氢元素,氧元素不能确定,故A错误。一种烃在足量的氧气中燃烧并通过浓硫酸只能说产物的体积减小的部分是生成水蒸气的
y<4,反之则y>4,故C错误。因为1 mol C消耗1 mol O2,1 mol C的质量为12 g,12 g H物质的量为12 mol,12 mol H消耗3 mol O2,因此相同质量的碳和氢,氢元素耗氧量大,所以相同质量的烃完全燃烧,氢元素的质量分数越高,消耗的O2越多,故D正确。
易错提醒 利用烃类燃烧通式计算问题时的注意事项
(1)注意水的状态是液态还是气态。
(2)气态烃完全燃烧前后,气体体积变化只与烃分子中氢原子个数有关。
(3)注意烃是否完全燃烧,也就是O2是否足量。
视角2通过烃燃烧的耗氧量分析烃的组成
2.1 mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑立体异构)有( )
A.3种 B.6种
C.5种 D.7种
C
3.两种气态烃以任意比例混合,在200 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中符合此条件的是( )
A.CH4、C2H4 B.CH4、C3H6
C.C2H4、C3H6 D.C2H2、C4H8
A
解析 根据1 mol气态烃耗氧量最多的C4H8分析,1 mol C4H8消耗6 mol O2,则1 L该混合烃与9 L氧气混合充分燃烧,O2过量,烃可完全燃烧。
由于两种气态烃以任意比例混合,则混合烃中各组分分子式中H原子数目为4符合题意,故A正确。
本 课 结 束
