4.2.1 醛的性质和应用课件(共52张PPT) 2023-2024学年高二化学苏教版选择性必修3
文档属性
| 名称 | 4.2.1 醛的性质和应用课件(共52张PPT) 2023-2024学年高二化学苏教版选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 13:11:08 | ||
图片预览










文档简介
(共52张PPT)
专题4
第二单元 第1课时 醛的性质和应用
素养 目标
1.了解醛和酮的同分异构现象,了解常见的几种简单的醛和酮的结构、物理性质和用途,培养科学态度与社会责任的化学核心素养。
2.了解醛、酮的结构特点和异同,能够预测醛、酮可能发生的化学反应及它们在化学性质上的异同。理解醛、酮的主要化学性质,并从反应条件、生成物种类等角度对比醛、酮性质上的差异,知道醛、酮与羧酸、醇等烃的衍生物之间的相互转化,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
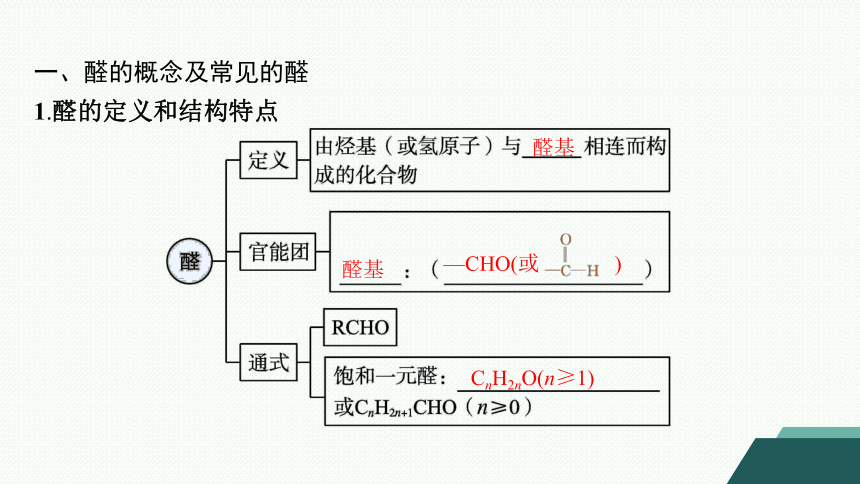
一、醛的概念及常见的醛
1.醛的定义和结构特点
醛基
醛基
—CHO(或 )
CnH2nO(n≥1)
微点拨 醛基(—CHO)中包含羰基( ),羰基以及羰基直接相连的原子处于同一平面上。
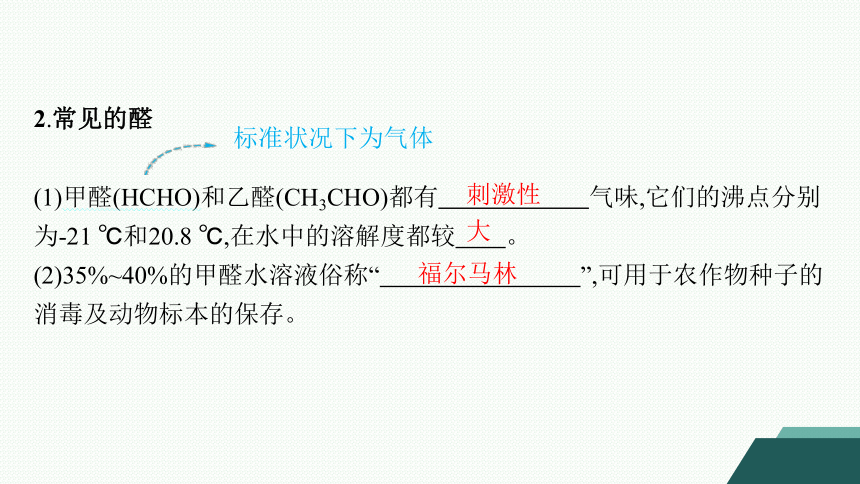
2.常见的醛
(1)甲醛(HCHO)和乙醛(CH3CHO)都有 气味,它们的沸点分别为-21 ℃和20.8 ℃,在水中的溶解度都较 。
(2)35%~40%的甲醛水溶液俗称“ ”,可用于农作物种子的消毒及动物标本的保存。
标准状况下为气体
刺激性
大
福尔马林
教材阅读想一想分子式为C5H10O的醛有几种 试写出它们的结构简式,并命名。
易错辨析判一判
(1)乙醛分子中所有原子处于同一平面上。( )
(2)福尔马林是甲醛的水溶液,可用于浸制生物标本,具有防腐性。( )
(3)碳原子数相同的醛和醚互为同分异构体。( )
(4)甲醛的1H核磁共振谱图中只有一组峰。( )
提示 乙醛的结构简式为CH3CHO,分子中含有甲基,因此不可能所有原子共平面。
提示 如乙醛的分子式为C2H4O,甲醚的分子式为C2H6O,二者分子式不同,不互为同分异构体。
×
√
×
√
二、醛的性质
1.氧化反应
(1)银镜反应(以乙醛为例):
有关化学方程式:CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O。
(2)与新制的Cu(OH)2悬浊液的反应(以乙醛为例):
有关化学方程式:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O。
(3)催化氧化(以乙醛为例):
乙醛在适当条件下,能被氧气氧化为乙酸,反应的化学方程式为
。
产物及化学计量数记忆口诀:一水二银三氨乙酸铵
2CH3CHO+O2 2CH3COOH
2.加成反应
在加热、加压和有催化剂(如Ni、Pt)存在的条件下,醛可以和氢气发生加成反应,生成 ,化学方程式为
RCHO+H2 。
醇
RCH2OH
教材阅读想一想分子式为C4H10O的醇有几种 其中不能通过醛与氢气发生加成反应得到的有几种 试写出它们的结构简式。
提示 分子式为C4H10O的醇有4种。不能通过醛与氢气发生加成反应得到的有2种,结构简式为
易错辨析判一判
(1)乙醛能使酸性高锰酸钾溶液褪色。( )
(2)乙醛和乙酸的混合液可以用分液漏斗分离。( )
(3)银氨溶液的配制,向硝酸银溶液中滴加稀氨水至生成的白色沉淀恰好完全溶解为止。( )
(4)乙醛加氢得到乙醇的反应是加成反应,也称为还原反应。( )
√
提示 乙醛、乙酸均易溶于水,溶液不分层,不能用分液漏斗分离。
×
√
√
三、甲醛、酮的结构与性质
1.甲醛
(1)甲醛是醛类中最简单的醛,俗称 。
(2)甲醛与苯酚反应生成线型酚醛树脂:
酚醛树脂的反应机理:在浓盐酸的催化下,甲醛分子中的 与苯酚分子中羟基 上的氢原子结合生成水,其余部分形成 。
蚁醛
氧原子
邻位或对位
高分子化合物
(3)酚醛树脂的结构与性质的关系:
在浓氨水催化下,主要得到 酚醛树脂,体型酚醛树脂是
的;
在浓盐酸催化下,主要得到 酚醛树脂,线型酚醛树脂是
的。
(4)缩聚反应:由有机化合物分子间脱去 获得 化合物的反应,称为缩聚反应。
体型
热固性
线型
热塑性
小分子
高分子
2.酮的代表物
(1)酮的定义和结构特点:
(2)丙酮:
1
②常温下丙酮是无色透明液体,易 ,能与水、乙醇等混溶,是常用的有机溶剂,主要用于制备重要化工原料双酚A和制备有机玻璃。
(3)环己酮(C6H10O)也是一种常见的酮,环己酮的键线式为 ,常作为生产合成纤维、合成树脂、合成橡胶、石蜡、虫胶、油漆、染料和制药中间体的溶剂,还可用于制备己二酸和己内酰胺,它们都是生产聚酰胺纤维的重要原料。
挥发
3.酮的化学性质
不能被 等弱氧化剂氧化,但能催化加氢生成 。
如反应的化学方程式:
银氨溶液、新制的氢氧化铜悬浊液
醇
易错辨析判一判
(1)1 mol HCHO发生银镜反应最多生成4 mol Ag。( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应。( )
(3)丙酮是结构最简单的酮,可以发生银镜反应和加氢还原。( )
(4)环己酮的1H核磁共振谱图有三组特征峰。( )
√
提示 酮可以燃烧,能发生氧化反应。
提示 丙酮不能发生银镜反应。
×
×
√
重难探究·能力素养全提升
探究一 醛类的特征反应及其检验
情境探究
在中国,几乎所有的家庭里,肉桂都是炖肉、炒菜主要的调味品;在西方,人们也会将肉桂打成粉末加入咖啡中调味。由于是含有特殊芳香的植物,肉桂还可以制作比较特殊的香料。
科学家发现,肉桂中的肉桂醛是一种赋予肉桂独特风味的有机化合物,结构简式如下:
1.能否用酸性高锰酸钾溶液鉴别肉桂醛中的醛基 可以使用什么试剂
2.能否直接使用溴水检验肉桂醛中的碳碳双键
3.根据上述结论,如何检验肉桂醛中的官能团
提示 不能。碳碳双键、苯环的侧链和醛基均能使酸性高锰酸钾溶液褪色。应该使用银氨溶液或新制的氢氧化铜悬浊液。
提示 不能。醛基也能使溴水褪色。
提示 先用银氨溶液或新制的氢氧化铜悬浊液检验醛基,酸化后加入溴水(注意不能使用酸性KMnO4溶液,因为苯环的侧链也可被酸性KMnO4溶液氧化)检验碳碳双键。
方法突破
1.醛类的两个特征反应及—CHO检验
特征反应 银镜反应 与新制的Cu(OH)2悬浊液反应
试剂 银氨溶液 新制的Cu(OH)2悬浊液
加热方式 水浴加热 直接加热
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2悬浊液要随用随配,不可久置。
(2)配制Cu(OH)2悬浊液时,所用NaOH溶液必须过量
2.含醛基物质中碳碳双键的检验方法
(1)醛基和碳碳双键性质的比较。
官能团 醛基 碳碳双键
酸性KMnO4溶液 褪色 褪色
溴水 褪色 褪色
银氨溶液 产生银镜 不反应
新制的Cu(OH)2悬浊液 产生砖红色沉淀 不反应
(2)含醛基物质中碳碳双键的检验流程。
3.使溴水、酸性KMnO4溶液褪色的有机物及褪色原因的比较
官能团 碳碳双键 碳碳三键 苯的同系物
能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 √ 加成反应 √ 加成反应 × —
酸性KMnO4 溶液 √ 氧化 反应 √ 氧化 反应 √ 氧化
反应
官能团 醇 酚 醛
能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 × — √ 取代反应 √ 氧化反应
酸性KMnO4 溶液 √ 氧化反应 √ 氧化反应 √ 氧化反应
注:“√”代表能,“×”代表不能。
应用体验
视角1醛类物质的结构与性质
1.下列关于醛的说法正确的是( )
A.甲醛是甲基跟醛基相连而构成的醛
B.醛的官能团是—COH
C.甲醛和乙二醛互为同系物
D.饱和一元脂肪醛的分子组成符合CnH2nO通式
D
解析 甲醛是氢原子跟醛基相连而构成的醛,故A错误;醛的官能团是
—CHO,故B错误;甲醛和乙二醛不互为同系物,故C错误;饱和一元脂肪醛的通式为CnH2nO,故D正确。
2.下列有关银镜反应的说法正确的是( )
A.配制银氨溶液时氨水必须过量
B.1 mol 甲醛发生银镜反应最多生成2 mol Ag
C.银镜反应通常采用水浴加热
D.银镜反应后的试管一般采用稀硫酸洗涤
C
解析 配制银氨溶液时,向硝酸银溶液中逐滴滴加稀氨水,至产生的沉淀恰好完全溶解为止,故氨水不可过量,A错误;甲醛相当于二元醛,故1 mol甲醛发生银镜反应最多生成4 mol Ag,B错误;实验为形成银镜,必须用水浴加热,C正确;实验后产生的银可溶于稀硝酸,故应用少量稀硝酸洗涤,银不溶于稀硫酸,不能用稀硫酸洗涤,D错误。
3.(1)做乙醛被新制的氢氧化铜悬浊液氧化的实验时,下列各步操作,正确的顺序是 (填序号)。
①加入0.5 mL 乙醛溶液 ②加入5%的氢氧化钠溶液3 mL ③加入2%的CuSO4溶液3~4滴 ④加热试管
(2)实验室配制少量银氨溶液的方法:先向试管中加入 ,然后 ,
其反应的离子方程式为________________________________________
,
向银氨溶液中滴加少量的乙醛, ,
片刻即可在试管内壁形成银镜,化学方程式为________________________
。
②③①④
2% 的AgNO3溶液
在不断振荡试管的同时滴加2%的稀氨水至产生的沉淀恰好完全溶解
AgOH+2NH3·H2O=== [Ag(NH3)2]++OH-+2H2O
振荡后将试管放在热水浴中加热
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O
解析 (1)做该实验时,应将少量CuSO4溶液滴入NaOH溶液中得新制的Cu(OH)2悬浊液,然后加入乙醛,并用酒精灯加热至沸腾,即可产生砖红色Cu2O沉淀。
(2)要熟悉银氨溶液的配制及所发生的反应。
易错提醒 (1)能发生银镜反应的物质不一定是醛类,也可以是甲酸、甲酸酯和葡萄糖等。
(2)配制银氨溶液是向AgNO3稀溶液中逐滴加稀氨水,直到最初生成沉淀恰好溶解为止,顺序不能颠倒。
(3)银镜反应、与新制的氢氧化铜悬浊液的反应都必须在碱性条件下进行。若溶液呈酸性,必须先用氢氧化钠中和至碱性,否则就不会产生对应的现象。
视角2含醛基的物质性质和醛基的检验
4.香草醛又名香兰素,是食品和药品的重要原料,其结构简式如下图所示。
下列有关香草醛的说法不正确的是( )
A.香草醛可以发生银镜反应
B.在一定条件下1 mol 香草醛可以与4 mol H2反应
C.香草醛遇FeCl3溶液变紫色
D.香草醛既可与NaOH溶液反应,也可与NaHCO3溶液反应
D
解析 香草醛分子中含有醛基,可以发生银镜反应,故A正确;香草醛分子中含苯环和醛基,因此在一定条件下1 mol香草醛可以与4 mol H2反应,故B正确;香草醛分子中含有酚羟基,FeCl3遇酚类显紫色,故C正确;香草醛分子中含有的酚羟基可与NaOH溶液反应,但不与NaHCO3反应,故D错误。
5.柠檬醛是一种具有柠檬香味的有机化合物,广泛存在于香精油中,是食品工业中重要的调味品,且可用于合成维生素A。已知柠檬醛的结构简式为
(1)检验柠檬醛分子中含有醛基的方法为 ,发生反应
的化学方程式为________________________________________________
。
加入银氨溶液后水浴加热,有银镜出现,说明含有醛基
(2)检验柠檬醛分子中含有碳碳双键的方法为________________________ ______________________________________________________________________________________________________________。
(3)实验操作中,应先检验哪一种官能团
。
在加银氨溶液[或新制的Cu(OH)2悬浊液]氧化醛基后,调节溶液pH至酸性再加入溴的四氯化碳溶液(或酸性KMnO4溶液),若溶液褪色说明含有碳碳双键
醛基(或—CHO)
解析 (1)常利用银镜反应或与新制的Cu(OH)2悬浊液的反应检验—CHO的存在。
(2)常用溴的CCl4溶液或酸性KMnO4溶液来检验碳碳双键的存在。
(3)—CHO也可使酸性KMnO4溶液褪色,当—CHO与碳碳双键同时出现时,应先检验并除去—CHO,再检验碳碳双键。
探究二 涉及醛的转化和定量计算
情境探究
已知甲醛的分子式为CH2O,其分子可以看成含两个醛基,如图:
1.1 mol HCHO与足量银氨溶液反应得到的银的物质的量是多少 试写出甲醛与足量银氨溶液反应的化学方程式。
提示 4 mol 。反应的化学方程式为HCHO+4Ag(NH3)2OH (NH4)2CO3+4Ag↓+6NH3+2H2O。
2.1 mol HCHO与足量新制的Cu(OH)2悬浊液反应得到的Cu2O的物质的量是多少 试写出甲醛与新制的Cu(OH)2悬浊液反应的化学方程式。
提示 2 mol 。反应的化学方程式为HCHO+4Cu(OH)2+2NaOH Na2CO3+2Cu2O↓+6H2O。
3.某一元醛3 g 与新制的氢氧化铜悬浊液反应,结果析出28.8 g 砖红色沉淀,则该醛是哪一种醛
方法突破
1.醛的氧化与还原规律
2.相关定量计算
(1)一元醛发生银镜反应或与新制的Cu(OH)2悬浊液反应时,量的关系如下:
(2)甲醛为饱和一元醛,但从结构组成看,其分子可以看成含两个醛基。发生氧化反应时,可理解为:
甲醛与足量的银氨溶液或新制的Cu(OH)2悬浊液作用时,可存在如下量的关系:
(3)二元醛反应时量的关系:
应用体验
视角1醛基的性质与转化
1.C、H、O三种元素组成的T、X两种物质在一定条件下可以发生如下转化,其中X不稳定,易分解。为使转化能够成功进行,方框内加入的试剂不合理的是( )
A.KMnO4溶液
B.新制的Cu(OH)2悬浊液
C.Ag(NH3)2OH溶液
D.NaOH溶液
D
解析 由图可知,T为HCHO,X为H2CO3,则方框内物质具有氧化性,选项中只有D项试剂不合理。
2.[2023河北沧州模拟]酿酒过程中若操作不当,会产生丙烯醛使酒的口味变辣,丙烯醛的沸点为52.5 ℃,下图为丙烯醛发生转化的流程,有关说法错误的是( )
A.可用银氨溶液检验丙烯醛的醛基
B.丙烯醛所有原子可能处于同一平面
C.上述合成路线涉及取代反应、氧化反应、加聚反应
D.M可以选用酸性KMnO4溶液或银氨溶液
D
解析 银氨溶液可以检验丙烯醛的醛基,碳碳双键不干扰醛基检验,A正确;丙烯醛所有碳原子都是sp2杂化,可能处于同一平面,B正确;题述合成路线依次为氧化反应、取代反应、加聚反应,C正确;M若选用酸性KMnO4溶液,碳碳双键会被氧化,D错误。
视角2与醛有关的量的计算
3.下列物质各1 mol 与足量的银氨溶液反应析出银的质量相等的是( )
①HCHO ②CH3CHO ③(CH3)2CHCHO
④OHC(CH2)3CHO
A.①②③ B.①④
C.①②③④ D.③④
B
解析 1 mol —CHO与足量银氨溶液反应生成2 mol Ag,1 mol ②③④产生的Ag的物质的量分别为2 mol 、2 mol 、4 mol,1 mol 甲醛与足量银氨溶液反应生成4 mol Ag,故选B。
4.某饱和一元醛和酮的混合物共3 g,与足量的银氨溶液完全反应后可还原出16.2 g 银。下列说法正确的是( )
A.混合物中一定有甲醛
B.混合物中可能含乙醛
C.醛与酮的质量比为4∶5
D.该酮为丙酮
A
【变式设问】
(1)该混合物与足量银氨溶液反应,请写出发生反应的化学方程式。
(2)该混合物与氢气加成,消耗H2的物质的量最多为多少 (保留2位小数)
提示 HCHO+4Ag(NH3)2OH (NH4)2CO3+4Ag↓+6NH3+2H2O
提示 0.07 mol 。当为甲醛和丙酮时消耗H2最多,n(HCHO)=0.037 5 mol , n(丙酮)= ≈0.032 3 mol 。
思维点拨 通过计算判断一元醛组成的思维模型
通过银镜反应或与新制的Cu(OH)2悬浊液反应判断一元醛的组成时,应首先假设一元醛不是甲醛进行计算,关系式为RCHO~2Ag或RCHO~Cu2O;若通过计算不符合题意,再考虑若一元醛为甲醛是否符合题意,关系式为HCHO~4Ag或HCHO~2Cu2O。
5.某一元醛发生银镜反应,生成10.8 g 银,再将等质量的醛完全燃烧生成6.72 L 的CO2(标准状况),则该醛可能是( )
A.丙醛 B.丁醛
C.己醛 D.苯甲醛
C
解析 设一元醛(甲醛除外)为RCHO。根据银镜反应特点及燃烧规律,知
RCHO~2Ag
1 2
得n=0.05 mol,而n(CO2)= =0.3 mol ,则0.05 mol RCHO中含0.3 mol C,即1 mol RCHO中含6 mol C,则该醛为己醛。
本 课 结 束
专题4
第二单元 第1课时 醛的性质和应用
素养 目标
1.了解醛和酮的同分异构现象,了解常见的几种简单的醛和酮的结构、物理性质和用途,培养科学态度与社会责任的化学核心素养。
2.了解醛、酮的结构特点和异同,能够预测醛、酮可能发生的化学反应及它们在化学性质上的异同。理解醛、酮的主要化学性质,并从反应条件、生成物种类等角度对比醛、酮性质上的差异,知道醛、酮与羧酸、醇等烃的衍生物之间的相互转化,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、醛的概念及常见的醛
1.醛的定义和结构特点
醛基
醛基
—CHO(或 )
CnH2nO(n≥1)
微点拨 醛基(—CHO)中包含羰基( ),羰基以及羰基直接相连的原子处于同一平面上。
2.常见的醛
(1)甲醛(HCHO)和乙醛(CH3CHO)都有 气味,它们的沸点分别为-21 ℃和20.8 ℃,在水中的溶解度都较 。
(2)35%~40%的甲醛水溶液俗称“ ”,可用于农作物种子的消毒及动物标本的保存。
标准状况下为气体
刺激性
大
福尔马林
教材阅读想一想分子式为C5H10O的醛有几种 试写出它们的结构简式,并命名。
易错辨析判一判
(1)乙醛分子中所有原子处于同一平面上。( )
(2)福尔马林是甲醛的水溶液,可用于浸制生物标本,具有防腐性。( )
(3)碳原子数相同的醛和醚互为同分异构体。( )
(4)甲醛的1H核磁共振谱图中只有一组峰。( )
提示 乙醛的结构简式为CH3CHO,分子中含有甲基,因此不可能所有原子共平面。
提示 如乙醛的分子式为C2H4O,甲醚的分子式为C2H6O,二者分子式不同,不互为同分异构体。
×
√
×
√
二、醛的性质
1.氧化反应
(1)银镜反应(以乙醛为例):
有关化学方程式:CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O。
(2)与新制的Cu(OH)2悬浊液的反应(以乙醛为例):
有关化学方程式:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O。
(3)催化氧化(以乙醛为例):
乙醛在适当条件下,能被氧气氧化为乙酸,反应的化学方程式为
。
产物及化学计量数记忆口诀:一水二银三氨乙酸铵
2CH3CHO+O2 2CH3COOH
2.加成反应
在加热、加压和有催化剂(如Ni、Pt)存在的条件下,醛可以和氢气发生加成反应,生成 ,化学方程式为
RCHO+H2 。
醇
RCH2OH
教材阅读想一想分子式为C4H10O的醇有几种 其中不能通过醛与氢气发生加成反应得到的有几种 试写出它们的结构简式。
提示 分子式为C4H10O的醇有4种。不能通过醛与氢气发生加成反应得到的有2种,结构简式为
易错辨析判一判
(1)乙醛能使酸性高锰酸钾溶液褪色。( )
(2)乙醛和乙酸的混合液可以用分液漏斗分离。( )
(3)银氨溶液的配制,向硝酸银溶液中滴加稀氨水至生成的白色沉淀恰好完全溶解为止。( )
(4)乙醛加氢得到乙醇的反应是加成反应,也称为还原反应。( )
√
提示 乙醛、乙酸均易溶于水,溶液不分层,不能用分液漏斗分离。
×
√
√
三、甲醛、酮的结构与性质
1.甲醛
(1)甲醛是醛类中最简单的醛,俗称 。
(2)甲醛与苯酚反应生成线型酚醛树脂:
酚醛树脂的反应机理:在浓盐酸的催化下,甲醛分子中的 与苯酚分子中羟基 上的氢原子结合生成水,其余部分形成 。
蚁醛
氧原子
邻位或对位
高分子化合物
(3)酚醛树脂的结构与性质的关系:
在浓氨水催化下,主要得到 酚醛树脂,体型酚醛树脂是
的;
在浓盐酸催化下,主要得到 酚醛树脂,线型酚醛树脂是
的。
(4)缩聚反应:由有机化合物分子间脱去 获得 化合物的反应,称为缩聚反应。
体型
热固性
线型
热塑性
小分子
高分子
2.酮的代表物
(1)酮的定义和结构特点:
(2)丙酮:
1
②常温下丙酮是无色透明液体,易 ,能与水、乙醇等混溶,是常用的有机溶剂,主要用于制备重要化工原料双酚A和制备有机玻璃。
(3)环己酮(C6H10O)也是一种常见的酮,环己酮的键线式为 ,常作为生产合成纤维、合成树脂、合成橡胶、石蜡、虫胶、油漆、染料和制药中间体的溶剂,还可用于制备己二酸和己内酰胺,它们都是生产聚酰胺纤维的重要原料。
挥发
3.酮的化学性质
不能被 等弱氧化剂氧化,但能催化加氢生成 。
如反应的化学方程式:
银氨溶液、新制的氢氧化铜悬浊液
醇
易错辨析判一判
(1)1 mol HCHO发生银镜反应最多生成4 mol Ag。( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应。( )
(3)丙酮是结构最简单的酮,可以发生银镜反应和加氢还原。( )
(4)环己酮的1H核磁共振谱图有三组特征峰。( )
√
提示 酮可以燃烧,能发生氧化反应。
提示 丙酮不能发生银镜反应。
×
×
√
重难探究·能力素养全提升
探究一 醛类的特征反应及其检验
情境探究
在中国,几乎所有的家庭里,肉桂都是炖肉、炒菜主要的调味品;在西方,人们也会将肉桂打成粉末加入咖啡中调味。由于是含有特殊芳香的植物,肉桂还可以制作比较特殊的香料。
科学家发现,肉桂中的肉桂醛是一种赋予肉桂独特风味的有机化合物,结构简式如下:
1.能否用酸性高锰酸钾溶液鉴别肉桂醛中的醛基 可以使用什么试剂
2.能否直接使用溴水检验肉桂醛中的碳碳双键
3.根据上述结论,如何检验肉桂醛中的官能团
提示 不能。碳碳双键、苯环的侧链和醛基均能使酸性高锰酸钾溶液褪色。应该使用银氨溶液或新制的氢氧化铜悬浊液。
提示 不能。醛基也能使溴水褪色。
提示 先用银氨溶液或新制的氢氧化铜悬浊液检验醛基,酸化后加入溴水(注意不能使用酸性KMnO4溶液,因为苯环的侧链也可被酸性KMnO4溶液氧化)检验碳碳双键。
方法突破
1.醛类的两个特征反应及—CHO检验
特征反应 银镜反应 与新制的Cu(OH)2悬浊液反应
试剂 银氨溶液 新制的Cu(OH)2悬浊液
加热方式 水浴加热 直接加热
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2悬浊液要随用随配,不可久置。
(2)配制Cu(OH)2悬浊液时,所用NaOH溶液必须过量
2.含醛基物质中碳碳双键的检验方法
(1)醛基和碳碳双键性质的比较。
官能团 醛基 碳碳双键
酸性KMnO4溶液 褪色 褪色
溴水 褪色 褪色
银氨溶液 产生银镜 不反应
新制的Cu(OH)2悬浊液 产生砖红色沉淀 不反应
(2)含醛基物质中碳碳双键的检验流程。
3.使溴水、酸性KMnO4溶液褪色的有机物及褪色原因的比较
官能团 碳碳双键 碳碳三键 苯的同系物
能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 √ 加成反应 √ 加成反应 × —
酸性KMnO4 溶液 √ 氧化 反应 √ 氧化 反应 √ 氧化
反应
官能团 醇 酚 醛
能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 × — √ 取代反应 √ 氧化反应
酸性KMnO4 溶液 √ 氧化反应 √ 氧化反应 √ 氧化反应
注:“√”代表能,“×”代表不能。
应用体验
视角1醛类物质的结构与性质
1.下列关于醛的说法正确的是( )
A.甲醛是甲基跟醛基相连而构成的醛
B.醛的官能团是—COH
C.甲醛和乙二醛互为同系物
D.饱和一元脂肪醛的分子组成符合CnH2nO通式
D
解析 甲醛是氢原子跟醛基相连而构成的醛,故A错误;醛的官能团是
—CHO,故B错误;甲醛和乙二醛不互为同系物,故C错误;饱和一元脂肪醛的通式为CnH2nO,故D正确。
2.下列有关银镜反应的说法正确的是( )
A.配制银氨溶液时氨水必须过量
B.1 mol 甲醛发生银镜反应最多生成2 mol Ag
C.银镜反应通常采用水浴加热
D.银镜反应后的试管一般采用稀硫酸洗涤
C
解析 配制银氨溶液时,向硝酸银溶液中逐滴滴加稀氨水,至产生的沉淀恰好完全溶解为止,故氨水不可过量,A错误;甲醛相当于二元醛,故1 mol甲醛发生银镜反应最多生成4 mol Ag,B错误;实验为形成银镜,必须用水浴加热,C正确;实验后产生的银可溶于稀硝酸,故应用少量稀硝酸洗涤,银不溶于稀硫酸,不能用稀硫酸洗涤,D错误。
3.(1)做乙醛被新制的氢氧化铜悬浊液氧化的实验时,下列各步操作,正确的顺序是 (填序号)。
①加入0.5 mL 乙醛溶液 ②加入5%的氢氧化钠溶液3 mL ③加入2%的CuSO4溶液3~4滴 ④加热试管
(2)实验室配制少量银氨溶液的方法:先向试管中加入 ,然后 ,
其反应的离子方程式为________________________________________
,
向银氨溶液中滴加少量的乙醛, ,
片刻即可在试管内壁形成银镜,化学方程式为________________________
。
②③①④
2% 的AgNO3溶液
在不断振荡试管的同时滴加2%的稀氨水至产生的沉淀恰好完全溶解
AgOH+2NH3·H2O=== [Ag(NH3)2]++OH-+2H2O
振荡后将试管放在热水浴中加热
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O
解析 (1)做该实验时,应将少量CuSO4溶液滴入NaOH溶液中得新制的Cu(OH)2悬浊液,然后加入乙醛,并用酒精灯加热至沸腾,即可产生砖红色Cu2O沉淀。
(2)要熟悉银氨溶液的配制及所发生的反应。
易错提醒 (1)能发生银镜反应的物质不一定是醛类,也可以是甲酸、甲酸酯和葡萄糖等。
(2)配制银氨溶液是向AgNO3稀溶液中逐滴加稀氨水,直到最初生成沉淀恰好溶解为止,顺序不能颠倒。
(3)银镜反应、与新制的氢氧化铜悬浊液的反应都必须在碱性条件下进行。若溶液呈酸性,必须先用氢氧化钠中和至碱性,否则就不会产生对应的现象。
视角2含醛基的物质性质和醛基的检验
4.香草醛又名香兰素,是食品和药品的重要原料,其结构简式如下图所示。
下列有关香草醛的说法不正确的是( )
A.香草醛可以发生银镜反应
B.在一定条件下1 mol 香草醛可以与4 mol H2反应
C.香草醛遇FeCl3溶液变紫色
D.香草醛既可与NaOH溶液反应,也可与NaHCO3溶液反应
D
解析 香草醛分子中含有醛基,可以发生银镜反应,故A正确;香草醛分子中含苯环和醛基,因此在一定条件下1 mol香草醛可以与4 mol H2反应,故B正确;香草醛分子中含有酚羟基,FeCl3遇酚类显紫色,故C正确;香草醛分子中含有的酚羟基可与NaOH溶液反应,但不与NaHCO3反应,故D错误。
5.柠檬醛是一种具有柠檬香味的有机化合物,广泛存在于香精油中,是食品工业中重要的调味品,且可用于合成维生素A。已知柠檬醛的结构简式为
(1)检验柠檬醛分子中含有醛基的方法为 ,发生反应
的化学方程式为________________________________________________
。
加入银氨溶液后水浴加热,有银镜出现,说明含有醛基
(2)检验柠檬醛分子中含有碳碳双键的方法为________________________ ______________________________________________________________________________________________________________。
(3)实验操作中,应先检验哪一种官能团
。
在加银氨溶液[或新制的Cu(OH)2悬浊液]氧化醛基后,调节溶液pH至酸性再加入溴的四氯化碳溶液(或酸性KMnO4溶液),若溶液褪色说明含有碳碳双键
醛基(或—CHO)
解析 (1)常利用银镜反应或与新制的Cu(OH)2悬浊液的反应检验—CHO的存在。
(2)常用溴的CCl4溶液或酸性KMnO4溶液来检验碳碳双键的存在。
(3)—CHO也可使酸性KMnO4溶液褪色,当—CHO与碳碳双键同时出现时,应先检验并除去—CHO,再检验碳碳双键。
探究二 涉及醛的转化和定量计算
情境探究
已知甲醛的分子式为CH2O,其分子可以看成含两个醛基,如图:
1.1 mol HCHO与足量银氨溶液反应得到的银的物质的量是多少 试写出甲醛与足量银氨溶液反应的化学方程式。
提示 4 mol 。反应的化学方程式为HCHO+4Ag(NH3)2OH (NH4)2CO3+4Ag↓+6NH3+2H2O。
2.1 mol HCHO与足量新制的Cu(OH)2悬浊液反应得到的Cu2O的物质的量是多少 试写出甲醛与新制的Cu(OH)2悬浊液反应的化学方程式。
提示 2 mol 。反应的化学方程式为HCHO+4Cu(OH)2+2NaOH Na2CO3+2Cu2O↓+6H2O。
3.某一元醛3 g 与新制的氢氧化铜悬浊液反应,结果析出28.8 g 砖红色沉淀,则该醛是哪一种醛
方法突破
1.醛的氧化与还原规律
2.相关定量计算
(1)一元醛发生银镜反应或与新制的Cu(OH)2悬浊液反应时,量的关系如下:
(2)甲醛为饱和一元醛,但从结构组成看,其分子可以看成含两个醛基。发生氧化反应时,可理解为:
甲醛与足量的银氨溶液或新制的Cu(OH)2悬浊液作用时,可存在如下量的关系:
(3)二元醛反应时量的关系:
应用体验
视角1醛基的性质与转化
1.C、H、O三种元素组成的T、X两种物质在一定条件下可以发生如下转化,其中X不稳定,易分解。为使转化能够成功进行,方框内加入的试剂不合理的是( )
A.KMnO4溶液
B.新制的Cu(OH)2悬浊液
C.Ag(NH3)2OH溶液
D.NaOH溶液
D
解析 由图可知,T为HCHO,X为H2CO3,则方框内物质具有氧化性,选项中只有D项试剂不合理。
2.[2023河北沧州模拟]酿酒过程中若操作不当,会产生丙烯醛使酒的口味变辣,丙烯醛的沸点为52.5 ℃,下图为丙烯醛发生转化的流程,有关说法错误的是( )
A.可用银氨溶液检验丙烯醛的醛基
B.丙烯醛所有原子可能处于同一平面
C.上述合成路线涉及取代反应、氧化反应、加聚反应
D.M可以选用酸性KMnO4溶液或银氨溶液
D
解析 银氨溶液可以检验丙烯醛的醛基,碳碳双键不干扰醛基检验,A正确;丙烯醛所有碳原子都是sp2杂化,可能处于同一平面,B正确;题述合成路线依次为氧化反应、取代反应、加聚反应,C正确;M若选用酸性KMnO4溶液,碳碳双键会被氧化,D错误。
视角2与醛有关的量的计算
3.下列物质各1 mol 与足量的银氨溶液反应析出银的质量相等的是( )
①HCHO ②CH3CHO ③(CH3)2CHCHO
④OHC(CH2)3CHO
A.①②③ B.①④
C.①②③④ D.③④
B
解析 1 mol —CHO与足量银氨溶液反应生成2 mol Ag,1 mol ②③④产生的Ag的物质的量分别为2 mol 、2 mol 、4 mol,1 mol 甲醛与足量银氨溶液反应生成4 mol Ag,故选B。
4.某饱和一元醛和酮的混合物共3 g,与足量的银氨溶液完全反应后可还原出16.2 g 银。下列说法正确的是( )
A.混合物中一定有甲醛
B.混合物中可能含乙醛
C.醛与酮的质量比为4∶5
D.该酮为丙酮
A
【变式设问】
(1)该混合物与足量银氨溶液反应,请写出发生反应的化学方程式。
(2)该混合物与氢气加成,消耗H2的物质的量最多为多少 (保留2位小数)
提示 HCHO+4Ag(NH3)2OH (NH4)2CO3+4Ag↓+6NH3+2H2O
提示 0.07 mol 。当为甲醛和丙酮时消耗H2最多,n(HCHO)=0.037 5 mol , n(丙酮)= ≈0.032 3 mol 。
思维点拨 通过计算判断一元醛组成的思维模型
通过银镜反应或与新制的Cu(OH)2悬浊液反应判断一元醛的组成时,应首先假设一元醛不是甲醛进行计算,关系式为RCHO~2Ag或RCHO~Cu2O;若通过计算不符合题意,再考虑若一元醛为甲醛是否符合题意,关系式为HCHO~4Ag或HCHO~2Cu2O。
5.某一元醛发生银镜反应,生成10.8 g 银,再将等质量的醛完全燃烧生成6.72 L 的CO2(标准状况),则该醛可能是( )
A.丙醛 B.丁醛
C.己醛 D.苯甲醛
C
解析 设一元醛(甲醛除外)为RCHO。根据银镜反应特点及燃烧规律,知
RCHO~2Ag
1 2
得n=0.05 mol,而n(CO2)= =0.3 mol ,则0.05 mol RCHO中含0.3 mol C,即1 mol RCHO中含6 mol C,则该醛为己醛。
本 课 结 束
