5.2 胺和酰胺课件(共43张PPT) 2023-2024学年高二化学苏教版选择性必修3
文档属性
| 名称 | 5.2 胺和酰胺课件(共43张PPT) 2023-2024学年高二化学苏教版选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 13:15:50 | ||
图片预览










文档简介
(共43张PPT)
专题5
第二单元 胺和酰胺
素养 目标
1.通过与氨的类比认识胺的结构和性质;能对胺类化合物进行命名。认识酰胺的结构特征,能通过与酯类比说明酰胺的主要性质,培养宏观辨识与微观探析的化学核心素养。
2.能运用胺的性质解释某些制药工艺,能举例说明胺、酰胺类化合物在药物合成中的重要作用,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、胺的结构与应用
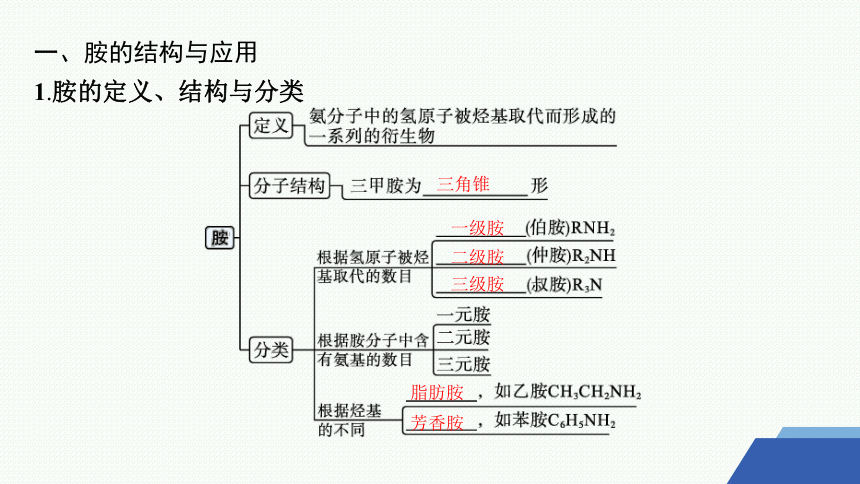
1.胺的定义、结构与分类
三角锥
一级胺
二级胺
三级胺
脂肪胺
芳香胺
2.胺类化合物的命名
普通命名法 结构简单的胺常在烃基后直接加“胺”,如CH3NH2称为
,CH3NHCH3称为 ,C6H5NH2称为苯胺
名称书写 需注意 ①表示基团时用“ ”;②表示氨的烃类衍生物时用“ ”;③表示胺的盐时用“ ”
伯胺、仲胺、 叔胺的意义 伯胺、仲胺、叔胺中分别含有氨基(—NH2)、亚氨基
(—NH—)和次氨基( )
甲胺
二甲胺
氨
胺
铵
3.胺的性质
(1)胺与酸反应转化为铵:
①胺的碱性:胺具有碱性,可与酸反应生成类似的铵盐。请写出乙胺与盐酸反应的化学方程式: 。
②应用:
在胺类药物的合成中,常将某些难溶于水、易被氧化的胺,转化为可溶于水的铵盐,增加药物的稳定性,便于保存和运输。
(2)铵与碱反应转化为胺:
①物理性质不同点:胺易溶于 ,而铵盐溶于水但不溶于 。
②铵与碱反应:向铵盐溶液中加 ,又转化为 。试写出氯化乙铵与NaOH溶液反应的化学方程式: 。
③应用:实验室可从含有胺的植物组织中分离、提纯胺类化合物(生物碱)。
有机溶剂
有机溶剂
强碱
胺
4.几种常见胺的应用
(1)乙二胺(H2NCH2CH2NH2):无色透明液体,溶于 ,具有扩张血管的作用。它是制备药物、乳化剂和杀虫剂的原料。乙二胺的戊酸盐是治疗动脉硬化的药物。乙二胺与氯乙酸作用,生成乙二胺四乙酸,简称EDTA,它是重要的分析试剂。
(2)己二胺[H2N(CH2)6NH2]:合成化学纤维“尼龙-66”的主要原料。
(3)苯胺是 中最重要的原料之一。
水和醇
染料工业
教材阅读想一想多巴胺可用于治疗心肌梗死、败血症、肾功能衰竭、心力衰竭、心功能不全等疾病,可增强心排血量。其结构简式为
,该物质能与强酸、强碱反应吗
提示 多巴胺分子中含有氨基,能与强酸发生反应;含有酚羟基,能与强碱发生反应。
易错辨析判一判
(1)三甲胺的分子结构为三角锥形。( )
(2)苯胺属于二级胺。( )
(3)胺的碱性比较弱,能与酸反应生成铵盐。( )
(4)己二胺属于二元胺,是合成高聚物的主要原料。( )
√
×
提示 苯胺属于一级胺。
√
√
二、酰胺的结构与应用
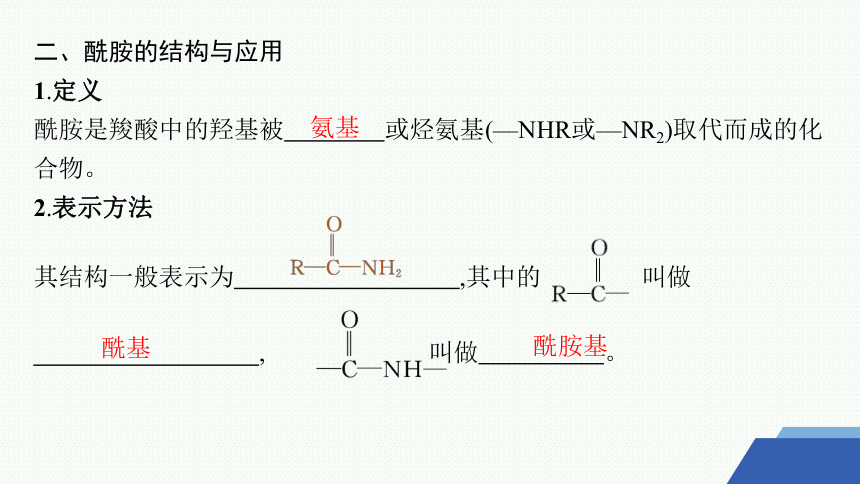
1.定义
酰胺是羧酸中的羟基被 或烃氨基(—NHR或—NR2)取代而成的化合物。
2.表示方法
其结构一般表示为 ,其中的 叫做 , 叫做 。
氨基
酰基
酰胺基
3.常见酰胺的名称与结构
4.物理性质
颜色、状态 熔、沸点 溶解性
除甲酰胺外,大部分是 色晶体 酰胺均高于相应的羧酸 低级的酰胺能溶于水,随着相对分子质量的增大,酰胺的溶解度逐渐
白
减小
5.化学性质
酰胺与酯类有机化合物一样,都是羧酸衍生物,两者的结构类似,决定了它们具有相似的性质。在酸、碱作用下,它们都能发生水解反应。
(1)写出乙酰胺与硫酸反应的化学方程式:
。
(2)写出乙酰胺与NaOH溶液反应的化学方程式:
。
2CH3CONH2+2H2O+H2SO4 2CH3COOH+(NH4)2SO4
CH3CONH2+NaOH CH3COONa+NH3↑
6.乙酰胺的制备
。
7.用途
常用作溶剂和化工原料、合成农药、医用等。
CH3COOH+NH3 CH3CONH2+H2O
教材阅读想一想尿素[CO(NH2)2]属于酰胺,其化学性质具有酰胺的通性。请分别写出尿素在酸性(H2SO4)、碱性(NaOH)条件下发生水解的化学方程式。
易错辨析判一判
(1)酰胺与胺属于同类化合物,官能团均为—NH2。( )
(2)氯硝柳胺( )是一种抗肠蠕虫药,分子中含有4种官能团。
( )
提示 酰胺与胺不是同类化合物,酰胺的官能团为 。
×
√
(3)一定条件下,1 mol 与KOH溶液反应,最多消耗3 mol KOH。( )
×
(4)1 mol 对乙酰氨基酚( )在一定条件下与足量H2发生加成反应,可消耗4 mol H2。( )
×
提示 在对乙酰氨基酚中,苯环可与H2加成,酰胺基难以与H2加成,因此1 mol 对乙酰氨基酚与H2加成时,消耗3 mol H2。
重难探究·能力素养全提升
探究一 胺的化学性质
情境探究
鱼是一种营养丰富、味道鲜美的食物,但鱼腥味十分影响食欲。引起鱼腥味的主要成分是一种名为“三甲胺”的物质,为除去鱼腥味,人们在做鱼时常加入料酒和食醋。
1.三甲胺的结构简式如何书写
提示 (CH3)3N。
2.为什么做鱼时加入料酒可除去鱼腥味
3.做鱼时常加入料酒和食醋,食醋与料酒、三甲胺均发生反应,试写出反应的化学方程式。
提示 因为引起鱼腥味的成分可以溶解在料酒的酒精中,烹调和加热时,随着酒精一起蒸发这些腥味成分,从而减少锅内腥味物质的存在。
提示 CH3COOH+C2H5OH CH3COOC2H5+H2O, CH3COOH+(CH3)3N→(CH3)3NH+CH3COO-。
方法突破
1.胺的碱性
2.胺的酰化反应
胺与羧酸、酰卤或酸酐反应中,胺的氮原子上氢原子被酰基(RCO—)取代生成酰胺。例如:
应用体验
视角1胺的结构与性质
1.下列说法错误的是( )
A.(CH3)2NH的分子结构为三角锥形
B.苯胺属于一级胺
C.三甲胺属于三元胺
D.与氮原子相连的两个烃基可以相同,也可以不同
C
解析 三甲胺的结构简式为(CH3)3N,属于三级胺,属于一元胺,C说法错误。
视角2胺的碱性
2.胺是指烃基取代氨分子中的氢原子而形成的化合物,下列关于胺的说法错误的是( )
A.甲胺是甲基取代氨分子中的一个氢原子形成的
B.胺类化合物含有的官能团均只有—NH2
C.苯胺与盐酸反应的化学方程式为
B
解析 甲胺的结构简式为CH3NH2,可看作甲基取代氨分子中的一个氢原子形成的,故A正确;胺类化合物中还可能含有碳碳双键等官能团,故B错误;胺类化合物具有碱性,能与盐酸反应,故C正确;三聚氰胺存在氨基,具有碱性,故D正确。
3.中草药麻黄的主要成分麻黄碱(2-甲氨基-苯丙烷-1-醇)的结构如图所示,它的熔点只有79 ℃,鱼腥味重,在临床上用于治疗习惯性支气管哮喘,预防哮喘发作以及过敏等。
下列说法错误的是( )
A.它可以发生酯化反应
B.它可以与盐酸反应生成麻黄碱盐酸盐
C.麻黄碱易被氧化
D.它遇FeCl3溶液发生显色反应
D
解析 麻黄碱含有醇羟基,能发生酯化反应,不含酚羟基,遇FeCl3溶液不显紫色,故A正确、D错误;胺类化合物具有弱碱性,能与盐酸反应生成盐,故B正确;含碳原子数较多的胺易被氧化,故C正确。
思维点拨 胺的碱性
在胺类化合物中,氨基(—NH2)、亚氨基(—NH—)和次氨基( )的氮原子上均含有1个孤电子对,可与H+结合,因此胺类化合物具有弱碱性,均可与强酸反应生成铵盐。
探究二 酰胺的化学性质
情境探究
一般情况下烧烤的食物容易诱发癌症,这部分是由于食物在高温烧烤下会产生一种特殊的致癌分子——丙烯酰胺分子。在工业生产中,丙烯酰胺可用作有机合成的原料及高分子材料的原料,用途十分广泛。
1.丙烯酰胺分子中含有哪些官能团 试写出它们的名称。
提示 丙烯酰胺结构简式为CH2==CHCONH2,分子中含有的官能团为碳碳双键和酰胺基。
2.写出丙烯酰胺的聚合反应,以及在KOH溶液中的水解反应。
3.丙烯酰胺在工业生产中最初是由丙烯酰氯( )和NH3反应得到的,试写出该反应的化学方程式。
方法突破
酰胺的水解反应
酰胺在强酸(强碱)的催化下,发生水解反应生成羧酸和铵盐[羧酸盐和氨气(或胺)]。
反应过程:
类比酯的水解,可以确定酰胺水解的规律
反应规律:
应用体验
视角1酰胺的结构与认识
1.下列关于胺、酰胺的性质和用途正确的是( )
A.胺和酰胺都可以发生水解
B.胺具有碱性可以与酸反应生成盐和水
C.酰胺在酸性条件下水解可生成NH3
D.胺和酰胺都是重要的化工原料
D
解析 胺不能发生水解反应,酰胺可以发生水解,A错误;胺具有碱性可以与酸反应生成盐,没有水生成,B错误;酰胺在酸性条件下水解可生成铵盐,C错误;胺和酰胺都是重要的化工原料,D正确。
视角2酰胺的水解反应
2.乙酰苯胺是磺胺类药物的原料,其结构如图所示,关于乙酰苯胺的说法正确的是( )
A.分子式为C8H9NO
B.乙酰苯胺是一种芳香烃
C.1 mol 乙酰苯胺最多能和含2 mol NaOH的水溶液完全反应
D.分子中所有原子一定在同一平面上
A
解析 根据该有机化合物的结构简式可知,分子式为C8H9NO,故A正确;该有机化合物含有碳、氢、氧、氮元素,不属于芳香烃,故B错误;乙酰苯胺在碱性条件下发生水解反应,生成对应的羧酸盐(CH3COONa)和胺( ),反应中断裂1 mol酰胺键,消耗1 mol NaOH,故C错误;甲烷的空间结构为正四面体形,NH3的空间结构为三角锥形,因该分子中含有甲基、—NH—,所以分子中所有原子一定不在同一平面上,故D错误。
3.2021年诺贝尔生理学或医学奖颁发给了发现温度和触觉感受器的两位科学家,其中温度感受器的发现与辣椒素有关。已知辣椒素的结构如图所示,下列有关辣椒素说法错误的是( )
A.分子式:C18H27NO3
B.可以发生取代、加成、氧化反应
C.可与NaOH溶液反应
D.1 mol辣椒素最多可与5 mol H2发生加成反应
D
解析 由题干信息中辣椒素的结构简式可知,其分子式为C18H27NO3,A正确;辣椒素分子中含有酚羟基、酰胺基、碳碳双键、醚键和苯环,可发生取代、加成、氧化反应,B正确;辣椒素分子中含有酚羟基和酰胺基,可与NaOH溶液反应,C正确;1 mol辣椒素中含1 mol苯环可与3 mol H2加成,1 mol 碳碳双键可与1 mol H2加成,故最多可与4 mol H2发生加成反应,D错误。
【变式设问】
(1)辣椒素可与溴水反应,请写出辣椒素与足量溴水反应生成有机物的结构简式。
(2)辣椒素在NaOH溶液中可发生水解反应,请写出水解得到产物的结构简式。
归纳总结 能与酸、碱均反应的常见物质
(1)铝及其化合物:Al、Al2O3、Al(OH)3;
(2)弱酸的铵盐:如(NH4)2S、(NH4)2CO3、CH3COONH4等;
(3)弱酸的酸式盐:如NaHCO3、NaHS、NaHSO3等;
(4)有机物:氨基酸、蛋白质、酰胺等。
本 课 结 束
专题5
第二单元 胺和酰胺
素养 目标
1.通过与氨的类比认识胺的结构和性质;能对胺类化合物进行命名。认识酰胺的结构特征,能通过与酯类比说明酰胺的主要性质,培养宏观辨识与微观探析的化学核心素养。
2.能运用胺的性质解释某些制药工艺,能举例说明胺、酰胺类化合物在药物合成中的重要作用,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、胺的结构与应用
1.胺的定义、结构与分类
三角锥
一级胺
二级胺
三级胺
脂肪胺
芳香胺
2.胺类化合物的命名
普通命名法 结构简单的胺常在烃基后直接加“胺”,如CH3NH2称为
,CH3NHCH3称为 ,C6H5NH2称为苯胺
名称书写 需注意 ①表示基团时用“ ”;②表示氨的烃类衍生物时用“ ”;③表示胺的盐时用“ ”
伯胺、仲胺、 叔胺的意义 伯胺、仲胺、叔胺中分别含有氨基(—NH2)、亚氨基
(—NH—)和次氨基( )
甲胺
二甲胺
氨
胺
铵
3.胺的性质
(1)胺与酸反应转化为铵:
①胺的碱性:胺具有碱性,可与酸反应生成类似的铵盐。请写出乙胺与盐酸反应的化学方程式: 。
②应用:
在胺类药物的合成中,常将某些难溶于水、易被氧化的胺,转化为可溶于水的铵盐,增加药物的稳定性,便于保存和运输。
(2)铵与碱反应转化为胺:
①物理性质不同点:胺易溶于 ,而铵盐溶于水但不溶于 。
②铵与碱反应:向铵盐溶液中加 ,又转化为 。试写出氯化乙铵与NaOH溶液反应的化学方程式: 。
③应用:实验室可从含有胺的植物组织中分离、提纯胺类化合物(生物碱)。
有机溶剂
有机溶剂
强碱
胺
4.几种常见胺的应用
(1)乙二胺(H2NCH2CH2NH2):无色透明液体,溶于 ,具有扩张血管的作用。它是制备药物、乳化剂和杀虫剂的原料。乙二胺的戊酸盐是治疗动脉硬化的药物。乙二胺与氯乙酸作用,生成乙二胺四乙酸,简称EDTA,它是重要的分析试剂。
(2)己二胺[H2N(CH2)6NH2]:合成化学纤维“尼龙-66”的主要原料。
(3)苯胺是 中最重要的原料之一。
水和醇
染料工业
教材阅读想一想多巴胺可用于治疗心肌梗死、败血症、肾功能衰竭、心力衰竭、心功能不全等疾病,可增强心排血量。其结构简式为
,该物质能与强酸、强碱反应吗
提示 多巴胺分子中含有氨基,能与强酸发生反应;含有酚羟基,能与强碱发生反应。
易错辨析判一判
(1)三甲胺的分子结构为三角锥形。( )
(2)苯胺属于二级胺。( )
(3)胺的碱性比较弱,能与酸反应生成铵盐。( )
(4)己二胺属于二元胺,是合成高聚物的主要原料。( )
√
×
提示 苯胺属于一级胺。
√
√
二、酰胺的结构与应用
1.定义
酰胺是羧酸中的羟基被 或烃氨基(—NHR或—NR2)取代而成的化合物。
2.表示方法
其结构一般表示为 ,其中的 叫做 , 叫做 。
氨基
酰基
酰胺基
3.常见酰胺的名称与结构
4.物理性质
颜色、状态 熔、沸点 溶解性
除甲酰胺外,大部分是 色晶体 酰胺均高于相应的羧酸 低级的酰胺能溶于水,随着相对分子质量的增大,酰胺的溶解度逐渐
白
减小
5.化学性质
酰胺与酯类有机化合物一样,都是羧酸衍生物,两者的结构类似,决定了它们具有相似的性质。在酸、碱作用下,它们都能发生水解反应。
(1)写出乙酰胺与硫酸反应的化学方程式:
。
(2)写出乙酰胺与NaOH溶液反应的化学方程式:
。
2CH3CONH2+2H2O+H2SO4 2CH3COOH+(NH4)2SO4
CH3CONH2+NaOH CH3COONa+NH3↑
6.乙酰胺的制备
。
7.用途
常用作溶剂和化工原料、合成农药、医用等。
CH3COOH+NH3 CH3CONH2+H2O
教材阅读想一想尿素[CO(NH2)2]属于酰胺,其化学性质具有酰胺的通性。请分别写出尿素在酸性(H2SO4)、碱性(NaOH)条件下发生水解的化学方程式。
易错辨析判一判
(1)酰胺与胺属于同类化合物,官能团均为—NH2。( )
(2)氯硝柳胺( )是一种抗肠蠕虫药,分子中含有4种官能团。
( )
提示 酰胺与胺不是同类化合物,酰胺的官能团为 。
×
√
(3)一定条件下,1 mol 与KOH溶液反应,最多消耗3 mol KOH。( )
×
(4)1 mol 对乙酰氨基酚( )在一定条件下与足量H2发生加成反应,可消耗4 mol H2。( )
×
提示 在对乙酰氨基酚中,苯环可与H2加成,酰胺基难以与H2加成,因此1 mol 对乙酰氨基酚与H2加成时,消耗3 mol H2。
重难探究·能力素养全提升
探究一 胺的化学性质
情境探究
鱼是一种营养丰富、味道鲜美的食物,但鱼腥味十分影响食欲。引起鱼腥味的主要成分是一种名为“三甲胺”的物质,为除去鱼腥味,人们在做鱼时常加入料酒和食醋。
1.三甲胺的结构简式如何书写
提示 (CH3)3N。
2.为什么做鱼时加入料酒可除去鱼腥味
3.做鱼时常加入料酒和食醋,食醋与料酒、三甲胺均发生反应,试写出反应的化学方程式。
提示 因为引起鱼腥味的成分可以溶解在料酒的酒精中,烹调和加热时,随着酒精一起蒸发这些腥味成分,从而减少锅内腥味物质的存在。
提示 CH3COOH+C2H5OH CH3COOC2H5+H2O, CH3COOH+(CH3)3N→(CH3)3NH+CH3COO-。
方法突破
1.胺的碱性
2.胺的酰化反应
胺与羧酸、酰卤或酸酐反应中,胺的氮原子上氢原子被酰基(RCO—)取代生成酰胺。例如:
应用体验
视角1胺的结构与性质
1.下列说法错误的是( )
A.(CH3)2NH的分子结构为三角锥形
B.苯胺属于一级胺
C.三甲胺属于三元胺
D.与氮原子相连的两个烃基可以相同,也可以不同
C
解析 三甲胺的结构简式为(CH3)3N,属于三级胺,属于一元胺,C说法错误。
视角2胺的碱性
2.胺是指烃基取代氨分子中的氢原子而形成的化合物,下列关于胺的说法错误的是( )
A.甲胺是甲基取代氨分子中的一个氢原子形成的
B.胺类化合物含有的官能团均只有—NH2
C.苯胺与盐酸反应的化学方程式为
B
解析 甲胺的结构简式为CH3NH2,可看作甲基取代氨分子中的一个氢原子形成的,故A正确;胺类化合物中还可能含有碳碳双键等官能团,故B错误;胺类化合物具有碱性,能与盐酸反应,故C正确;三聚氰胺存在氨基,具有碱性,故D正确。
3.中草药麻黄的主要成分麻黄碱(2-甲氨基-苯丙烷-1-醇)的结构如图所示,它的熔点只有79 ℃,鱼腥味重,在临床上用于治疗习惯性支气管哮喘,预防哮喘发作以及过敏等。
下列说法错误的是( )
A.它可以发生酯化反应
B.它可以与盐酸反应生成麻黄碱盐酸盐
C.麻黄碱易被氧化
D.它遇FeCl3溶液发生显色反应
D
解析 麻黄碱含有醇羟基,能发生酯化反应,不含酚羟基,遇FeCl3溶液不显紫色,故A正确、D错误;胺类化合物具有弱碱性,能与盐酸反应生成盐,故B正确;含碳原子数较多的胺易被氧化,故C正确。
思维点拨 胺的碱性
在胺类化合物中,氨基(—NH2)、亚氨基(—NH—)和次氨基( )的氮原子上均含有1个孤电子对,可与H+结合,因此胺类化合物具有弱碱性,均可与强酸反应生成铵盐。
探究二 酰胺的化学性质
情境探究
一般情况下烧烤的食物容易诱发癌症,这部分是由于食物在高温烧烤下会产生一种特殊的致癌分子——丙烯酰胺分子。在工业生产中,丙烯酰胺可用作有机合成的原料及高分子材料的原料,用途十分广泛。
1.丙烯酰胺分子中含有哪些官能团 试写出它们的名称。
提示 丙烯酰胺结构简式为CH2==CHCONH2,分子中含有的官能团为碳碳双键和酰胺基。
2.写出丙烯酰胺的聚合反应,以及在KOH溶液中的水解反应。
3.丙烯酰胺在工业生产中最初是由丙烯酰氯( )和NH3反应得到的,试写出该反应的化学方程式。
方法突破
酰胺的水解反应
酰胺在强酸(强碱)的催化下,发生水解反应生成羧酸和铵盐[羧酸盐和氨气(或胺)]。
反应过程:
类比酯的水解,可以确定酰胺水解的规律
反应规律:
应用体验
视角1酰胺的结构与认识
1.下列关于胺、酰胺的性质和用途正确的是( )
A.胺和酰胺都可以发生水解
B.胺具有碱性可以与酸反应生成盐和水
C.酰胺在酸性条件下水解可生成NH3
D.胺和酰胺都是重要的化工原料
D
解析 胺不能发生水解反应,酰胺可以发生水解,A错误;胺具有碱性可以与酸反应生成盐,没有水生成,B错误;酰胺在酸性条件下水解可生成铵盐,C错误;胺和酰胺都是重要的化工原料,D正确。
视角2酰胺的水解反应
2.乙酰苯胺是磺胺类药物的原料,其结构如图所示,关于乙酰苯胺的说法正确的是( )
A.分子式为C8H9NO
B.乙酰苯胺是一种芳香烃
C.1 mol 乙酰苯胺最多能和含2 mol NaOH的水溶液完全反应
D.分子中所有原子一定在同一平面上
A
解析 根据该有机化合物的结构简式可知,分子式为C8H9NO,故A正确;该有机化合物含有碳、氢、氧、氮元素,不属于芳香烃,故B错误;乙酰苯胺在碱性条件下发生水解反应,生成对应的羧酸盐(CH3COONa)和胺( ),反应中断裂1 mol酰胺键,消耗1 mol NaOH,故C错误;甲烷的空间结构为正四面体形,NH3的空间结构为三角锥形,因该分子中含有甲基、—NH—,所以分子中所有原子一定不在同一平面上,故D错误。
3.2021年诺贝尔生理学或医学奖颁发给了发现温度和触觉感受器的两位科学家,其中温度感受器的发现与辣椒素有关。已知辣椒素的结构如图所示,下列有关辣椒素说法错误的是( )
A.分子式:C18H27NO3
B.可以发生取代、加成、氧化反应
C.可与NaOH溶液反应
D.1 mol辣椒素最多可与5 mol H2发生加成反应
D
解析 由题干信息中辣椒素的结构简式可知,其分子式为C18H27NO3,A正确;辣椒素分子中含有酚羟基、酰胺基、碳碳双键、醚键和苯环,可发生取代、加成、氧化反应,B正确;辣椒素分子中含有酚羟基和酰胺基,可与NaOH溶液反应,C正确;1 mol辣椒素中含1 mol苯环可与3 mol H2加成,1 mol 碳碳双键可与1 mol H2加成,故最多可与4 mol H2发生加成反应,D错误。
【变式设问】
(1)辣椒素可与溴水反应,请写出辣椒素与足量溴水反应生成有机物的结构简式。
(2)辣椒素在NaOH溶液中可发生水解反应,请写出水解得到产物的结构简式。
归纳总结 能与酸、碱均反应的常见物质
(1)铝及其化合物:Al、Al2O3、Al(OH)3;
(2)弱酸的铵盐:如(NH4)2S、(NH4)2CO3、CH3COONH4等;
(3)弱酸的酸式盐:如NaHCO3、NaHS、NaHSO3等;
(4)有机物:氨基酸、蛋白质、酰胺等。
本 课 结 束
