4.2.2 羧酸的性质及应用课件(共55张PPT) 2023-2024学年高二化学苏教版选择性必修3
文档属性
| 名称 | 4.2.2 羧酸的性质及应用课件(共55张PPT) 2023-2024学年高二化学苏教版选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 13:17:59 | ||
图片预览









文档简介
(共55张PPT)
专题4
第二单元 第2课时 羧酸的性质及应用
素养 目标
1.能基于官能团、化学键的特点分析羧酸的化学性质,能描述和分析羧酸的重要反应,能书写相应的化学方程式,逐渐形成宏观辨识与微观探析的化学核心素养。
2.通过实验探究乙酸、碳酸、苯酚的酸性强弱及乙酸乙酯的制备,认识反应条件控制的重要性,了解同位素示踪法在酯化反应反应机理分析中的应用,逐渐形成科学探究与创新意识的化学核心素养。
3.通过结合生产、生活实际了解羧酸在生活和生产中的应用,形成科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
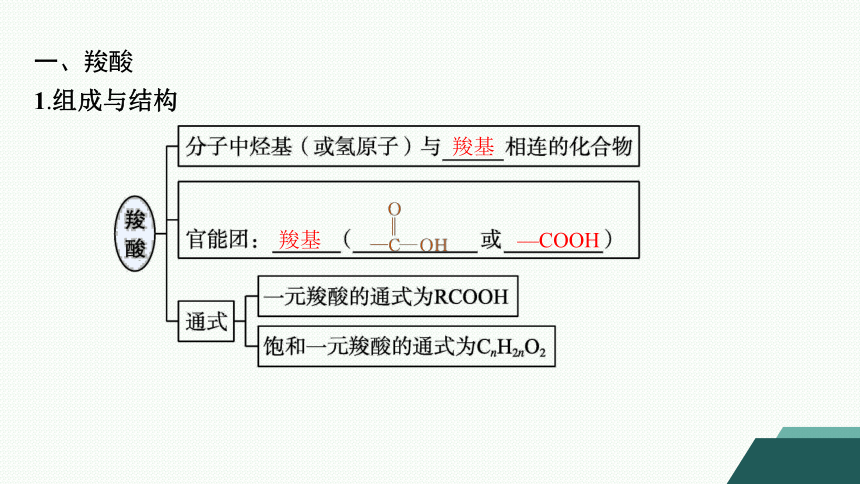
一、羧酸
1.组成与结构
羧基
羧基
—COOH
2.分类
甲酸、乙酸
苯甲酸
CH3CH2COOH
HOOC—COOH
3.甲酸
甲酸的结构比较特殊,分子中的羧基和氢原子直接相连,既有 结构,又有 结构。
甲酸又称 ,是 色、有 气味的液体,可与水、乙醇等混溶。
4.其他常见羧酸
除甲酸、乙酸外,常见羧酸还有乙二酸(草酸)、苯甲酸、对苯二甲酸等。
羧基
醛基
蚁酸
无
刺激性
教材阅读想一想阅读教材“方法导引·羧酸的分类”。
分子式为C5H10O2的羧酸有几种 试写出这些同分异构体中1H核磁共振谱中吸收峰最少的羧酸。
提示 4种。1H核磁共振谱中吸收峰最少的羧酸为(CH3)3CCOOH。
易错辨析判一判
(1)乙酸可看作乙烷中的一个氢原子被羧基取代的产物。( )
(2)软脂酸(C15H31COOH)属于饱和高级脂肪酸。( )
(3)羧基官能团可以简写成—COOH或者HOOC—。( )
(4)乙酸、草酸、硬脂酸和苯酚均属于羧酸类有机物。( )
提示 乙酸(CH3COOH)可看作甲烷(CH4)中的一个氢原子被羧基(—COOH)取代的产物。
提示 苯酚属于酚类化合物,不属于羧酸。
×
√
√
×
二、羧酸的化学性质
1.酸性
羧酸具有酸的共性。
写出乙酸与下列物质反应的化学方程式:
①与Na: 。
②与NaOH: 。
③与Na2CO3: 。
④与NaHCO3: 。
2CH3COOH+2Na→2CH3COONa+H2↑
CH3COOH+NaOH→CH3COONa+H2O
2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O
CH3COOH+NaHCO3→CH3COONa+CO2↑+H2O
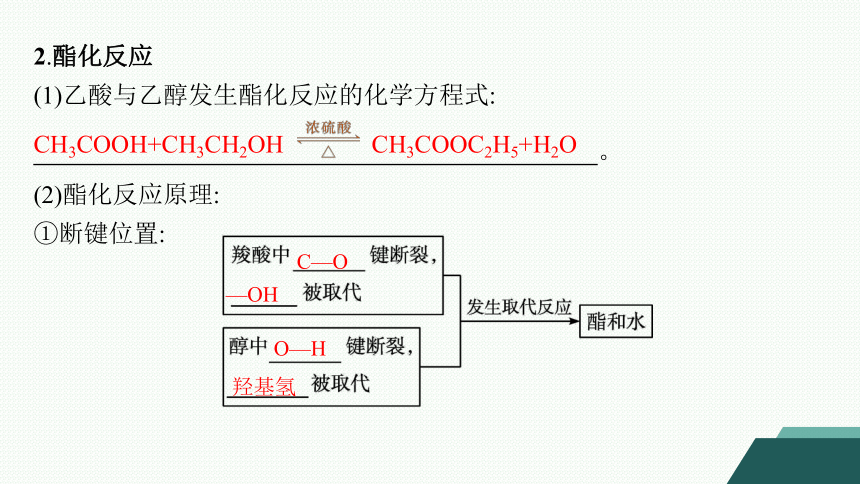
2.酯化反应
(1)乙酸与乙醇发生酯化反应的化学方程式:
。
(2)酯化反应原理:
①断键位置:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
C—O
—OH
O—H
羟基氢
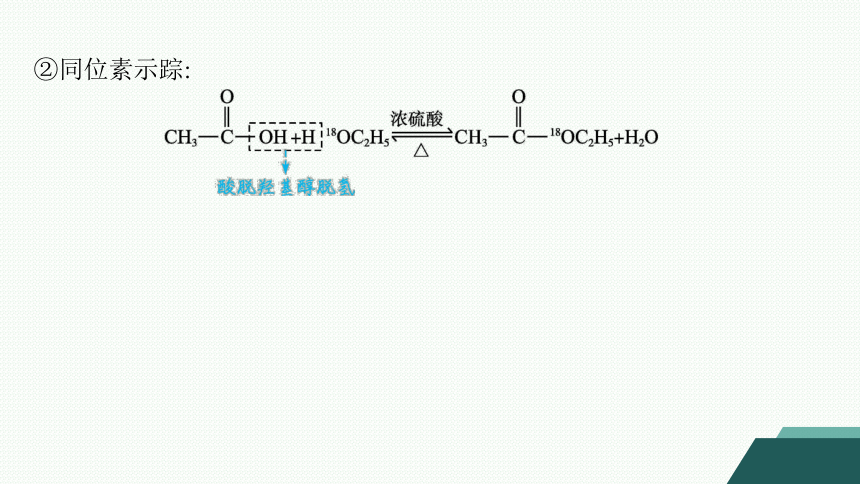
②同位素示踪:
3.羧酸与醇的缩聚反应
教材阅读想一想由于甲酸( )的特殊结构使其表现特有的性质。
(1)甲酸中加入新制的氢氧化铜悬浊液,可能有怎样的现象 试写出反应的化学方程式。
(2)若在新制的氢氧化铜悬浊液中滴入少量甲酸并加热,产生砖红色沉淀,其原因是什么
提示 蓝色的悬浊液变为蓝色溶液,2HCOOH+Cu(OH)2→ (HCOO)2Cu+2H2O。
提示 甲酸中含有醛基,具有还原性,能将新制的氢氧化铜悬浊液还原为砖红色的Cu2O沉淀。
易错辨析判一判
(1)分子式相同的羧酸和酯类互为同分异构体。( )
(2)1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5。( )
(3)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应。
( )
(4)乙酸显酸性,电离出H+,因此发生酯化反应时断裂H—O键。( )
提示 酯化反应为可逆反应,因此1 mol C2H5OH和1 mol CH3COOH不可能完全反应生成1 mol CH3COOC2H5。
提示 羧酸分子中的碳氧双键不能与H2发生加成反应。
提示 酯化反应中,乙酸分子断裂碳氧键。
√
×
×
×
重难探究·能力素养全提升
探究一 典型有机物中羟基氢活泼性比较
情境探究
绿原酸是金银花抗菌、抗病毒的有效药理成分之一,可发生水解反应生成A和B。
1.A可与Na2CO3反应,试写出A与过量Na2CO3反应的化学方程式。
3.绿原酸可在碱性条件下水解,1 mol 绿原酸与足量NaOH溶液反应消耗NaOH的物质的量为多少
2.1 mol A分别与足量的Na、NaOH、NaHCO3反应,消耗三种物质的物质的量之比为多少 等物质的量的B分别与Na和NaHCO3反应,产生的气体体积(相同状况)之比是多少
提示 1 mol A消耗Na、NaOH、NaHCO3的物质的量之比为3∶3∶1;等物质的量的B与Na和NaHCO3反应,产生的气体体积之比为5∶2。
提示 4 mol NaOH。绿原酸中含有的官能团有碳碳双键、羧基、醇羟基、酚羟基和酯基,与NaOH反应的官能团有酚羟基、羧基和酯基,1 mol绿原酸与足量NaOH溶液反应消耗4 mol NaOH。
方法突破
羟基氢活泼性的比较
类别 醇 水 酚 低级羧酸
羟基上氢原 子活泼性
在水溶液中 电离程度 不能 电离 难电离 微弱 电离 部分
电离
酸碱性 中性 中性 很弱的酸性 弱酸性
加入Na 反应放出H2
分子中含碳数较少的羧酸
类别 醇 水 酚 低级羧酸
加入NaOH 溶液 不反应 不反应 反应 反应
加入Na2CO3 溶液(少量) 不反应 水解 反应生成NaHCO3 反应放出CO2
加入NaHCO3 溶液 不反应 水解 不反应 反应放出CO2
分子中含碳数较少的羧酸
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为
应用体验
视角1羧酸的结构与性质
1.丙烯酸的结构简式为CH2==CHCOOH,下列对其性质的叙述不正确的是
( )
A.与钠反应放出氢气
B.能发生酯化反应
C.不能与新制的Cu(OH)2悬浊液反应
D.能与溴水发生加成反应
C
解析 CH2==CHCOOH中含有—COOH,能与钠反应放出氢气,能与醇发生酯化反应,能与新制的Cu(OH)2悬浊液发生中和反应,A、B均正确,C错误;CH2==CHCOOH中含有碳碳双键,能与溴水发生加成反应,D正确。
2.下列物质中,能显示酸性,还能发生酯化反应和消去反应的是( )
B
解析 A中物质含有羧基和羟基,羧基显酸性,羧基和羟基均可发生酯化反应,连有羟基的碳原子的邻位碳上没有氢原子,故不能发生消去反应,错误;B中物质含有羧基和羟基,羧基显酸性,羧基和羟基均可发生酯化反应,连有羟基的碳原子的邻位碳上有氢原子,能发生消去反应,正确;C、D中物质含有羧基显酸性,可发生酯化反应,不能发生消去反应,错误。
3.某同学在学习了乙酸的性质后,根据甲酸的结构( )对甲酸的化学性质进行下列推断,其中不正确的是( )
A.能与碳酸钠溶液反应
B.能发生银镜反应也能与新制的Cu(OH)2悬浊液反应
C.不能使酸性KMnO4溶液褪色
D.能与单质镁反应
C
解析 甲酸分子中含有醛基和羧基两种官能团,具有醛与羧酸的双重性质,羧基可与Na2CO3反应,可与Mg反应,A、D说法正确;含有醛基,能发生银镜反应,能与新制的Cu(OH)2悬浊液反应,可被酸性KMnO4溶液氧化,B说法正确,C说法错误。
视角2典型有机物中羟基氢活泼性比较
4.研究表明,咖啡中含有的咖啡酸可能使人心脑血管更年轻。咖啡酸的结构简式如图所示,下列有关咖啡酸的叙述不正确的是( )
A.咖啡酸的分子式为C9H8O4
B.1 mol 咖啡酸可以和1 mol NaHCO3反应
C.1 mol 咖啡酸可以和3 mol NaOH反应
D.可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键
D
解析 由咖啡酸的结构可知,有机物的分子式为C9H8O4,故A正确;酚羟基与NaHCO3不反应,1 mol 咖啡酸可以与1 mol NaHCO3反应,故B正确;羧基和酚羟基都能与氢氧化钠反应,所以1 mol 咖啡酸可以与3 mol NaOH反应,故C正确;因为酚、苯环侧链也能被高锰酸钾氧化,所以不能用高锰酸钾检验碳碳双键,故D错误。
5.某种药物合成中间体的结构简式为 ,下列有关该物质的说法不正确的是( )
A.属于芳香族化合物
B.能发生消去反应、还原反应和酯化反应,不能发生水解反应
C.1 mol 该有机物与足量Na2CO3溶液反应,消耗2.5 mol Na2CO3
D.能分别与金属Na、NaOH溶液、NaHCO3溶液反应
C
解析 该有机物分子中含有苯环,为芳香族化合物,所以A正确。分子中连有醇羟基的碳原子的相邻碳原子上有氢原子,可发生消去反应;含有醇羟基和羧基,可发生酯化反应;含有羰基和苯环,可以发生还原反应;没有能发生水解反应的官能团,不能发生水解反应,所以B正确。1个分子中含有2个酚羟基和1个羧基,则1 mol 该有机物与足量Na2CO3溶液反应,消耗3 mol Na2CO3,故C错误。分子中含有的醇羟基、酚羟基和羧基,可与金属Na反应;酚羟基和羧基可与NaOH溶液反应;羧基可与NaHCO3溶液反应,所以D正确。
【变式设问】
(1)1 mol 该有机物分别与金属Na、NaOH溶液、NaHCO3溶液反应消耗Na、NaOH、NaHCO3的物质的量之比是多少
(2)1 mol 该有机物与足量H2发生加成反应反应,最多消耗H2的物质的量为多少
提示 5∶3∶1。
提示 8 mol 。1 mol 该有机物中含有2 mol 苯环和2 mol 羰基,一定条件下均可与H2发生加成反应。
归纳总结 羟基氢活泼性的比较注意事项
(1)羧酸是比H2CO3酸性强的酸,但不同的羧酸酸性也不相同。酸性关系:甲酸>苯甲酸>乙酸>丙酸。
(2)酚羟基和羧基都能与碳酸钠溶液反应,但是酚羟基与碳酸钠反应不会产生CO2,而是生成NaHCO3。
(3)酚羟基不能与NaHCO3反应,若一种有机物能与碳酸氢钠溶液反应产生CO2气体,一般可说明该有机物分子中含有羧基。
探究二 酯化反应和酯的水解
情境探究
早在汉代,人们已懂得酿造和食用醋。如今的山西陈醋和镇江香醋是我国传统食醋的名品,各具风味,蜚声宇内。
醋酸在生活中有很多应用。
1.用食醋浸泡有水垢(主要成分为CaCO3)的暖瓶,可以清除其中的水垢。清除水垢利用了醋酸的什么性质 通过这个事实你能比较出醋酸与碳酸的酸性强弱吗 写出清除水垢的化学方程式。
提示 利用食醋清除水垢是利用了醋酸的酸性,该反应的发生可以说明CH3COOH的酸性比H2CO3的酸性强,化学方程式为2CH3COOH+CaCO3→(CH3COO)2Ca+H2O+CO2↑。
2.厨师炒菜时为了增加菜的香味,常常加入食醋和白酒,你能解释其中的原理吗
提示 食醋中的乙酸和白酒中的乙醇在炒菜时发生反应生成具有香味的乙酸乙酯。
3.乙二酸与乙二醇可以发生酯化反应,生成多种不同结构的酯,如环酯、高分子酯等。写出形成的最小环酯的结构简式。写出形成高分子酯的化学方程式。
方法突破
1.酯化反应的基本类型
(1)生成链状酯。
①一元酸与一元醇的反应:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O。
②一元酸与二元醇或二元酸与一元醇的反应:
③无机含氧酸与醇形成无机酸酯:
(2)生成环酯。
①多元醇与多元羧酸进行分子间脱水形成环酯:
反应生成环酯时,五元环和六元环最容易生成
②羟基酸分子间脱水形成环酯:
③羟基酸分子内脱水形成环酯:
(3)形成聚酯。
①羟基酸缩聚:
②二元酸与二元醇缩聚:
2.乙酸乙酯的制备与性质
(1)制备实验。
实验 操作
实验 现象 饱和碳酸钠溶液的液面上有无色透明的不溶于水的油状液体产生,可闻到香味
有关化学 方程式
(2)性质实验。
实验 操作
实验 现象 A试管较长时间内酯层厚度基本不变,乙酸乙酯气味很浓;B试管酯层厚度减小,略有乙酸乙酯的气味;C试管酯层基本消失,无乙酸乙酯的气味
实验 结论 乙酸乙酯在中性条件下基本不水解;酸性条件下部分水解;碱性条件下全部水解
(3)酯水解反应的方程式。
①酸性条件下水解:
RCOOR'+H2O RCOOH+R'OH
②碱性条件下水解:
RCOOR'+NaOH RCOONa+R'OH
③若为酚形成的酯,碱性条件下水解得到的酚也可与NaOH中和,如
应用体验
视角1酯化反应实验
1.下列制取乙酸乙酯的实验能达到实验目的的是( )
A.装置甲:混合乙醇与浓硫酸
B.装置乙:制取乙酸乙酯
C.装置丙:分离乙酸乙酯和水层
D.装置丁:分离乙酸乙酯和乙醇
C
解析 混合乙醇与浓硫酸时应将浓硫酸缓慢注入乙醇中并不断搅拌,A项错误;收集乙酸乙酯时不能用饱和氢氧化钠溶液,因其碱性太强会使乙酸乙酯水解,B项错误;酯的密度比水小,且难溶于水,采用分液的方法分离,水层在下层,有机层在上层,C项正确;蒸馏分离乙酸乙酯和乙醇时温度计的水银球应处于蒸馏烧瓶支管口处,D项错误。
2.[2023河北石家庄高二阶段练习]某课外兴趣小组欲在实验室里制备少量乙酸乙酯,设计了如图所示装置(夹持装置已略去),下列说法不正确的是
( )
A.该装置中冷凝水的流向为b进a出
B.加入过量乙醇可提高乙酸的转化率
C.该反应可能生成副产物乙醚
D.收集到的馏分需用饱和NaOH溶液除去杂质
D
解析 为了使冷凝管中充满水且增强冷凝效果,冷凝水和被冷凝的液体逆向流动,故该装置中冷凝水的流向为b进a出,A正确;乙酸与乙醇在浓硫酸、加热条件下发生的酯化反应为可逆反应,加入过量乙醇,平衡正向移动,可提高乙酸的转化率,B正确;该反应可能生成副产物乙醚(乙醇发生分子间脱水反应),C正确;因为在NaOH溶液中乙酸乙酯会发生水解反应,所以收集到的馏分不能用饱和NaOH溶液分离杂质,应该用饱和碳酸钠溶液除去杂质,D错误。
视角2酯化反应的应用
3.[2023河北邯郸高二期中]脱落酸是一种抑制植物生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示。下列有关脱落酸的说法错误的是( )
A.存在芳香族同分异构体
B.可发生分子内酯化反应
C.1 mol脱落酸与足量金属钠反应可得到22.4 L H2
D.与HBr加成生成一溴代物时,最多可得到6种一溴代物
C
解析 脱落酸分子存在6个不饱和度,而苯环有4个不饱和度,故可存在芳香族同分异构体,A正确;分子中含有羟基、羧基,可发生分子内酯化反应,B正确;1 mol脱落酸与足量Na反应可得到1 mol H2,由于没有明确温度和压强,因此无法确定H2的体积是多少,C错误;1个脱落酸分子中有3个碳碳双键,每个碳碳双键和HBr加成生成一溴代物时可得两种产物,故其一溴代物最多有6种,D正确。
4.有机物A的结构简式为
据此回答下列问题:
(1)A的分子式为 。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简
式为 。
C12H14O5
2
本 课 结 束
专题4
第二单元 第2课时 羧酸的性质及应用
素养 目标
1.能基于官能团、化学键的特点分析羧酸的化学性质,能描述和分析羧酸的重要反应,能书写相应的化学方程式,逐渐形成宏观辨识与微观探析的化学核心素养。
2.通过实验探究乙酸、碳酸、苯酚的酸性强弱及乙酸乙酯的制备,认识反应条件控制的重要性,了解同位素示踪法在酯化反应反应机理分析中的应用,逐渐形成科学探究与创新意识的化学核心素养。
3.通过结合生产、生活实际了解羧酸在生活和生产中的应用,形成科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
基础落实·必备知识全过关
一、羧酸
1.组成与结构
羧基
羧基
—COOH
2.分类
甲酸、乙酸
苯甲酸
CH3CH2COOH
HOOC—COOH
3.甲酸
甲酸的结构比较特殊,分子中的羧基和氢原子直接相连,既有 结构,又有 结构。
甲酸又称 ,是 色、有 气味的液体,可与水、乙醇等混溶。
4.其他常见羧酸
除甲酸、乙酸外,常见羧酸还有乙二酸(草酸)、苯甲酸、对苯二甲酸等。
羧基
醛基
蚁酸
无
刺激性
教材阅读想一想阅读教材“方法导引·羧酸的分类”。
分子式为C5H10O2的羧酸有几种 试写出这些同分异构体中1H核磁共振谱中吸收峰最少的羧酸。
提示 4种。1H核磁共振谱中吸收峰最少的羧酸为(CH3)3CCOOH。
易错辨析判一判
(1)乙酸可看作乙烷中的一个氢原子被羧基取代的产物。( )
(2)软脂酸(C15H31COOH)属于饱和高级脂肪酸。( )
(3)羧基官能团可以简写成—COOH或者HOOC—。( )
(4)乙酸、草酸、硬脂酸和苯酚均属于羧酸类有机物。( )
提示 乙酸(CH3COOH)可看作甲烷(CH4)中的一个氢原子被羧基(—COOH)取代的产物。
提示 苯酚属于酚类化合物,不属于羧酸。
×
√
√
×
二、羧酸的化学性质
1.酸性
羧酸具有酸的共性。
写出乙酸与下列物质反应的化学方程式:
①与Na: 。
②与NaOH: 。
③与Na2CO3: 。
④与NaHCO3: 。
2CH3COOH+2Na→2CH3COONa+H2↑
CH3COOH+NaOH→CH3COONa+H2O
2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O
CH3COOH+NaHCO3→CH3COONa+CO2↑+H2O
2.酯化反应
(1)乙酸与乙醇发生酯化反应的化学方程式:
。
(2)酯化反应原理:
①断键位置:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
C—O
—OH
O—H
羟基氢
②同位素示踪:
3.羧酸与醇的缩聚反应
教材阅读想一想由于甲酸( )的特殊结构使其表现特有的性质。
(1)甲酸中加入新制的氢氧化铜悬浊液,可能有怎样的现象 试写出反应的化学方程式。
(2)若在新制的氢氧化铜悬浊液中滴入少量甲酸并加热,产生砖红色沉淀,其原因是什么
提示 蓝色的悬浊液变为蓝色溶液,2HCOOH+Cu(OH)2→ (HCOO)2Cu+2H2O。
提示 甲酸中含有醛基,具有还原性,能将新制的氢氧化铜悬浊液还原为砖红色的Cu2O沉淀。
易错辨析判一判
(1)分子式相同的羧酸和酯类互为同分异构体。( )
(2)1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5。( )
(3)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应。
( )
(4)乙酸显酸性,电离出H+,因此发生酯化反应时断裂H—O键。( )
提示 酯化反应为可逆反应,因此1 mol C2H5OH和1 mol CH3COOH不可能完全反应生成1 mol CH3COOC2H5。
提示 羧酸分子中的碳氧双键不能与H2发生加成反应。
提示 酯化反应中,乙酸分子断裂碳氧键。
√
×
×
×
重难探究·能力素养全提升
探究一 典型有机物中羟基氢活泼性比较
情境探究
绿原酸是金银花抗菌、抗病毒的有效药理成分之一,可发生水解反应生成A和B。
1.A可与Na2CO3反应,试写出A与过量Na2CO3反应的化学方程式。
3.绿原酸可在碱性条件下水解,1 mol 绿原酸与足量NaOH溶液反应消耗NaOH的物质的量为多少
2.1 mol A分别与足量的Na、NaOH、NaHCO3反应,消耗三种物质的物质的量之比为多少 等物质的量的B分别与Na和NaHCO3反应,产生的气体体积(相同状况)之比是多少
提示 1 mol A消耗Na、NaOH、NaHCO3的物质的量之比为3∶3∶1;等物质的量的B与Na和NaHCO3反应,产生的气体体积之比为5∶2。
提示 4 mol NaOH。绿原酸中含有的官能团有碳碳双键、羧基、醇羟基、酚羟基和酯基,与NaOH反应的官能团有酚羟基、羧基和酯基,1 mol绿原酸与足量NaOH溶液反应消耗4 mol NaOH。
方法突破
羟基氢活泼性的比较
类别 醇 水 酚 低级羧酸
羟基上氢原 子活泼性
在水溶液中 电离程度 不能 电离 难电离 微弱 电离 部分
电离
酸碱性 中性 中性 很弱的酸性 弱酸性
加入Na 反应放出H2
分子中含碳数较少的羧酸
类别 醇 水 酚 低级羧酸
加入NaOH 溶液 不反应 不反应 反应 反应
加入Na2CO3 溶液(少量) 不反应 水解 反应生成NaHCO3 反应放出CO2
加入NaHCO3 溶液 不反应 水解 不反应 反应放出CO2
分子中含碳数较少的羧酸
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为
应用体验
视角1羧酸的结构与性质
1.丙烯酸的结构简式为CH2==CHCOOH,下列对其性质的叙述不正确的是
( )
A.与钠反应放出氢气
B.能发生酯化反应
C.不能与新制的Cu(OH)2悬浊液反应
D.能与溴水发生加成反应
C
解析 CH2==CHCOOH中含有—COOH,能与钠反应放出氢气,能与醇发生酯化反应,能与新制的Cu(OH)2悬浊液发生中和反应,A、B均正确,C错误;CH2==CHCOOH中含有碳碳双键,能与溴水发生加成反应,D正确。
2.下列物质中,能显示酸性,还能发生酯化反应和消去反应的是( )
B
解析 A中物质含有羧基和羟基,羧基显酸性,羧基和羟基均可发生酯化反应,连有羟基的碳原子的邻位碳上没有氢原子,故不能发生消去反应,错误;B中物质含有羧基和羟基,羧基显酸性,羧基和羟基均可发生酯化反应,连有羟基的碳原子的邻位碳上有氢原子,能发生消去反应,正确;C、D中物质含有羧基显酸性,可发生酯化反应,不能发生消去反应,错误。
3.某同学在学习了乙酸的性质后,根据甲酸的结构( )对甲酸的化学性质进行下列推断,其中不正确的是( )
A.能与碳酸钠溶液反应
B.能发生银镜反应也能与新制的Cu(OH)2悬浊液反应
C.不能使酸性KMnO4溶液褪色
D.能与单质镁反应
C
解析 甲酸分子中含有醛基和羧基两种官能团,具有醛与羧酸的双重性质,羧基可与Na2CO3反应,可与Mg反应,A、D说法正确;含有醛基,能发生银镜反应,能与新制的Cu(OH)2悬浊液反应,可被酸性KMnO4溶液氧化,B说法正确,C说法错误。
视角2典型有机物中羟基氢活泼性比较
4.研究表明,咖啡中含有的咖啡酸可能使人心脑血管更年轻。咖啡酸的结构简式如图所示,下列有关咖啡酸的叙述不正确的是( )
A.咖啡酸的分子式为C9H8O4
B.1 mol 咖啡酸可以和1 mol NaHCO3反应
C.1 mol 咖啡酸可以和3 mol NaOH反应
D.可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键
D
解析 由咖啡酸的结构可知,有机物的分子式为C9H8O4,故A正确;酚羟基与NaHCO3不反应,1 mol 咖啡酸可以与1 mol NaHCO3反应,故B正确;羧基和酚羟基都能与氢氧化钠反应,所以1 mol 咖啡酸可以与3 mol NaOH反应,故C正确;因为酚、苯环侧链也能被高锰酸钾氧化,所以不能用高锰酸钾检验碳碳双键,故D错误。
5.某种药物合成中间体的结构简式为 ,下列有关该物质的说法不正确的是( )
A.属于芳香族化合物
B.能发生消去反应、还原反应和酯化反应,不能发生水解反应
C.1 mol 该有机物与足量Na2CO3溶液反应,消耗2.5 mol Na2CO3
D.能分别与金属Na、NaOH溶液、NaHCO3溶液反应
C
解析 该有机物分子中含有苯环,为芳香族化合物,所以A正确。分子中连有醇羟基的碳原子的相邻碳原子上有氢原子,可发生消去反应;含有醇羟基和羧基,可发生酯化反应;含有羰基和苯环,可以发生还原反应;没有能发生水解反应的官能团,不能发生水解反应,所以B正确。1个分子中含有2个酚羟基和1个羧基,则1 mol 该有机物与足量Na2CO3溶液反应,消耗3 mol Na2CO3,故C错误。分子中含有的醇羟基、酚羟基和羧基,可与金属Na反应;酚羟基和羧基可与NaOH溶液反应;羧基可与NaHCO3溶液反应,所以D正确。
【变式设问】
(1)1 mol 该有机物分别与金属Na、NaOH溶液、NaHCO3溶液反应消耗Na、NaOH、NaHCO3的物质的量之比是多少
(2)1 mol 该有机物与足量H2发生加成反应反应,最多消耗H2的物质的量为多少
提示 5∶3∶1。
提示 8 mol 。1 mol 该有机物中含有2 mol 苯环和2 mol 羰基,一定条件下均可与H2发生加成反应。
归纳总结 羟基氢活泼性的比较注意事项
(1)羧酸是比H2CO3酸性强的酸,但不同的羧酸酸性也不相同。酸性关系:甲酸>苯甲酸>乙酸>丙酸。
(2)酚羟基和羧基都能与碳酸钠溶液反应,但是酚羟基与碳酸钠反应不会产生CO2,而是生成NaHCO3。
(3)酚羟基不能与NaHCO3反应,若一种有机物能与碳酸氢钠溶液反应产生CO2气体,一般可说明该有机物分子中含有羧基。
探究二 酯化反应和酯的水解
情境探究
早在汉代,人们已懂得酿造和食用醋。如今的山西陈醋和镇江香醋是我国传统食醋的名品,各具风味,蜚声宇内。
醋酸在生活中有很多应用。
1.用食醋浸泡有水垢(主要成分为CaCO3)的暖瓶,可以清除其中的水垢。清除水垢利用了醋酸的什么性质 通过这个事实你能比较出醋酸与碳酸的酸性强弱吗 写出清除水垢的化学方程式。
提示 利用食醋清除水垢是利用了醋酸的酸性,该反应的发生可以说明CH3COOH的酸性比H2CO3的酸性强,化学方程式为2CH3COOH+CaCO3→(CH3COO)2Ca+H2O+CO2↑。
2.厨师炒菜时为了增加菜的香味,常常加入食醋和白酒,你能解释其中的原理吗
提示 食醋中的乙酸和白酒中的乙醇在炒菜时发生反应生成具有香味的乙酸乙酯。
3.乙二酸与乙二醇可以发生酯化反应,生成多种不同结构的酯,如环酯、高分子酯等。写出形成的最小环酯的结构简式。写出形成高分子酯的化学方程式。
方法突破
1.酯化反应的基本类型
(1)生成链状酯。
①一元酸与一元醇的反应:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O。
②一元酸与二元醇或二元酸与一元醇的反应:
③无机含氧酸与醇形成无机酸酯:
(2)生成环酯。
①多元醇与多元羧酸进行分子间脱水形成环酯:
反应生成环酯时,五元环和六元环最容易生成
②羟基酸分子间脱水形成环酯:
③羟基酸分子内脱水形成环酯:
(3)形成聚酯。
①羟基酸缩聚:
②二元酸与二元醇缩聚:
2.乙酸乙酯的制备与性质
(1)制备实验。
实验 操作
实验 现象 饱和碳酸钠溶液的液面上有无色透明的不溶于水的油状液体产生,可闻到香味
有关化学 方程式
(2)性质实验。
实验 操作
实验 现象 A试管较长时间内酯层厚度基本不变,乙酸乙酯气味很浓;B试管酯层厚度减小,略有乙酸乙酯的气味;C试管酯层基本消失,无乙酸乙酯的气味
实验 结论 乙酸乙酯在中性条件下基本不水解;酸性条件下部分水解;碱性条件下全部水解
(3)酯水解反应的方程式。
①酸性条件下水解:
RCOOR'+H2O RCOOH+R'OH
②碱性条件下水解:
RCOOR'+NaOH RCOONa+R'OH
③若为酚形成的酯,碱性条件下水解得到的酚也可与NaOH中和,如
应用体验
视角1酯化反应实验
1.下列制取乙酸乙酯的实验能达到实验目的的是( )
A.装置甲:混合乙醇与浓硫酸
B.装置乙:制取乙酸乙酯
C.装置丙:分离乙酸乙酯和水层
D.装置丁:分离乙酸乙酯和乙醇
C
解析 混合乙醇与浓硫酸时应将浓硫酸缓慢注入乙醇中并不断搅拌,A项错误;收集乙酸乙酯时不能用饱和氢氧化钠溶液,因其碱性太强会使乙酸乙酯水解,B项错误;酯的密度比水小,且难溶于水,采用分液的方法分离,水层在下层,有机层在上层,C项正确;蒸馏分离乙酸乙酯和乙醇时温度计的水银球应处于蒸馏烧瓶支管口处,D项错误。
2.[2023河北石家庄高二阶段练习]某课外兴趣小组欲在实验室里制备少量乙酸乙酯,设计了如图所示装置(夹持装置已略去),下列说法不正确的是
( )
A.该装置中冷凝水的流向为b进a出
B.加入过量乙醇可提高乙酸的转化率
C.该反应可能生成副产物乙醚
D.收集到的馏分需用饱和NaOH溶液除去杂质
D
解析 为了使冷凝管中充满水且增强冷凝效果,冷凝水和被冷凝的液体逆向流动,故该装置中冷凝水的流向为b进a出,A正确;乙酸与乙醇在浓硫酸、加热条件下发生的酯化反应为可逆反应,加入过量乙醇,平衡正向移动,可提高乙酸的转化率,B正确;该反应可能生成副产物乙醚(乙醇发生分子间脱水反应),C正确;因为在NaOH溶液中乙酸乙酯会发生水解反应,所以收集到的馏分不能用饱和NaOH溶液分离杂质,应该用饱和碳酸钠溶液除去杂质,D错误。
视角2酯化反应的应用
3.[2023河北邯郸高二期中]脱落酸是一种抑制植物生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示。下列有关脱落酸的说法错误的是( )
A.存在芳香族同分异构体
B.可发生分子内酯化反应
C.1 mol脱落酸与足量金属钠反应可得到22.4 L H2
D.与HBr加成生成一溴代物时,最多可得到6种一溴代物
C
解析 脱落酸分子存在6个不饱和度,而苯环有4个不饱和度,故可存在芳香族同分异构体,A正确;分子中含有羟基、羧基,可发生分子内酯化反应,B正确;1 mol脱落酸与足量Na反应可得到1 mol H2,由于没有明确温度和压强,因此无法确定H2的体积是多少,C错误;1个脱落酸分子中有3个碳碳双键,每个碳碳双键和HBr加成生成一溴代物时可得两种产物,故其一溴代物最多有6种,D正确。
4.有机物A的结构简式为
据此回答下列问题:
(1)A的分子式为 。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简
式为 。
C12H14O5
2
本 课 结 束
