3.2 水的电离与溶液的pH 同步检验 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2 水的电离与溶液的pH 同步检验 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 334.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 15:08:20 | ||
图片预览


文档简介
3.2 水的电离与溶液的ph 同步检验
一、单选题
1.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)的溶液
C.使酚酞呈无色的溶液 D.盐的溶液
2.物质的量浓度相同的下列物质的水溶液,酸性最强的是( )
A.HCl B.H2SO4 C.CH3COOH D.NaCl
3.在25 ℃时,已知:①NaOH溶液、②NH4Cl溶液、③NaCl溶液、④Na2CO3溶液,相同物质的量浓度的上述溶液按pH减小排序正确的是( )
A.④③②① B.①④③②
C.①②④③ D.①②③④
4.25 ℃时,水的电离达到平衡:H2O H++OH-;ΔH > 0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中通入HCl气体,pH值减小,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大
D.将水加热,KW增大,pH不变
5.对常温下 的 溶液,下列叙述错误的是( )
A.
B.加入少量 固体后, 降低
C.该溶液中由 电离出的 是
D.与等体积 的 溶液混合后所得溶液显酸性
6.常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙变红的溶液: 、 , 、
B. =0.1mol/L的溶液: 、 , 、
C.含有大量 的溶液中: 、 、 、
D.由水电离产生的 的溶液: 、 、 、
7.在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( )
A.9.3 B.9.7 C.10 D.10.7
8.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c( ):c(H+)约为( )
A.1:1 B.1:2 C.1:10 D.10:1
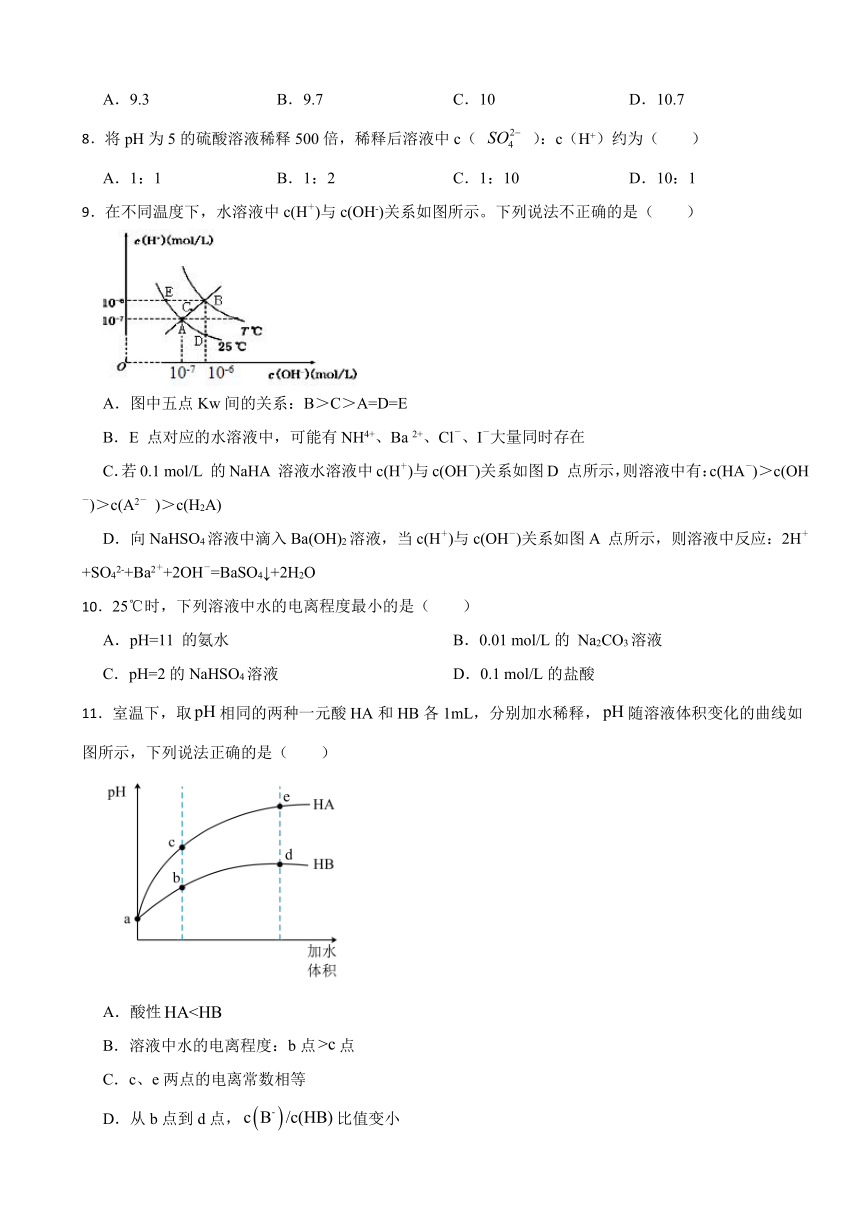
9.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
10.25℃时,下列溶液中水的电离程度最小的是( )
A.pH=11 的氨水 B.0.01 mol/L的 Na2CO3溶液
C.pH=2的NaHSO4溶液 D.0.1 mol/L的盐酸
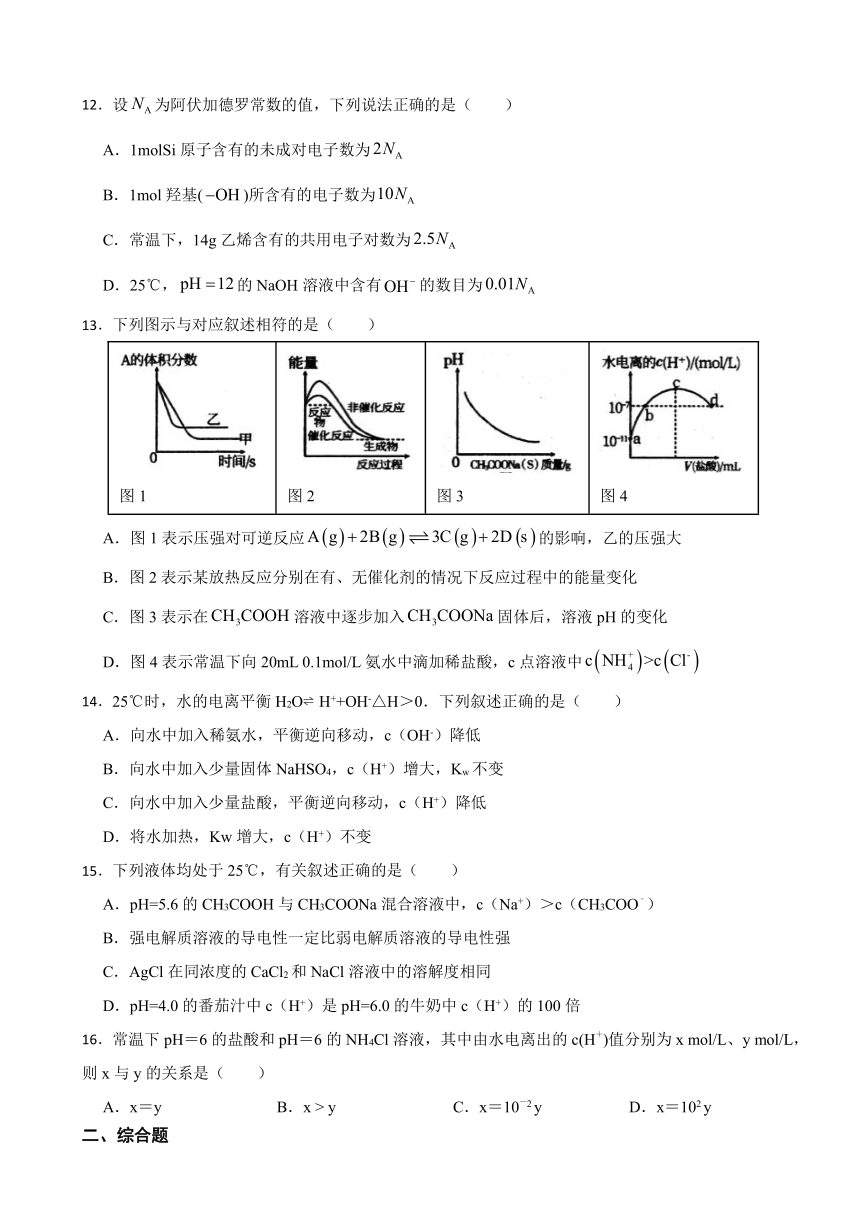
11.室温下,取相同的两种一元酸HA和HB各1mL,分别加水稀释,随溶液体积变化的曲线如图所示,下列说法正确的是( )
A.酸性
B.溶液中水的电离程度:b点点
C.c、e两点的电离常数相等
D.从b点到d点,比值变小
12.设为阿伏加德罗常数的值,下列说法正确的是( )
A.1molSi原子含有的未成对电子数为
B.1mol羟基()所含有的电子数为
C.常温下,14g乙烯含有的共用电子对数为
D.25℃,的NaOH溶液中含有的数目为
13.下列图示与对应叙述相符的是( )
图1 图2 图3 图4
A.图1表示压强对可逆反应的影响,乙的压强大
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示在溶液中逐步加入固体后,溶液pH的变化
D.图4表示常温下向20mL 0.1mol/L氨水中滴加稀盐酸,c点溶液中
14.25℃时,水的电离平衡H2O H++OH-△H>0.下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体NaHSO4,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变
15.下列液体均处于25℃,有关叙述正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO﹣)
B.强电解质溶液的导电性一定比弱电解质溶液的导电性强
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍
16.常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)值分别为x mol/L、y mol/L,则x与y的关系是( )
A.x=y B.x > y C.x=10-2 y D.x=102 y
二、综合题
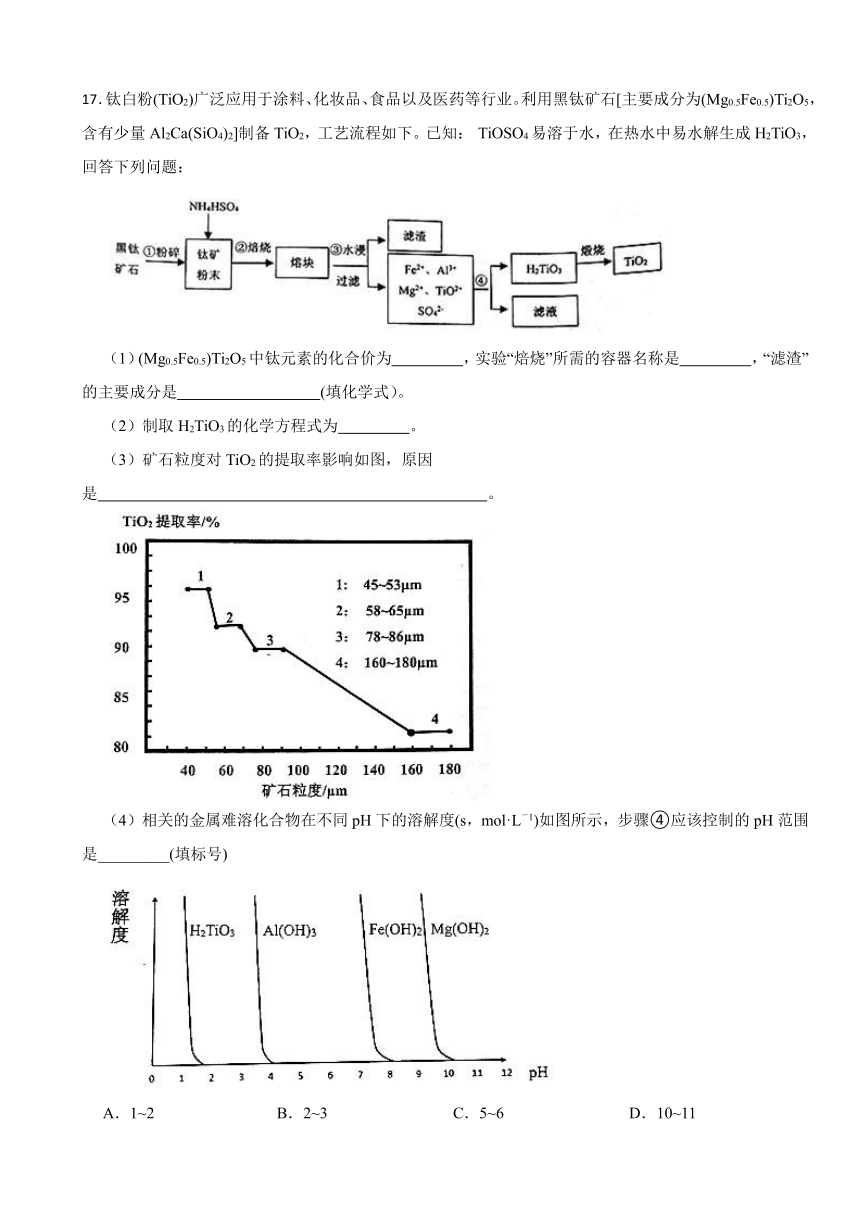
17.钛白粉(TiO2)广泛应用于涂料、化妆品、食品以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下。已知: TiOSO4易溶于水,在热水中易水解生成H2TiO3,回答下列问题:
(1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为 ,实验“焙烧”所需的容器名称是 ,“滤渣”的主要成分是 (填化学式)。
(2)制取H2TiO3的化学方程式为 。
(3)矿石粒度对TiO2的提取率影响如图,原因是 。
(4)相关的金属难溶化合物在不同pH下的溶解度(s,mol·L-1)如图所示,步骤④应该控制的pH范围是_________(填标号)
A.1~2 B.2~3 C.5~6 D.10~11
(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量酸溶解ag二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100mL,取20.00mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+
①滴定终点的现象为 。
②滴定终点时消耗bmol·L-1NH4Fe(SO4)2溶液VmL,则TiO2纯度为 。 (写表达式)
18.某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是: 。
(3)如下图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L。
滴定次数 待测体积(mL) 标准烧碱体积(mL)
滴定前读数 滴定后读数
第一次 20.00 0.40 20.40
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
19.碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)常温常压下,溶于水达到平衡时,溶液的,。若忽略水的电离及的第二级电离,则碳酸的第一级电离的平衡常数= (已知,结果保留1位小数)。
(2)已知的第二级电离常数,的电离常数,写出下列所发生反应的离子方程式:
a.与按物质的量之比1:1恰好反应: 。
b.少量通入过量的溶液中: 。
(3)人体血液里主要通过碳酸氢盐缓冲体系维持稳定。已知正常人体血液在正常体温时,的一级电离常数,,。由上述数据可计算正常人体血液的约为 ,当过量的碱进入血液中时,血液缓冲体系中的值将 (填“变大”、“变小”或“不变”)。
(4)在常温下向二氧化碳水溶液中滴加溶液,所得溶液的与粒子浓度的变化关系如图。则图中 (填“I”或“II”)线表示,碳酸的两级电离常数与的关系为= (用含m、n的式子表示)。
20.根据问题填空:
(1)有溶质的物质的量浓度均为0.2mol L﹣1的下列八种溶液①HCl ②H2SO4③HClO ④Ba(OH)2⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl.这些溶液的pH由小到大的顺序是(填写序号) .
(2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有 、 .用离子方程式表示产生上述现象的原因 .
(3)在饱和FeCl3溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是 (填序号).
A.铁 B.铜 C.镁 D.硫.
21.回答下列问题:
(1)不同温度下水的离子积为25℃:1×10-14;t1:a;t2:1×10-12。试回答以下问题:
①若25<t1<t2,则a 1×10-14(填“>”“<”或“=”),做此判断的理由是 。
②25℃时,某Na2SO4溶液中c(SO)=5×10-4mol L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
③在t2温度下测得某溶液pH=7,该溶液显 (填“酸”“碱”或“中”)性。
(2)在一定温度下,有a.醋酸,b.硫酸,c.盐酸三种酸。
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是 (用a、b、c表示,下同)。
②将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
答案解析部分
1.【答案】B
【解析】【解答】A.pH =7的溶液,不一定是常温下,水的离子积不一定是KW= 1×10-14,溶液中c(H+)、c(OH-)不一定相等,A项不符合题意;
B.溶液呈酸碱性本质取决于溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度等于氢氧根离子浓度,溶液一定显示中性,B项符合题意;
C.酚酞显示无色,溶液有可能显示酸性,C项不符合题意;
D.酸式盐中的硫酸氢钠显酸性,碳酸钠显碱性,D项不符合题意;
故答案为:B。
【分析】A、没有标明温度;
B、氢离子和氢氧根浓度相等,为中性溶液;
C、酚酞无色的范围在常温下pH小于8.2;
D、含有弱离子的盐会发生水解,可能呈酸性或者中性、碱性。
2.【答案】B
【解析】【解答】硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,氯化钠显中性..
故答案为:B
【分析】相同物质的量浓度情况下,氢离子的浓度越大,酸性越强,据此解答即可.
3.【答案】B
【解析】【解答】①NaOH是一元强碱,其溶液碱性最强;②NH4Cl溶液中铵根水解,溶液显酸性;③NaCl是强酸强碱盐,不水解,溶液显中性;④Na2CO3溶液中碳酸根水解,溶液显碱性,但要弱于氢氧化钠溶液的碱性,所以相同物质的量浓度的上述溶液按pH减小排序顺序为①④③②,
故答案为:B。
【分析】氢氧化钠属于一元强碱,完全电离;氯化铵属于强酸弱碱盐,溶液显弱酸性;氯化钠属于强酸强碱,溶液显中性;碳酸钠属于强碱弱酸盐,溶液显弱碱性;
4.【答案】B
【解析】【解答】A、向水中加入稀氨水,氢氧根浓度增大,平衡逆向移动,最终平衡后c(OH-)增大,A不符合题意;
B、向水中通入HCl气体,氢离子浓度增大,pH值减小,温度不变,KW不变,B符合题意;
C、向水中加入少量固体CH3COONa,醋酸根水解,平衡正向移动,c(H+)降低,C不符合题意;
D、将水加热促进电离,KW增大,氢离子浓度增大,pH降低,D不符合题意,
故答案为:B。
【分析】A、加入氨水,使溶液中水的c(OH-)增大,水电离的c(OH-)变小,平衡逆向移动,但是加入的氨水使c(OH-)的浓度变大;
B、向水中通入HCl,形成盐酸溶液,增大了溶液中的c(H+),pH降低;
C、醋酸跟在溶液中会发生水解,消耗水电离的H+,促进水的电离向正方向移动;
D、Kw随着温度的增大而增大,加热促进水的电离,pH降低;
5.【答案】B
【解析】【解答】A.醋酸溶液中遵循电荷守恒,则c(H+)=c(CH3COO-)+c(OH-),故A不符合题意;
B.加入少量CH3COONa固体后,c(CH3COO-)增大,故B符合题意;
C.常温下Kw=10-14,醋酸电离的c(H+)=10-3mol/L,由水电离的氢离子与氢氧根离子浓度相同,均为 mol/L =1.0×10-11 mol/L,故C不符合题意;
D.醋酸浓度大于10-3mol/L,NaOH浓度为10-3mol/L,等体积混合时醋酸过量,则混合后所得溶液显酸性,故D不符合题意;
故答案为:B。
【分析】A、根据溶液中电荷守恒解答:阳离子的电荷量=阴离子的电荷量;
B、加入少量醋酸钠固体后,溶液中的醋酸跟浓度增大,抑制醋酸的电离,但最终结果溶液中的醋酸跟浓度变大;
C、常温下Kw=10-14,pH=3的醋酸溶液中c(H+)=10-3mol/L,水电离的氢离子与氢氧根离子浓度相同c(OH-)=10-11mol/L;
D、醋酸属于弱酸,氢氧化钠属于强碱,pH相同时,两种溶液中和,醋酸过量;
6.【答案】B
【解析】【解答】A.使甲基橙变红的溶液显酸性,亚硫酸根为弱酸根,不能大量存在,故A不符合题意;
B. =0.1mol/L的溶液显碱性,碱性溶液中四种离子相互之间不反应,也不与氢氧根反应,可以大量共存,故B符合题意;
C.偏铝酸根会和碳酸氢根反应生成氢氧化铝沉淀和碳酸根,不能大量共存,故C不符合题意;
D.由水电离产生的 的溶液中,水的电离受到抑制,可能是酸性溶液,也可能是碱性溶液,酸性溶液中硝酸根会将亚铁离子氧化,碱性溶液中亚铁离子会生成沉淀,故D不符合题意;
故答案为:B。
【分析】 离子不能共存,说明可以发生化学反应,主要是发生复分解反应、氧化还原反应、络合反应等等
常见发生复分解反应不能共存的是:氢离子与氢氧根离子、以及可以形成弱电解质的阴离子,氢氧根与氢离子、碳酸氢根、亚硫酸氢根、铜离子、铁离子、镁离子等不同共存,银离子和氯离子,钡离子和碳酸根、硫酸根、钙离子和碳酸根
发生氧化还原反应不能共存的是:氢离子、硝酸根以及次氯酸根以及高锰酸根和亚铁离子、硫离子等还原性离子
发生络合不能共存的是:铁离子和硫氰酸根、铜离子和氨水等等
7.【答案】D
【解析】【解答】解:常温下pH=9的NaOH溶液中c(OH﹣)=1×10﹣5mol/L,pH=11的NaOH溶液中c(OH﹣)=1×10﹣3mol/L,
混合液中氢氧根离子浓度为:c(OH﹣)= {#mathmL#}{#/mathmL#} mol/L≈ {#mathmL#}{#/mathmL#} mol/L,
则混合液中的c(H+)= {#mathmL#}{#/mathmL#} = {#mathmL#}{#/mathmL#} mol/L=2.0×10﹣11mol/L,
所以混合液的pH=﹣lg2.0×10﹣11=11﹣lg2=10.7,
故选D.
【分析】两种碱溶液混合,先计算出混合后溶液中的c(OH﹣),再根据常温下水的离子积计算出溶液的c(H+),然后根据pH=﹣lgc(H+)计算混合液的pH.
8.【答案】C
【解析】【解答】解:pH为5的溶液中氢离子浓度为:c(H+)=1×10﹣5mol/L,硫酸根离子的浓度为:c(SO42﹣)=5×10﹣6mol/L;
溶液稀释500倍后,氢离子浓度不可能小于1×10﹣7mol/L,只能无限接近1×10﹣7mol/L,而硫酸根离子浓度为:c(SO42﹣)=1×10﹣8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10﹣8mol/L:1×10﹣7mol/L=1:10,
故选C.
【分析】稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42﹣与H+浓度的比值约为1:10.
9.【答案】C
【解析】【解答】A、温度相同Kw相同,温度越高Kw越大,所以图中五点Kw间的关系:B>C>A=D=E,A不符合题意;
B、E点对应的溶液呈酸性,NH4+、Ba2+、Cl-、I-不反应,能大量同时存在,B不符合题意;
C、D 点对应的溶液呈碱性,说明HA-水解大于电离,c(HA-)>c(OH-)>c(H2A)>c(A2-),C符合题意;
D、A 点对应的溶液呈中性,向NaHSO4溶液中滴入Ba(OH)2溶液的关系为2:1,则溶液中反应:2H+ + SO42- + Ba2+ + 2OH- =BaSO4↓+ 2H2O,D不符合题意。答案选C。
【分析】根据水的离子积常数与温度的关系分析溶液中离子浓度的相对大小关系和发生的离子反应方程式.
10.【答案】D
【解析】【解答】氨水、盐酸和NaHSO4溶液均抑制水的电离,Na2CO3溶液促进水的电离,pH=11的氨水c(H+)=10-11mol·L-1,c(OH-)=10-3mol·L-1;0.1 mol·L-1的盐酸中c(H+)=10-1mol·L-1,pH=2 的NaHSO4溶液中c(H+)=10-2mol·L-1,酸溶液和强酸酸式盐溶液中氢离子或碱溶液中氢氧根离子浓度越大,抑制水的电离程度越大,溶液中水的电离程度越小,所以水的电离程度最小的是0.1 mol·L-1的盐酸,
故答案为:D。
【分析】酸或碱抑制水的电离,弱酸强碱盐和强酸弱碱盐促进水的电离。
11.【答案】C
【解析】【解答】A.根据分析可知HB的电离程度小于HA,则酸性HA>HB,A不符合题意;
B.b点和c点相比,pH更小,则溶液中酸电离出的氢离子浓度更大,对水电离的抑制作用越强烈,则溶液中水的电离程度b点C.HA的电离常数只与温度有关,温度不变的情况下,电离常数不变,则c、e两点的电离常数相等,C符合题意;
D.,从b点到d点,K值保持不变,c(H+)减小,则增大,D不符合题意;
故答案为:C。
【分析】A.酸性越强,稀释过程中pH变化越大;
B.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
D.根据分析。
12.【答案】A
【解析】【解答】A.Si原子中有2个未成对电子,1molSi原子含有的未成对电子数为,故A符合题意;
B.含有9个电子,1mol羟基()所含有的电子数为,故B不符合题意;
C.1个乙烯分子中含有6个共价键,常温下,14g乙烯含有的共用电子对数为,故C不符合题意;
D.25℃,的NaOH溶液,没有明确溶液体积不能计算的数目,故D不符合题意;
故答案为:A。
【分析】A.Si原子的价层电子数为3s23p2,有2个未成对电子,结合N=n·NA进行分析。
B.1个羟基中含有9个电子,结合N=n·NA进行分析。
C.1个乙烯分子中含有6对共用电子对,结合m=nM和N=n·NA进行分析。
D.溶液体积未知,无法计算物质的量。
13.【答案】B
【解析】【解答】A.该反应是气体体积不变的反应,压强对本反应无影响,图示与对应叙述不相符,A项不符合题意;
B.反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,图示与对应叙述相符,B项符合题意;
C.在溶液中逐步加入固体后,溶液pH应该增大,图示与对应叙述不相符,C项不符合题意;
D.c点是水电离程度最大的点,此时溶液中仅为氯化铵,铵根离子会水解,浓度减小,故铵根离子浓度小于氯离子浓度,D项不符合题意;
故答案为:B。
【分析】A.反应是气体体积不变的反应,压强对本反应无影响;
B.催化剂会降低活化能,改变反应的速率,但反应热不改变;
C.依据盐类水解规律分析;
D.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离;
14.【答案】B
【解析】【解答】A.向纯水中加稀氨水,平衡逆向移动,c(H+)减小,新平衡时c(OH-)比原平衡时大,A项不符合题意;
B. 向水中加入少量固体NaHSO4,溶液体积不变。NaHSO4电离产生H+,使平衡向左移动,新平衡时c(H+)比原平衡时大。因温度不变,故Kw不变。B项符合题意;
C.向水中加入少量盐酸,平衡逆向移动,新平衡时c(H+)比原平衡时大。C项不符合题意;
D. 将水加热,水的电离平衡向右移动,c(H+)、c(OH-)都变大,Kw也增大。D项不符合题意。
故答案为:B。
【分析】A.水中加入稀氨水,碱性增强;
B.硫酸氢钠溶液呈酸性,水的离子积常数只是温度的函数;
C.水中加入盐酸后酸性增强;
D.加热促进水的电离,水的离子积常数变大。
15.【答案】D
【解析】【解答】解:A、pH=5.6,则c(OH )<c(H+),根据电荷守恒可知:c(CH3COO )+c(OH )=c(H+)+c(Na+),则有c(Na+)<c(CH3COO﹣),故A错误;
B、溶液的导电性取决于离子浓度大小,和电解质的强弱无关,故B错误;
C、同浓度的CaCl2和NaCl溶液中氯离子浓度不同,前者是后者的2倍,故对氯化银的溶解的抑制前者更大,则氯化银在CaCl2溶液中的溶解度更小,故C错误;
D、c(H+)=10﹣pH,故pH=4的番茄汁中氢离子浓度为10﹣4mol/L,pH=6的牛奶中氢离子浓度为10﹣6mol/L,故前者是后者的100倍,故D正确.
故选D.
【分析】A、pH=5.6,则c(OH )<c(H+),根据电荷守恒来分析;
B、溶液的导电性取决于离子浓度大小;
C、同浓度的CaCl2和NaCl溶液中氯离子浓度不同;
D、c(H+)=10﹣pH.
16.【答案】C
【解析】【解答】pH=6的盐酸,由水电离出的c(H+)=c(OH-)值为x=10-14/10-6=10-8mol/L,pH=6的NH4Cl溶液由水电离出的c(H+) y=10-6mol/L ,故x=10-2 y,选项C符合题意。
【分析】盐酸中的氢氧根离子浓度等于水电离出的氢离子浓度,氯化铵溶液中氢离子浓度等于氢氧根离子浓度即为水电离出的氢离子浓度,据此解答即可。
17.【答案】(1)+4;坩埚;CaSO4和CaSiO3
(2)
(3)矿石粒度越小,反应接触面积越大,反应速率越快
(4)B
(5)当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;
【解析】【解答】(1)设Ti的化合价为+x,(Mg0.5Fe0.5)Ti2O5化合价代数和等于0,(2×0.5+2×0.5)+2x-2×5=0,x=4;灼烧固体用坩埚;黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]加入NH4HSO4焙烧后,加水过滤,沉淀中含有CaSO4和CaSiO3;(2)由TiOSO4水解制备H2TiO3,反应方程式为: ;(3)由图中变量结合影响反应的速率、转化率的因素,矿石粒度对TiO2的提取率影响,原因是矿石粒度越小,反应接触面积越大,反应速率越快;(4)由图读出:金属难溶化合物在不同pH下的溶解度(s,mol·L-1),步骤④应该控制的pH范围是:钛酸沉淀pH大于2,而氢氧化铝不沉淀,pH小于3,
故答案为:B;(5)①铁离子过量时,反应结束,故终点现象为:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=bmol·L-1×V×10-3L×100mL/20mL=5bV×10-3mol,TiO2纯度为 = 。
【分析】(1)根据化合物的化合价之和为0可以计算出钛的化合价;固体灼烧实验采取的仪器是坩埚;铵根和铝离子水解后,滤渣中还有硅酸钙和硫酸钙;
(2)TiOSO4在加热的条件水解为H2TiO3和H2SO4;
(3)有固体参与的化学反应中,固体的接触面积越大,反应的速率就越快;
(4)步骤④主要是获取H2TiO3而不获取Al(OH)3,因此用调节pH值在2~3 之间;
(5)NH4SCN会与铁离子发生络合反应,生成血红色的络合物,因此反应的终点为:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;
根据氧化还原反应的方程式可以计算出TiO2的物质的量,继而求出其纯度。
18.【答案】(1)①;偏大
(2)无色变为粉红,半分钟内不变色
(3))22.60
(4)0.2000
【解析】【解答】(1)碱式滴定管在装液前应用待装液进行润洗,否则标准液的浓度偏小,滴定结果会偏高;
(2)当滴入最后一滴NaOH溶液,溶液由无色变为粉红色,且半分钟内不褪色,即为终点;
(3)滴定管中的液面读数为22.60mL;
(4)三次滴定消耗的体积为:20.00mL,19.80mL,20.20.08,数据均有效,则平均消耗V(NaOH)=20.00mL,c(待测)=═0.2000mol/L。
【分析】(1)盛装标准溶液的滴定管必须用标准溶液润洗,否则结果偏大;
(2)根据f酚酞溶液与碱反应的现象进行分析;
(3)根据滴定管的读数方法进行判断;
(4)根据酸碱中和进行计算。
19.【答案】(1)
(2);
(3)7.4;变大
(4)II;
【解析】【解答】(1)溶液的pH=5.60,则c(H+)=10-5.6mol/L=2.5×10-6mol/L,若忽略水的电离及H2CO3的第二级电离,该溶液中c(HCO)=c(H+)=2.5×10-6mol/L,c(H2CO3)为1.5×10-5 mol L-1,则H2CO3 HCO3-+H+的平衡常数K1===4.2×10-7;
(2)根据电离平衡常数大小关系可知酸性H2CO3>HClO> ,HCl为强酸;
a.少量Cl2通入到过量的Na2CO3溶液中,氯气和水反应生成少量的HCl、HClO,酸性越强结合氢离子的能力越弱,而氢离子少量,所以只有碳酸根结合氢离子生成碳酸氢根,最终的产物为氯化钠、次氯酸钠、碳酸氢钠,所以离子方程式为;
b.由于酸性H2CO3>HClO> HCO,根据强酸可以制弱酸可知:少量CO2通入过量的NaClO溶液中生成碳酸氢钠和次氯酸,离子方程式为;
(3)K1=,≈,所以c(H+)=,则pH=-lg=7.4;当过量的碱进入血液中时,氢氧根离子增大,氢离子浓度减小,而温度不变则K1不变,所以变大;
(4)K1=、K2=,K1 K2,当、相同时,K1表示的酸性更强,故II表示;由图可知K1==10-n、K2==10-m ,则。
【分析】(1)根据Ka1=计算;
(2)电离平衡常数越大,酸性越强,根据强酸制弱酸原理分析;
(3)根据pH=-lgc(H+)计算;当过量的碱进入血液中时,氢氧根离子增大,氢离子浓度减小,同时温度不变,平衡常数不变;
(4)Ka1==10-n、Ka2==10-m 。
20.【答案】(1)②①③⑧⑦⑥⑤④
(2)有无色无味气体生成;溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O
(3)A;C
【解析】【解答】解:(1)溶质的物质的量浓度均为0.2mol/L的下列八种溶液.
酸性溶液:①HCl为一元强酸;②H2SO4为二元强酸;③HClO为一元弱酸;⑧NH4Cl溶液中,铵根离子水解,溶液显示酸性;溶液的pH:②<①<③<⑧,
碱性溶液:④Ba(OH)2为二元强碱;⑤KOH为一元强碱;⑥NaF为强碱弱酸盐,溶液显示碱性;溶液的pH:⑥<⑤<④;⑦KCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由小到大的排列顺序是:②①③⑧⑦⑥⑤④,
故答案为:②①③⑧⑦⑥⑤④;(2)氯化铁水解呈酸性,Fe3++3H2O Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;故答案为:①有无色无味气体生成; ②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O; 在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中D是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和铁与溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:AC.
【分析】(1)酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小;(2)氯化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成,以此解答;(3)饱和氯化铁溶液中存在Fe3++3H2O Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气.
21.【答案】(1)>;温度升高,水的电离程度增大,水的离子积增大;1000∶1;碱
(2)a>c>b;a>b=c
【解析】【解答】(1)①水是弱电解质,存在电离平衡,电离吸热,所以温度升高,水的电离程度增大,水的离子积增大;
②25℃时,某Na2SO4溶液中c()=5×10-4mol L-1,则溶液中钠离子浓度是1×10-3mol L-1,如果稀释10倍,则钠离子浓度是1×10-4mol L-1,但硫酸钠溶液是显中性的,所以c(Na+)∶c(OH-)=10-4∶10-7=1000∶1;
③t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的,因此某溶液pH=7,则该溶液显碱性;
(2)①盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,所以当三种酸物质的量浓度相等时,溶液中c(H+)由大到小的顺序是b>c>a,氢离子浓度越大,水的电离程度越小,三种溶液中水的电离程度由大到小的顺序为a>c>b;
②醋酸在稀释过程中会促进电离,所以氢离子的物质的量增加,氢离子的浓度变化程度小,硫酸和盐酸溶液中氢离子物质的量不变且相等,所以c(H+)由大到小的顺序为a>b=c。
【分析】(1)①水的电离过程吸收热量;
②硫酸钠溶液始终呈中性;
③t2温度下水的离子积常数为1×10-12;
(2)①酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
②稀释促进醋酸的电离。
一、单选题
1.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)的溶液
C.使酚酞呈无色的溶液 D.盐的溶液
2.物质的量浓度相同的下列物质的水溶液,酸性最强的是( )
A.HCl B.H2SO4 C.CH3COOH D.NaCl
3.在25 ℃时,已知:①NaOH溶液、②NH4Cl溶液、③NaCl溶液、④Na2CO3溶液,相同物质的量浓度的上述溶液按pH减小排序正确的是( )
A.④③②① B.①④③②
C.①②④③ D.①②③④
4.25 ℃时,水的电离达到平衡:H2O H++OH-;ΔH > 0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中通入HCl气体,pH值减小,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大
D.将水加热,KW增大,pH不变
5.对常温下 的 溶液,下列叙述错误的是( )
A.
B.加入少量 固体后, 降低
C.该溶液中由 电离出的 是
D.与等体积 的 溶液混合后所得溶液显酸性
6.常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙变红的溶液: 、 , 、
B. =0.1mol/L的溶液: 、 , 、
C.含有大量 的溶液中: 、 、 、
D.由水电离产生的 的溶液: 、 、 、
7.在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( )
A.9.3 B.9.7 C.10 D.10.7
8.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c( ):c(H+)约为( )
A.1:1 B.1:2 C.1:10 D.10:1
9.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
10.25℃时,下列溶液中水的电离程度最小的是( )
A.pH=11 的氨水 B.0.01 mol/L的 Na2CO3溶液
C.pH=2的NaHSO4溶液 D.0.1 mol/L的盐酸
11.室温下,取相同的两种一元酸HA和HB各1mL,分别加水稀释,随溶液体积变化的曲线如图所示,下列说法正确的是( )
A.酸性
B.溶液中水的电离程度:b点点
C.c、e两点的电离常数相等
D.从b点到d点,比值变小
12.设为阿伏加德罗常数的值,下列说法正确的是( )
A.1molSi原子含有的未成对电子数为
B.1mol羟基()所含有的电子数为
C.常温下,14g乙烯含有的共用电子对数为
D.25℃,的NaOH溶液中含有的数目为
13.下列图示与对应叙述相符的是( )
图1 图2 图3 图4
A.图1表示压强对可逆反应的影响,乙的压强大
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示在溶液中逐步加入固体后,溶液pH的变化
D.图4表示常温下向20mL 0.1mol/L氨水中滴加稀盐酸,c点溶液中
14.25℃时,水的电离平衡H2O H++OH-△H>0.下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体NaHSO4,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变
15.下列液体均处于25℃,有关叙述正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO﹣)
B.强电解质溶液的导电性一定比弱电解质溶液的导电性强
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍
16.常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)值分别为x mol/L、y mol/L,则x与y的关系是( )
A.x=y B.x > y C.x=10-2 y D.x=102 y
二、综合题
17.钛白粉(TiO2)广泛应用于涂料、化妆品、食品以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下。已知: TiOSO4易溶于水,在热水中易水解生成H2TiO3,回答下列问题:
(1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为 ,实验“焙烧”所需的容器名称是 ,“滤渣”的主要成分是 (填化学式)。
(2)制取H2TiO3的化学方程式为 。
(3)矿石粒度对TiO2的提取率影响如图,原因是 。
(4)相关的金属难溶化合物在不同pH下的溶解度(s,mol·L-1)如图所示,步骤④应该控制的pH范围是_________(填标号)
A.1~2 B.2~3 C.5~6 D.10~11
(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量酸溶解ag二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100mL,取20.00mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+
①滴定终点的现象为 。
②滴定终点时消耗bmol·L-1NH4Fe(SO4)2溶液VmL,则TiO2纯度为 。 (写表达式)
18.某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是: 。
(3)如下图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L。
滴定次数 待测体积(mL) 标准烧碱体积(mL)
滴定前读数 滴定后读数
第一次 20.00 0.40 20.40
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
19.碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)常温常压下,溶于水达到平衡时,溶液的,。若忽略水的电离及的第二级电离,则碳酸的第一级电离的平衡常数= (已知,结果保留1位小数)。
(2)已知的第二级电离常数,的电离常数,写出下列所发生反应的离子方程式:
a.与按物质的量之比1:1恰好反应: 。
b.少量通入过量的溶液中: 。
(3)人体血液里主要通过碳酸氢盐缓冲体系维持稳定。已知正常人体血液在正常体温时,的一级电离常数,,。由上述数据可计算正常人体血液的约为 ,当过量的碱进入血液中时,血液缓冲体系中的值将 (填“变大”、“变小”或“不变”)。
(4)在常温下向二氧化碳水溶液中滴加溶液,所得溶液的与粒子浓度的变化关系如图。则图中 (填“I”或“II”)线表示,碳酸的两级电离常数与的关系为= (用含m、n的式子表示)。
20.根据问题填空:
(1)有溶质的物质的量浓度均为0.2mol L﹣1的下列八种溶液①HCl ②H2SO4③HClO ④Ba(OH)2⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl.这些溶液的pH由小到大的顺序是(填写序号) .
(2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有 、 .用离子方程式表示产生上述现象的原因 .
(3)在饱和FeCl3溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是 (填序号).
A.铁 B.铜 C.镁 D.硫.
21.回答下列问题:
(1)不同温度下水的离子积为25℃:1×10-14;t1:a;t2:1×10-12。试回答以下问题:
①若25<t1<t2,则a 1×10-14(填“>”“<”或“=”),做此判断的理由是 。
②25℃时,某Na2SO4溶液中c(SO)=5×10-4mol L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
③在t2温度下测得某溶液pH=7,该溶液显 (填“酸”“碱”或“中”)性。
(2)在一定温度下,有a.醋酸,b.硫酸,c.盐酸三种酸。
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是 (用a、b、c表示,下同)。
②将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
答案解析部分
1.【答案】B
【解析】【解答】A.pH =7的溶液,不一定是常温下,水的离子积不一定是KW= 1×10-14,溶液中c(H+)、c(OH-)不一定相等,A项不符合题意;
B.溶液呈酸碱性本质取决于溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度等于氢氧根离子浓度,溶液一定显示中性,B项符合题意;
C.酚酞显示无色,溶液有可能显示酸性,C项不符合题意;
D.酸式盐中的硫酸氢钠显酸性,碳酸钠显碱性,D项不符合题意;
故答案为:B。
【分析】A、没有标明温度;
B、氢离子和氢氧根浓度相等,为中性溶液;
C、酚酞无色的范围在常温下pH小于8.2;
D、含有弱离子的盐会发生水解,可能呈酸性或者中性、碱性。
2.【答案】B
【解析】【解答】硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,氯化钠显中性..
故答案为:B
【分析】相同物质的量浓度情况下,氢离子的浓度越大,酸性越强,据此解答即可.
3.【答案】B
【解析】【解答】①NaOH是一元强碱,其溶液碱性最强;②NH4Cl溶液中铵根水解,溶液显酸性;③NaCl是强酸强碱盐,不水解,溶液显中性;④Na2CO3溶液中碳酸根水解,溶液显碱性,但要弱于氢氧化钠溶液的碱性,所以相同物质的量浓度的上述溶液按pH减小排序顺序为①④③②,
故答案为:B。
【分析】氢氧化钠属于一元强碱,完全电离;氯化铵属于强酸弱碱盐,溶液显弱酸性;氯化钠属于强酸强碱,溶液显中性;碳酸钠属于强碱弱酸盐,溶液显弱碱性;
4.【答案】B
【解析】【解答】A、向水中加入稀氨水,氢氧根浓度增大,平衡逆向移动,最终平衡后c(OH-)增大,A不符合题意;
B、向水中通入HCl气体,氢离子浓度增大,pH值减小,温度不变,KW不变,B符合题意;
C、向水中加入少量固体CH3COONa,醋酸根水解,平衡正向移动,c(H+)降低,C不符合题意;
D、将水加热促进电离,KW增大,氢离子浓度增大,pH降低,D不符合题意,
故答案为:B。
【分析】A、加入氨水,使溶液中水的c(OH-)增大,水电离的c(OH-)变小,平衡逆向移动,但是加入的氨水使c(OH-)的浓度变大;
B、向水中通入HCl,形成盐酸溶液,增大了溶液中的c(H+),pH降低;
C、醋酸跟在溶液中会发生水解,消耗水电离的H+,促进水的电离向正方向移动;
D、Kw随着温度的增大而增大,加热促进水的电离,pH降低;
5.【答案】B
【解析】【解答】A.醋酸溶液中遵循电荷守恒,则c(H+)=c(CH3COO-)+c(OH-),故A不符合题意;
B.加入少量CH3COONa固体后,c(CH3COO-)增大,故B符合题意;
C.常温下Kw=10-14,醋酸电离的c(H+)=10-3mol/L,由水电离的氢离子与氢氧根离子浓度相同,均为 mol/L =1.0×10-11 mol/L,故C不符合题意;
D.醋酸浓度大于10-3mol/L,NaOH浓度为10-3mol/L,等体积混合时醋酸过量,则混合后所得溶液显酸性,故D不符合题意;
故答案为:B。
【分析】A、根据溶液中电荷守恒解答:阳离子的电荷量=阴离子的电荷量;
B、加入少量醋酸钠固体后,溶液中的醋酸跟浓度增大,抑制醋酸的电离,但最终结果溶液中的醋酸跟浓度变大;
C、常温下Kw=10-14,pH=3的醋酸溶液中c(H+)=10-3mol/L,水电离的氢离子与氢氧根离子浓度相同c(OH-)=10-11mol/L;
D、醋酸属于弱酸,氢氧化钠属于强碱,pH相同时,两种溶液中和,醋酸过量;
6.【答案】B
【解析】【解答】A.使甲基橙变红的溶液显酸性,亚硫酸根为弱酸根,不能大量存在,故A不符合题意;
B. =0.1mol/L的溶液显碱性,碱性溶液中四种离子相互之间不反应,也不与氢氧根反应,可以大量共存,故B符合题意;
C.偏铝酸根会和碳酸氢根反应生成氢氧化铝沉淀和碳酸根,不能大量共存,故C不符合题意;
D.由水电离产生的 的溶液中,水的电离受到抑制,可能是酸性溶液,也可能是碱性溶液,酸性溶液中硝酸根会将亚铁离子氧化,碱性溶液中亚铁离子会生成沉淀,故D不符合题意;
故答案为:B。
【分析】 离子不能共存,说明可以发生化学反应,主要是发生复分解反应、氧化还原反应、络合反应等等
常见发生复分解反应不能共存的是:氢离子与氢氧根离子、以及可以形成弱电解质的阴离子,氢氧根与氢离子、碳酸氢根、亚硫酸氢根、铜离子、铁离子、镁离子等不同共存,银离子和氯离子,钡离子和碳酸根、硫酸根、钙离子和碳酸根
发生氧化还原反应不能共存的是:氢离子、硝酸根以及次氯酸根以及高锰酸根和亚铁离子、硫离子等还原性离子
发生络合不能共存的是:铁离子和硫氰酸根、铜离子和氨水等等
7.【答案】D
【解析】【解答】解:常温下pH=9的NaOH溶液中c(OH﹣)=1×10﹣5mol/L,pH=11的NaOH溶液中c(OH﹣)=1×10﹣3mol/L,
混合液中氢氧根离子浓度为:c(OH﹣)= {#mathmL#}{#/mathmL#} mol/L≈ {#mathmL#}{#/mathmL#} mol/L,
则混合液中的c(H+)= {#mathmL#}{#/mathmL#} = {#mathmL#}{#/mathmL#} mol/L=2.0×10﹣11mol/L,
所以混合液的pH=﹣lg2.0×10﹣11=11﹣lg2=10.7,
故选D.
【分析】两种碱溶液混合,先计算出混合后溶液中的c(OH﹣),再根据常温下水的离子积计算出溶液的c(H+),然后根据pH=﹣lgc(H+)计算混合液的pH.
8.【答案】C
【解析】【解答】解:pH为5的溶液中氢离子浓度为:c(H+)=1×10﹣5mol/L,硫酸根离子的浓度为:c(SO42﹣)=5×10﹣6mol/L;
溶液稀释500倍后,氢离子浓度不可能小于1×10﹣7mol/L,只能无限接近1×10﹣7mol/L,而硫酸根离子浓度为:c(SO42﹣)=1×10﹣8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10﹣8mol/L:1×10﹣7mol/L=1:10,
故选C.
【分析】稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42﹣与H+浓度的比值约为1:10.
9.【答案】C
【解析】【解答】A、温度相同Kw相同,温度越高Kw越大,所以图中五点Kw间的关系:B>C>A=D=E,A不符合题意;
B、E点对应的溶液呈酸性,NH4+、Ba2+、Cl-、I-不反应,能大量同时存在,B不符合题意;
C、D 点对应的溶液呈碱性,说明HA-水解大于电离,c(HA-)>c(OH-)>c(H2A)>c(A2-),C符合题意;
D、A 点对应的溶液呈中性,向NaHSO4溶液中滴入Ba(OH)2溶液的关系为2:1,则溶液中反应:2H+ + SO42- + Ba2+ + 2OH- =BaSO4↓+ 2H2O,D不符合题意。答案选C。
【分析】根据水的离子积常数与温度的关系分析溶液中离子浓度的相对大小关系和发生的离子反应方程式.
10.【答案】D
【解析】【解答】氨水、盐酸和NaHSO4溶液均抑制水的电离,Na2CO3溶液促进水的电离,pH=11的氨水c(H+)=10-11mol·L-1,c(OH-)=10-3mol·L-1;0.1 mol·L-1的盐酸中c(H+)=10-1mol·L-1,pH=2 的NaHSO4溶液中c(H+)=10-2mol·L-1,酸溶液和强酸酸式盐溶液中氢离子或碱溶液中氢氧根离子浓度越大,抑制水的电离程度越大,溶液中水的电离程度越小,所以水的电离程度最小的是0.1 mol·L-1的盐酸,
故答案为:D。
【分析】酸或碱抑制水的电离,弱酸强碱盐和强酸弱碱盐促进水的电离。
11.【答案】C
【解析】【解答】A.根据分析可知HB的电离程度小于HA,则酸性HA>HB,A不符合题意;
B.b点和c点相比,pH更小,则溶液中酸电离出的氢离子浓度更大,对水电离的抑制作用越强烈,则溶液中水的电离程度b点
D.,从b点到d点,K值保持不变,c(H+)减小,则增大,D不符合题意;
故答案为:C。
【分析】A.酸性越强,稀释过程中pH变化越大;
B.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
D.根据分析。
12.【答案】A
【解析】【解答】A.Si原子中有2个未成对电子,1molSi原子含有的未成对电子数为,故A符合题意;
B.含有9个电子,1mol羟基()所含有的电子数为,故B不符合题意;
C.1个乙烯分子中含有6个共价键,常温下,14g乙烯含有的共用电子对数为,故C不符合题意;
D.25℃,的NaOH溶液,没有明确溶液体积不能计算的数目,故D不符合题意;
故答案为:A。
【分析】A.Si原子的价层电子数为3s23p2,有2个未成对电子,结合N=n·NA进行分析。
B.1个羟基中含有9个电子,结合N=n·NA进行分析。
C.1个乙烯分子中含有6对共用电子对,结合m=nM和N=n·NA进行分析。
D.溶液体积未知,无法计算物质的量。
13.【答案】B
【解析】【解答】A.该反应是气体体积不变的反应,压强对本反应无影响,图示与对应叙述不相符,A项不符合题意;
B.反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,图示与对应叙述相符,B项符合题意;
C.在溶液中逐步加入固体后,溶液pH应该增大,图示与对应叙述不相符,C项不符合题意;
D.c点是水电离程度最大的点,此时溶液中仅为氯化铵,铵根离子会水解,浓度减小,故铵根离子浓度小于氯离子浓度,D项不符合题意;
故答案为:B。
【分析】A.反应是气体体积不变的反应,压强对本反应无影响;
B.催化剂会降低活化能,改变反应的速率,但反应热不改变;
C.依据盐类水解规律分析;
D.依据酸或碱抑制水的电离,含有弱根离子的盐促进水的电离;
14.【答案】B
【解析】【解答】A.向纯水中加稀氨水,平衡逆向移动,c(H+)减小,新平衡时c(OH-)比原平衡时大,A项不符合题意;
B. 向水中加入少量固体NaHSO4,溶液体积不变。NaHSO4电离产生H+,使平衡向左移动,新平衡时c(H+)比原平衡时大。因温度不变,故Kw不变。B项符合题意;
C.向水中加入少量盐酸,平衡逆向移动,新平衡时c(H+)比原平衡时大。C项不符合题意;
D. 将水加热,水的电离平衡向右移动,c(H+)、c(OH-)都变大,Kw也增大。D项不符合题意。
故答案为:B。
【分析】A.水中加入稀氨水,碱性增强;
B.硫酸氢钠溶液呈酸性,水的离子积常数只是温度的函数;
C.水中加入盐酸后酸性增强;
D.加热促进水的电离,水的离子积常数变大。
15.【答案】D
【解析】【解答】解:A、pH=5.6,则c(OH )<c(H+),根据电荷守恒可知:c(CH3COO )+c(OH )=c(H+)+c(Na+),则有c(Na+)<c(CH3COO﹣),故A错误;
B、溶液的导电性取决于离子浓度大小,和电解质的强弱无关,故B错误;
C、同浓度的CaCl2和NaCl溶液中氯离子浓度不同,前者是后者的2倍,故对氯化银的溶解的抑制前者更大,则氯化银在CaCl2溶液中的溶解度更小,故C错误;
D、c(H+)=10﹣pH,故pH=4的番茄汁中氢离子浓度为10﹣4mol/L,pH=6的牛奶中氢离子浓度为10﹣6mol/L,故前者是后者的100倍,故D正确.
故选D.
【分析】A、pH=5.6,则c(OH )<c(H+),根据电荷守恒来分析;
B、溶液的导电性取决于离子浓度大小;
C、同浓度的CaCl2和NaCl溶液中氯离子浓度不同;
D、c(H+)=10﹣pH.
16.【答案】C
【解析】【解答】pH=6的盐酸,由水电离出的c(H+)=c(OH-)值为x=10-14/10-6=10-8mol/L,pH=6的NH4Cl溶液由水电离出的c(H+) y=10-6mol/L ,故x=10-2 y,选项C符合题意。
【分析】盐酸中的氢氧根离子浓度等于水电离出的氢离子浓度,氯化铵溶液中氢离子浓度等于氢氧根离子浓度即为水电离出的氢离子浓度,据此解答即可。
17.【答案】(1)+4;坩埚;CaSO4和CaSiO3
(2)
(3)矿石粒度越小,反应接触面积越大,反应速率越快
(4)B
(5)当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;
【解析】【解答】(1)设Ti的化合价为+x,(Mg0.5Fe0.5)Ti2O5化合价代数和等于0,(2×0.5+2×0.5)+2x-2×5=0,x=4;灼烧固体用坩埚;黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]加入NH4HSO4焙烧后,加水过滤,沉淀中含有CaSO4和CaSiO3;(2)由TiOSO4水解制备H2TiO3,反应方程式为: ;(3)由图中变量结合影响反应的速率、转化率的因素,矿石粒度对TiO2的提取率影响,原因是矿石粒度越小,反应接触面积越大,反应速率越快;(4)由图读出:金属难溶化合物在不同pH下的溶解度(s,mol·L-1),步骤④应该控制的pH范围是:钛酸沉淀pH大于2,而氢氧化铝不沉淀,pH小于3,
故答案为:B;(5)①铁离子过量时,反应结束,故终点现象为:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=bmol·L-1×V×10-3L×100mL/20mL=5bV×10-3mol,TiO2纯度为 = 。
【分析】(1)根据化合物的化合价之和为0可以计算出钛的化合价;固体灼烧实验采取的仪器是坩埚;铵根和铝离子水解后,滤渣中还有硅酸钙和硫酸钙;
(2)TiOSO4在加热的条件水解为H2TiO3和H2SO4;
(3)有固体参与的化学反应中,固体的接触面积越大,反应的速率就越快;
(4)步骤④主要是获取H2TiO3而不获取Al(OH)3,因此用调节pH值在2~3 之间;
(5)NH4SCN会与铁离子发生络合反应,生成血红色的络合物,因此反应的终点为:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;
根据氧化还原反应的方程式可以计算出TiO2的物质的量,继而求出其纯度。
18.【答案】(1)①;偏大
(2)无色变为粉红,半分钟内不变色
(3))22.60
(4)0.2000
【解析】【解答】(1)碱式滴定管在装液前应用待装液进行润洗,否则标准液的浓度偏小,滴定结果会偏高;
(2)当滴入最后一滴NaOH溶液,溶液由无色变为粉红色,且半分钟内不褪色,即为终点;
(3)滴定管中的液面读数为22.60mL;
(4)三次滴定消耗的体积为:20.00mL,19.80mL,20.20.08,数据均有效,则平均消耗V(NaOH)=20.00mL,c(待测)=═0.2000mol/L。
【分析】(1)盛装标准溶液的滴定管必须用标准溶液润洗,否则结果偏大;
(2)根据f酚酞溶液与碱反应的现象进行分析;
(3)根据滴定管的读数方法进行判断;
(4)根据酸碱中和进行计算。
19.【答案】(1)
(2);
(3)7.4;变大
(4)II;
【解析】【解答】(1)溶液的pH=5.60,则c(H+)=10-5.6mol/L=2.5×10-6mol/L,若忽略水的电离及H2CO3的第二级电离,该溶液中c(HCO)=c(H+)=2.5×10-6mol/L,c(H2CO3)为1.5×10-5 mol L-1,则H2CO3 HCO3-+H+的平衡常数K1===4.2×10-7;
(2)根据电离平衡常数大小关系可知酸性H2CO3>HClO> ,HCl为强酸;
a.少量Cl2通入到过量的Na2CO3溶液中,氯气和水反应生成少量的HCl、HClO,酸性越强结合氢离子的能力越弱,而氢离子少量,所以只有碳酸根结合氢离子生成碳酸氢根,最终的产物为氯化钠、次氯酸钠、碳酸氢钠,所以离子方程式为;
b.由于酸性H2CO3>HClO> HCO,根据强酸可以制弱酸可知:少量CO2通入过量的NaClO溶液中生成碳酸氢钠和次氯酸,离子方程式为;
(3)K1=,≈,所以c(H+)=,则pH=-lg=7.4;当过量的碱进入血液中时,氢氧根离子增大,氢离子浓度减小,而温度不变则K1不变,所以变大;
(4)K1=、K2=,K1 K2,当、相同时,K1表示的酸性更强,故II表示;由图可知K1==10-n、K2==10-m ,则。
【分析】(1)根据Ka1=计算;
(2)电离平衡常数越大,酸性越强,根据强酸制弱酸原理分析;
(3)根据pH=-lgc(H+)计算;当过量的碱进入血液中时,氢氧根离子增大,氢离子浓度减小,同时温度不变,平衡常数不变;
(4)Ka1==10-n、Ka2==10-m 。
20.【答案】(1)②①③⑧⑦⑥⑤④
(2)有无色无味气体生成;溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O
(3)A;C
【解析】【解答】解:(1)溶质的物质的量浓度均为0.2mol/L的下列八种溶液.
酸性溶液:①HCl为一元强酸;②H2SO4为二元强酸;③HClO为一元弱酸;⑧NH4Cl溶液中,铵根离子水解,溶液显示酸性;溶液的pH:②<①<③<⑧,
碱性溶液:④Ba(OH)2为二元强碱;⑤KOH为一元强碱;⑥NaF为强碱弱酸盐,溶液显示碱性;溶液的pH:⑥<⑤<④;⑦KCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由小到大的排列顺序是:②①③⑧⑦⑥⑤④,
故答案为:②①③⑧⑦⑥⑤④;(2)氯化铁水解呈酸性,Fe3++3H2O Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;故答案为:①有无色无味气体生成; ②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O; 在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中D是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和铁与溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:AC.
【分析】(1)酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小;(2)氯化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成,以此解答;(3)饱和氯化铁溶液中存在Fe3++3H2O Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气.
21.【答案】(1)>;温度升高,水的电离程度增大,水的离子积增大;1000∶1;碱
(2)a>c>b;a>b=c
【解析】【解答】(1)①水是弱电解质,存在电离平衡,电离吸热,所以温度升高,水的电离程度增大,水的离子积增大;
②25℃时,某Na2SO4溶液中c()=5×10-4mol L-1,则溶液中钠离子浓度是1×10-3mol L-1,如果稀释10倍,则钠离子浓度是1×10-4mol L-1,但硫酸钠溶液是显中性的,所以c(Na+)∶c(OH-)=10-4∶10-7=1000∶1;
③t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的,因此某溶液pH=7,则该溶液显碱性;
(2)①盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,所以当三种酸物质的量浓度相等时,溶液中c(H+)由大到小的顺序是b>c>a,氢离子浓度越大,水的电离程度越小,三种溶液中水的电离程度由大到小的顺序为a>c>b;
②醋酸在稀释过程中会促进电离,所以氢离子的物质的量增加,氢离子的浓度变化程度小,硫酸和盐酸溶液中氢离子物质的量不变且相等,所以c(H+)由大到小的顺序为a>b=c。
【分析】(1)①水的电离过程吸收热量;
②硫酸钠溶液始终呈中性;
③t2温度下水的离子积常数为1×10-12;
(2)①酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
②稀释促进醋酸的电离。
