人教版 初中化学 九上 5.2如何正确书写化学方程式 课件(共28张PPT)
文档属性
| 名称 | 人教版 初中化学 九上 5.2如何正确书写化学方程式 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 21:14:12 | ||
图片预览








文档简介
(共28张PPT)
课题2 如何正确书写
化学方程式
人教版九年级上册
第五单元 化学方程式
本课目录
新知导入
1
学习目标
2
新知讲解
3
要点梳理
4
课堂小结
5
板书设计
6
课堂练习
7
新知导入
点燃
+
O
H
H
H
H
H
H
O
O
1.方框内应填的微观图示是 。
结合上图,请从微观的角度解释质量守恒定律:在化学反应中,反应前后
没有改变, 没有增减,原子的质量也没有改变。
2.请尝试写出反应的化学方程式: 。
O
H
H
原子的种类
原子的数目
2H2+O2==== 2H2O
点燃
温故知新
新知导入
3.该化学方程式表示的意义有哪些?
1.氢气和氧气在点燃的条件下反应生成水;
2.每4份质量的氢气与32份质量的氧气恰好完全反应生成36份质量的水;
3.该反应中微粒的个数比为2∶1∶2。
2H2+O2==== 2H2O
点燃
了解自来水厂生产的简单流程。
学习目标
1
3
能正确简单地书写并配平化学方程式。
建立“宏观—微观—符号”三重表征的思维方法。
2
了解书写化学方程式的原则和步骤。
3
新知讲解
观察下列方程式的正误,并说明原因。
(1) H2 + O2 H2O2
点燃
(2) H2 + O2 H2O
点燃
(3) 2H2 + O2 2H2O
点燃
观察思考
生成物写成了过氧化氢,不符合客观事实
左右两边氧原子的数目不相等,
不遵守质量守恒定律
√
新知讲解
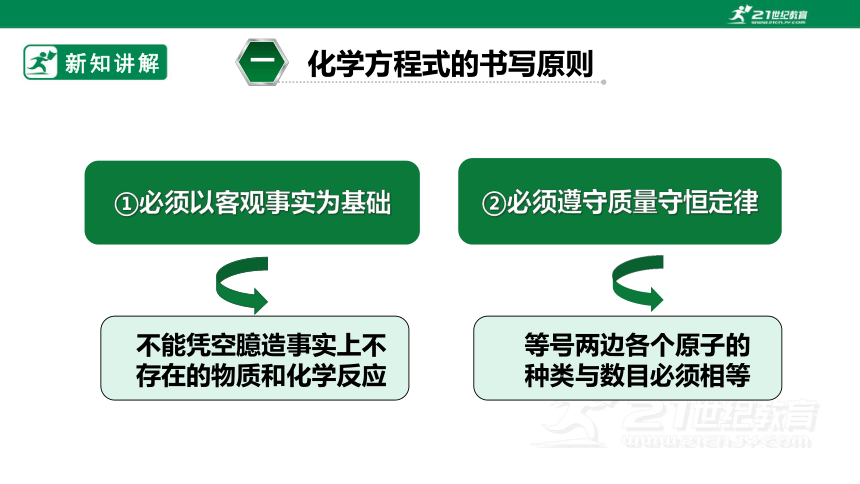
化学方程式的书写原则
3
一
②必须遵守质量守恒定律
不能凭空臆造事实上不存在的物质和化学反应
①必须以客观事实为基础
等号两边各个原子的种类与数目必须相等
在式子的左、右两边写出反应物和生成物的化学式,并在式子左、右两边之间画一条短线。
写
例:P + O2 —— P2O5
在化学式前面配上化学计量数,使短线两边原子的种类和数目相等,符合质量守恒定律。
配
4P + 5O2 2P2O5
点燃
4P + 5O2 —— 2P2O5
注明反应条件,将短线改为等号,标明生成物的状态,气体用“↑”,固体用“↓”。
注
检查化学式书写是否正确,是否配平,反应条件标注是否正确,生成物状态符号是否恰当。
查
4P + 5O2 2P2O5
点燃
化学方程式的书写步骤
3
二
新知讲解
2.标:(1)反应条件(点燃、 、高温、催化剂)不能混淆;如有两个条件,一上一下。
(2)生成物状态①“无中生有”。②反应物不标、生成水不标 ③两边都有不标
Fe + CuSO4 = FeSO4 + Cu
NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
1.配:只能改变化学式前面的系数,不能改变化学式。
2H2O —— O2 + 2H2
H2O2 —— O2 + H2 (×)
2KClO3 2KCl + 3O2↑
C + O2 CO2
注意事项
新知讲解
1.将下列化学方程式中的错误加以改正:
(3)2H2O 2H2 + O2
(4)2KClO3 2KCl + O2↑
(1)S + O2 SO2↑
(2)4P + 5O2↑ 2P2O5
烧燃
点燃
通电
↑
↑
MnO2
3
练习巩固
点燃
新知讲解
化学方程式的配平
3
三
H2+O2 H2O
点燃
H原子总数:2 2
O原子总数: 2 1
原子总个数: 4 3
在这个式子中右边的氧原子数少于左边的,这时为使式子两边每一种元素原子的总数相等,就需要配平,即在式子两边的化学式前面配上适当的化学计量数。
新知讲解
化学方程式的配平
3
三
在H2前配上2,在H2O前配上 2,式子两边的H原子、O原子数目就都相等了,亦即化学方程式配平了。
H2+O2 H2O
点燃
2
2
新知讲解
配平方法1:最小公倍数法
化学方程式的配平
3
三
例:P + O2 —— P2O5
入手:式子两边个数多,
相差大的原子
(1)求最小公倍数: 2×5=10
(2)求化学计量数:
P + 5O2 —— 2P2O5
(3)配平其它化学计量数。
从左右两端各出现一次、且原子个数相差较大、原子个数的最小公倍数也较大的元素入手配平,然后依次配平其他元素的原子个数。
新知讲解
⑴ H2+ O2 H2O
点燃
⑵ Al+ CuSO4 Al2(SO4)3+ Cu
(2) Fe2O3+ HCl FeCl3+ H2O
(3) KClO3 MnO2 KCl + O2
练习1:配平下列化学方程式:
(3) Fe + O2 点燃 Fe3O4
2
1
2
3
2
1
1
3
6
2
2
2
3
3
3
1
2
练习巩固
①适用于大多数化学反应,且几乎每一个化学反应都会用到;
②看哪种元素原子个数比较大,就先配哪种元素;
若个数相同,则有氧先配氧,单质最后一步配。
配平方法2:奇数配偶法
化学方程式的配平
3
三
FeS2 + O2 Fe2O3 + SO2
2
4
8
11
点燃
左右两端的原子总数为一奇一偶,在其含有奇数个原子的化学式前配上一个偶数2,变奇数为偶数,然后依次配平与其相关的其他元素原子。
入手:式子两边原子个数一奇一偶
(1)在原子奇数化学前配偶数2
(2)配平其它化学计量数。
FeS2 + O2 Fe2O3 + SO2
点燃
练习2:配平下列化学方程式:
① C2H4+ O2 CO2+ H2O
点燃
③ C2H2+ O2 CO2+ H2O
点燃
② Al+ O2 Al2O3
点燃
④ KClO3 KCl+ O2↑
MnO2
△
新知讲解
练习巩固
2
1
4
3
3
2
2
2
4
5
2
2
3
2
①适用于有元素的原子个数左右两边一边是奇数一边是偶数的情况;
②看哪种元素原子个数比较大,就先配哪种元素;
若个数相同,则有氧先配氧,单质最后一步配。
新知讲解
配平方法3:观察法
化学方程式的配平
3
三
(入手:两边化学式构成上的变化)
最基本、常用的配平方法,任何特殊的配平方法都离不开观察法的配合。对于一些比较简单的化学反应,配平时可直接观察看出结果。
Fe3O4 + CO —— Fe + CO2
4
4
3
新知讲解
总结:
适用于有得氧和失氧的化学方程式配平。
练习3:配平下列化学方程式:
① H2+ Fe2O3 Fe+ H2O
△
② C+ Fe3O4 Fe+ CO2 ↑
高温
3
3
1
2
2
1
3
2
练习巩固
化学方程式书写常见错误:
(1)臆造不存在的反应。
(2)写错物质的化学式。
(3)未配平。
(4)反应条件未标或写错,漏标或多标“↑”或“↓”符号。
注意
新知讲解
1.化学方程式的书写原则:(1)以 为基础,
(2)遵守 ,等号两边各原子的
与 必须相等。
2.化学方程式的书写:(1)写出反应物和生成物的 ;
(2)配平化学方程式;(3)标明化学反应的 ,
把短线改为等号。
客观事实
质量守恒定律
种类
数目
化学式
发生条件
要点梳理
如何正确书写化学方程式
书写
原则
书写
步骤
配平法
客观原则
遵守质量守恒定律
注明反应条件,符号“↑”、“↓”等
将短线改成长等号
写出反应物、生成物的化学式
根据质量守恒定律配平化学方程式
最小公倍数法、奇偶配平法、观察法
课堂小结
板书设计
课题2 如何正确书写化学方程式
一、化学方程式的书写
1.书写原则:
(1)必须以客观事实为基础。
(2)遵守质量守恒定律。
2.书写步骤:写、配、注、等、查。
二、化学方程式的配平
1.最小公倍数法;2.奇数配偶法;3.观察法。
1.下列说法正确的是( )
A.配平化学方程式的依据是质量守恒定律
B.配平化学方程式可以改变化学式中各组成元素右下角的数字
C.原子团在化学反应中是不能拆开的
D.化学方程式中的“↓”表示生成物是固体,所以只要生成物
是固体就必须标“↓”
课堂练习
A
课堂练习
2.下列化学方程式正确的是( )
A.S+O2 SO2↑ B.Mg+O2 MgO2
C.P+O2 PO2 D.4Al+3O2 2Al2O3
D
3.下列化学方程式中,aC2H5OH+bO2═cCO2+dH2O,
各化学计算系数的关系正确的是( )
A.2c=a B.5a=2d
C.a+2b=2c+d D.b=c
C
新知讲解
4.如图是用来表示物质间发生化学变化的模型示意图,
图中“ ”分别表示两种不同元素的原子.能用
该示意图表示的反应是( )
A.2H2+O2 2H2O B.2H2O 2H2↑+O2↑
C.2CO+O2 2CO2 D.H2+Cl2 2HCl
通电
C
5.[教材习题变式]配平下列化学方程式(化学计量数为1也要填入“ ”。
(1) Mg+ N2 Mg3N2
(2) Fe2O3+ C Fe+ CO2↑
(3) CO+ O2 CO2
(4) C2H6+ O2 H2O+ CO2
点燃
点燃
点燃
点燃
3
1
1
2
3
4
3
2
1
2
2
7
6
4
课堂练习
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题2 如何正确书写
化学方程式
人教版九年级上册
第五单元 化学方程式
本课目录
新知导入
1
学习目标
2
新知讲解
3
要点梳理
4
课堂小结
5
板书设计
6
课堂练习
7
新知导入
点燃
+
O
H
H
H
H
H
H
O
O
1.方框内应填的微观图示是 。
结合上图,请从微观的角度解释质量守恒定律:在化学反应中,反应前后
没有改变, 没有增减,原子的质量也没有改变。
2.请尝试写出反应的化学方程式: 。
O
H
H
原子的种类
原子的数目
2H2+O2==== 2H2O
点燃
温故知新
新知导入
3.该化学方程式表示的意义有哪些?
1.氢气和氧气在点燃的条件下反应生成水;
2.每4份质量的氢气与32份质量的氧气恰好完全反应生成36份质量的水;
3.该反应中微粒的个数比为2∶1∶2。
2H2+O2==== 2H2O
点燃
了解自来水厂生产的简单流程。
学习目标
1
3
能正确简单地书写并配平化学方程式。
建立“宏观—微观—符号”三重表征的思维方法。
2
了解书写化学方程式的原则和步骤。
3
新知讲解
观察下列方程式的正误,并说明原因。
(1) H2 + O2 H2O2
点燃
(2) H2 + O2 H2O
点燃
(3) 2H2 + O2 2H2O
点燃
观察思考
生成物写成了过氧化氢,不符合客观事实
左右两边氧原子的数目不相等,
不遵守质量守恒定律
√
新知讲解
化学方程式的书写原则
3
一
②必须遵守质量守恒定律
不能凭空臆造事实上不存在的物质和化学反应
①必须以客观事实为基础
等号两边各个原子的种类与数目必须相等
在式子的左、右两边写出反应物和生成物的化学式,并在式子左、右两边之间画一条短线。
写
例:P + O2 —— P2O5
在化学式前面配上化学计量数,使短线两边原子的种类和数目相等,符合质量守恒定律。
配
4P + 5O2 2P2O5
点燃
4P + 5O2 —— 2P2O5
注明反应条件,将短线改为等号,标明生成物的状态,气体用“↑”,固体用“↓”。
注
检查化学式书写是否正确,是否配平,反应条件标注是否正确,生成物状态符号是否恰当。
查
4P + 5O2 2P2O5
点燃
化学方程式的书写步骤
3
二
新知讲解
2.标:(1)反应条件(点燃、 、高温、催化剂)不能混淆;如有两个条件,一上一下。
(2)生成物状态①“无中生有”。②反应物不标、生成水不标 ③两边都有不标
Fe + CuSO4 = FeSO4 + Cu
NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
1.配:只能改变化学式前面的系数,不能改变化学式。
2H2O —— O2 + 2H2
H2O2 —— O2 + H2 (×)
2KClO3 2KCl + 3O2↑
C + O2 CO2
注意事项
新知讲解
1.将下列化学方程式中的错误加以改正:
(3)2H2O 2H2 + O2
(4)2KClO3 2KCl + O2↑
(1)S + O2 SO2↑
(2)4P + 5O2↑ 2P2O5
烧燃
点燃
通电
↑
↑
MnO2
3
练习巩固
点燃
新知讲解
化学方程式的配平
3
三
H2+O2 H2O
点燃
H原子总数:2 2
O原子总数: 2 1
原子总个数: 4 3
在这个式子中右边的氧原子数少于左边的,这时为使式子两边每一种元素原子的总数相等,就需要配平,即在式子两边的化学式前面配上适当的化学计量数。
新知讲解
化学方程式的配平
3
三
在H2前配上2,在H2O前配上 2,式子两边的H原子、O原子数目就都相等了,亦即化学方程式配平了。
H2+O2 H2O
点燃
2
2
新知讲解
配平方法1:最小公倍数法
化学方程式的配平
3
三
例:P + O2 —— P2O5
入手:式子两边个数多,
相差大的原子
(1)求最小公倍数: 2×5=10
(2)求化学计量数:
P + 5O2 —— 2P2O5
(3)配平其它化学计量数。
从左右两端各出现一次、且原子个数相差较大、原子个数的最小公倍数也较大的元素入手配平,然后依次配平其他元素的原子个数。
新知讲解
⑴ H2+ O2 H2O
点燃
⑵ Al+ CuSO4 Al2(SO4)3+ Cu
(2) Fe2O3+ HCl FeCl3+ H2O
(3) KClO3 MnO2 KCl + O2
练习1:配平下列化学方程式:
(3) Fe + O2 点燃 Fe3O4
2
1
2
3
2
1
1
3
6
2
2
2
3
3
3
1
2
练习巩固
①适用于大多数化学反应,且几乎每一个化学反应都会用到;
②看哪种元素原子个数比较大,就先配哪种元素;
若个数相同,则有氧先配氧,单质最后一步配。
配平方法2:奇数配偶法
化学方程式的配平
3
三
FeS2 + O2 Fe2O3 + SO2
2
4
8
11
点燃
左右两端的原子总数为一奇一偶,在其含有奇数个原子的化学式前配上一个偶数2,变奇数为偶数,然后依次配平与其相关的其他元素原子。
入手:式子两边原子个数一奇一偶
(1)在原子奇数化学前配偶数2
(2)配平其它化学计量数。
FeS2 + O2 Fe2O3 + SO2
点燃
练习2:配平下列化学方程式:
① C2H4+ O2 CO2+ H2O
点燃
③ C2H2+ O2 CO2+ H2O
点燃
② Al+ O2 Al2O3
点燃
④ KClO3 KCl+ O2↑
MnO2
△
新知讲解
练习巩固
2
1
4
3
3
2
2
2
4
5
2
2
3
2
①适用于有元素的原子个数左右两边一边是奇数一边是偶数的情况;
②看哪种元素原子个数比较大,就先配哪种元素;
若个数相同,则有氧先配氧,单质最后一步配。
新知讲解
配平方法3:观察法
化学方程式的配平
3
三
(入手:两边化学式构成上的变化)
最基本、常用的配平方法,任何特殊的配平方法都离不开观察法的配合。对于一些比较简单的化学反应,配平时可直接观察看出结果。
Fe3O4 + CO —— Fe + CO2
4
4
3
新知讲解
总结:
适用于有得氧和失氧的化学方程式配平。
练习3:配平下列化学方程式:
① H2+ Fe2O3 Fe+ H2O
△
② C+ Fe3O4 Fe+ CO2 ↑
高温
3
3
1
2
2
1
3
2
练习巩固
化学方程式书写常见错误:
(1)臆造不存在的反应。
(2)写错物质的化学式。
(3)未配平。
(4)反应条件未标或写错,漏标或多标“↑”或“↓”符号。
注意
新知讲解
1.化学方程式的书写原则:(1)以 为基础,
(2)遵守 ,等号两边各原子的
与 必须相等。
2.化学方程式的书写:(1)写出反应物和生成物的 ;
(2)配平化学方程式;(3)标明化学反应的 ,
把短线改为等号。
客观事实
质量守恒定律
种类
数目
化学式
发生条件
要点梳理
如何正确书写化学方程式
书写
原则
书写
步骤
配平法
客观原则
遵守质量守恒定律
注明反应条件,符号“↑”、“↓”等
将短线改成长等号
写出反应物、生成物的化学式
根据质量守恒定律配平化学方程式
最小公倍数法、奇偶配平法、观察法
课堂小结
板书设计
课题2 如何正确书写化学方程式
一、化学方程式的书写
1.书写原则:
(1)必须以客观事实为基础。
(2)遵守质量守恒定律。
2.书写步骤:写、配、注、等、查。
二、化学方程式的配平
1.最小公倍数法;2.奇数配偶法;3.观察法。
1.下列说法正确的是( )
A.配平化学方程式的依据是质量守恒定律
B.配平化学方程式可以改变化学式中各组成元素右下角的数字
C.原子团在化学反应中是不能拆开的
D.化学方程式中的“↓”表示生成物是固体,所以只要生成物
是固体就必须标“↓”
课堂练习
A
课堂练习
2.下列化学方程式正确的是( )
A.S+O2 SO2↑ B.Mg+O2 MgO2
C.P+O2 PO2 D.4Al+3O2 2Al2O3
D
3.下列化学方程式中,aC2H5OH+bO2═cCO2+dH2O,
各化学计算系数的关系正确的是( )
A.2c=a B.5a=2d
C.a+2b=2c+d D.b=c
C
新知讲解
4.如图是用来表示物质间发生化学变化的模型示意图,
图中“ ”分别表示两种不同元素的原子.能用
该示意图表示的反应是( )
A.2H2+O2 2H2O B.2H2O 2H2↑+O2↑
C.2CO+O2 2CO2 D.H2+Cl2 2HCl
通电
C
5.[教材习题变式]配平下列化学方程式(化学计量数为1也要填入“ ”。
(1) Mg+ N2 Mg3N2
(2) Fe2O3+ C Fe+ CO2↑
(3) CO+ O2 CO2
(4) C2H6+ O2 H2O+ CO2
点燃
点燃
点燃
点燃
3
1
1
2
3
4
3
2
1
2
2
7
6
4
课堂练习
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
