福建省上杭县蛟洋中学九年级化学教学课件:第五章第一节 金属的性质和利用(共58张PPT)
文档属性
| 名称 | 福建省上杭县蛟洋中学九年级化学教学课件:第五章第一节 金属的性质和利用(共58张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-23 20:49:36 | ||
图片预览











文档简介
课件58张PPT。第5章 金属与矿物
第一节 金属的性质和利用北京奥运会的金牌味道真不错哦!这些是什么?好炫啊!真气魄
!好
壮
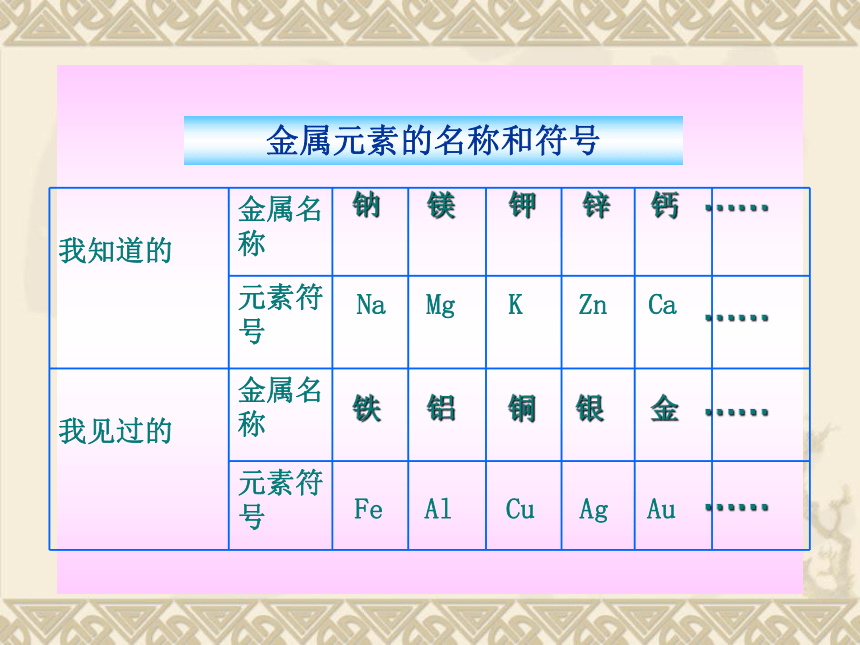
观啊!这些你乘坐过吗?这个你一定没坐过!你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成课本P.113的表5-1 。看看谁知道的最多!钠镁钾锌钙NaMgKZnCa铁铝铜银金FeAlCuAgAu……………………金属元素的名称和符号 你知道我们在什么地方使用了金属吗?想一想,你会发现我们的生活离不开金属。金属有很多的用途思考1:铁、铝常用于制作锅、铲等炊具,表现出金属哪
种物理性质?铁锅铝锅导热性金属的物理性质铜线思考2:铁、铝、铜能加工成导线、能压成薄片,表现出金属 哪些物理性质?导电性、铝锭可压成很薄的铝箔用来包装糖果等延展性金属的物理性质思考3:金、银、铂做成各种首饰等,表现出金属哪种
物理性质?有金属光泽金属的物理性质金属的物理性质金属铁金 属 锌铜 块金 条汞金属光泽有些金属粉末细小到一定程度时,吸收可
见光后辐射不出去,
所以金属粉末一般
呈暗灰色或黑色。金属的物理性质请充分调动起你的思维1、为何铁制锅铲需要加上木柄或塑料柄?
2、银的导电性比铜好,为什么不用银制造电线、电缆?
3、联合国卫生组织为什么推荐使用中国的铁锅炊具?防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热性较差,这样就可以防止手拿锅铲时被烫伤。因为银较稀少,价格昂贵,而铜相对较多,价格便宜。铁锅做炊具,可以补充人体所需的铁元素,防止缺铁性贫血。4、选择铸造硬币的金属材料需要考虑哪些因素?需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、性质稳定等因素。 根据你以前所学的知识及你的生活经验,请大胆猜测金属可能有哪些化学性质? 1、金属与氧气反应剧烈燃烧,火星四射,放出大量的热,生成黑色固体表面由红色变成黑色Fe 、Mg、 Cu 能与氧气反应常见金属的化学性质剧烈燃烧,发出耀眼的强光,放热,有少量白烟,生成白色固体3Fe+2O2 ==== Fe3O4点燃2Mg+O2====2MgO燃点2Cu+O2=2CuO 铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗? 原因:常温下,铝就能和氧气发生反应,在其表面生成一层致密的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密2、金属与酸溶液反应产生少量气泡,放热,溶液由无色变成浅绿色产生大量气泡,放热,固体逐渐消失无明显现象Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑Mg+2HCl =MgCl2+H2↑不反应铁、镁能与盐酸、稀硫酸反应,而铜不能。金属与盐酸的反应镁、锌、铁、铜的金属活动性由强到弱AlFe+CuSO4=3、金属与盐溶液反应FeSO4+Cu铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色点击下面画面播放视频Mg + 2HCl = H2↑ + MgCl2 下面是我们刚才探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?单质化合物单质化合物Fe + H2SO4 = H2↑ + FeSO4Fe + CuSO4 = Cu + FeSO4特点:ABCAAB 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃化合反应:A+B+…→C
分解反应:A→B+C+…置换反应:Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2OC(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢元素。
(3)在金属活动性顺序里,位于前面的金属能把位于其后面的金属从它们盐溶液中置换出来。金属活动性顺序最理想的绿色能源——氢气1、氢气的物理性质⑴通常为无色、无味的气体;
⑵难溶于水;
⑶相同状况下,密度最小的气体;
⑷有三态变化。2、氢气的化学性质⑴可燃但不助燃H2现象:
1、产生淡蓝色火焰
2、放出大量的热
3、干冷的烧杯内壁有水雾—点燃前需要检验纯度2H2 + O2 ==== 2H2O点燃⑵还原性3、氢气的用途⑴作燃料⑵冶金优点:存在问题:热值高;原料来源广;
无污染;可循环利用。如何大量、廉价制取;
如何安全运输、贮存。(1)药品:锌和稀硫酸(或稀盐酸)4、氢气的实验室制法 Zn+H2SO4=ZnSO4+H2↑为何不用镁或铁等来和酸反应制取氢气?(2)原理: Zn+2HCl=ZnCl2+H2↑思考: ——镁和酸反应速度太快,而铁的反应速度又太慢,不便于操作。 (4)收集: ①排水法固液不加热型(3)装置: ②向下排空气法 (5)步骤
①按照要求连 接装置。
②检查 气密性。
③装 药品:先装固体,后装液体。
④开始反应,并收集一小试管氢气,进行验 纯(任何
可燃性气体,在做性质实验之前务必进行验纯)。
⑤用排水法或向下排空气法收 集气体,盖上玻璃片倒
放在实验桌上。 二.合金
金属是生活、生产中应用非常广泛的一类材料。金属材料具有各种特殊性能。
如:制造飞机的金属材料,需要有坚硬而轻的特点;
用于切割的金属材料,要有很大的硬度;
白炽灯的灯丝熔点要高,保险丝的金属材料熔点要低;
纯金属很难满足各种特殊要求。因此,人们在生产实践中制造出了由一种金属跟其它金属(或非金属)熔合形成的有金属特性的物质----合金。
如:古代的青铜,现在应用广泛的钢和生铁都是合金。
拓展视野:
生铁和钢:最主要的区别——含碳量不同。钢铁的生产和使用 钢铁的生产和使用是人类文明和社会进
步的一个重要标志。早在春秋战国时期,
我国就已经开始生产和使用铁器。
1996年,我国的钢产量首次突破一亿
吨,居世界前列,多年来,我国的钢铁产
量连续保持世界第一。金属材料
通常所说的“金属材料”,既包括各种纯金
属,也包括各种合金。
合金的用途很广泛。合金的性质 合金具有许多良好的物理、化学和机械性能。
合金的硬度一般比各成分金属大;
多数合金的熔点低于组成它的成分金属。
通过调整合金的组成比例和改变合金的形成条件,可以制造性能不同的各种合金。
目前,合金的种类已不下万种。合金的制造大大拓宽了金属材料的应用范围和使用价值。一些常见合金的特性和用途一些合金 不锈钢 形状记忆合金
高温合金 储氢合金金属和
金属矿物 课堂小结金属的物理性质 常见金属的化学性质大多数金属能与氧气反应——有金属光泽、导电导热性、延展性等活泼金属能与稀盐酸、稀硫酸反应金属能与某些盐溶液反应1、下表是某种常见金属的部分性质。
将该金属投入稀盐酸中,可产生大量无色气体。根据上述信息回答以下问题:
⑴试推断该金属的一种用途是 ;
⑵该金属的活动性比铜 (填“强”或“弱”);
⑶请自选试剂,设计实验,探究该金属与铁的活动性强弱,完成下表。做导线强该金属的活动性比铁强将该金属投入氯化亚铁溶液中溶液浅绿色逐渐消失该金属的活动性比铁强该金属的活动性比铁强将该金属和铁分别投入稀硫酸中该金属表面产生气泡的速率比铁快该金属的活动性比铁强 2、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应(1)2Al+6HCl====2AlCl3+3H2↑( )(2)H2CO3====CO2↑+H2O ( )(3)Fe+CuSO4====FeSO4+Cu ( )(4)CaO+H2O====Ca(OH)2 ( )CBCA3.判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液 (5)银与氯化铜溶液
(6)镁与硫酸亚铁溶液解答:可发生反应的:(2)(4)(6)化学方程式:(2) Zn + CuSO4 = Cu + ZnSO4(4) Al + 3AgNO3 = Al(NO3)3 + 3Ag(6) Mg + FeSO4 = MgSO4 +Fe 4.有X Y Z三种金属,如果把X和Y分别放入稀硫酸中, X 溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序。金属活动性顺序:X>Y>Z5、相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。mtabc0MgFeZnt2t1t3拓 展1.如何分离铜粉和铁粉?2.如何除去硫酸亚铁中的硫酸铜?用磁铁吸引 加入稍过量的铁粉,搅拌,充分反应后,过滤去滤渣。 3.将铁粉和铜粉一起放入足量的稀硫酸中,充分反应后,剩余的固体是 。
将镁粉和铜粉一起放入一定量的稀硫酸中,充分反应后,剩余的固体中一定有 。 CuCu4.将铁粉放入一定量的硫酸铜中,充分反应后,剩余的固体中一定有 。 Cu5.等质量的镁、铝、锌、铁与足量稀硫酸反应得到氢气的质量的顺序是 。
足量的镁、铝、锌、铁与等质量的稀硫酸反应得到的氢气的质量顺序是 。 Al>Mg>Fe>ZnAl=Mg=Fe=Zn 6.铁与某金属的混合物56g与足量的稀硫酸反应,得到氢气共2.1g。则另一种金属可能是( )
A、锌 B、铝 C、铜 D、镁 B D 作业:
课本122页第8.10.12题Thank you!
!好
壮
观啊!这些你乘坐过吗?这个你一定没坐过!你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成课本P.113的表5-1 。看看谁知道的最多!钠镁钾锌钙NaMgKZnCa铁铝铜银金FeAlCuAgAu……………………金属元素的名称和符号 你知道我们在什么地方使用了金属吗?想一想,你会发现我们的生活离不开金属。金属有很多的用途思考1:铁、铝常用于制作锅、铲等炊具,表现出金属哪
种物理性质?铁锅铝锅导热性金属的物理性质铜线思考2:铁、铝、铜能加工成导线、能压成薄片,表现出金属 哪些物理性质?导电性、铝锭可压成很薄的铝箔用来包装糖果等延展性金属的物理性质思考3:金、银、铂做成各种首饰等,表现出金属哪种
物理性质?有金属光泽金属的物理性质金属的物理性质金属铁金 属 锌铜 块金 条汞金属光泽有些金属粉末细小到一定程度时,吸收可
见光后辐射不出去,
所以金属粉末一般
呈暗灰色或黑色。金属的物理性质请充分调动起你的思维1、为何铁制锅铲需要加上木柄或塑料柄?
2、银的导电性比铜好,为什么不用银制造电线、电缆?
3、联合国卫生组织为什么推荐使用中国的铁锅炊具?防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热性较差,这样就可以防止手拿锅铲时被烫伤。因为银较稀少,价格昂贵,而铜相对较多,价格便宜。铁锅做炊具,可以补充人体所需的铁元素,防止缺铁性贫血。4、选择铸造硬币的金属材料需要考虑哪些因素?需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、性质稳定等因素。 根据你以前所学的知识及你的生活经验,请大胆猜测金属可能有哪些化学性质? 1、金属与氧气反应剧烈燃烧,火星四射,放出大量的热,生成黑色固体表面由红色变成黑色Fe 、Mg、 Cu 能与氧气反应常见金属的化学性质剧烈燃烧,发出耀眼的强光,放热,有少量白烟,生成白色固体3Fe+2O2 ==== Fe3O4点燃2Mg+O2====2MgO燃点2Cu+O2=2CuO 铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗? 原因:常温下,铝就能和氧气发生反应,在其表面生成一层致密的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密2、金属与酸溶液反应产生少量气泡,放热,溶液由无色变成浅绿色产生大量气泡,放热,固体逐渐消失无明显现象Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑Mg+2HCl =MgCl2+H2↑不反应铁、镁能与盐酸、稀硫酸反应,而铜不能。金属与盐酸的反应镁、锌、铁、铜的金属活动性由强到弱AlFe+CuSO4=3、金属与盐溶液反应FeSO4+Cu铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色点击下面画面播放视频Mg + 2HCl = H2↑ + MgCl2 下面是我们刚才探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?单质化合物单质化合物Fe + H2SO4 = H2↑ + FeSO4Fe + CuSO4 = Cu + FeSO4特点:ABCAAB 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃化合反应:A+B+…→C
分解反应:A→B+C+…置换反应:Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2OC(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢元素。
(3)在金属活动性顺序里,位于前面的金属能把位于其后面的金属从它们盐溶液中置换出来。金属活动性顺序最理想的绿色能源——氢气1、氢气的物理性质⑴通常为无色、无味的气体;
⑵难溶于水;
⑶相同状况下,密度最小的气体;
⑷有三态变化。2、氢气的化学性质⑴可燃但不助燃H2现象:
1、产生淡蓝色火焰
2、放出大量的热
3、干冷的烧杯内壁有水雾—点燃前需要检验纯度2H2 + O2 ==== 2H2O点燃⑵还原性3、氢气的用途⑴作燃料⑵冶金优点:存在问题:热值高;原料来源广;
无污染;可循环利用。如何大量、廉价制取;
如何安全运输、贮存。(1)药品:锌和稀硫酸(或稀盐酸)4、氢气的实验室制法 Zn+H2SO4=ZnSO4+H2↑为何不用镁或铁等来和酸反应制取氢气?(2)原理: Zn+2HCl=ZnCl2+H2↑思考: ——镁和酸反应速度太快,而铁的反应速度又太慢,不便于操作。 (4)收集: ①排水法固液不加热型(3)装置: ②向下排空气法 (5)步骤
①按照要求连 接装置。
②检查 气密性。
③装 药品:先装固体,后装液体。
④开始反应,并收集一小试管氢气,进行验 纯(任何
可燃性气体,在做性质实验之前务必进行验纯)。
⑤用排水法或向下排空气法收 集气体,盖上玻璃片倒
放在实验桌上。 二.合金
金属是生活、生产中应用非常广泛的一类材料。金属材料具有各种特殊性能。
如:制造飞机的金属材料,需要有坚硬而轻的特点;
用于切割的金属材料,要有很大的硬度;
白炽灯的灯丝熔点要高,保险丝的金属材料熔点要低;
纯金属很难满足各种特殊要求。因此,人们在生产实践中制造出了由一种金属跟其它金属(或非金属)熔合形成的有金属特性的物质----合金。
如:古代的青铜,现在应用广泛的钢和生铁都是合金。
拓展视野:
生铁和钢:最主要的区别——含碳量不同。钢铁的生产和使用 钢铁的生产和使用是人类文明和社会进
步的一个重要标志。早在春秋战国时期,
我国就已经开始生产和使用铁器。
1996年,我国的钢产量首次突破一亿
吨,居世界前列,多年来,我国的钢铁产
量连续保持世界第一。金属材料
通常所说的“金属材料”,既包括各种纯金
属,也包括各种合金。
合金的用途很广泛。合金的性质 合金具有许多良好的物理、化学和机械性能。
合金的硬度一般比各成分金属大;
多数合金的熔点低于组成它的成分金属。
通过调整合金的组成比例和改变合金的形成条件,可以制造性能不同的各种合金。
目前,合金的种类已不下万种。合金的制造大大拓宽了金属材料的应用范围和使用价值。一些常见合金的特性和用途一些合金 不锈钢 形状记忆合金
高温合金 储氢合金金属和
金属矿物 课堂小结金属的物理性质 常见金属的化学性质大多数金属能与氧气反应——有金属光泽、导电导热性、延展性等活泼金属能与稀盐酸、稀硫酸反应金属能与某些盐溶液反应1、下表是某种常见金属的部分性质。
将该金属投入稀盐酸中,可产生大量无色气体。根据上述信息回答以下问题:
⑴试推断该金属的一种用途是 ;
⑵该金属的活动性比铜 (填“强”或“弱”);
⑶请自选试剂,设计实验,探究该金属与铁的活动性强弱,完成下表。做导线强该金属的活动性比铁强将该金属投入氯化亚铁溶液中溶液浅绿色逐渐消失该金属的活动性比铁强该金属的活动性比铁强将该金属和铁分别投入稀硫酸中该金属表面产生气泡的速率比铁快该金属的活动性比铁强 2、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应(1)2Al+6HCl====2AlCl3+3H2↑( )(2)H2CO3====CO2↑+H2O ( )(3)Fe+CuSO4====FeSO4+Cu ( )(4)CaO+H2O====Ca(OH)2 ( )CBCA3.判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液 (5)银与氯化铜溶液
(6)镁与硫酸亚铁溶液解答:可发生反应的:(2)(4)(6)化学方程式:(2) Zn + CuSO4 = Cu + ZnSO4(4) Al + 3AgNO3 = Al(NO3)3 + 3Ag(6) Mg + FeSO4 = MgSO4 +Fe 4.有X Y Z三种金属,如果把X和Y分别放入稀硫酸中, X 溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序。金属活动性顺序:X>Y>Z5、相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。mtabc0MgFeZnt2t1t3拓 展1.如何分离铜粉和铁粉?2.如何除去硫酸亚铁中的硫酸铜?用磁铁吸引 加入稍过量的铁粉,搅拌,充分反应后,过滤去滤渣。 3.将铁粉和铜粉一起放入足量的稀硫酸中,充分反应后,剩余的固体是 。
将镁粉和铜粉一起放入一定量的稀硫酸中,充分反应后,剩余的固体中一定有 。 CuCu4.将铁粉放入一定量的硫酸铜中,充分反应后,剩余的固体中一定有 。 Cu5.等质量的镁、铝、锌、铁与足量稀硫酸反应得到氢气的质量的顺序是 。
足量的镁、铝、锌、铁与等质量的稀硫酸反应得到的氢气的质量顺序是 。 Al>Mg>Fe>ZnAl=Mg=Fe=Zn 6.铁与某金属的混合物56g与足量的稀硫酸反应,得到氢气共2.1g。则另一种金属可能是( )
A、锌 B、铝 C、铜 D、镁 B D 作业:
课本122页第8.10.12题Thank you!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
