福建省上杭县蛟洋中学九年级化学教学课件:第四章第三节 化学方程式的书写与应用(共39张PPT)
文档属性
| 名称 | 福建省上杭县蛟洋中学九年级化学教学课件:第四章第三节 化学方程式的书写与应用(共39张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 293.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-23 00:00:00 | ||
图片预览










文档简介
课件39张PPT。化学方程式
蛟洋中学 杨海华 前面我们学过,用文字表达式来描述化学变化。如碳燃烧生成二氧化碳可表示为:
碳 + 氧气 二氧化碳
用文字表达式可以表示物质的转变关系,但不能表示物质间的质量关系。
问题:有没有一种方法既能表示物质的转变关系,又能表示物质间的质量关系呢?点燃一.化学反应的表示方法 观察与思考:
下面的三种方法都能表示铁在氧气中燃烧。你认为哪种方式准确又简便地描述这一反应?
点燃点燃 1.化学方程式的定义:
用化学式表示化学反应的式子叫化学方程式。
问题:怎样正确书写化学方程式?(示范)
(1)铁 + 氧气 四氧化三铁
(2)Fe + O2 Fe3O4
(3)3Fe+2O2=====Fe3O4
点燃点燃化学方程式书写原则1、以客观事实为基础。
正确书写各物质的化学式。
2、遵守质量守恒定律。“等号”两边各原子的数目必须相等。
3、注明反应条件、标“↑、↓”、变“----”为“== ” 。
4P + 5 O2 2 P2O5
1、写符号表达式:
P + O2 ─ P2O5
2、配平:4P + 5 O2 ─ 2 P2O5
例如:化学方程式书写步骤:在化学方程式中:
“+”表示“和”、“跟”、“与”
“=”表示反应物质量与生成物质量相等、同时也表示生成号。“↑”表示有气体产生
“↓”表示沉淀(不溶于水的物质)生成化学方程式书写的步骤: 1.写出反应物和生成物的化学式;用短线相
连
2.配平化学方程式;
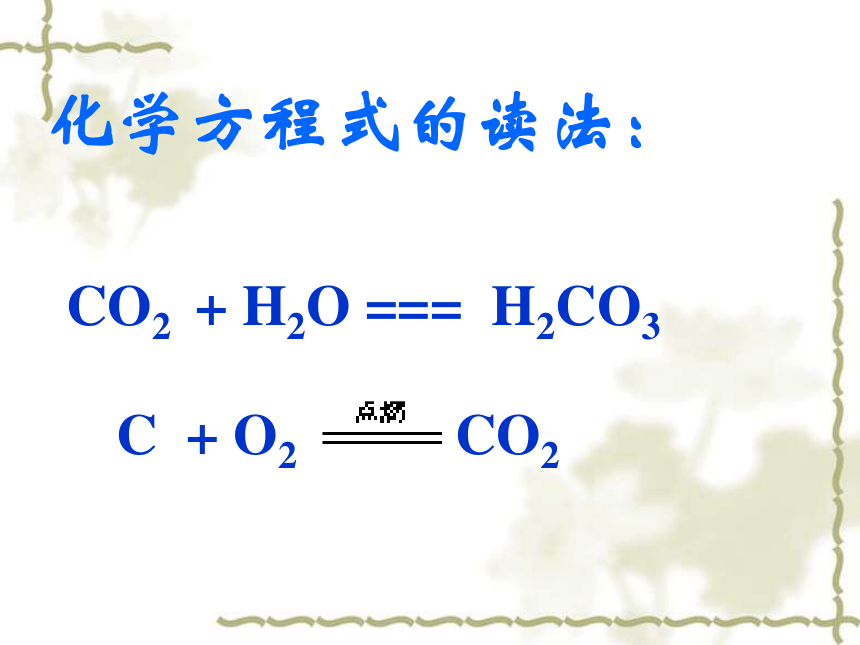
3.将化学反应中的条件用文字或符号在“等号”上面标出。(加热用“ ”表示)并在生成的气体或沉淀物化学式的右边用“ ”或“ ”标明。化学方程式的读法:CO2 + H2O === H2CO3 C + O2 CO2说明:1、将“—”变成“=”,“=”表示遵循质量守恒定律。
2、标“↑、 ↓”。
“↑”只标在生成的气体后面,若反应物中有气体,则不标。
“↓”只标在难溶于水的物质后面,若反应体系中无水,则不标。
写出用氯酸钾和二氧化锰混合制氧气的化学方程式 1、写:KClO3 ─ KCl+O2
2、配:2 KClO3 ─ 2KCl+3O2
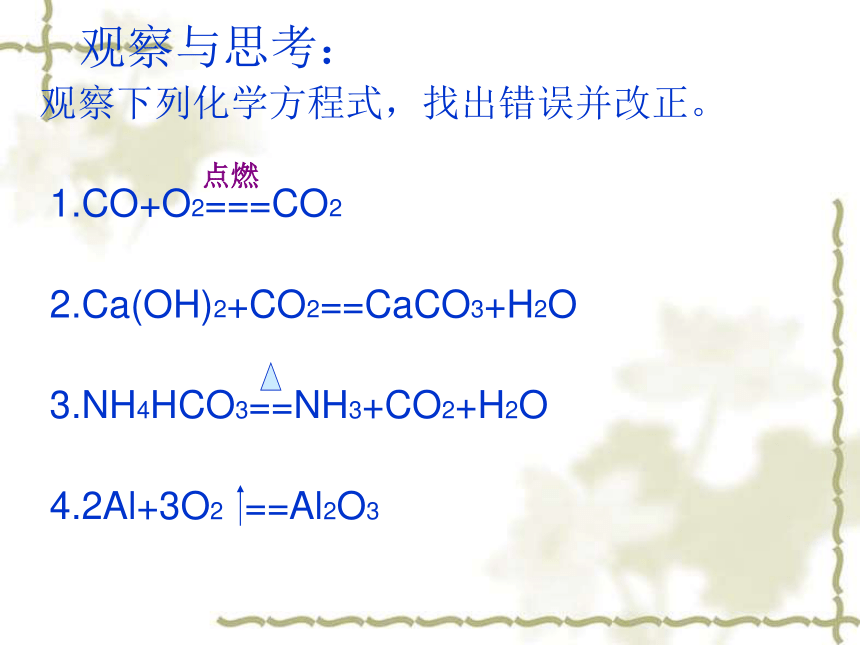
3、注:2 KClO3 2KCl+3O2↑ 观察与思考:
观察下列化学方程式,找出错误并改正。
1.CO+O2===CO2
2.Ca(OH)2+CO2==CaCO3+H2O
3.NH4HCO3==NH3+CO2+H2O
4.2Al+3O2 ==Al2O3点燃写出下列反应的化学方程式
(1)、加热高锰酸钾制氧气(2)、电解水(3)、硫酸铜溶液与氢氧化钠溶液生成氢氧化铜与硫酸钠
(4)甲烷燃烧生成水和二氧化碳
(5)、实验室制备二氧化碳(6)、将二氧化碳通入澄清石灰水(7)、按要求写化学方程式有水生成的分解反应
有水参加的化合反应
有水参加的分解反应
有二氧化碳生成的化合反应
有二氧化碳生成的分解反应 配平化学方程式:目的:遵循质量守恒定律
原则:使两边的原子种类和个数相同
方法:下面介绍三种配平方法化学方程式的配平方法 1.最小公倍数法
如: KClO3 ─ KCl+O2
练习(1)Al+O2 Al2O3
(2) P+O2 P2O5 2. 观察法:
如:Mg + O2 MgO
练习:(1)H2 + O2 H2O
(2) Fe + O2 Fe3O4
3.奇偶法:
如:C2H2 + O2 CO2 + H2O
练习: (1)FeS2 + O2 Fe2O3 + SO2
(2) NH3 + O2 NO2 + H2O
练习:配平下列化学方程式
点燃1、 Na + H2O ------ NaOH + H2↑
2、 C2H5OH + O2 —— CO2 + H2O
3、 FeS2 + O2—— SO2 + Fe2O3
4、 CO + Fe 3O4 —— CO2 + Fe
36432由上述化学方程式得到的信息有?H2在氧气中充分燃烧的化学方程式为:2H2 + O2 2H2O从上式你能得到哪些信息?4 32 361、氢气和氧气在点燃条件下生成水。2、每2个氢分子和1个氧分子反应后生成两个水分子。3、每4份质量氢气和32份质量氧气完全反应生成36份质量水。4、该反应是化合反应。化学方程式表示的意义1、表明了反应物、生成物和反应条件。2、表示反应物、生成物各物质的质量比。(各物质的质量比 == 各物质总相对分子质量之比)3、表示反应物、生成物各物质的分子数或原子数比
364328g??2g????实际质量比等于化学方程式中各物质的总的相对分子质量比18g根据化学方程式计算步骤:
算出已知量与未知量的质量比标出已知量与未知量列关系式①设(求什么,设什么,不带
单位。设:××质量为x)②写(正确书写方程式)
③列
④求 ⑤答例:15.5克红磷在氧气中充分燃烧,可生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5------- = ---------142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.××××未配平
相对分子质量计算错误
未注明单位计算结果错误且无单位×点燃× 练习:
1.电解18g水可得氢气多少克?2. 要使12g碳完全燃烧至少需要多少升的氧气?[氧气的密度为32/22.4(g/L)]至少需要多少升空气?
3.实验室中,将10g碳酸
钙与足量称盐酸充分反
应,可以生成多少质量
的二氧化碳?生成的二
氧化碳是几升(密度是
2g/L)?4.某科研小组需要制取H210克,至少需要电解多少g水?同时可以得到几克氧气?
5.用25g含CaCO380%的石灰石与
足量的稀盐酸反应,可生成CO2几
克?例:化学反应A+B=C+2D ,已知49gA恰好与29gB完全反应,生成60gC ,则同时生成D_____g;若要生成36gD,需____gA参加反应。
***若A的相对分子质量为98,则D的相对分子质量___ ***例:密闭容器中有X、Y、Z、Q四种物质,在一定条件下发生化学变化,测定反应前后物质质量如下:
根据数据可知,反应后X的质量为___此变化的反应类型是__________。6.密闭容器中有A、B、C、D四种物质各10g,在一定条件下发生化学变化,测定反应前后物质质量如下:
根据数据可知,反应后C质量为___
此变化的反应类型是__________。7.
分别表示A、B、C三种物质的分子,下图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。用A、B、C来表示该反应的化学方程式:
8.水垢的主要成份是CaCO3和Mg(OH)2,某化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成的CO2的质量,结果如下表,试回答下列问题:(1)4分钟后,水垢中CaCO3是否反应完全?(2)该水垢中CaCO3的质量分数是多少?9.石灰石的主要成份是CaCO3,某化学研究小组的同学通过实验测定石灰石中CaCO3的含量:取12g样品,加入过量的 100g稀盐酸,反应完全后,烧杯中剩余物质的质量为107.6g。(1)反应中生成二氧化碳多少g?(2)该样品中CaCO3的质量分数是多少?10.某石灰石与某种溶质质量分数的盐酸(杂质不与盐酸反应)盐酸用量与乘余固体的质量见下表,利用实验数据绘制的图象见下图:求:石灰石纯度;所用盐酸溶质质量分数;化学计算— 数据分析与应用
1、方法:①比较相邻两组数据的异同点。②注意数据的变化规律。比较、分析每一组数据,得出 :
(1)哪组物质的量正好完全反应。
(2)每一组中哪种物质已反应完;
哪种物质有剩余。2、应用:用已经反应完全的哪种物质的
量来解决有关问题。
11.为了测定一批石灰石碳酸钙的质量分数,取2g石灰石样品,把20g稀盐酸分四次加入样品中(样品中杂质不与酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
求:①第___次石灰石中碳酸钙完全反应。
②石灰石中
碳酸钙的
质量分数。
12.为了分析某石灰石的纯度,现取8g石灰石放入烧杯中,取40毫升稀盐酸分四次加入到烧杯中,充分反应剩余固体质量与加入的稀盐酸的量关系如下表所示。求:该石灰石中碳酸钙的质量分数;m;所用稀盐酸的溶质质量分数(杂质不参加反应)。13.为了测定某铜锌合金(即铜锌混合物)
中锌的质量分数,某同学利用该合金与
稀硫酸反应,进行了三次实验,所得实
验数据如下:(1)试计算锌的质量分数
(2)从表中数据分析,当所取合金与稀
硫酸质量比为____时,表明合金中的锌
正好与稀硫酸正好反应。提示:锌与稀硫酸反应的方程式,铜不与稀硫酸反应。 小结:
1. 化学方程式的意义、读法和书写;
2.根据化学方程式的简单计算
作业:课本108页1.4. 题
课本112页5.8 题
蛟洋中学 杨海华 前面我们学过,用文字表达式来描述化学变化。如碳燃烧生成二氧化碳可表示为:
碳 + 氧气 二氧化碳
用文字表达式可以表示物质的转变关系,但不能表示物质间的质量关系。
问题:有没有一种方法既能表示物质的转变关系,又能表示物质间的质量关系呢?点燃一.化学反应的表示方法 观察与思考:
下面的三种方法都能表示铁在氧气中燃烧。你认为哪种方式准确又简便地描述这一反应?
点燃点燃 1.化学方程式的定义:
用化学式表示化学反应的式子叫化学方程式。
问题:怎样正确书写化学方程式?(示范)
(1)铁 + 氧气 四氧化三铁
(2)Fe + O2 Fe3O4
(3)3Fe+2O2=====Fe3O4
点燃点燃化学方程式书写原则1、以客观事实为基础。
正确书写各物质的化学式。
2、遵守质量守恒定律。“等号”两边各原子的数目必须相等。
3、注明反应条件、标“↑、↓”、变“----”为“== ” 。
4P + 5 O2 2 P2O5
1、写符号表达式:
P + O2 ─ P2O5
2、配平:4P + 5 O2 ─ 2 P2O5
例如:化学方程式书写步骤:在化学方程式中:
“+”表示“和”、“跟”、“与”
“=”表示反应物质量与生成物质量相等、同时也表示生成号。“↑”表示有气体产生
“↓”表示沉淀(不溶于水的物质)生成化学方程式书写的步骤: 1.写出反应物和生成物的化学式;用短线相
连
2.配平化学方程式;
3.将化学反应中的条件用文字或符号在“等号”上面标出。(加热用“ ”表示)并在生成的气体或沉淀物化学式的右边用“ ”或“ ”标明。化学方程式的读法:CO2 + H2O === H2CO3 C + O2 CO2说明:1、将“—”变成“=”,“=”表示遵循质量守恒定律。
2、标“↑、 ↓”。
“↑”只标在生成的气体后面,若反应物中有气体,则不标。
“↓”只标在难溶于水的物质后面,若反应体系中无水,则不标。
写出用氯酸钾和二氧化锰混合制氧气的化学方程式 1、写:KClO3 ─ KCl+O2
2、配:2 KClO3 ─ 2KCl+3O2
3、注:2 KClO3 2KCl+3O2↑ 观察与思考:
观察下列化学方程式,找出错误并改正。
1.CO+O2===CO2
2.Ca(OH)2+CO2==CaCO3+H2O
3.NH4HCO3==NH3+CO2+H2O
4.2Al+3O2 ==Al2O3点燃写出下列反应的化学方程式
(1)、加热高锰酸钾制氧气(2)、电解水(3)、硫酸铜溶液与氢氧化钠溶液生成氢氧化铜与硫酸钠
(4)甲烷燃烧生成水和二氧化碳
(5)、实验室制备二氧化碳(6)、将二氧化碳通入澄清石灰水(7)、按要求写化学方程式有水生成的分解反应
有水参加的化合反应
有水参加的分解反应
有二氧化碳生成的化合反应
有二氧化碳生成的分解反应 配平化学方程式:目的:遵循质量守恒定律
原则:使两边的原子种类和个数相同
方法:下面介绍三种配平方法化学方程式的配平方法 1.最小公倍数法
如: KClO3 ─ KCl+O2
练习(1)Al+O2 Al2O3
(2) P+O2 P2O5 2. 观察法:
如:Mg + O2 MgO
练习:(1)H2 + O2 H2O
(2) Fe + O2 Fe3O4
3.奇偶法:
如:C2H2 + O2 CO2 + H2O
练习: (1)FeS2 + O2 Fe2O3 + SO2
(2) NH3 + O2 NO2 + H2O
练习:配平下列化学方程式
点燃1、 Na + H2O ------ NaOH + H2↑
2、 C2H5OH + O2 —— CO2 + H2O
3、 FeS2 + O2—— SO2 + Fe2O3
4、 CO + Fe 3O4 —— CO2 + Fe
36432由上述化学方程式得到的信息有?H2在氧气中充分燃烧的化学方程式为:2H2 + O2 2H2O从上式你能得到哪些信息?4 32 361、氢气和氧气在点燃条件下生成水。2、每2个氢分子和1个氧分子反应后生成两个水分子。3、每4份质量氢气和32份质量氧气完全反应生成36份质量水。4、该反应是化合反应。化学方程式表示的意义1、表明了反应物、生成物和反应条件。2、表示反应物、生成物各物质的质量比。(各物质的质量比 == 各物质总相对分子质量之比)3、表示反应物、生成物各物质的分子数或原子数比
364328g??2g????实际质量比等于化学方程式中各物质的总的相对分子质量比18g根据化学方程式计算步骤:
算出已知量与未知量的质量比标出已知量与未知量列关系式①设(求什么,设什么,不带
单位。设:××质量为x)②写(正确书写方程式)
③列
④求 ⑤答例:15.5克红磷在氧气中充分燃烧,可生成五氧化二磷多少克?(找出下列所解答案中的错误)解:设可生成X克五氧化二磷
P + O 2 ====== P 2 O 5
31 142
15.5 X 31 15.5------- = ---------142 XX = --------------142×15.531= 71答:可生成五氧化二磷71克.××××未配平
相对分子质量计算错误
未注明单位计算结果错误且无单位×点燃× 练习:
1.电解18g水可得氢气多少克?2. 要使12g碳完全燃烧至少需要多少升的氧气?[氧气的密度为32/22.4(g/L)]至少需要多少升空气?
3.实验室中,将10g碳酸
钙与足量称盐酸充分反
应,可以生成多少质量
的二氧化碳?生成的二
氧化碳是几升(密度是
2g/L)?4.某科研小组需要制取H210克,至少需要电解多少g水?同时可以得到几克氧气?
5.用25g含CaCO380%的石灰石与
足量的稀盐酸反应,可生成CO2几
克?例:化学反应A+B=C+2D ,已知49gA恰好与29gB完全反应,生成60gC ,则同时生成D_____g;若要生成36gD,需____gA参加反应。
***若A的相对分子质量为98,则D的相对分子质量___ ***例:密闭容器中有X、Y、Z、Q四种物质,在一定条件下发生化学变化,测定反应前后物质质量如下:
根据数据可知,反应后X的质量为___此变化的反应类型是__________。6.密闭容器中有A、B、C、D四种物质各10g,在一定条件下发生化学变化,测定反应前后物质质量如下:
根据数据可知,反应后C质量为___
此变化的反应类型是__________。7.
分别表示A、B、C三种物质的分子,下图形象地表示了某化学反应前后反应物与生成物分子及其数目的变化。用A、B、C来表示该反应的化学方程式:
8.水垢的主要成份是CaCO3和Mg(OH)2,某化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成的CO2的质量,结果如下表,试回答下列问题:(1)4分钟后,水垢中CaCO3是否反应完全?(2)该水垢中CaCO3的质量分数是多少?9.石灰石的主要成份是CaCO3,某化学研究小组的同学通过实验测定石灰石中CaCO3的含量:取12g样品,加入过量的 100g稀盐酸,反应完全后,烧杯中剩余物质的质量为107.6g。(1)反应中生成二氧化碳多少g?(2)该样品中CaCO3的质量分数是多少?10.某石灰石与某种溶质质量分数的盐酸(杂质不与盐酸反应)盐酸用量与乘余固体的质量见下表,利用实验数据绘制的图象见下图:求:石灰石纯度;所用盐酸溶质质量分数;化学计算— 数据分析与应用
1、方法:①比较相邻两组数据的异同点。②注意数据的变化规律。比较、分析每一组数据,得出 :
(1)哪组物质的量正好完全反应。
(2)每一组中哪种物质已反应完;
哪种物质有剩余。2、应用:用已经反应完全的哪种物质的
量来解决有关问题。
11.为了测定一批石灰石碳酸钙的质量分数,取2g石灰石样品,把20g稀盐酸分四次加入样品中(样品中杂质不与酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
求:①第___次石灰石中碳酸钙完全反应。
②石灰石中
碳酸钙的
质量分数。
12.为了分析某石灰石的纯度,现取8g石灰石放入烧杯中,取40毫升稀盐酸分四次加入到烧杯中,充分反应剩余固体质量与加入的稀盐酸的量关系如下表所示。求:该石灰石中碳酸钙的质量分数;m;所用稀盐酸的溶质质量分数(杂质不参加反应)。13.为了测定某铜锌合金(即铜锌混合物)
中锌的质量分数,某同学利用该合金与
稀硫酸反应,进行了三次实验,所得实
验数据如下:(1)试计算锌的质量分数
(2)从表中数据分析,当所取合金与稀
硫酸质量比为____时,表明合金中的锌
正好与稀硫酸正好反应。提示:锌与稀硫酸反应的方程式,铜不与稀硫酸反应。 小结:
1. 化学方程式的意义、读法和书写;
2.根据化学方程式的简单计算
作业:课本108页1.4. 题
课本112页5.8 题
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
