沪教版九年级化学上册:第5章《(第1课时)金属的性质和利用》20张ppt
文档属性
| 名称 | 沪教版九年级化学上册:第5章《(第1课时)金属的性质和利用》20张ppt |  | |
| 格式 | zip | ||
| 文件大小 | 669.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-23 21:06:59 | ||
图片预览








文档简介
课件20张PPT。第5章 金属的冶炼与利用第1课时 金属的性质和利用 考点扫描1.了解金属的物理特征,认识常见金属的主要化学性质。
2.认识金属材料在生产、生活和社会发展中的作用。
3.知道生铁和钢等重要的合金。
一、金属材料金属材料包括: 以及它们的 。纯金属合金1、金属的物理性质大多数金属具有金属光泽,密度和硬度较 ,熔沸点较 ,具有良好的 性、 性和 性。在室温下,除 外,金属都是固体。大多数金属为银白色,铜为红色,金为黄色。大高导电导热延展汞重点梳理2、金属之最地壳中含量最多的金属元素:人体中含量最多的金属元素:目前世界年产量最高的金属:导电、导热性最好的金属:延展性最好的金属:熔点最高的金属:硬度最大的金属:密度最大的金属:密度最小的金属:重点梳理铝(Al)
钙(Ca)铁(Fe)银(Ag)金(Au)
钨(w)铬(Cr)
锇(Os)锂(Li)
3、合金⑴概念:由一种金属跟其他 或 熔合形成的有 的物质。
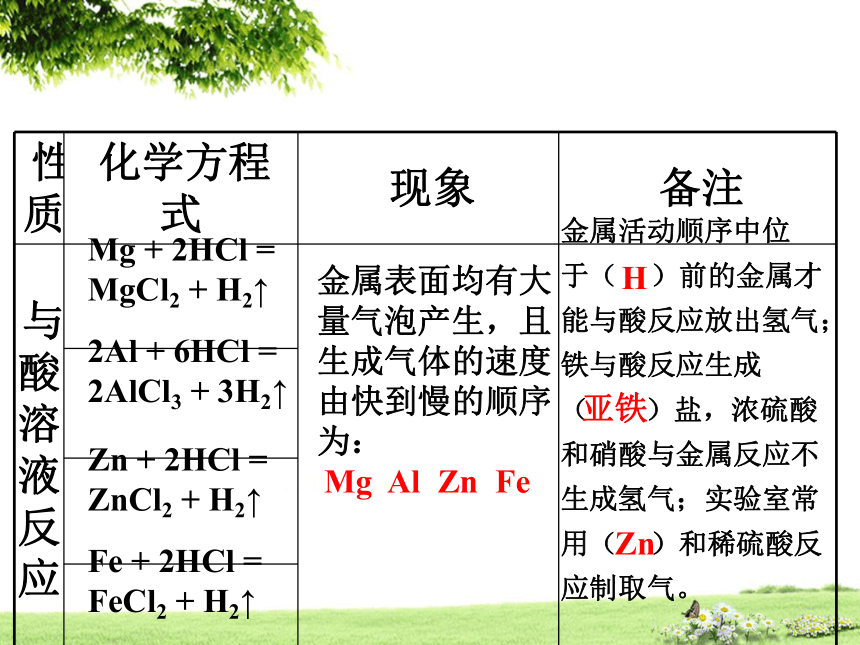
⑵性质特点:合金的 一般比它们的纯金属更高, 更好,而熔点 。金属非金属金属特征硬度和强度抗腐蚀性较低思考:金属特征的具体内容有哪些?金属光泽、导电导热性、延展性,在反应中易失电子。重点梳理二、金属的化学性质放出大量热,产生耀眼的白光,生成白色固体。军事上可用于燃烧弹和照明弹,常温下铝表面易形成致密氧化膜,因而有抗腐蚀性。剧烈燃烧,火星四射,生成黑色固体在空气中不能燃烧,集气瓶中少量水的作用是防止高温熔融物使瓶底炸裂固体由红色变黑色重点梳理Mg + 2HCl = MgCl2 + H2↑2Al + 6HCl = 2AlCl3 + 3H2↑Zn + 2HCl = ZnCl2 + H2↑Fe + 2HCl = FeCl2 + H2↑金属表面均有大量气泡产生,且生成气体的速度由快到慢的顺序为:
Mg Al Zn Fe金属活动顺序中位 于( )前的金属才能与酸反应放出氢气;铁与酸反应生成( )盐,浓硫酸和硝酸与金属反应不生成氢气;实验室常用( )和稀硫酸反应制取气。H亚铁Zn重点梳理Fe + CuSO4 = FeSO4 + Cu2Al + 3CuSO4 = Al2(SO4)3 + 3CuCu + 2AgNO3 = Cu(NO3)2 + 2Ag铁丝表面有红色物质生成,溶液由蓝色变为浅绿色铝丝表面有红色物质生成,溶液由蓝色变为无色铜丝表面有银白色物质生成,溶液由无色变为蓝色1.钾钙钠与水反应,故不与盐溶液发生置换反应;
2.前置换后;
3.盐须可溶;
4.活泼金属优先与不活泼金属的盐溶液反应。重点梳理重点梳理金属活动性顺序 Ag Mg Al Zn Cu Hg 化合物的溶液强氢1、(2013 佛山)以下说法正确的是( ) A. 常温下金属都是固体
B. 钠比铝抗腐蚀能力强
C. 青铜、生铁、焊锡均属合金
D. 木炭和 ZnO 在高温条件下不能反应
C2、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
C.HgCl2 D.CuSO4B典例解析 3、 A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D
C.D、C、A、B D.D、C、B、A C典例解析4、(2013德州市)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是 ( )
A.生成氢气的质量:甲﹥乙﹥丙
B.相对原子质量:乙﹥丙﹥甲
C.金属活动性:乙﹥甲﹥丙
D.消耗硫酸的质量:甲﹥乙﹥丙B典例解析5、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。 合金Mg>Cr>Cu能Cr + CuSO4 = CrSO4 + Cu典例解析1、(2013 黄石)有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到 CuSO4 溶液中,一
段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是( )
A. 甲>丙>乙B. 丙>乙>甲C. 甲>乙>丙D. 丙>甲>乙A练习反馈2. 金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的
性
(2)金属锌可以提取AgNO3废水中的银,这是因为锌的活动性比银 .
(3)将生铁加入足量的稀盐酸中,充分反应后得到浅绿色溶液,该溶液中含有的金属离子主要是 (写符号),溶液底部残留的黑色不溶物主要是 .导热强Fe2+碳 ___练习反馈1、(2014年四川成都)下列有关金属的说法错误的是( ) A.常温下金属均为固态 B.合金的很多性能与组成它们的纯金属不同 C.铁在潮湿的空气中比在干燥的空气中更易生锈 D.铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能 A中考链接2、(2012年湖北武汉).向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法( ) ①向滤渣中加入稀盐酸,一定有气泡产生。 ②向滤渣中加入稀盐酸,一定有沉淀产生。 ③滤渣中一定含有Ag。 ④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。 以上说法正确的个数为 A. 0个 B. 1个 C. 2个 D. 3个 B中考链接3、(2014年重庆)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。 ⑴铸造以上硬币用到的都是(填“合成”或“金属材料”)。 ⑵选择铸造硬币的材料不需要考虑的因素是(填序号)。 A.金属的导电性 B.金属的耐腐蚀性 C.金属的硬度 D.金属价格与硬币面值的吻合度 ⑶以上硬币中涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应: Ni+ H2SO4= H2↑+NiSO4 Fe+NiCl2= Ni+ FeCl2金属材料A这两个反应基本类型都是。
置换反应Al Fe Ni Cu 四种金属的活动性由强到弱的顺序为(用元素符号表示)。
中考链接4、 (2014年山东烟台)某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,此外还有一些不溶性杂质。若废液直接排放到下水道不仅造成重金属污染,而且造成浪费。该校化学兴趣小组同学设计了如下图费用处理方案,请回答有关问题。 (1)废液在加入金属X前需进行过滤,目的是将其中的__________除去。进行过滤操作所需的玻璃仪器有:________________________。 (2)金属X是________,其加入废液后发生反应的化学方程式为___________________________;溶液Y是____________,利用其除去铜中杂质,有关反应的化学方程式为_____________________________。 不溶性杂质 漏斗、烧杯、玻璃棒 铁(或Fe) CuSO4+Fe===FeSO4+Cu 稀硫酸H2SO4+ Fe=== FeSO4 +H2↑ 中考链接谢谢!再见!
2.认识金属材料在生产、生活和社会发展中的作用。
3.知道生铁和钢等重要的合金。
一、金属材料金属材料包括: 以及它们的 。纯金属合金1、金属的物理性质大多数金属具有金属光泽,密度和硬度较 ,熔沸点较 ,具有良好的 性、 性和 性。在室温下,除 外,金属都是固体。大多数金属为银白色,铜为红色,金为黄色。大高导电导热延展汞重点梳理2、金属之最地壳中含量最多的金属元素:人体中含量最多的金属元素:目前世界年产量最高的金属:导电、导热性最好的金属:延展性最好的金属:熔点最高的金属:硬度最大的金属:密度最大的金属:密度最小的金属:重点梳理铝(Al)
钙(Ca)铁(Fe)银(Ag)金(Au)
钨(w)铬(Cr)
锇(Os)锂(Li)
3、合金⑴概念:由一种金属跟其他 或 熔合形成的有 的物质。
⑵性质特点:合金的 一般比它们的纯金属更高, 更好,而熔点 。金属非金属金属特征硬度和强度抗腐蚀性较低思考:金属特征的具体内容有哪些?金属光泽、导电导热性、延展性,在反应中易失电子。重点梳理二、金属的化学性质放出大量热,产生耀眼的白光,生成白色固体。军事上可用于燃烧弹和照明弹,常温下铝表面易形成致密氧化膜,因而有抗腐蚀性。剧烈燃烧,火星四射,生成黑色固体在空气中不能燃烧,集气瓶中少量水的作用是防止高温熔融物使瓶底炸裂固体由红色变黑色重点梳理Mg + 2HCl = MgCl2 + H2↑2Al + 6HCl = 2AlCl3 + 3H2↑Zn + 2HCl = ZnCl2 + H2↑Fe + 2HCl = FeCl2 + H2↑金属表面均有大量气泡产生,且生成气体的速度由快到慢的顺序为:
Mg Al Zn Fe金属活动顺序中位 于( )前的金属才能与酸反应放出氢气;铁与酸反应生成( )盐,浓硫酸和硝酸与金属反应不生成氢气;实验室常用( )和稀硫酸反应制取气。H亚铁Zn重点梳理Fe + CuSO4 = FeSO4 + Cu2Al + 3CuSO4 = Al2(SO4)3 + 3CuCu + 2AgNO3 = Cu(NO3)2 + 2Ag铁丝表面有红色物质生成,溶液由蓝色变为浅绿色铝丝表面有红色物质生成,溶液由蓝色变为无色铜丝表面有银白色物质生成,溶液由无色变为蓝色1.钾钙钠与水反应,故不与盐溶液发生置换反应;
2.前置换后;
3.盐须可溶;
4.活泼金属优先与不活泼金属的盐溶液反应。重点梳理重点梳理金属活动性顺序 Ag Mg Al Zn Cu Hg 化合物的溶液强氢1、(2013 佛山)以下说法正确的是( ) A. 常温下金属都是固体
B. 钠比铝抗腐蚀能力强
C. 青铜、生铁、焊锡均属合金
D. 木炭和 ZnO 在高温条件下不能反应
C2、下列化合物能由金属与酸发生置换反应直接制取的是( )
A.FeCl3 B.ZnCl2
C.HgCl2 D.CuSO4B典例解析 3、 A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D
C.D、C、A、B D.D、C、B、A C典例解析4、(2013德州市)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是 ( )
A.生成氢气的质量:甲﹥乙﹥丙
B.相对原子质量:乙﹥丙﹥甲
C.金属活动性:乙﹥甲﹥丙
D.消耗硫酸的质量:甲﹥乙﹥丙B典例解析5、铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)不锈钢是一种 (填“合金”或“金属”)。
(2)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
①三种金属的活动性由强到弱的顺序是 。
②从上述探究实验可知,Cr 跟CuSO4溶液反应。若反应,请写出反应的化学方程式_________________。 合金Mg>Cr>Cu能Cr + CuSO4 = CrSO4 + Cu典例解析1、(2013 黄石)有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到 CuSO4 溶液中,一
段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是( )
A. 甲>丙>乙B. 丙>乙>甲C. 甲>乙>丙D. 丙>甲>乙A练习反馈2. 金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的
性
(2)金属锌可以提取AgNO3废水中的银,这是因为锌的活动性比银 .
(3)将生铁加入足量的稀盐酸中,充分反应后得到浅绿色溶液,该溶液中含有的金属离子主要是 (写符号),溶液底部残留的黑色不溶物主要是 .导热强Fe2+碳 ___练习反馈1、(2014年四川成都)下列有关金属的说法错误的是( ) A.常温下金属均为固态 B.合金的很多性能与组成它们的纯金属不同 C.铁在潮湿的空气中比在干燥的空气中更易生锈 D.铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能 A中考链接2、(2012年湖北武汉).向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法( ) ①向滤渣中加入稀盐酸,一定有气泡产生。 ②向滤渣中加入稀盐酸,一定有沉淀产生。 ③滤渣中一定含有Ag。 ④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。 以上说法正确的个数为 A. 0个 B. 1个 C. 2个 D. 3个 B中考链接3、(2014年重庆)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。 ⑴铸造以上硬币用到的都是(填“合成”或“金属材料”)。 ⑵选择铸造硬币的材料不需要考虑的因素是(填序号)。 A.金属的导电性 B.金属的耐腐蚀性 C.金属的硬度 D.金属价格与硬币面值的吻合度 ⑶以上硬币中涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应: Ni+ H2SO4= H2↑+NiSO4 Fe+NiCl2= Ni+ FeCl2金属材料A这两个反应基本类型都是。
置换反应Al Fe Ni Cu 四种金属的活动性由强到弱的顺序为(用元素符号表示)。
中考链接4、 (2014年山东烟台)某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,此外还有一些不溶性杂质。若废液直接排放到下水道不仅造成重金属污染,而且造成浪费。该校化学兴趣小组同学设计了如下图费用处理方案,请回答有关问题。 (1)废液在加入金属X前需进行过滤,目的是将其中的__________除去。进行过滤操作所需的玻璃仪器有:________________________。 (2)金属X是________,其加入废液后发生反应的化学方程式为___________________________;溶液Y是____________,利用其除去铜中杂质,有关反应的化学方程式为_____________________________。 不溶性杂质 漏斗、烧杯、玻璃棒 铁(或Fe) CuSO4+Fe===FeSO4+Cu 稀硫酸H2SO4+ Fe=== FeSO4 +H2↑ 中考链接谢谢!再见!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
