苏教版(2019) 必修第一册 从铝土矿到铝合金(共62张PPT)
文档属性
| 名称 | 苏教版(2019) 必修第一册 从铝土矿到铝合金(共62张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 11:07:15 | ||
图片预览









文档简介
(共62张PPT)
汇报人:XXX
XX月XX日
苏教版高中化学必修一课件
从铝土矿到铝合金
在19世纪中期,法兰西第二共和国总统拿破仑三世,珍藏着一套铝制的餐具,平时舍不得用,直到国宴时才拿出来炫耀一番,而元素周期表的创始人门捷列夫在受到英国皇家学会的表彰时,得到的却是一只铝杯。为什么拿破仑没有珍藏金制的餐具,而门捷列夫也没有给奖励一只金杯呢?
在19世纪,从铝矿石中提炼铝——极其困难。
电解法——铝才得到普及
生活生产中的铝制品
从铝土矿中提取铝
二:Al2O3两性氧化物
四:铝的应用
三: Al(OH)3两性氢氧化物
一:铝的制备
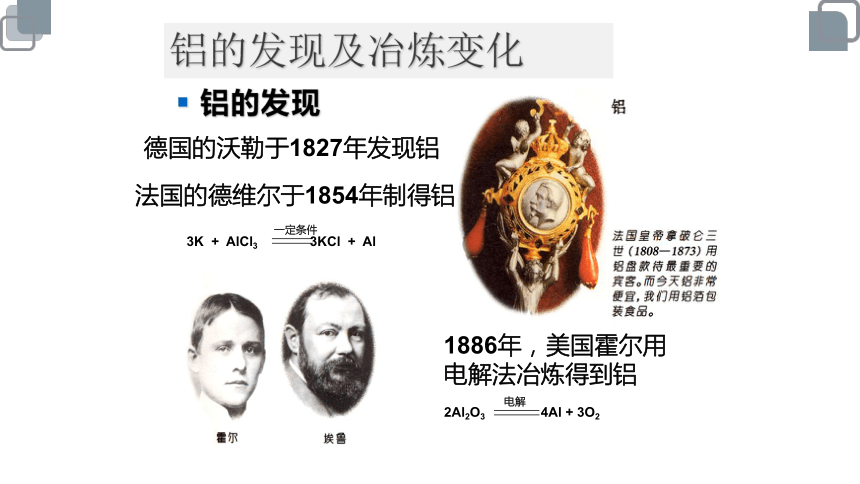
铝的发现及冶炼变化
铝的发现
德国的沃勒于1827年发现铝
3K + AlCl3 3KCl + Al
一定条件
1886年,美国霍尔用电解法冶炼得到铝
2Al2O3 4Al + 3O2
电解
法国的德维尔于1854年制得铝
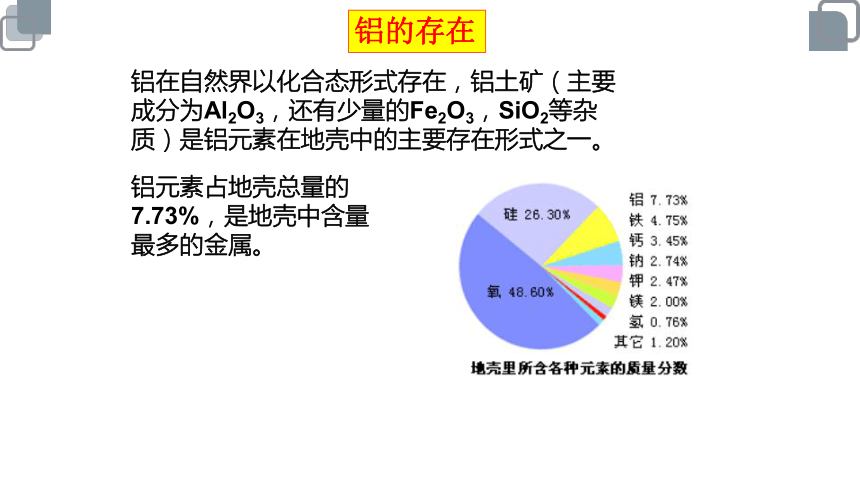
氧
49.13%
硅
26%
铝7.73%
铁钙钠钾镁
14.55%
铝的存在
铝在自然界以化合态形式存在,铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)是铝元素在地壳中的主要存在形式之一。
铝元素占地壳总量的7.73%,是地壳中含量最多的金属。
从铝土矿中提取铝
主要成分:Al2O3
少量:Fe2O3、SiO2等杂质
铝土矿的成分:
天然氧化铝—刚玉
红宝石(Al2O3)
蓝宝石(Al2O3)
氧化铝的主要性质:P62、64
(1)物理性质:白色、不溶于水的固体,熔点很高。(红宝石、蓝宝石的主要成分)
(3)化学性质—是典型的两性氧化物
①不与水反应
氧化铝 Al2O3
(2)主要用途:
①作耐火材料:制耐火管、耐火坩埚、耐高温的实验仪器等
②冶炼铝的原料.
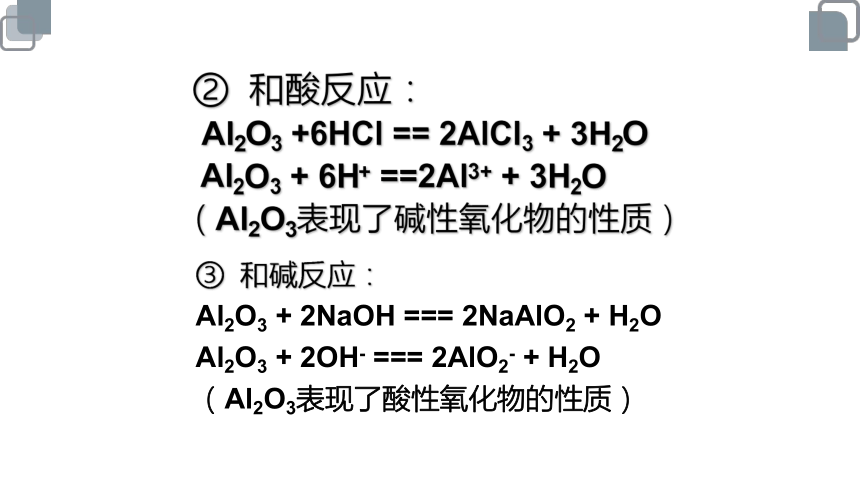
② 和酸反应:
Al2O3 +6HCl == 2AlCl3 + 3H2O
Al2O3 + 6H+ ==2Al3+ + 3H2O
(Al2O3表现了碱性氧化物的性质)
③ 和碱反应:
Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3 + 2OH- === 2AlO2- + H2O
(Al2O3表现了酸性氧化物的性质)
问题讨论:
问题1:用NaOH溶液溶解铝土矿的目的是什么?
溶解氧化铝,过滤,从而除去少量的Fe2O3、等杂质
问题2:铝土矿中的氧化铝与氢氧化钠溶液反应,生成偏铝酸钠和水。向偏铝酸钠溶液中通入二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,灼烧氢氧化铝得到氧化铝。请结合工艺流程,写出从铝土矿制备氧化铝过程中发生的化学反应方程式,判断是否为氧化还原反应,是离子反应的写离子方程式。 P63
问题讨论:
2Al(OH)3==Al2O3+3H2O
灼烧
NaAlO2+CO2+2H2O==Al(OH)3 +NaHCO3
2NaOH+Al2O3==2NaAlO2+H2O
溶解
铝土矿
NaOH溶液
过滤
残渣
二氧化碳
酸化
过滤
滤液
灼烧
H2O
电解
铝
2Al2O3==4Al+3O2
电解
铝的制备
Al2O3+2NaOH=2NaAlO2+H2O
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
2Al(OH)3 Al2O3+3H2O
灼烧
2Al2O3 4Al+3O2↑
电解
铝的提取原理
巩固练习
1.从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化钠固体
D.电解熔融的氧化铝
D
2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合的使用须加以控制的是 ( )
①制铝锭 ②制易拉罐 ③制电线、电缆 ④制包糖果用的铝箔 ⑤用明矾净水⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
C
3.电解熔融的氧化铝制取金属铝,若有0.2mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少克?
分析:
2Al2O3 4Al+3O2↑
电解
得12e-
失12e-
由上述知:
2Al2O3 ~ 4Al ~ 转移电子12
2mol 4mol 12mol
0.2mol
将一个用金属铝做的易拉罐内充满CO2,然后
往罐内注入足量的NaOH溶液,立即用胶布密封
罐口。经过一段时间后,罐壁内凹而瘪,再过一段
时间后,瘪了的罐壁重新鼓起来。
(1)罐壁内凹而瘪的原因是___________ ;
(2)罐再鼓起的原因是______________ 。
课 堂 练 习
CO2被NaOH吸收,压强减小
铝和NaOH反应生成H2,压强增大
【课堂小结】
二、铝的制备过程和原理
Al2O3
NaAlO2
Al(OH)3
Al2O3
Al
NaOH
CO2
溶解、过滤
酸化、过滤
灼烧
电解
三、Al2O3的性质
AlCl3
Al
Al(OH)3
通电
+HCl
+CO2
Al2O3
NaAlO2
NaOH
NaOH
△
四.氢氧化铝的性质
1.物理性质
氢氧化铝是几乎不溶于水的白色
胶状固体物质。能凝聚水中悬浮物,
又有吸附色素的性能。
三:氢氧化铝
在氯化铝溶液分两份分别滴加氨水
AlCl3 + 3NH3·H2O =Al(OH)3 + 3NH4Cl
——典型的两性氢氧化物
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
两性氢氧化物:既与酸反应又可与碱反应生成盐和水的氢氧化物。
实验1
实验1的两支试管分别滴加盐酸和氢氧化钠
实验2
现象:出现白色沉淀
现象:白色沉淀都消失
思考
沉淀Al(OH)3
加稀盐酸
沉淀溶解
加NaOH
沉淀溶解
加氨水
沉淀不溶解
AlCl3 + 3NH3·H2O =Al(OH)3↓ + 3NH4Cl
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
注意:Al(OH)3沉淀不溶于弱酸或者弱碱
①Al(OH)3制取
②与强酸反应
③与强碱反应
NaAlO2 + 2H2O+H2O=Al(OH)3 ↓ +NaHCO3
④受热分解
2Al(OH)3 = Al2O3 + 3H2O
△
常用净水剂
电离方程式:KAl(SO4)2 = K++Al3++2SO42-
化学式:KAl(SO4)2·12H2O,是一种复盐。
Al3+ +3H2O = Al(OH)3(胶体) +3H+
吸附能力
五.明矾
Al(OH)3
Al3+
AlO2-
①
②
③
④
⑤
⑥
①Al3+ + 3OH- =Al(OH)3
②Al(OH)3+ OH- = AlO2-+2H2O
③ Al3+ + 4OH- = AlO2-+2H2O
④ AlO2- +H2O+H+= Al(OH)3
⑤ Al(OH)3 +3H+ = Al3+ +3H2O
⑥ AlO2- +4H+= Al3+ + 2H2O
有关方程式
Al3++3OH- =Al(OH)3↓
Al3++4OH- = AlO2- +2H2O
Al3++3NH3·H2O = Al(OH)3 ↓+3 NH4 +
AlO2- +H+ +H2O =Al(OH)3 ↓
AlO2- +4H+ =Al 3+ + 2H2O
2AlO2- +CO2 +3H2O =2 Al(OH)3 ↓ +CO3 2-
AlO2- +CO2 +2H2O = Al(OH)3 ↓ +HCO3-
Al(OH)3+3H+ = Al3+ +3H2O
Al(OH)3+OH- = AlO2- +2H2O 3AlO2- +Al3+ +6H2O=4Al(OH)3↓
1:3
1:4
1:1
1:4
特殊反应: H2O+AlO2- +HCO3 - = Al(OH)3↓+CO32-
铝三角:
NH3·H2O
H+
过量OH-
过量H+
CO2
+H2O
OH-
OH-
H+
Al3+
Al(OH)3
AlO2-
【课堂小结】
一、Al(OH)3的性质
AlCl3
Al
Al(OH)3
通电
+HCl
+CO2
Al2O3
NaAlO2
NaOH
NaOH
△
NH3·H2O
+HCl
+HCl
NaOH
Al(OH)3+NaOH====NaAlO2+2H2O
Al(OH)3+3HCl==== AlCl3 + 3H2O
两性
二、Al(OH)3的制取:
AlCl3 + 3NH3·H2O = Al(OH)3↓+ 3NH4Cl
组成:KAl(SO4)2·12H2O
用途:净水Al3+ + H2O Al(OH)3(胶体)+3H+
三、明矾性质和用途
一.铝的物理性质和用途
物理性质 用途
用途不一的各种铝合金
易加工成各种形状,
包装、装饰工艺,
铝箔、铝丝、银粉涂料
铝锅、铝壶等加热器具
铝芯电线、电缆
银白色,有金属光泽
质地较软,延展性好
导热性能好
导电性能较好
密度小、熔点低、硬度小
一、铝的物理性质
银白色金属,密度小、良好的导电导热性和延展性。
复习与思考
铝的原子结构特点及在金属活动顺序表中的位置
Al-3e- == Al3+
Al的化学性质活泼,
具有较强还原性
K Ca Na Mg Zn Fe Sn Pb H Cu Hg …
Al
思考:铝是一种较活泼的金属,那为什么其在空气中不易被腐蚀呢?
1.与O2的反应:4Al + 3O2 = 2Al2O3
想一想:
有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?
(二)铝的化学性质:
二.铝的化学性质
生活与思考
铝是一种较活泼的金属,那为什么其在
空气中不易被腐蚀呢?
1.与O2的反应:4Al + 3O2 == 2Al2O3
铝在氧气中点燃可以看到耀眼的白光
有人对铝制品因为表面氧化出现灰色而总感到
不美观,所以常用钢丝球进行擦洗,你认为有
必要吗?为什么?
铝具有导热性。常温下铝的表面被氧化,生成
一层致密氧化物薄膜而具有抗腐蚀性。若擦去,
会导致铝制品快速被腐蚀
能写出Al和S、Cl2反应的化学方程式吗?
点燃
观察与思考并完成P66表格
把铝分别加入浓硝酸、浓硫酸、盐酸中
2Al+6HCl=2AlCl3+3H2↑
②铝能将稀硫酸、盐酸中的H+置换成H2
①冷的浓硝酸,浓硫酸使铝表面钝化!
生活应用:浓硝酸、浓硫酸的运输
2.与酸反应
铝比铁活泼,为什么铝反而耐腐蚀?铝制品表面不光洁时,能否用用硬物来擦洗?
【问题情境】
【观察思考】
观察铝片浸入NaOH溶液的 实验,观察并思考以下问题:
1.浸入NaOH溶液的铝片颜色有什么变化?为什么?
2.有无气泡冒出?静置较长一段时间后呢?为什么?
【活动与探究】
铝的性质
实验 实验现象 结论或化学方程式
1.盐酸
2.NaOH溶液
3.浓硝酸
4.浓硫酸
有无色无味气体放出
有无色无味气体放出
无明显现象
无明显现象
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
钝化
钝化
【交流讨论】
1.为什么铝与浓酸反而没有气体生成了?
2.从原子守恒的角度推断铝与氢氧化钠溶液反应生成的气体是什么气体?
3. 分析两反应的电子得失,实质上有什么共同之处?
【归纳小结】
铝的两性
2Al+6HCl= 2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
钝化:
铝与到浓硫酸、浓硝酸,会在铝的表面反应生成一层致密的氧化物保护膜。
铝的两性
试一试
将表面已完全钝化的铝条投入下列溶液中,
不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
C
把铝加入到NaOH溶液中
现象:
铝与NaOH反应,有氢气产生。
化学方程式:
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
Al与强碱反应才能生成H2
3.与碱反应
4.铝 热 反 应
2Al + Fe2O3 == 2Fe + Al2O3
高温
Al的还原性强,且反应能放
出大量的热,将生成物熔化
发出耀眼的光芒
写方程式:Al与V2O5 、 Al与CrO3
用途:焊接铁轨、冶炼难熔的金属
【阅读思考】
阅读教材中铝热剂内容 ,思考以下问题
1.铝热剂的组成
2.铝热剂的反应原理,为什么生成的铁会熔化?
3.设想铝热剂有哪些用途?
【归纳小结】
铝热剂:
铝粉和某些金属氧化物(Fe2O3、 V2O5、MnO2)组成的混合物。
组成:
原理:
2Al+ Fe2O3 == 2Fe+ Al2O3
高温
用途:
焊接、冶炼金属等
放热
2Al + Fe2O3 = 2Fe + Al2O3
高温
铝热反应的实质是高温下,较活泼的铝置换出较不活泼的金属,工业上常用于冶炼金属。
利用铝的强还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物,这类反应被称为铝热反应。
练一练
和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉
C.氧化钨 D.硫粉
C
密度小
强度高
塑性好
制造工艺简单
成本低
抗腐蚀力强
铝合金的特点
四、应用:
主要用途:
常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。
特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。
合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
问 题 探 究
1、为什么铝制餐具不宜蒸煮或长期存放
有酸性或碱性的食物?
2、相同物质的量的铝与足量的酸或足量的
氢氧化钠反应时,用去的酸和氢氧化钠的
物质的量相等吗?产生的氢气的物质的量
相等吗?
小结:
铝在自然界以化合态形式存在
物理性质及用途
化学性质
与氧气等非金属反应
与酸反应
与强碱溶液反应
与氧化物反应
1.下列关于铝的叙述中,不正确的是:
A.铝属于金属单质,不与任何碱反应
B.铝是地壳中含量最多的金属
C.在常温下,铝不能与氧气反应
D.铝既能与酸反应,也能与强碱反应
AC
课 堂 练 习
2、铝粉投入某无色溶液中产生H2,则下列离子
组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-
AB
课 堂 练 习
3.铝具有较强的抗腐蚀性,主要因为( )
A.铝不活泼
B.具有两性
C.铝与氧气在常温下不反应
D.铝表面在常温下能形成一层致密的氧化物薄膜
D
课 堂 练 习
练习2.可用作制作熔融烧碱的坩埚物质是 ( )
A.铁 B.氧化镁
C.氧化铝 D.钠和钾合金
练习3.在铝土矿制金属制备铝的4个主要操作:①溶解 ②酸化 ③灼热 ④电解中发生了如下类型的反应,按要求写出反应方程式
(1)氧化还原反应________________________
(2)复分解反应______________________________
(3)分解反应______________________________
AB
4.下列离子方程式不正确的是 A.氯气通入水中:Cl2+H2O=2H++Cl-+ClO- B.向偏铝酸钠溶液中通入过量的CO2:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- C.澄清的石灰水中加入碳酸钠: Ca2++CO32-=CaCO3↓ D.氧化铝溶于稀硫酸: Al2O3+6H+=2Al3++3H2O
5.下列物质既能与稀硫酸反应,又能与NaOH溶液反应的是 A.NaHCO3 B.NH4Cl C.Al2O3 D.NaClO
【目标检测】
1.下列反应最后有沉淀生成的是:
A.AlCl3溶液加过量NaOH溶液
B.NaAlO2溶液加过量盐酸
C.石灰水通入过量CO2
D. AlCl3溶液加过量氨水
2.在使溶液中的AlO2-完全转化成Al(OH)3,应选择的最好试剂是:
A.H2SO4 B.HCl C.CO2 D.NH3·H2O
D
C
3.下列关于Al(OH)3的性质的叙述错误的是
A、Al(OH)3 是能溶于NaOH溶液
B、Al(OH)3 能吸附水中的悬浮物,是因为胶体有很强吸附力。
C、Al(OH)3 能溶于氨水
D、Al(OH)3属于两性氢氧化物
C
4.有A、B、C、D是铝元素的化合物,化合物间发生如下反应: ①A+NaOH→D+H2O ②B →A+H2O ③C+ NH3·H2O→B+NH4Cl
④B+NaOH→D+H2O ⑤B+HCl→C+H2O (1)确定物质A、B、C、D的化学式:
A_______,B________,C________,D________。 (2)写出① 、 ④、⑤反应的离子方程式为______________________,
_____________________,
______________________。
Al2O3+2OH- = 2AlO2-+H2O
Al(OH)3+OH- = AlO2-+2H2O
Al(OH)3 + 3H+ = Al3+ + H2O
Al2O3
NaAlO2
AlCl3
Al(OH)3
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好。该佛像未锈蚀的主要原因是 A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应 C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用
【目标检测】
D
2.镁和铝都是较活泼金属,下列叙述正确的是 ①镁易溶于冷水,而铝难溶于冷水 ②铝溶于碱溶液,而镁难溶于碱溶液 ③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸 ④反应中铝失去3个电子而镁失去2个电子,所以铝比镁的还原性强。 A. ① B.③ C.④ D.全部
3.用含少量镁的铝粉制取纯净的Al(OH)3,下列操作步骤恰当的组合是: ①加盐酸溶解②加烧碱溶液溶解③过滤④通入足量二氧化碳⑤加过量烧碱溶液⑥加过量盐酸 A.②③④③ B.①⑤③④③
C.①⑤④③ D.①⑤⑥③
A
A
1.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 A、H2SO4和Ba(OH)2 B、Na2CO3和HCl C、NaAlO2和H2SO4 D、Al2 (SO4)3和NaOH
A
2.下列各组溶液只需通过相互滴加就可以鉴别出来的是 A.NaAlO2溶液和盐酸 B.NaHCO3溶液和Ca(OH)2溶液 C.浓NaOH溶液和浓NH4Cl溶液 D.稀硫酸和碳酸氢钠溶液
A
3.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是 A.Na+ Ba2+ Cl- NO3-
B.H+ NH4+ Al3+ SO42- C.K+ AlO2- NO3- H+
D.H+ Cl- CH3COO- NO3-
A
4.一定量的钠、镁、铝分别与足量盐酸反应,放出的氢气的质量之比为1︰2︰4,则钠、镁、铝三种金属的物质的量之比为 A、1︰1︰1 B4︰2︰1 C、2︰3︰4 D 3︰3︰4
D
1.电解法炼铝时,冰晶石的作用是 ( )
A.助熔剂 B. 催化剂
C.还原剂 D. 氧化剂
2、用于飞机制造业的重要材料的是 ( )
A.Mg-Al合金 B.Cu-Sn合金
C.Al-Si合金 D.不锈钢
A
A
3、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有( )
A. AlO2- B.Cu2+
C.Al3+ D.Mg2+
A
4、在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是( )
A.
B.
C.
D.
D
汇报人:XXX
XX月XX日
苏教版高中化学必修一课件
从铝土矿到铝合金
在19世纪中期,法兰西第二共和国总统拿破仑三世,珍藏着一套铝制的餐具,平时舍不得用,直到国宴时才拿出来炫耀一番,而元素周期表的创始人门捷列夫在受到英国皇家学会的表彰时,得到的却是一只铝杯。为什么拿破仑没有珍藏金制的餐具,而门捷列夫也没有给奖励一只金杯呢?
在19世纪,从铝矿石中提炼铝——极其困难。
电解法——铝才得到普及
生活生产中的铝制品
从铝土矿中提取铝
二:Al2O3两性氧化物
四:铝的应用
三: Al(OH)3两性氢氧化物
一:铝的制备
铝的发现及冶炼变化
铝的发现
德国的沃勒于1827年发现铝
3K + AlCl3 3KCl + Al
一定条件
1886年,美国霍尔用电解法冶炼得到铝
2Al2O3 4Al + 3O2
电解
法国的德维尔于1854年制得铝
氧
49.13%
硅
26%
铝7.73%
铁钙钠钾镁
14.55%
铝的存在
铝在自然界以化合态形式存在,铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)是铝元素在地壳中的主要存在形式之一。
铝元素占地壳总量的7.73%,是地壳中含量最多的金属。
从铝土矿中提取铝
主要成分:Al2O3
少量:Fe2O3、SiO2等杂质
铝土矿的成分:
天然氧化铝—刚玉
红宝石(Al2O3)
蓝宝石(Al2O3)
氧化铝的主要性质:P62、64
(1)物理性质:白色、不溶于水的固体,熔点很高。(红宝石、蓝宝石的主要成分)
(3)化学性质—是典型的两性氧化物
①不与水反应
氧化铝 Al2O3
(2)主要用途:
①作耐火材料:制耐火管、耐火坩埚、耐高温的实验仪器等
②冶炼铝的原料.
② 和酸反应:
Al2O3 +6HCl == 2AlCl3 + 3H2O
Al2O3 + 6H+ ==2Al3+ + 3H2O
(Al2O3表现了碱性氧化物的性质)
③ 和碱反应:
Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3 + 2OH- === 2AlO2- + H2O
(Al2O3表现了酸性氧化物的性质)
问题讨论:
问题1:用NaOH溶液溶解铝土矿的目的是什么?
溶解氧化铝,过滤,从而除去少量的Fe2O3、等杂质
问题2:铝土矿中的氧化铝与氢氧化钠溶液反应,生成偏铝酸钠和水。向偏铝酸钠溶液中通入二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,灼烧氢氧化铝得到氧化铝。请结合工艺流程,写出从铝土矿制备氧化铝过程中发生的化学反应方程式,判断是否为氧化还原反应,是离子反应的写离子方程式。 P63
问题讨论:
2Al(OH)3==Al2O3+3H2O
灼烧
NaAlO2+CO2+2H2O==Al(OH)3 +NaHCO3
2NaOH+Al2O3==2NaAlO2+H2O
溶解
铝土矿
NaOH溶液
过滤
残渣
二氧化碳
酸化
过滤
滤液
灼烧
H2O
电解
铝
2Al2O3==4Al+3O2
电解
铝的制备
Al2O3+2NaOH=2NaAlO2+H2O
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
2Al(OH)3 Al2O3+3H2O
灼烧
2Al2O3 4Al+3O2↑
电解
铝的提取原理
巩固练习
1.从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化钠固体
D.电解熔融的氧化铝
D
2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合的使用须加以控制的是 ( )
①制铝锭 ②制易拉罐 ③制电线、电缆 ④制包糖果用的铝箔 ⑤用明矾净水⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
C
3.电解熔融的氧化铝制取金属铝,若有0.2mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少克?
分析:
2Al2O3 4Al+3O2↑
电解
得12e-
失12e-
由上述知:
2Al2O3 ~ 4Al ~ 转移电子12
2mol 4mol 12mol
0.2mol
将一个用金属铝做的易拉罐内充满CO2,然后
往罐内注入足量的NaOH溶液,立即用胶布密封
罐口。经过一段时间后,罐壁内凹而瘪,再过一段
时间后,瘪了的罐壁重新鼓起来。
(1)罐壁内凹而瘪的原因是___________ ;
(2)罐再鼓起的原因是______________ 。
课 堂 练 习
CO2被NaOH吸收,压强减小
铝和NaOH反应生成H2,压强增大
【课堂小结】
二、铝的制备过程和原理
Al2O3
NaAlO2
Al(OH)3
Al2O3
Al
NaOH
CO2
溶解、过滤
酸化、过滤
灼烧
电解
三、Al2O3的性质
AlCl3
Al
Al(OH)3
通电
+HCl
+CO2
Al2O3
NaAlO2
NaOH
NaOH
△
四.氢氧化铝的性质
1.物理性质
氢氧化铝是几乎不溶于水的白色
胶状固体物质。能凝聚水中悬浮物,
又有吸附色素的性能。
三:氢氧化铝
在氯化铝溶液分两份分别滴加氨水
AlCl3 + 3NH3·H2O =Al(OH)3 + 3NH4Cl
——典型的两性氢氧化物
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
两性氢氧化物:既与酸反应又可与碱反应生成盐和水的氢氧化物。
实验1
实验1的两支试管分别滴加盐酸和氢氧化钠
实验2
现象:出现白色沉淀
现象:白色沉淀都消失
思考
沉淀Al(OH)3
加稀盐酸
沉淀溶解
加NaOH
沉淀溶解
加氨水
沉淀不溶解
AlCl3 + 3NH3·H2O =Al(OH)3↓ + 3NH4Cl
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
注意:Al(OH)3沉淀不溶于弱酸或者弱碱
①Al(OH)3制取
②与强酸反应
③与强碱反应
NaAlO2 + 2H2O+H2O=Al(OH)3 ↓ +NaHCO3
④受热分解
2Al(OH)3 = Al2O3 + 3H2O
△
常用净水剂
电离方程式:KAl(SO4)2 = K++Al3++2SO42-
化学式:KAl(SO4)2·12H2O,是一种复盐。
Al3+ +3H2O = Al(OH)3(胶体) +3H+
吸附能力
五.明矾
Al(OH)3
Al3+
AlO2-
①
②
③
④
⑤
⑥
①Al3+ + 3OH- =Al(OH)3
②Al(OH)3+ OH- = AlO2-+2H2O
③ Al3+ + 4OH- = AlO2-+2H2O
④ AlO2- +H2O+H+= Al(OH)3
⑤ Al(OH)3 +3H+ = Al3+ +3H2O
⑥ AlO2- +4H+= Al3+ + 2H2O
有关方程式
Al3++3OH- =Al(OH)3↓
Al3++4OH- = AlO2- +2H2O
Al3++3NH3·H2O = Al(OH)3 ↓+3 NH4 +
AlO2- +H+ +H2O =Al(OH)3 ↓
AlO2- +4H+ =Al 3+ + 2H2O
2AlO2- +CO2 +3H2O =2 Al(OH)3 ↓ +CO3 2-
AlO2- +CO2 +2H2O = Al(OH)3 ↓ +HCO3-
Al(OH)3+3H+ = Al3+ +3H2O
Al(OH)3+OH- = AlO2- +2H2O 3AlO2- +Al3+ +6H2O=4Al(OH)3↓
1:3
1:4
1:1
1:4
特殊反应: H2O+AlO2- +HCO3 - = Al(OH)3↓+CO32-
铝三角:
NH3·H2O
H+
过量OH-
过量H+
CO2
+H2O
OH-
OH-
H+
Al3+
Al(OH)3
AlO2-
【课堂小结】
一、Al(OH)3的性质
AlCl3
Al
Al(OH)3
通电
+HCl
+CO2
Al2O3
NaAlO2
NaOH
NaOH
△
NH3·H2O
+HCl
+HCl
NaOH
Al(OH)3+NaOH====NaAlO2+2H2O
Al(OH)3+3HCl==== AlCl3 + 3H2O
两性
二、Al(OH)3的制取:
AlCl3 + 3NH3·H2O = Al(OH)3↓+ 3NH4Cl
组成:KAl(SO4)2·12H2O
用途:净水Al3+ + H2O Al(OH)3(胶体)+3H+
三、明矾性质和用途
一.铝的物理性质和用途
物理性质 用途
用途不一的各种铝合金
易加工成各种形状,
包装、装饰工艺,
铝箔、铝丝、银粉涂料
铝锅、铝壶等加热器具
铝芯电线、电缆
银白色,有金属光泽
质地较软,延展性好
导热性能好
导电性能较好
密度小、熔点低、硬度小
一、铝的物理性质
银白色金属,密度小、良好的导电导热性和延展性。
复习与思考
铝的原子结构特点及在金属活动顺序表中的位置
Al-3e- == Al3+
Al的化学性质活泼,
具有较强还原性
K Ca Na Mg Zn Fe Sn Pb H Cu Hg …
Al
思考:铝是一种较活泼的金属,那为什么其在空气中不易被腐蚀呢?
1.与O2的反应:4Al + 3O2 = 2Al2O3
想一想:
有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?
(二)铝的化学性质:
二.铝的化学性质
生活与思考
铝是一种较活泼的金属,那为什么其在
空气中不易被腐蚀呢?
1.与O2的反应:4Al + 3O2 == 2Al2O3
铝在氧气中点燃可以看到耀眼的白光
有人对铝制品因为表面氧化出现灰色而总感到
不美观,所以常用钢丝球进行擦洗,你认为有
必要吗?为什么?
铝具有导热性。常温下铝的表面被氧化,生成
一层致密氧化物薄膜而具有抗腐蚀性。若擦去,
会导致铝制品快速被腐蚀
能写出Al和S、Cl2反应的化学方程式吗?
点燃
观察与思考并完成P66表格
把铝分别加入浓硝酸、浓硫酸、盐酸中
2Al+6HCl=2AlCl3+3H2↑
②铝能将稀硫酸、盐酸中的H+置换成H2
①冷的浓硝酸,浓硫酸使铝表面钝化!
生活应用:浓硝酸、浓硫酸的运输
2.与酸反应
铝比铁活泼,为什么铝反而耐腐蚀?铝制品表面不光洁时,能否用用硬物来擦洗?
【问题情境】
【观察思考】
观察铝片浸入NaOH溶液的 实验,观察并思考以下问题:
1.浸入NaOH溶液的铝片颜色有什么变化?为什么?
2.有无气泡冒出?静置较长一段时间后呢?为什么?
【活动与探究】
铝的性质
实验 实验现象 结论或化学方程式
1.盐酸
2.NaOH溶液
3.浓硝酸
4.浓硫酸
有无色无味气体放出
有无色无味气体放出
无明显现象
无明显现象
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
钝化
钝化
【交流讨论】
1.为什么铝与浓酸反而没有气体生成了?
2.从原子守恒的角度推断铝与氢氧化钠溶液反应生成的气体是什么气体?
3. 分析两反应的电子得失,实质上有什么共同之处?
【归纳小结】
铝的两性
2Al+6HCl= 2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
钝化:
铝与到浓硫酸、浓硝酸,会在铝的表面反应生成一层致密的氧化物保护膜。
铝的两性
试一试
将表面已完全钝化的铝条投入下列溶液中,
不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
C
把铝加入到NaOH溶液中
现象:
铝与NaOH反应,有氢气产生。
化学方程式:
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
Al与强碱反应才能生成H2
3.与碱反应
4.铝 热 反 应
2Al + Fe2O3 == 2Fe + Al2O3
高温
Al的还原性强,且反应能放
出大量的热,将生成物熔化
发出耀眼的光芒
写方程式:Al与V2O5 、 Al与CrO3
用途:焊接铁轨、冶炼难熔的金属
【阅读思考】
阅读教材中铝热剂内容 ,思考以下问题
1.铝热剂的组成
2.铝热剂的反应原理,为什么生成的铁会熔化?
3.设想铝热剂有哪些用途?
【归纳小结】
铝热剂:
铝粉和某些金属氧化物(Fe2O3、 V2O5、MnO2)组成的混合物。
组成:
原理:
2Al+ Fe2O3 == 2Fe+ Al2O3
高温
用途:
焊接、冶炼金属等
放热
2Al + Fe2O3 = 2Fe + Al2O3
高温
铝热反应的实质是高温下,较活泼的铝置换出较不活泼的金属,工业上常用于冶炼金属。
利用铝的强还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物,这类反应被称为铝热反应。
练一练
和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉
C.氧化钨 D.硫粉
C
密度小
强度高
塑性好
制造工艺简单
成本低
抗腐蚀力强
铝合金的特点
四、应用:
主要用途:
常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。
特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。
合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
问 题 探 究
1、为什么铝制餐具不宜蒸煮或长期存放
有酸性或碱性的食物?
2、相同物质的量的铝与足量的酸或足量的
氢氧化钠反应时,用去的酸和氢氧化钠的
物质的量相等吗?产生的氢气的物质的量
相等吗?
小结:
铝在自然界以化合态形式存在
物理性质及用途
化学性质
与氧气等非金属反应
与酸反应
与强碱溶液反应
与氧化物反应
1.下列关于铝的叙述中,不正确的是:
A.铝属于金属单质,不与任何碱反应
B.铝是地壳中含量最多的金属
C.在常温下,铝不能与氧气反应
D.铝既能与酸反应,也能与强碱反应
AC
课 堂 练 习
2、铝粉投入某无色溶液中产生H2,则下列离子
组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-
AB
课 堂 练 习
3.铝具有较强的抗腐蚀性,主要因为( )
A.铝不活泼
B.具有两性
C.铝与氧气在常温下不反应
D.铝表面在常温下能形成一层致密的氧化物薄膜
D
课 堂 练 习
练习2.可用作制作熔融烧碱的坩埚物质是 ( )
A.铁 B.氧化镁
C.氧化铝 D.钠和钾合金
练习3.在铝土矿制金属制备铝的4个主要操作:①溶解 ②酸化 ③灼热 ④电解中发生了如下类型的反应,按要求写出反应方程式
(1)氧化还原反应________________________
(2)复分解反应______________________________
(3)分解反应______________________________
AB
4.下列离子方程式不正确的是 A.氯气通入水中:Cl2+H2O=2H++Cl-+ClO- B.向偏铝酸钠溶液中通入过量的CO2:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- C.澄清的石灰水中加入碳酸钠: Ca2++CO32-=CaCO3↓ D.氧化铝溶于稀硫酸: Al2O3+6H+=2Al3++3H2O
5.下列物质既能与稀硫酸反应,又能与NaOH溶液反应的是 A.NaHCO3 B.NH4Cl C.Al2O3 D.NaClO
【目标检测】
1.下列反应最后有沉淀生成的是:
A.AlCl3溶液加过量NaOH溶液
B.NaAlO2溶液加过量盐酸
C.石灰水通入过量CO2
D. AlCl3溶液加过量氨水
2.在使溶液中的AlO2-完全转化成Al(OH)3,应选择的最好试剂是:
A.H2SO4 B.HCl C.CO2 D.NH3·H2O
D
C
3.下列关于Al(OH)3的性质的叙述错误的是
A、Al(OH)3 是能溶于NaOH溶液
B、Al(OH)3 能吸附水中的悬浮物,是因为胶体有很强吸附力。
C、Al(OH)3 能溶于氨水
D、Al(OH)3属于两性氢氧化物
C
4.有A、B、C、D是铝元素的化合物,化合物间发生如下反应: ①A+NaOH→D+H2O ②B →A+H2O ③C+ NH3·H2O→B+NH4Cl
④B+NaOH→D+H2O ⑤B+HCl→C+H2O (1)确定物质A、B、C、D的化学式:
A_______,B________,C________,D________。 (2)写出① 、 ④、⑤反应的离子方程式为______________________,
_____________________,
______________________。
Al2O3+2OH- = 2AlO2-+H2O
Al(OH)3+OH- = AlO2-+2H2O
Al(OH)3 + 3H+ = Al3+ + H2O
Al2O3
NaAlO2
AlCl3
Al(OH)3
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好。该佛像未锈蚀的主要原因是 A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应 C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用
【目标检测】
D
2.镁和铝都是较活泼金属,下列叙述正确的是 ①镁易溶于冷水,而铝难溶于冷水 ②铝溶于碱溶液,而镁难溶于碱溶液 ③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸 ④反应中铝失去3个电子而镁失去2个电子,所以铝比镁的还原性强。 A. ① B.③ C.④ D.全部
3.用含少量镁的铝粉制取纯净的Al(OH)3,下列操作步骤恰当的组合是: ①加盐酸溶解②加烧碱溶液溶解③过滤④通入足量二氧化碳⑤加过量烧碱溶液⑥加过量盐酸 A.②③④③ B.①⑤③④③
C.①⑤④③ D.①⑤⑥③
A
A
1.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 A、H2SO4和Ba(OH)2 B、Na2CO3和HCl C、NaAlO2和H2SO4 D、Al2 (SO4)3和NaOH
A
2.下列各组溶液只需通过相互滴加就可以鉴别出来的是 A.NaAlO2溶液和盐酸 B.NaHCO3溶液和Ca(OH)2溶液 C.浓NaOH溶液和浓NH4Cl溶液 D.稀硫酸和碳酸氢钠溶液
A
3.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是 A.Na+ Ba2+ Cl- NO3-
B.H+ NH4+ Al3+ SO42- C.K+ AlO2- NO3- H+
D.H+ Cl- CH3COO- NO3-
A
4.一定量的钠、镁、铝分别与足量盐酸反应,放出的氢气的质量之比为1︰2︰4,则钠、镁、铝三种金属的物质的量之比为 A、1︰1︰1 B4︰2︰1 C、2︰3︰4 D 3︰3︰4
D
1.电解法炼铝时,冰晶石的作用是 ( )
A.助熔剂 B. 催化剂
C.还原剂 D. 氧化剂
2、用于飞机制造业的重要材料的是 ( )
A.Mg-Al合金 B.Cu-Sn合金
C.Al-Si合金 D.不锈钢
A
A
3、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有( )
A. AlO2- B.Cu2+
C.Al3+ D.Mg2+
A
4、在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是( )
A.
B.
C.
D.
D
