苏教版(2019)高化 必修第一册 铁、铜的获取及应用 课时1(共27张PPT)
文档属性
| 名称 | 苏教版(2019)高化 必修第一册 铁、铜的获取及应用 课时1(共27张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 16:23:43 | ||
图片预览







文档简介
(共27张PPT)
汇报人:XXX
XX月XX日
苏教版高中化学必修一课件
铁、铜的获取及应用
1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。
2、铁和铜都有良好的导电性和导热性。
3、铁和铜的密度较大,熔沸点较高。
一、单质的物理性质
二、单质化学性质
2Fe+3Cl2
点燃
2FeCl3
点燃
Cu+Cl2
CuCl2
3Fe+2O2
点燃
Fe3O4
不反应
Fe+2HCl
FeCl2+H2
Cu+2AgNO3
2Ag+Cu(NO3)2
Fe+CuSO4
FeSO4+Cu
△
2Cu+O2
2CuO
与非金属反应
与盐酸反应
与盐溶液反应
Fe
Cu
①铜在反应中一般转化为+2价铜的化合物。
特别提醒
②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。
③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。
鉴别方法 Fe2+ Fe3+
观察溶液颜色 浅绿色 棕黄色
与KSCN反应 无明显现象 溶液变为血红色
与NaOH反应 白色沉淀迅速变灰
绿色最后呈红褐色 立即产生红褐色沉淀
三、Fe2+与Fe3+的鉴别
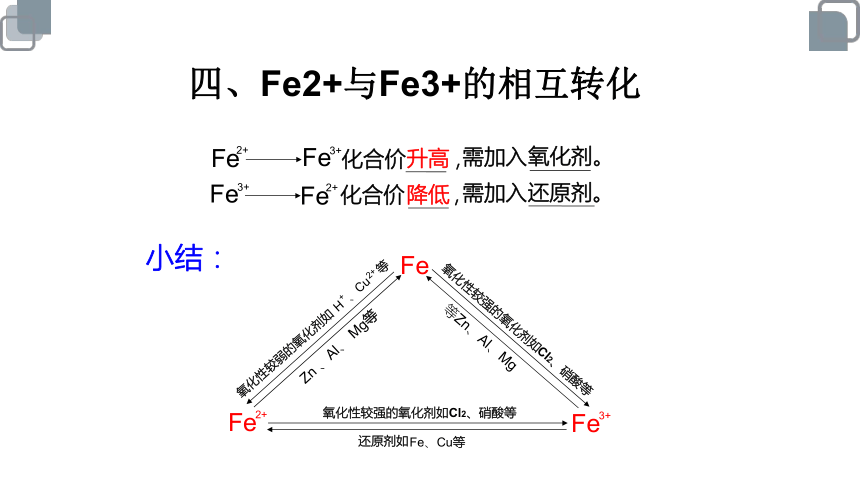
Fe
2+
小结:
Fe
3+
氧化性较强的氧化剂如Cl2、硝酸等
还原剂如
Fe、Cu等
Fe
2+
Fe
3+
化合价 ,
升高
需加入
氧化剂。
还原剂。
降低
Fe
3+
Fe
2+
化合价 ,
需加入
Fe
氧化性较弱的氧化剂如 H 、Cu 等
+
2+
氧化性较强的氧化剂如Cl2、硝酸等
Zn 、Al、 Mg等
等Zn、Al、Mg
四、Fe2+与Fe3+的相互转化
五、铁及铜的化合物的应用
1.铁的化合物
①Fe2O3作颜料
②氯化铁、硫酸亚铁可作净水剂
③作磁性材料
④维持生命的微量元素
2.铜的化合物:
铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病
2Fe3++Cu=2Fe2++Cu2+
练习:
1、向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )
B
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN不能形成红色物质
D.Fe2+被氯水氧化为Fe3+
练习:
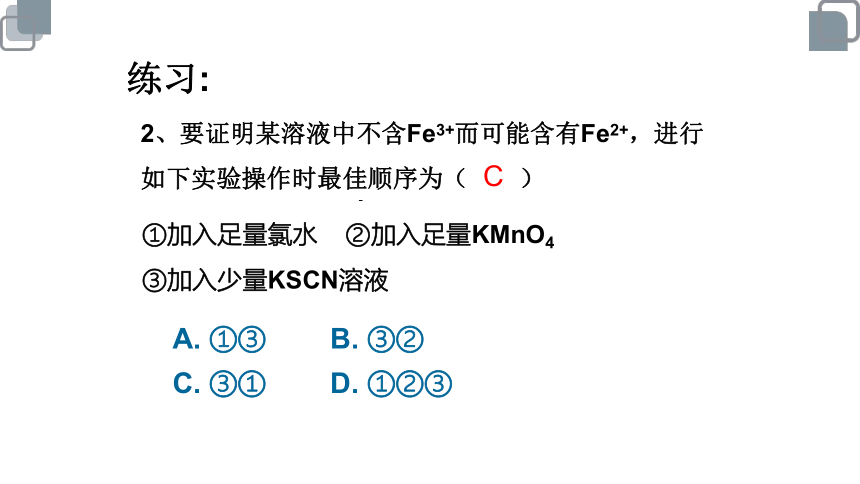
①加入足量氯水 ②加入足量KMnO4
③加入少量KSCN溶液
A. ①③ B. ③②
C. ③① D. ①②③
C
-
2、要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
金属材料包括纯金属和合金,如钢铁、铜、铝、各种合金及一些新型金属材料等
钢铁腐蚀占年产量的十分之一
钢铁生锈
铜也会生锈
金属的腐蚀
金属表面与周围介质(如O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀。
化学腐蚀
电化学腐蚀
?
金属腐蚀:金属材料受周围介质的作用而损坏
一般情况下,温度升高会加快化学反应速率。因此,温度对化学腐蚀的影响较明显。
化学腐蚀
燃气灶中心部位的锈蚀
存放在南极的食品罐头
电化学腐蚀形成条件:不纯金属、电解质环境。
电化学腐蚀
不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
电化学腐蚀特征:原电池反应,并伴有电流的产生。
吸氧腐蚀:(钢铁表面的水膜呈中性或弱酸性)
Fe(负极):2Fe - 4e-=2Fe2+
C(正极):2H2O + O2 + 4e-=4OH-
吸氧腐蚀
析氢腐蚀:(钢铁表面的水膜呈酸性)
Fe(负极):Fe - 2e-=Fe2+
C(正极):2H+ + 2e-=H2↑
析氢腐蚀
在常温下,只要存在发生电化学腐蚀的条件,金属腐蚀的过程就是电化学腐蚀,而吸氧腐蚀又占其中的绝大部分。
金属保护
表面保护
电化学保护
改变金属成分
涂油漆
覆盖搪瓷或塑料
电镀
外加电流的阴极保护
牺牲阳极的阴极保护
制成合金
表面保护:包括涂层保护和镀层保护
刚玉(陶瓷)层
过渡层
钢管层
耐磨、耐蚀输送管道
铝材电镀着色
冷镀锌丝
电化学保护:
⑴外加直流电源的阴极保护法
外加一个直流电源,把电源输出电子的一极接到被保护的金属部件上,金属就会得到保护
⑵牺牲阳极的阴极保护法
在被保护的金属上连接更活泼的金属
三峡船闸
防锈方法的选择
●使用期限要多久?很明显,如果物品只需保存很短的时间,就没有必要去考虑给它一个长久的保护。
●在什么场合使用?如果物品主要用于室外,它就需要较好地进行保护;物品要接受高温,就不能用油漆进行保护。
●外观是否很重要?某些保护方法也是为了装饰外观用的.例如,镀铬。
●经济上是否合算?
金属蚀刻板画
金属蚀刻过滤网
金属腐蚀的利用
汇报人:XXX
XX月XX日
苏教版高中化学必修一课件
铁、铜的获取及应用
1、铁是可以被磁铁吸引的银白色金属
铜是紫红色的金属。
2、铁和铜都有良好的导电性和导热性。
3、铁和铜的密度较大,熔沸点较高。
一、单质的物理性质
二、单质化学性质
2Fe+3Cl2
点燃
2FeCl3
点燃
Cu+Cl2
CuCl2
3Fe+2O2
点燃
Fe3O4
不反应
Fe+2HCl
FeCl2+H2
Cu+2AgNO3
2Ag+Cu(NO3)2
Fe+CuSO4
FeSO4+Cu
△
2Cu+O2
2CuO
与非金属反应
与盐酸反应
与盐溶液反应
Fe
Cu
①铜在反应中一般转化为+2价铜的化合物。
特别提醒
②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。
③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。
鉴别方法 Fe2+ Fe3+
观察溶液颜色 浅绿色 棕黄色
与KSCN反应 无明显现象 溶液变为血红色
与NaOH反应 白色沉淀迅速变灰
绿色最后呈红褐色 立即产生红褐色沉淀
三、Fe2+与Fe3+的鉴别
Fe
2+
小结:
Fe
3+
氧化性较强的氧化剂如Cl2、硝酸等
还原剂如
Fe、Cu等
Fe
2+
Fe
3+
化合价 ,
升高
需加入
氧化剂。
还原剂。
降低
Fe
3+
Fe
2+
化合价 ,
需加入
Fe
氧化性较弱的氧化剂如 H 、Cu 等
+
2+
氧化性较强的氧化剂如Cl2、硝酸等
Zn 、Al、 Mg等
等Zn、Al、Mg
四、Fe2+与Fe3+的相互转化
五、铁及铜的化合物的应用
1.铁的化合物
①Fe2O3作颜料
②氯化铁、硫酸亚铁可作净水剂
③作磁性材料
④维持生命的微量元素
2.铜的化合物:
铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病
2Fe3++Cu=2Fe2++Cu2+
练习:
1、向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )
B
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN不能形成红色物质
D.Fe2+被氯水氧化为Fe3+
练习:
①加入足量氯水 ②加入足量KMnO4
③加入少量KSCN溶液
A. ①③ B. ③②
C. ③① D. ①②③
C
-
2、要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
金属材料包括纯金属和合金,如钢铁、铜、铝、各种合金及一些新型金属材料等
钢铁腐蚀占年产量的十分之一
钢铁生锈
铜也会生锈
金属的腐蚀
金属表面与周围介质(如O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀。
化学腐蚀
电化学腐蚀
?
金属腐蚀:金属材料受周围介质的作用而损坏
一般情况下,温度升高会加快化学反应速率。因此,温度对化学腐蚀的影响较明显。
化学腐蚀
燃气灶中心部位的锈蚀
存放在南极的食品罐头
电化学腐蚀形成条件:不纯金属、电解质环境。
电化学腐蚀
不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
电化学腐蚀特征:原电池反应,并伴有电流的产生。
吸氧腐蚀:(钢铁表面的水膜呈中性或弱酸性)
Fe(负极):2Fe - 4e-=2Fe2+
C(正极):2H2O + O2 + 4e-=4OH-
吸氧腐蚀
析氢腐蚀:(钢铁表面的水膜呈酸性)
Fe(负极):Fe - 2e-=Fe2+
C(正极):2H+ + 2e-=H2↑
析氢腐蚀
在常温下,只要存在发生电化学腐蚀的条件,金属腐蚀的过程就是电化学腐蚀,而吸氧腐蚀又占其中的绝大部分。
金属保护
表面保护
电化学保护
改变金属成分
涂油漆
覆盖搪瓷或塑料
电镀
外加电流的阴极保护
牺牲阳极的阴极保护
制成合金
表面保护:包括涂层保护和镀层保护
刚玉(陶瓷)层
过渡层
钢管层
耐磨、耐蚀输送管道
铝材电镀着色
冷镀锌丝
电化学保护:
⑴外加直流电源的阴极保护法
外加一个直流电源,把电源输出电子的一极接到被保护的金属部件上,金属就会得到保护
⑵牺牲阳极的阴极保护法
在被保护的金属上连接更活泼的金属
三峡船闸
防锈方法的选择
●使用期限要多久?很明显,如果物品只需保存很短的时间,就没有必要去考虑给它一个长久的保护。
●在什么场合使用?如果物品主要用于室外,它就需要较好地进行保护;物品要接受高温,就不能用油漆进行保护。
●外观是否很重要?某些保护方法也是为了装饰外观用的.例如,镀铬。
●经济上是否合算?
金属蚀刻板画
金属蚀刻过滤网
金属腐蚀的利用
