苏教版(2019) 必修第一册 专题1 第三单元 人类对原子结构的认识(1)(共19张PPT)
文档属性
| 名称 | 苏教版(2019) 必修第一册 专题1 第三单元 人类对原子结构的认识(1)(共19张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-12 16:27:05 | ||
图片预览





文档简介
(共19张PPT)
汇报人:XXX
XX月XX日
人类对原子结构的认识
苏教版高中化学必修一课件
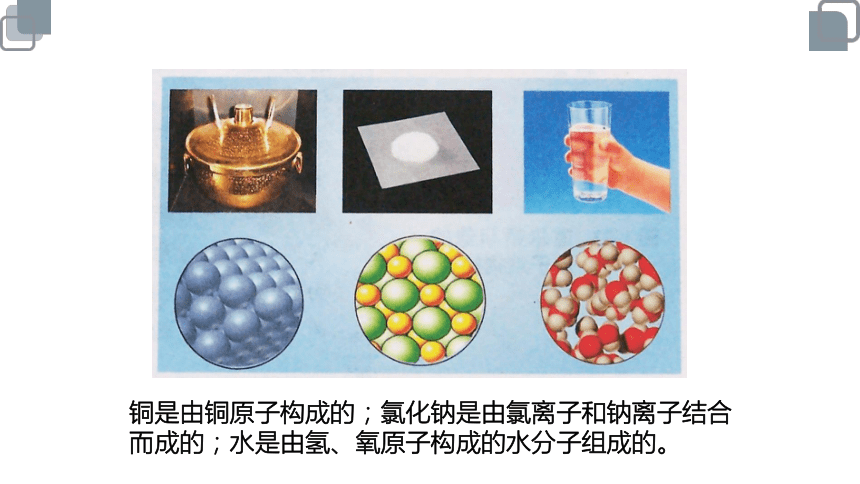
铜是由铜原子构成的;氯化钠是由氯离子和钠离子结合而成的;水是由氢、氧原子构成的水分子组成的。
公元前5世纪,希腊哲学家德谟克利特等人认为,万物是由大量的不可分割的微粒即原子构成。
1803年,英国科学家道尔顿总结了一些元素化合时的质量比例关系,阐述了他的化学原子论。
物质是由原子组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,在化学反应中保持本性不变。
1897年,汤姆生提出新的原子结构模型。
汤姆生认为,正电荷均匀地分布在原子之中,而电子就像是面包中的葡萄干一样散布在原子的正电荷之中。
汤姆生的原子结构模型
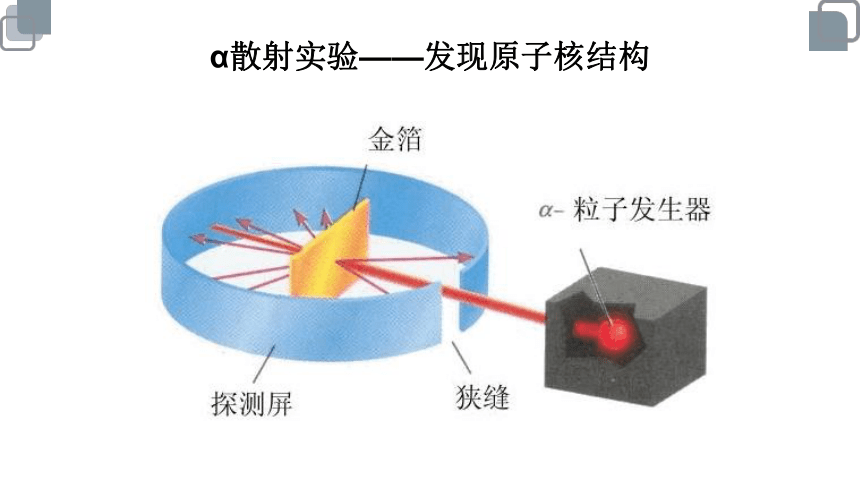
α散射实验——发现原子核结构
玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称轨道模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
20世纪初,科学家发现了中子,揭示了微观世界波粒二象性规律、认识到原子核外电子的运动不遵循经典力学的原理,建立用量子力学方法描述核外电子运动的数学模型。
道尔顿模型(1803)
汤姆生模型(1904)
卢瑟福模型(1911)
波尔模型(1913)
提出问题:核外电子是如何分层排布的呢?
得出结论:
2、第一层最多排2个电子,第二层最多排
8个电子,最外层最多排8个电子。
3、稀有气体最外层是2个或8个,达到
稳定结构。
原子核
核电荷数
电子
第一电子层
第二电子层
第三电子层
(最外层)
1、每层最多容纳电子数2n2(n表示电子 层数)
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
12
第1层
第2层
第3层
2
8
2
原子结构示意图
原子核
核电荷数
该电子层上的电子
电子层
原子核
原子核带正电
核电荷数
+12
Mg2+
2 8
2
Mg
+8
O2-
2
6
O
8
Mg2+
+12
2 8
O2-
+8
2
8
MgO
原子结构示意图与离子结构示意图辨别
原子: 核电荷数=外层电子总数
阳离子:核电荷数>外层电子总数
阴离子:核电荷数<外层电子总数
2 8 8
+16
辨别左图是原子还是离子结构示意图
1.化学反应中,原子核不发生变化,但原子的核外电子排布发生变化,最外层电子影响元素的化学性质。
2.镁等金属元素的原子,最外层电子数较少,与活泼非金属反应时,易失电子,形成8电子的稳定结构。
3.氧、氯等非金属元素的原子,最外层电子数较多,与活泼金属反应时,易得电子,形成8电子的稳定结构。
寻找规律
分析NaCl、MgO中各元素的化合价,找出化合价与得失电子的数目的关系。
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
+1
1
失去1
+2
失去2
-2
得到2
7
得到1
练习巩固
1、19世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生
2 、已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( ) A. Ne B. Mg C. S D. C
3、A元素的最外层有3个电子,B元素的最外层有7个电子,当他们得到或失去电子形成稳定的化合物时,A的化合价为( ),B的化合价为( ),A与B形成的化合物化学式为( )
+3
-1
AB3
4. 下列微粒结构示意图是否正确?如有错误,指出错误的原因。
5、用下面的结构示意图的字母填空:
(1)属于非金属原子的是( );
(2)属于离子结构示意图的是( );
(3)具有稳定结构的是( )。
B
C
C
汇报人:XXX
XX月XX日
人类对原子结构的认识
苏教版高中化学必修一课件
铜是由铜原子构成的;氯化钠是由氯离子和钠离子结合而成的;水是由氢、氧原子构成的水分子组成的。
公元前5世纪,希腊哲学家德谟克利特等人认为,万物是由大量的不可分割的微粒即原子构成。
1803年,英国科学家道尔顿总结了一些元素化合时的质量比例关系,阐述了他的化学原子论。
物质是由原子组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,在化学反应中保持本性不变。
1897年,汤姆生提出新的原子结构模型。
汤姆生认为,正电荷均匀地分布在原子之中,而电子就像是面包中的葡萄干一样散布在原子的正电荷之中。
汤姆生的原子结构模型
α散射实验——发现原子核结构
玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称轨道模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
20世纪初,科学家发现了中子,揭示了微观世界波粒二象性规律、认识到原子核外电子的运动不遵循经典力学的原理,建立用量子力学方法描述核外电子运动的数学模型。
道尔顿模型(1803)
汤姆生模型(1904)
卢瑟福模型(1911)
波尔模型(1913)
提出问题:核外电子是如何分层排布的呢?
得出结论:
2、第一层最多排2个电子,第二层最多排
8个电子,最外层最多排8个电子。
3、稀有气体最外层是2个或8个,达到
稳定结构。
原子核
核电荷数
电子
第一电子层
第二电子层
第三电子层
(最外层)
1、每层最多容纳电子数2n2(n表示电子 层数)
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
12
第1层
第2层
第3层
2
8
2
原子结构示意图
原子核
核电荷数
该电子层上的电子
电子层
原子核
原子核带正电
核电荷数
+12
Mg2+
2 8
2
Mg
+8
O2-
2
6
O
8
Mg2+
+12
2 8
O2-
+8
2
8
MgO
原子结构示意图与离子结构示意图辨别
原子: 核电荷数=外层电子总数
阳离子:核电荷数>外层电子总数
阴离子:核电荷数<外层电子总数
2 8 8
+16
辨别左图是原子还是离子结构示意图
1.化学反应中,原子核不发生变化,但原子的核外电子排布发生变化,最外层电子影响元素的化学性质。
2.镁等金属元素的原子,最外层电子数较少,与活泼非金属反应时,易失电子,形成8电子的稳定结构。
3.氧、氯等非金属元素的原子,最外层电子数较多,与活泼金属反应时,易得电子,形成8电子的稳定结构。
寻找规律
分析NaCl、MgO中各元素的化合价,找出化合价与得失电子的数目的关系。
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
+1
1
失去1
+2
失去2
-2
得到2
7
得到1
练习巩固
1、19世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学家是( )
A、法国的拉瓦锡 B、瑞典的舍勒
C、英国的道尔顿 D、英国的汤姆生
2 、已知最外层电子数相等的元素原子具有相似化学性质。下列原子中,与氧元素原子的化学性质相似的是( ) A. Ne B. Mg C. S D. C
3、A元素的最外层有3个电子,B元素的最外层有7个电子,当他们得到或失去电子形成稳定的化合物时,A的化合价为( ),B的化合价为( ),A与B形成的化合物化学式为( )
+3
-1
AB3
4. 下列微粒结构示意图是否正确?如有错误,指出错误的原因。
5、用下面的结构示意图的字母填空:
(1)属于非金属原子的是( );
(2)属于离子结构示意图的是( );
(3)具有稳定结构的是( )。
B
C
C
