第三章 铁 金属材料 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 545.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 13:03:20 | ||
图片预览




文档简介
第三章 铁金属材料 测试题
一、选择题
1.化学焊接技术的原理之一是利用焊剂(主要成分为Al与CaO)在高温下反应制得液态金属(或合金),凝固后,除去焊接点表面的焊渣,实现焊件金属的焊接。下列说法错误的是
A.Al与Fe2O3也能发生类似反应
B.焊渣的主要成分是Al(OH)3
C.焊接前可用还原性气体在加热条件下除去焊件金属表面的氧化膜
D.若在反应体系中加入低熔点金属,则可形成低熔点液态合金便于焊接
2.某混合物可能含有Al、Cu、、,为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析错误的是
A.固体P一定是纯净物
B.若,则原混合物中可能含有Al
C.蓝绿色溶液中一定含有的金属阳离子为、
D.向溶液N中通入足量的,一定可观察到有白色沉淀生成
3.化学与生活息息相关,以下说法正确的是
A.漂白粉、漂白液和漂粉精可用于游泳池等场所的消毒剂
B.Cl2具有漂白性,所以可以漂白有色布条
C.铁生锈过程中未涉及到氧化还原反应
D.铝表面容易生成一层致密的氧化膜,所以铝制品可以长期存放酸性或碱性食物。
4.下列物质无法通过单质与直接化合生成的是
A. B.NO C. D.
5.下列有关“实验操作”、“现象”及“实验结论”都正确的是
选项 实验操作 现象 实验结论
A 将氯气通入到紫色石蕊试液中 观察溶液先变红后褪色 氯气具有漂白性
B 在CO还原,得到的黑色固体中加入盐酸,固体溶解,再加入KSCN溶液 溶液不显血红色 黑色固体一定是Fe
C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 金属铝熔化而不滴落下来 金属铝熔点比氧化铝低
D 分别加热碳酸钠与碳酸氢钠固体 试管内壁均出现水珠 两种固体均受热分解
A.A B.B C.C D.D
6.下列离子方程式书写正确的是:
A.常温下,铝遇到浓硝酸:
B.少量通入NaClO溶液中:
C.向溶液中加入过量NaOH溶液并加热:
D.向溶液中加溶液至中性:
7.下列说法不正确的是
A.赤铁矿的主要成分是Fe3O4
B.目前我国流通的硬币是由合金材料制造的
C.铝制品在生活中非常普遍,这是因为表面覆盖着氧化膜,对内部金属起保护作用
D.由镍、铁、碳、钴组成的合金可以制造喷气式飞机的发动机叶片,能承受1100℃的高温
8.下列操作不能达到实验目的的是
选项 目的 操作
A 测定氯水的pH 用玻璃棒蘸取饱和氯水点在置于玻璃片的pH试纸上,稍后与标准比色卡对照
B 检验某溶液中只含不含 先向该溶液中滴加KSCN溶液,再滴加少量氯水
C 制取氢氧化铁胶体 向40 mL沸水中滴加5~6滴饱和溶液,继续煮沸直到形成红褐色液体停止加热
D 验证的还原性强于 向溶液中加入少量氯水,再加,振荡
A.A B.B C.C D.D
9.下列物质对应的俗称错误的是
A.:过氧化氢 B.:纯碱
C.:磁性氧化铁 D.:苛性钠
10.下列物质的俗称与化学式不一致的是
A.熟石灰——CaO B.纯碱——
C.铁红—— D.食盐——NaCl
11.中国传统文化和历史文物中蕴藏着丰富的化学知识,下列说法错误的是
A.“天接云涛连晓雾”中“雾”、“云”属于胶体
B.“以火烧之,紫青烟起,乃真硝石也”,硝石中含有钾元素
C.“方家以磁石磨针锋,则能指南”中的磁石主要成分为。
D.“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,铁合金的硬度和熔点比纯铁高
12.下列实验现象与氧化还原反应无关的是
A.过氧化钠放置于空气中逐渐变白
B.将生石灰投入溶液中,产生白色沉淀
C.通入硝酸酸化的溶液中,产生白色沉淀
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色
二、非选择题
13.Fe与Cl2在一定条件下恰好完全反应。将产物溶于水,置于两支试管中。
(1)向第一支试管中滴加KSCN溶液,溶液呈 色;
(2)向第二支试管中加入足量铁粉,振荡,反应的离子方程式是 ;静置后,取上层清液于另一支试管中,滴加NaOH溶液,可以观察到的现象是 ,反应的化学方程式是 。
14.地壳中含量最多的金属元素是 ,它处于元素周期表的位置是 , 。将其单质除出表面保护膜后,放入硝酸汞溶液反应一会儿取出,吸干表面溶液静置会观察到的现象是 ,该现象可用化学反应方程式可表示为 ,写出该反应产物分别与盐酸、氢氧化钠溶液反应的化学方程式: , 。
15.完成下列化学方程式
(1)过氧化钠与二氧化碳反应
(2)工业制漂白粉
(3)氧化铝溶于氢氧化钠
(4)氢氧化亚铁在空气中被氧化
(5)铁与水蒸气高温下反应
16.向和组成的混合物中加入溶于某浓度的盐酸,恰好完全反应,生成标准状况下,若向反应后的溶液中滴入几滴溶液,溶液不呈红色。试求:
(1)原混合物中的质量为 。
(2)所用盐酸的物质的量浓度是 。(保留3位有效数字)
17.(1)含0.4molAl3+的Al2(SO4)3中所含的的物质的量是 。
(2)0.2molNH3与 gH2O具有相同的氢原子数。
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳,原子总数之比为 。
(4)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是 ,混合气体的平均摩尔质量是 。
(5)200mL0.25mol·L-1的NaOH溶液与足量Al完全反应。计算在标准状况下生成H2的体积为 L
18.把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。则:
(1)混合溶液中H+、Cu2+、的物质的量浓度分别为: ;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度为 ;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式 ,并计算残渣的质量 (不计操作带来的损失)。
19.有一无色溶液.其中可能含有Fe3+、Al3+、Na+、Mg2+、Cu2+、NH、K+、CO、SO 等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)焰色反应是 (填“物理”或“化学”)变化。
(2)原溶液中一定存在的离子有 (写离子符号,下同),可能存在的离子有 。
(3)实验③中产生的白色沉淀的成分可能是 。
(4)若100mL原溶液中K+的物质的量为0.06mol,则c(Na+)= 。
20.A、B、C、D、X、Y六种物质之间有如图所示转化关系,请回答下列问题。
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是 (填序号)。
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为 ;将32g铜与200mL一定浓度的D溶液发生反应,铜完全溶解,产生B和C混合气体的体积为11.2L(标准状况),待产生的气体全部释放后,向溶液中加入500mL3.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为 mol/L。
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为 ;向C溶液中加入Y溶液,可观察到的现象是 ;B溶液常用于蚀刻印刷电路铜板,若将该反应设计成原电池,负极电极反应式为 。
(3)若X是酸性氧化物CO2,B俗称纯碱,A、B、C、D四种物质的焰色试验均为黄色,请写出A与C反应生成B的离子方程式 。
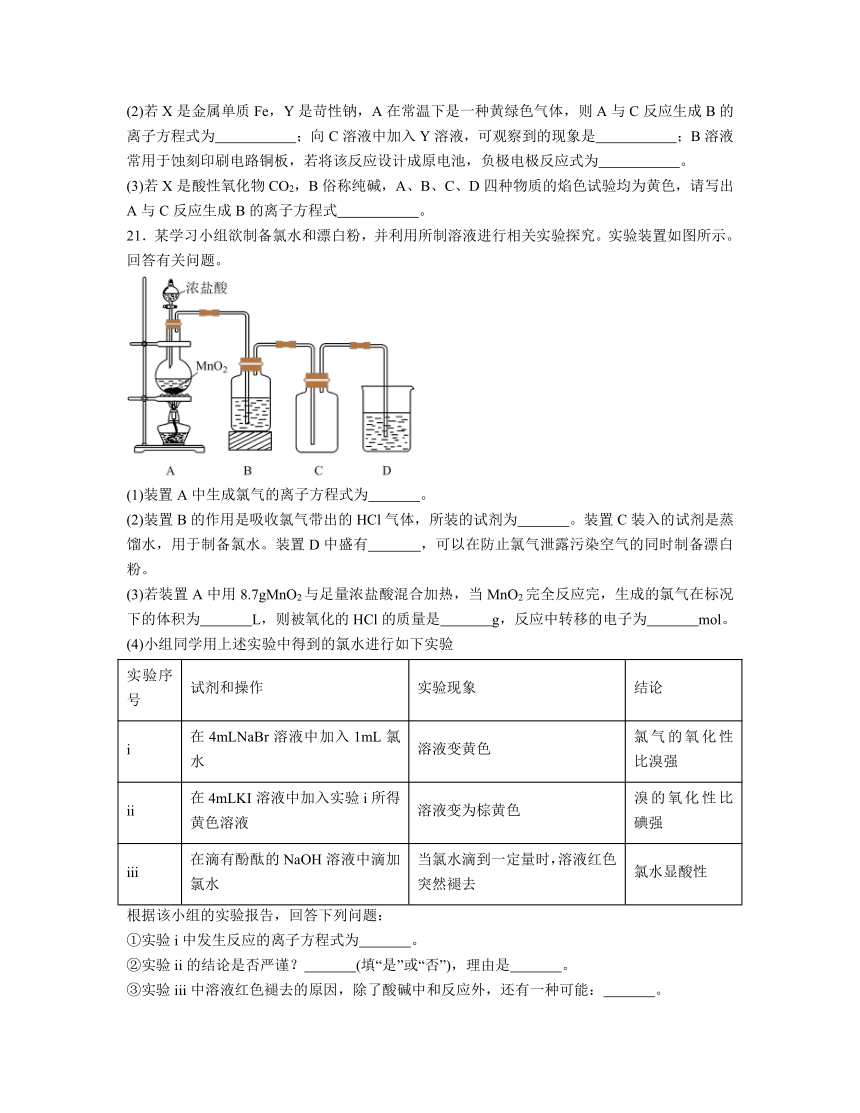
21.某学习小组欲制备氯水和漂白粉,并利用所制溶液进行相关实验探究。实验装置如图所示。回答有关问题。
(1)装置A中生成氯气的离子方程式为 。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为 。装置C装入的试剂是蒸馏水,用于制备氯水。装置D中盛有 ,可以在防止氯气泄露污染空气的同时制备漂白粉。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,当MnO2完全反应完,生成的氯气在标况下的体积为 L,则被氧化的HCl的质量是 g,反应中转移的电子为 mol。
(4)小组同学用上述实验中得到的氯水进行如下实验
实验序号 试剂和操作 实验现象 结论
i 在4mLNaBr溶液中加入1mL氯水 溶液变黄色 氯气的氧化性比溴强
ii 在4mLKI溶液中加入实验i所得黄色溶液 溶液变为棕黄色 溴的氧化性比碘强
iii 在滴有酚酞的NaOH溶液中滴加氯水 当氯水滴到一定量时,溶液红色突然褪去 氯水显酸性
根据该小组的实验报告,回答下列问题:
①实验i中发生反应的离子方程式为 。
②实验ii的结论是否严谨? (填“是”或“否”),理由是 。
③实验iii中溶液红色褪去的原因,除了酸碱中和反应外,还有一种可能: 。
如要证明到底是什么原因使溶液褪色,还需进一步设计实验验证。
22.绿矾晶体()是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为及少量),制备绿矾过程如下:
试回答:
(1)操作Ⅰ为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 、
(3)操作Ⅲ的顺序依次为: 。
(4)某同学用酸性溶液测定绿矾产品中含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的溶液滴定至终点,消耗溶液的体积的平均值为20.00mL。
配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
【参考答案】
一、选择题
1.B
解析:A.Fe的活泼性弱于Al,在高温条件下可发生铝热反应,故A正确;
B.焊剂(主要成分为Al与CaO)在高温下反应得到液体金属,结合元素守恒可知,焊渣的主要成分为Al2O3,故B错误;
C.利用还原性气体(如H2,CO等)除去焊件金属表面的氧化膜可使焊接更加牢固,故C正确;
D.一般合金的熔点低于任一组分金属,加入低熔点金属,可在更低温度下得到液态合金,便于焊接,同时还可以保护焊件金属,故D正确;
故答案选B。
2.D
【分析】M加入过量氢氧化钠,若有铝、氧化铝则转化为偏铝酸钠,铜、氧化铁不反应进入N;N加入过量稀盐酸,氧化铁和盐酸生成氯化铁、氯化铁会与铜生成氯化铜和氯化亚铁,得到固体P,说明铜过量,得到蓝绿色溶液,则说明铁和部分铜转化为氯化铜、氯化亚铁;
解析:A.由分析可知,固体P一定是纯净物铜,A正确;
B.若,则原混合物中可能含有和氢氧化钠反应的铝或氧化铝或两者均有,B正确;
C.由分析可知,蓝绿色溶液中一定含有的金属阳离子为、,C正确;
D.若不含铝、氧化铝,则向溶液N中通入足量的,不能观察到白色沉淀生成,D错误;
故选D。
3.A
解析:A.漂白粉、漂白液和漂粉精的主要成分是次氯酸盐,水溶液具有强氧化性可以杀菌消毒,可用于游泳池等场所的消毒剂,故A正确;
B.Cl2不具有漂白性,不能漂白干燥的有色布条,故B错误;
C.铁生锈过程中铁单质发生了价态改变最终转化为氧化铁,涉及到了氧化还原反应,故C错误;
D.铝表面尽管容易生成一层致密的氧化膜,但氧化铝是两性氧化物能与酸或者碱发生反应,故不能用铝制品长期存放酸性或碱性食物,故D错误;
故选A。
4.A
解析:A.硫与氧气直接化合产物为SO2,无法直接得到SO3,故A错误;
B.氮气与氧气在放电条件下直接化合生成NO,故B正确;
C.钠与氧气在点燃条件下燃烧生成Na2O2,故C正确;
D.铝与氧气在点燃的条件下燃烧生成Al2O3,故D正确;
故答案为:A。
5.C
解析:A.将氯气通入到紫色石蕊试液中,溶液先变红后褪色,说明生成的盐酸使石蕊变红,生成的次氯酸使变红的溶液褪色,次氯酸有漂白性,不能说氯气有漂白性,故A错误;
B.黑色固体不一定是铁,可能有四氧化三铁,当四氧化三铁和盐酸反应后生成铁离子,铁与铁离子反应生成亚铁离子,溶液中依然没有铁离子,不能使KSCN溶液变为红色,故B错误;
C.金属铝熔化而不滴落下来,主要是铝的外面是氧化铝,氧化铝熔点比金属铝高,氧化铝像一层膜将铝兜着一样,不能使铝滴落下来,故C正确;
D.试管内壁均出现水珠,可能是固体表面的水分加热时蒸发在试管口凝结成液体,不能说明碳酸钠分解,故D错误。
综上所述,答案为C。
6.D
解析:A.常温下,铝遇到浓硝酸发生钝化,选项A错误;
B.少量通入NaClO溶液中,反应生成氯化钠和硫酸,反应的离子方程式为:,选项B错误;
C.向溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,反应的离子方程式为:,选项C错误;
D.向溶液中加溶液至中性,反应生成硫酸钠、硫酸钡和水,反应的离子方程式为:,选项D正确;
答案选D。
7.A
解析:A.赤铁矿的主要成分是Fe2O3,故A选;
B.目前我国流通的硬币是由合金材料制造的,故B不选;
C.铝制品在生活中非常普遍,这是因为铝容易被氧化形成致密的氧化膜,对内部金属起保护作用,故C不选;
D.由镍、铁、碳、钴组成的合金可以制造喷气式飞机的发动机叶片,能承受1100℃的高温,故D不选。
故选A。
8.A
解析:A.饱和氯水中含有氯气和水生成次氯酸,次氯酸具有漂白性能使pH试纸褪色,不能用pH试纸测氯水的pH值,A错误;
B.先向该溶液中滴加KSCN溶液,溶液不变血红色,可排除存在,再滴加少量氯水,溶液变血红色,说明溶液含有亚铁离子,B正确;
C.制备氢氧化铁胶体的方法:将饱和氯化铁滴入沸水中,继续加热至液体呈红褐色,C正确;
D.向FeBr2溶液中加入少量氯水,再加CCl4,振荡,下层有机层为无色,说明氯水首先和亚铁离子反应,证明Fe2+的还原性强于Br-,D正确;
故选:A。
9.A
解析:A.,化学名称为过氧化氢,俗称双氧水,错误,B.碳酸钠俗名纯碱,C.四氧化三铁俗称磁性氧化铁,D.氢氧化钠俗称苛性钠,均正确,只有A符合题意,故选A。
10.A
解析:A.熟石灰是氢氧化钙,生石灰是CaO,故A符合题意;
B.纯碱化学式是,又俗称苏打,故B不符合题意;
C.铁红化学式是,故C不符合题意;
D.食盐化学式为NaCl,故D不符合题意;
综上所述,答案为A。
11.D
解析:A.云、雾属于气溶胶,属于胶体的一部分,其中分散质是液体,分散剂是气体,A正确;
B.硝石受热分解,产生紫青色的烟,钾元素焰色反应为紫色,故含有钾元素,故B正确;
C.磁石主要成分为,故C正确;
D.剂钢为铁的合金,其硬度比纯铁大,熔点比纯铁的低,故D错误;
故选D。
12.B
解析:A.过氧化钠和空气中二氧化碳反应生成碳酸钠和氧气,为氧化还原反应,与氧化还原反应有关,A不符合题意;
B.生石灰氧化钙和水生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀,没有元素化合价改变,与氧化还原反应无关,B符合题意;
C.氯气和溶液中水生成盐酸和次氯酸为氧化还原反应,盐酸和硝酸银生成氯化银白色沉淀,C不符合题意;
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色,反应中生成的氢氧化亚铁和空气中氧气反应转化为氢氧化铁沉淀,与氧化还原反应有关,D不符合题意;
故选B。
二、非选择题
13.(1)血红/红
(2) 2Fe3++Fe=3Fe2+ 产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色 FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O═4Fe(OH)3
【分析】Fe跟Cl2在一定条件下恰好完全反应:2Fe+3Cl22FeCl3产物为FeCl3。
解析:(1)Fe3+遇SCN-发生反应Fe3++3SCNFe(SCN)3,Fe(SCN)3为血红色。
(2)加入Fe粉反应为:Fe+2Fe3+═3Fe2+,加入NaOH后,发生FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2易被空气中的氧气氧化:4Fe(OH)2+O2+2H2O═4Fe(OH)3(红褐色),观察到产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
14. 铝 第三周期 第ⅢA族 表面生出白色毛状物 4Al+3O2=2Al2O3 Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH=2NaAlO2+H2O
解析:地壳中含量最多的金属元素为Al,为13号元素,位于第三周期,第ⅢA族;铝性质较为活泼,在空气中容易被氧气氧化,发生反应4Al+3O2=2Al2O3,所以可以观察到的现象为表面生出白色毛状物;氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
15. 2Na2O2+2 CO2=2Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Al2O3+2NaOH=2NaAlO2+H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Fe+4H2O(g)Fe3O4+4H2
解析:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2 CO2=2Na2CO3+O2;
(2)工业上将氯气通入石灰乳制取漂白粉,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
(3)氧化铝溶于氢氧化钠反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)氢氧化亚铁、氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁与水蒸气在高温下的反应方程式为:3Fe+4H2O(g)Fe3O4+4H2。
【点睛】书写工业制漂白粉的离子方程式时要注意,由于用的是石灰乳,所以Ca(OH)2不拆成离子。
16.(1) (2)
解析:(1)设原混合物中Fe和Fe2O3的物质的量分别为x 、y ,生成氢气物质的量为:=0.03mol,发生反应:
根据题意,得方程:①x-y = 0.03mol、②56x +160y =3.84g,将①①联立,解得x=0.04mol,y=0.01mol,故m(Fe)=0.04 mol×56 g·mol-1=2.24 g,m(Fe2O3)=0.01 mol×160 g·mol-1=1.6 g;
(2)通过分析可知,溶解完混合物的溶液中仅有FeCl2一种溶质,又因为溶解过程Cl-没有减少,所以溶液中Cl-的物质的量即为原盐酸溶液中HCl的物质的量为:n(HCl)=2n(FeCl2)=2[n(Fe)+2n(Fe2O3)]=2×(0.04+0.01×2)mol=0.12 mol,c(HCl)===1.0 mol·L-1。
17.6mol 5.4 5:3 1:3 40g/mol 1.68
解析:(1)Al2(SO4)3中n(Al3+)∶n()=2∶3,则含0.4mol A13+的Al2(SO4)3中所含的的物质的量=0.4mol×=0.6mol;
(2) 0.2molNH3中含的氢原子的物质的量为0.2mol×3=0.6mol,则与之具有相同氢原子数的H2O的物质的量应为=0.3mol,所以H2O的质量为0.3mol×18g/mol=5.4g;
(3)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3;
(4)CO和CO2组成的混合气体8.96L,物质的量为=0.4mol,令CO和CO2的物质的量分别为x mol、y mol,则:x+y=0.4 ,28x+44y=16,联立方程组解得:x=0.1,y=0.3,混合物中CO和CO2的物质的量比为0.1mol:0.3mol=1:3;因为混合物的质量是16g,所以混合气体的平均摩尔质量为=40g/mol;
(5)设在标准状况下生成H2的体积为VL,则
解得V=,在标准状况下生成H2的体积为1.68L。
18.(1)c(H+)=2.0mol/L;c(Cu2+)=1.0mol/L;c()=2.0mol/L
(2)2.0mol/L
(3) Fe2O3 16g
解析:(1)把2.0mol L-1CuSO4和2.0mol L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=×2.0mol/L=1.0mol/L,c(H2SO4)=×2.0mol/L=1.0mol/L,混合后溶液中c(H+)=2c(H2SO4)=2×1.0mol/L=2mol/L,c(Cu2+)=c(CuSO4)=1.0mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故 c()=c(CuSO4)+c(H2SO4)=1mol/L+1mol/L=2mol/L;答案为:c(H+)=2.0mol/L;c(Cu2+)=1.0mol/L;c()=2.0mol/L;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c()=2mol/L;答案为:2mol/L;
(3)加入适量硝酸将Fe2+ 氧化为Fe3+,再加入足量氢氧化钠溶液,得到红褐色沉淀是氢氧化铁,加热沉淀氢氧化铁分解,生成Fe2O3,m(Fe2O3)=×2mol/L×0.1L×160g/mol=16g。答案为:Fe2O3;16g。
19.物理 Al3+、Na+、Mg2+、SO K+ Mg(OH)2或Al(OH)3和 Mg(OH)2 0.4mol/L
【分析】溶液焰色反应呈黄色,说明一定含有Na+;过氧化钠和水反应生成氢氧化钠和氧气,溶液中加入过氧化钠固体放出无色无味的气体,同时生成白色沉淀,说明溶液中Al3+、Mg2+至少含有有1种,一定不含Fe3+、Cu2+;溶液加氯化钡和稀盐酸,生成69.9g白色沉淀,白色沉淀一定是硫酸钡,且硫酸钡的物质的量是0.3mol,说明溶液中一定含有0.3mol SO;溶液中滴加过量的氢氧化钠生成白色沉淀,白色沉淀的量先增后减,说明溶液中一定含有Al3+、Mg2+,沉淀最大值是0.2mol,最后剩余沉淀0.1mol,说明溶液中含有0.1mol Al3+、0.1mol Mg2+,加入氢氧化钠不放氨气,说明不含NH,根据离子共存,含有Al3+、Mg2+,则一定不含CO,根据电荷守恒,0.1mol Al3+、0.1mol Mg2+所带正电荷总数小于0.3mol SO所带负电荷总数,由于Na+的量不确定,所以溶液中可能含有带正电荷的K+。
解析:(1)焰色反应没有新物质生成,是物理变化;
(2)根据以上分析,原溶液中一定存在的离子有Al3+、Na+、Mg2+、SO,一定不含Fe3+、Cu2+、CO、NH,可能存在的离子有K+;
(3)实验③中氢氧化钠和水反应生成氢氧化钠和氧气,若氢氧化钠不足,与Al3+、Mg2+反应生成氢氧化镁、氢氧化铝沉淀,若氢氧化钠过量,与Al3+、Mg2+反应生成氢氧化镁沉淀、偏铝酸钠,产生的白色沉淀的成分可能是Mg(OH)2或Al(OH)3和 Mg(OH)2;
(4)若100mL原溶液中K+的物质的量为0.06mol,根据电荷守,n(Na+)+ n(K+)+2n(Mg2+)+ 3n(Al3+)= 2n(SO ),n(Na+)=0.6-0.06-0.2-0.3=0.04mol,c(Na+)=0.04mol÷0.1L=0.4mol/L。
【点睛】本题考查离子推断,明确离子的性质是解题关键,注意根据电荷守恒判断K+是否存在,溶液中阴离子所带负电荷总数一定等于阳离子所带正电荷总数,根据电荷守计算Na+浓度。
20. b 4NH3+5O24NO+6H2O 10 2Fe2++Cl2=2Fe3++2Cl- 生成的白色絮状沉淀迅速变成灰绿色,最红变成红褐色 Cu-2e-=Cu2+ OH-+HCO=CO+H2O
解析:(1) ①Fe的氧化物不能与H2O反应,故A不可能是Fe;
②B是汽年尾气之一,遇空气变红棕色,可知B为NO,A为NH3,则A→B的化学方程式为4NH3+5O24NO+6H2O;D为硝酸,溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部特化成沉淀时,此时溶液中溶质为NaNO3溶液,由Na元素守恒得n(NaNO3)= n(NaOH)=0.5L×3.0mo/L=1.5mol, 由NO和NO2混合气体的物质的量为0.5mol,根据氮元素守恒得n(HNO3)= n(NaNO3)+ n(NO + NO2)= 1.5mol + 0.5mol=2mol,故原有硝酸的物质的量浓度为2mol/(0.2L)= 10molL。
(2) X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,可知A为Cl2, B为FeCl3,C为FeCl2,D为Fe(OH)2,则A与C反应生成B的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;FeCl2溶液中加入NaOH溶液,先生成Fe(OH)2白色絮状沉淀,Fe(OH)2最终被氧化得Fe(OH)3红褐色沉淀,故现象为生成的白色絮状沉淀迅速变成灰绿色,最终变成红褐色;FeCl3溶液用于蚀刻印刷电路铜板的离子方程式为:2Fe3+ +Cu= 2Fe2+ +Cu2+,若设计成原电池,负极发生氧化反应为Cu-2e =Cu2+。
(3)依题可知,A为NaOH, B为Na2CO3,C NaHCO3,D为NaCl,A与C生成B 的离子反应方程式为:OH-+HCO=CO+H2O。
21.(1)
(2)饱和食盐水 石灰乳
(3) 2.24 7.3 0.2
(4) 否 实验i溶液中可能还有未反应完全的Cl2 强氧化性的HClO与酚酞发生反应
【分析】装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:,由于浓盐酸会挥发,制取氯气中含有杂质气体HCl,用装置B中饱和食盐水吸收HCl,氯气密度比空气大,用装置C的向上排空气法收集氯气,最后用装置D中Ca(OH)2溶液吸收氯气并制取漂白粉。
解析:(1)装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为饱和食盐水;装置C用于制备氯水,应装入的试剂是蒸馏水,装置D中盛有石灰乳,含有溶质质量更大,氯气和Ca(OH)2反应生成Ca(ClO)2制取漂白粉,由于氯气有毒,可防止氯气泄露污染空气。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,MnO2的物质的量为=0.1mol,由方程式可知生成的氯气物质的量为0.1mol,在标况下的体积为2.24L,被氧化的HCl的质量是0.2mol,质量为0.2mol×36.5g/mol=7.3g,Cl元素化合价由-1价上升到0价,生成0.1molCl2,转移0.2mol电子。
(4)①由氧化性:Cl2>Br2,实验i中发生反应的离子方程式为;
②由于实验i溶液中可能还有未反应完全的Cl2,也可以氧化KI,则实验ii的结论不严谨;
③实验iii中溶液红色褪去的原因,有可能是:强氧化性的HClO与酚酞发生反应。
22. 过滤 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 1000mL容量瓶
【分析】烧渣中主要含Fe2O3、FeS、SiO2,经过酸溶和氧气氧化后Fe2O3转化为Fe2(SO4)3,FeS转化为Fe2(SO4)3和S(由流程得出),SiO2不参与反应,过滤(操作Ⅰ)后滤渣1中主要含S和SiO2,所得溶液X中主要含Fe2(SO4)3和过量H2SO4;由于最终要获得FeSO4·7H2O,故需将溶液X中Fe3+还原为Fe2+,为了不引入新杂质,试剂Y选择Fe粉,经过过滤(操作Ⅱ)后,溶液Z中主要含FeSO4,经过操作Ⅲ获得绿矾晶体,滤渣2主要为过量的Fe。
解析:(1) 操作Ⅰ将滤渣和溶液分离,故为过滤;
(2) 溶液X中主要含Fe2(SO4)3和过量H2SO4,加入Fe(试剂Y)反应为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(3)操作Ⅲ为制备晶体的操作,具体步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)配制溶液需要用到相应规格的容量瓶,故还需1000 mL容量瓶
一、选择题
1.化学焊接技术的原理之一是利用焊剂(主要成分为Al与CaO)在高温下反应制得液态金属(或合金),凝固后,除去焊接点表面的焊渣,实现焊件金属的焊接。下列说法错误的是
A.Al与Fe2O3也能发生类似反应
B.焊渣的主要成分是Al(OH)3
C.焊接前可用还原性气体在加热条件下除去焊件金属表面的氧化膜
D.若在反应体系中加入低熔点金属,则可形成低熔点液态合金便于焊接
2.某混合物可能含有Al、Cu、、,为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析错误的是
A.固体P一定是纯净物
B.若,则原混合物中可能含有Al
C.蓝绿色溶液中一定含有的金属阳离子为、
D.向溶液N中通入足量的,一定可观察到有白色沉淀生成
3.化学与生活息息相关,以下说法正确的是
A.漂白粉、漂白液和漂粉精可用于游泳池等场所的消毒剂
B.Cl2具有漂白性,所以可以漂白有色布条
C.铁生锈过程中未涉及到氧化还原反应
D.铝表面容易生成一层致密的氧化膜,所以铝制品可以长期存放酸性或碱性食物。
4.下列物质无法通过单质与直接化合生成的是
A. B.NO C. D.
5.下列有关“实验操作”、“现象”及“实验结论”都正确的是
选项 实验操作 现象 实验结论
A 将氯气通入到紫色石蕊试液中 观察溶液先变红后褪色 氯气具有漂白性
B 在CO还原,得到的黑色固体中加入盐酸,固体溶解,再加入KSCN溶液 溶液不显血红色 黑色固体一定是Fe
C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 金属铝熔化而不滴落下来 金属铝熔点比氧化铝低
D 分别加热碳酸钠与碳酸氢钠固体 试管内壁均出现水珠 两种固体均受热分解
A.A B.B C.C D.D
6.下列离子方程式书写正确的是:
A.常温下,铝遇到浓硝酸:
B.少量通入NaClO溶液中:
C.向溶液中加入过量NaOH溶液并加热:
D.向溶液中加溶液至中性:
7.下列说法不正确的是
A.赤铁矿的主要成分是Fe3O4
B.目前我国流通的硬币是由合金材料制造的
C.铝制品在生活中非常普遍,这是因为表面覆盖着氧化膜,对内部金属起保护作用
D.由镍、铁、碳、钴组成的合金可以制造喷气式飞机的发动机叶片,能承受1100℃的高温
8.下列操作不能达到实验目的的是
选项 目的 操作
A 测定氯水的pH 用玻璃棒蘸取饱和氯水点在置于玻璃片的pH试纸上,稍后与标准比色卡对照
B 检验某溶液中只含不含 先向该溶液中滴加KSCN溶液,再滴加少量氯水
C 制取氢氧化铁胶体 向40 mL沸水中滴加5~6滴饱和溶液,继续煮沸直到形成红褐色液体停止加热
D 验证的还原性强于 向溶液中加入少量氯水,再加,振荡
A.A B.B C.C D.D
9.下列物质对应的俗称错误的是
A.:过氧化氢 B.:纯碱
C.:磁性氧化铁 D.:苛性钠
10.下列物质的俗称与化学式不一致的是
A.熟石灰——CaO B.纯碱——
C.铁红—— D.食盐——NaCl
11.中国传统文化和历史文物中蕴藏着丰富的化学知识,下列说法错误的是
A.“天接云涛连晓雾”中“雾”、“云”属于胶体
B.“以火烧之,紫青烟起,乃真硝石也”,硝石中含有钾元素
C.“方家以磁石磨针锋,则能指南”中的磁石主要成分为。
D.“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,铁合金的硬度和熔点比纯铁高
12.下列实验现象与氧化还原反应无关的是
A.过氧化钠放置于空气中逐渐变白
B.将生石灰投入溶液中,产生白色沉淀
C.通入硝酸酸化的溶液中,产生白色沉淀
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色
二、非选择题
13.Fe与Cl2在一定条件下恰好完全反应。将产物溶于水,置于两支试管中。
(1)向第一支试管中滴加KSCN溶液,溶液呈 色;
(2)向第二支试管中加入足量铁粉,振荡,反应的离子方程式是 ;静置后,取上层清液于另一支试管中,滴加NaOH溶液,可以观察到的现象是 ,反应的化学方程式是 。
14.地壳中含量最多的金属元素是 ,它处于元素周期表的位置是 , 。将其单质除出表面保护膜后,放入硝酸汞溶液反应一会儿取出,吸干表面溶液静置会观察到的现象是 ,该现象可用化学反应方程式可表示为 ,写出该反应产物分别与盐酸、氢氧化钠溶液反应的化学方程式: , 。
15.完成下列化学方程式
(1)过氧化钠与二氧化碳反应
(2)工业制漂白粉
(3)氧化铝溶于氢氧化钠
(4)氢氧化亚铁在空气中被氧化
(5)铁与水蒸气高温下反应
16.向和组成的混合物中加入溶于某浓度的盐酸,恰好完全反应,生成标准状况下,若向反应后的溶液中滴入几滴溶液,溶液不呈红色。试求:
(1)原混合物中的质量为 。
(2)所用盐酸的物质的量浓度是 。(保留3位有效数字)
17.(1)含0.4molAl3+的Al2(SO4)3中所含的的物质的量是 。
(2)0.2molNH3与 gH2O具有相同的氢原子数。
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳,原子总数之比为 。
(4)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是 ,混合气体的平均摩尔质量是 。
(5)200mL0.25mol·L-1的NaOH溶液与足量Al完全反应。计算在标准状况下生成H2的体积为 L
18.把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。则:
(1)混合溶液中H+、Cu2+、的物质的量浓度分别为: ;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度为 ;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式 ,并计算残渣的质量 (不计操作带来的损失)。
19.有一无色溶液.其中可能含有Fe3+、Al3+、Na+、Mg2+、Cu2+、NH、K+、CO、SO 等离子中的几种(忽略水的电离),为分析其成分,各取此溶液100mL分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
(1)焰色反应是 (填“物理”或“化学”)变化。
(2)原溶液中一定存在的离子有 (写离子符号,下同),可能存在的离子有 。
(3)实验③中产生的白色沉淀的成分可能是 。
(4)若100mL原溶液中K+的物质的量为0.06mol,则c(Na+)= 。
20.A、B、C、D、X、Y六种物质之间有如图所示转化关系,请回答下列问题。
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是 (填序号)。
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为 ;将32g铜与200mL一定浓度的D溶液发生反应,铜完全溶解,产生B和C混合气体的体积为11.2L(标准状况),待产生的气体全部释放后,向溶液中加入500mL3.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为 mol/L。
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为 ;向C溶液中加入Y溶液,可观察到的现象是 ;B溶液常用于蚀刻印刷电路铜板,若将该反应设计成原电池,负极电极反应式为 。
(3)若X是酸性氧化物CO2,B俗称纯碱,A、B、C、D四种物质的焰色试验均为黄色,请写出A与C反应生成B的离子方程式 。
21.某学习小组欲制备氯水和漂白粉,并利用所制溶液进行相关实验探究。实验装置如图所示。回答有关问题。
(1)装置A中生成氯气的离子方程式为 。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为 。装置C装入的试剂是蒸馏水,用于制备氯水。装置D中盛有 ,可以在防止氯气泄露污染空气的同时制备漂白粉。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,当MnO2完全反应完,生成的氯气在标况下的体积为 L,则被氧化的HCl的质量是 g,反应中转移的电子为 mol。
(4)小组同学用上述实验中得到的氯水进行如下实验
实验序号 试剂和操作 实验现象 结论
i 在4mLNaBr溶液中加入1mL氯水 溶液变黄色 氯气的氧化性比溴强
ii 在4mLKI溶液中加入实验i所得黄色溶液 溶液变为棕黄色 溴的氧化性比碘强
iii 在滴有酚酞的NaOH溶液中滴加氯水 当氯水滴到一定量时,溶液红色突然褪去 氯水显酸性
根据该小组的实验报告,回答下列问题:
①实验i中发生反应的离子方程式为 。
②实验ii的结论是否严谨? (填“是”或“否”),理由是 。
③实验iii中溶液红色褪去的原因,除了酸碱中和反应外,还有一种可能: 。
如要证明到底是什么原因使溶液褪色,还需进一步设计实验验证。
22.绿矾晶体()是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为及少量),制备绿矾过程如下:
试回答:
(1)操作Ⅰ为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 、
(3)操作Ⅲ的顺序依次为: 。
(4)某同学用酸性溶液测定绿矾产品中含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的溶液滴定至终点,消耗溶液的体积的平均值为20.00mL。
配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
【参考答案】
一、选择题
1.B
解析:A.Fe的活泼性弱于Al,在高温条件下可发生铝热反应,故A正确;
B.焊剂(主要成分为Al与CaO)在高温下反应得到液体金属,结合元素守恒可知,焊渣的主要成分为Al2O3,故B错误;
C.利用还原性气体(如H2,CO等)除去焊件金属表面的氧化膜可使焊接更加牢固,故C正确;
D.一般合金的熔点低于任一组分金属,加入低熔点金属,可在更低温度下得到液态合金,便于焊接,同时还可以保护焊件金属,故D正确;
故答案选B。
2.D
【分析】M加入过量氢氧化钠,若有铝、氧化铝则转化为偏铝酸钠,铜、氧化铁不反应进入N;N加入过量稀盐酸,氧化铁和盐酸生成氯化铁、氯化铁会与铜生成氯化铜和氯化亚铁,得到固体P,说明铜过量,得到蓝绿色溶液,则说明铁和部分铜转化为氯化铜、氯化亚铁;
解析:A.由分析可知,固体P一定是纯净物铜,A正确;
B.若,则原混合物中可能含有和氢氧化钠反应的铝或氧化铝或两者均有,B正确;
C.由分析可知,蓝绿色溶液中一定含有的金属阳离子为、,C正确;
D.若不含铝、氧化铝,则向溶液N中通入足量的,不能观察到白色沉淀生成,D错误;
故选D。
3.A
解析:A.漂白粉、漂白液和漂粉精的主要成分是次氯酸盐,水溶液具有强氧化性可以杀菌消毒,可用于游泳池等场所的消毒剂,故A正确;
B.Cl2不具有漂白性,不能漂白干燥的有色布条,故B错误;
C.铁生锈过程中铁单质发生了价态改变最终转化为氧化铁,涉及到了氧化还原反应,故C错误;
D.铝表面尽管容易生成一层致密的氧化膜,但氧化铝是两性氧化物能与酸或者碱发生反应,故不能用铝制品长期存放酸性或碱性食物,故D错误;
故选A。
4.A
解析:A.硫与氧气直接化合产物为SO2,无法直接得到SO3,故A错误;
B.氮气与氧气在放电条件下直接化合生成NO,故B正确;
C.钠与氧气在点燃条件下燃烧生成Na2O2,故C正确;
D.铝与氧气在点燃的条件下燃烧生成Al2O3,故D正确;
故答案为:A。
5.C
解析:A.将氯气通入到紫色石蕊试液中,溶液先变红后褪色,说明生成的盐酸使石蕊变红,生成的次氯酸使变红的溶液褪色,次氯酸有漂白性,不能说氯气有漂白性,故A错误;
B.黑色固体不一定是铁,可能有四氧化三铁,当四氧化三铁和盐酸反应后生成铁离子,铁与铁离子反应生成亚铁离子,溶液中依然没有铁离子,不能使KSCN溶液变为红色,故B错误;
C.金属铝熔化而不滴落下来,主要是铝的外面是氧化铝,氧化铝熔点比金属铝高,氧化铝像一层膜将铝兜着一样,不能使铝滴落下来,故C正确;
D.试管内壁均出现水珠,可能是固体表面的水分加热时蒸发在试管口凝结成液体,不能说明碳酸钠分解,故D错误。
综上所述,答案为C。
6.D
解析:A.常温下,铝遇到浓硝酸发生钝化,选项A错误;
B.少量通入NaClO溶液中,反应生成氯化钠和硫酸,反应的离子方程式为:,选项B错误;
C.向溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,反应的离子方程式为:,选项C错误;
D.向溶液中加溶液至中性,反应生成硫酸钠、硫酸钡和水,反应的离子方程式为:,选项D正确;
答案选D。
7.A
解析:A.赤铁矿的主要成分是Fe2O3,故A选;
B.目前我国流通的硬币是由合金材料制造的,故B不选;
C.铝制品在生活中非常普遍,这是因为铝容易被氧化形成致密的氧化膜,对内部金属起保护作用,故C不选;
D.由镍、铁、碳、钴组成的合金可以制造喷气式飞机的发动机叶片,能承受1100℃的高温,故D不选。
故选A。
8.A
解析:A.饱和氯水中含有氯气和水生成次氯酸,次氯酸具有漂白性能使pH试纸褪色,不能用pH试纸测氯水的pH值,A错误;
B.先向该溶液中滴加KSCN溶液,溶液不变血红色,可排除存在,再滴加少量氯水,溶液变血红色,说明溶液含有亚铁离子,B正确;
C.制备氢氧化铁胶体的方法:将饱和氯化铁滴入沸水中,继续加热至液体呈红褐色,C正确;
D.向FeBr2溶液中加入少量氯水,再加CCl4,振荡,下层有机层为无色,说明氯水首先和亚铁离子反应,证明Fe2+的还原性强于Br-,D正确;
故选:A。
9.A
解析:A.,化学名称为过氧化氢,俗称双氧水,错误,B.碳酸钠俗名纯碱,C.四氧化三铁俗称磁性氧化铁,D.氢氧化钠俗称苛性钠,均正确,只有A符合题意,故选A。
10.A
解析:A.熟石灰是氢氧化钙,生石灰是CaO,故A符合题意;
B.纯碱化学式是,又俗称苏打,故B不符合题意;
C.铁红化学式是,故C不符合题意;
D.食盐化学式为NaCl,故D不符合题意;
综上所述,答案为A。
11.D
解析:A.云、雾属于气溶胶,属于胶体的一部分,其中分散质是液体,分散剂是气体,A正确;
B.硝石受热分解,产生紫青色的烟,钾元素焰色反应为紫色,故含有钾元素,故B正确;
C.磁石主要成分为,故C正确;
D.剂钢为铁的合金,其硬度比纯铁大,熔点比纯铁的低,故D错误;
故选D。
12.B
解析:A.过氧化钠和空气中二氧化碳反应生成碳酸钠和氧气,为氧化还原反应,与氧化还原反应有关,A不符合题意;
B.生石灰氧化钙和水生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀,没有元素化合价改变,与氧化还原反应无关,B符合题意;
C.氯气和溶液中水生成盐酸和次氯酸为氧化还原反应,盐酸和硝酸银生成氯化银白色沉淀,C不符合题意;
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色,反应中生成的氢氧化亚铁和空气中氧气反应转化为氢氧化铁沉淀,与氧化还原反应有关,D不符合题意;
故选B。
二、非选择题
13.(1)血红/红
(2) 2Fe3++Fe=3Fe2+ 产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色 FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O═4Fe(OH)3
【分析】Fe跟Cl2在一定条件下恰好完全反应:2Fe+3Cl22FeCl3产物为FeCl3。
解析:(1)Fe3+遇SCN-发生反应Fe3++3SCNFe(SCN)3,Fe(SCN)3为血红色。
(2)加入Fe粉反应为:Fe+2Fe3+═3Fe2+,加入NaOH后,发生FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2易被空气中的氧气氧化:4Fe(OH)2+O2+2H2O═4Fe(OH)3(红褐色),观察到产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
14. 铝 第三周期 第ⅢA族 表面生出白色毛状物 4Al+3O2=2Al2O3 Al2O3+6HCl=2AlCl3+3H2O Al2O3+2NaOH=2NaAlO2+H2O
解析:地壳中含量最多的金属元素为Al,为13号元素,位于第三周期,第ⅢA族;铝性质较为活泼,在空气中容易被氧气氧化,发生反应4Al+3O2=2Al2O3,所以可以观察到的现象为表面生出白色毛状物;氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
15. 2Na2O2+2 CO2=2Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Al2O3+2NaOH=2NaAlO2+H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Fe+4H2O(g)Fe3O4+4H2
解析:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2 CO2=2Na2CO3+O2;
(2)工业上将氯气通入石灰乳制取漂白粉,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
(3)氧化铝溶于氢氧化钠反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)氢氧化亚铁、氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁与水蒸气在高温下的反应方程式为:3Fe+4H2O(g)Fe3O4+4H2。
【点睛】书写工业制漂白粉的离子方程式时要注意,由于用的是石灰乳,所以Ca(OH)2不拆成离子。
16.(1) (2)
解析:(1)设原混合物中Fe和Fe2O3的物质的量分别为x 、y ,生成氢气物质的量为:=0.03mol,发生反应:
根据题意,得方程:①x-y = 0.03mol、②56x +160y =3.84g,将①①联立,解得x=0.04mol,y=0.01mol,故m(Fe)=0.04 mol×56 g·mol-1=2.24 g,m(Fe2O3)=0.01 mol×160 g·mol-1=1.6 g;
(2)通过分析可知,溶解完混合物的溶液中仅有FeCl2一种溶质,又因为溶解过程Cl-没有减少,所以溶液中Cl-的物质的量即为原盐酸溶液中HCl的物质的量为:n(HCl)=2n(FeCl2)=2[n(Fe)+2n(Fe2O3)]=2×(0.04+0.01×2)mol=0.12 mol,c(HCl)===1.0 mol·L-1。
17.6mol 5.4 5:3 1:3 40g/mol 1.68
解析:(1)Al2(SO4)3中n(Al3+)∶n()=2∶3,则含0.4mol A13+的Al2(SO4)3中所含的的物质的量=0.4mol×=0.6mol;
(2) 0.2molNH3中含的氢原子的物质的量为0.2mol×3=0.6mol,则与之具有相同氢原子数的H2O的物质的量应为=0.3mol,所以H2O的质量为0.3mol×18g/mol=5.4g;
(3)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3;
(4)CO和CO2组成的混合气体8.96L,物质的量为=0.4mol,令CO和CO2的物质的量分别为x mol、y mol,则:x+y=0.4 ,28x+44y=16,联立方程组解得:x=0.1,y=0.3,混合物中CO和CO2的物质的量比为0.1mol:0.3mol=1:3;因为混合物的质量是16g,所以混合气体的平均摩尔质量为=40g/mol;
(5)设在标准状况下生成H2的体积为VL,则
解得V=,在标准状况下生成H2的体积为1.68L。
18.(1)c(H+)=2.0mol/L;c(Cu2+)=1.0mol/L;c()=2.0mol/L
(2)2.0mol/L
(3) Fe2O3 16g
解析:(1)把2.0mol L-1CuSO4和2.0mol L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=×2.0mol/L=1.0mol/L,c(H2SO4)=×2.0mol/L=1.0mol/L,混合后溶液中c(H+)=2c(H2SO4)=2×1.0mol/L=2mol/L,c(Cu2+)=c(CuSO4)=1.0mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故 c()=c(CuSO4)+c(H2SO4)=1mol/L+1mol/L=2mol/L;答案为:c(H+)=2.0mol/L;c(Cu2+)=1.0mol/L;c()=2.0mol/L;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c()=2mol/L;答案为:2mol/L;
(3)加入适量硝酸将Fe2+ 氧化为Fe3+,再加入足量氢氧化钠溶液,得到红褐色沉淀是氢氧化铁,加热沉淀氢氧化铁分解,生成Fe2O3,m(Fe2O3)=×2mol/L×0.1L×160g/mol=16g。答案为:Fe2O3;16g。
19.物理 Al3+、Na+、Mg2+、SO K+ Mg(OH)2或Al(OH)3和 Mg(OH)2 0.4mol/L
【分析】溶液焰色反应呈黄色,说明一定含有Na+;过氧化钠和水反应生成氢氧化钠和氧气,溶液中加入过氧化钠固体放出无色无味的气体,同时生成白色沉淀,说明溶液中Al3+、Mg2+至少含有有1种,一定不含Fe3+、Cu2+;溶液加氯化钡和稀盐酸,生成69.9g白色沉淀,白色沉淀一定是硫酸钡,且硫酸钡的物质的量是0.3mol,说明溶液中一定含有0.3mol SO;溶液中滴加过量的氢氧化钠生成白色沉淀,白色沉淀的量先增后减,说明溶液中一定含有Al3+、Mg2+,沉淀最大值是0.2mol,最后剩余沉淀0.1mol,说明溶液中含有0.1mol Al3+、0.1mol Mg2+,加入氢氧化钠不放氨气,说明不含NH,根据离子共存,含有Al3+、Mg2+,则一定不含CO,根据电荷守恒,0.1mol Al3+、0.1mol Mg2+所带正电荷总数小于0.3mol SO所带负电荷总数,由于Na+的量不确定,所以溶液中可能含有带正电荷的K+。
解析:(1)焰色反应没有新物质生成,是物理变化;
(2)根据以上分析,原溶液中一定存在的离子有Al3+、Na+、Mg2+、SO,一定不含Fe3+、Cu2+、CO、NH,可能存在的离子有K+;
(3)实验③中氢氧化钠和水反应生成氢氧化钠和氧气,若氢氧化钠不足,与Al3+、Mg2+反应生成氢氧化镁、氢氧化铝沉淀,若氢氧化钠过量,与Al3+、Mg2+反应生成氢氧化镁沉淀、偏铝酸钠,产生的白色沉淀的成分可能是Mg(OH)2或Al(OH)3和 Mg(OH)2;
(4)若100mL原溶液中K+的物质的量为0.06mol,根据电荷守,n(Na+)+ n(K+)+2n(Mg2+)+ 3n(Al3+)= 2n(SO ),n(Na+)=0.6-0.06-0.2-0.3=0.04mol,c(Na+)=0.04mol÷0.1L=0.4mol/L。
【点睛】本题考查离子推断,明确离子的性质是解题关键,注意根据电荷守恒判断K+是否存在,溶液中阴离子所带负电荷总数一定等于阳离子所带正电荷总数,根据电荷守计算Na+浓度。
20. b 4NH3+5O24NO+6H2O 10 2Fe2++Cl2=2Fe3++2Cl- 生成的白色絮状沉淀迅速变成灰绿色,最红变成红褐色 Cu-2e-=Cu2+ OH-+HCO=CO+H2O
解析:(1) ①Fe的氧化物不能与H2O反应,故A不可能是Fe;
②B是汽年尾气之一,遇空气变红棕色,可知B为NO,A为NH3,则A→B的化学方程式为4NH3+5O24NO+6H2O;D为硝酸,溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部特化成沉淀时,此时溶液中溶质为NaNO3溶液,由Na元素守恒得n(NaNO3)= n(NaOH)=0.5L×3.0mo/L=1.5mol, 由NO和NO2混合气体的物质的量为0.5mol,根据氮元素守恒得n(HNO3)= n(NaNO3)+ n(NO + NO2)= 1.5mol + 0.5mol=2mol,故原有硝酸的物质的量浓度为2mol/(0.2L)= 10molL。
(2) X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,可知A为Cl2, B为FeCl3,C为FeCl2,D为Fe(OH)2,则A与C反应生成B的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;FeCl2溶液中加入NaOH溶液,先生成Fe(OH)2白色絮状沉淀,Fe(OH)2最终被氧化得Fe(OH)3红褐色沉淀,故现象为生成的白色絮状沉淀迅速变成灰绿色,最终变成红褐色;FeCl3溶液用于蚀刻印刷电路铜板的离子方程式为:2Fe3+ +Cu= 2Fe2+ +Cu2+,若设计成原电池,负极发生氧化反应为Cu-2e =Cu2+。
(3)依题可知,A为NaOH, B为Na2CO3,C NaHCO3,D为NaCl,A与C生成B 的离子反应方程式为:OH-+HCO=CO+H2O。
21.(1)
(2)饱和食盐水 石灰乳
(3) 2.24 7.3 0.2
(4) 否 实验i溶液中可能还有未反应完全的Cl2 强氧化性的HClO与酚酞发生反应
【分析】装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:,由于浓盐酸会挥发,制取氯气中含有杂质气体HCl,用装置B中饱和食盐水吸收HCl,氯气密度比空气大,用装置C的向上排空气法收集氯气,最后用装置D中Ca(OH)2溶液吸收氯气并制取漂白粉。
解析:(1)装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为饱和食盐水;装置C用于制备氯水,应装入的试剂是蒸馏水,装置D中盛有石灰乳,含有溶质质量更大,氯气和Ca(OH)2反应生成Ca(ClO)2制取漂白粉,由于氯气有毒,可防止氯气泄露污染空气。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,MnO2的物质的量为=0.1mol,由方程式可知生成的氯气物质的量为0.1mol,在标况下的体积为2.24L,被氧化的HCl的质量是0.2mol,质量为0.2mol×36.5g/mol=7.3g,Cl元素化合价由-1价上升到0价,生成0.1molCl2,转移0.2mol电子。
(4)①由氧化性:Cl2>Br2,实验i中发生反应的离子方程式为;
②由于实验i溶液中可能还有未反应完全的Cl2,也可以氧化KI,则实验ii的结论不严谨;
③实验iii中溶液红色褪去的原因,有可能是:强氧化性的HClO与酚酞发生反应。
22. 过滤 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 1000mL容量瓶
【分析】烧渣中主要含Fe2O3、FeS、SiO2,经过酸溶和氧气氧化后Fe2O3转化为Fe2(SO4)3,FeS转化为Fe2(SO4)3和S(由流程得出),SiO2不参与反应,过滤(操作Ⅰ)后滤渣1中主要含S和SiO2,所得溶液X中主要含Fe2(SO4)3和过量H2SO4;由于最终要获得FeSO4·7H2O,故需将溶液X中Fe3+还原为Fe2+,为了不引入新杂质,试剂Y选择Fe粉,经过过滤(操作Ⅱ)后,溶液Z中主要含FeSO4,经过操作Ⅲ获得绿矾晶体,滤渣2主要为过量的Fe。
解析:(1) 操作Ⅰ将滤渣和溶液分离,故为过滤;
(2) 溶液X中主要含Fe2(SO4)3和过量H2SO4,加入Fe(试剂Y)反应为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(3)操作Ⅲ为制备晶体的操作,具体步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)配制溶液需要用到相应规格的容量瓶,故还需1000 mL容量瓶
