1.2.2 离子反应课件(共35张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 1.2.2 离子反应课件(共35张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:28:15 | ||
图片预览







文档简介
(共35张PPT)
第一章
第二节 第2课时 离子反应
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件,正确书写这些反应的离子方程式,形成宏观辨识与微观探析的核心素养。
2.通过实验了解常见离子的检验方法,进一步理解离子反应,形成科学探究与创新意识的核心素养。
基础落实·必备知识全过关
一、离子反应
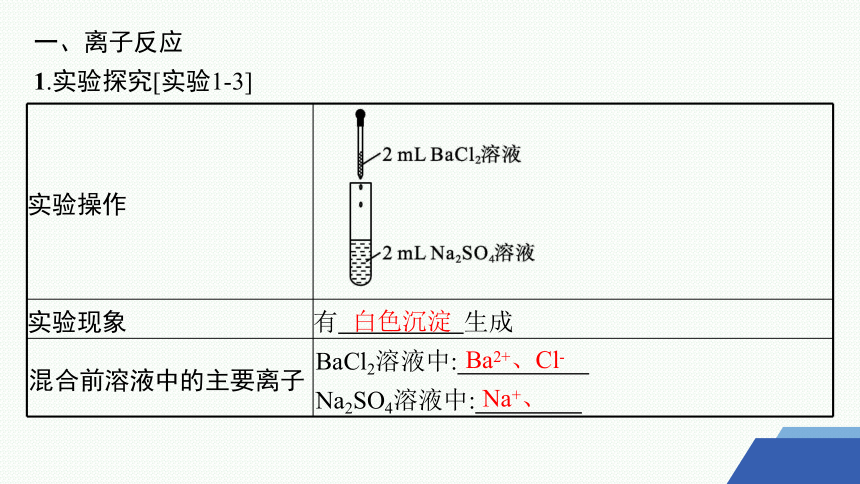
1.实验探究[实验1-3]
实验操作
实验现象 有 生成
混合前溶液中的主要离子 BaCl2溶液中:
Na2SO4溶液中:
白色沉淀
Ba2+、Cl-
Na+、
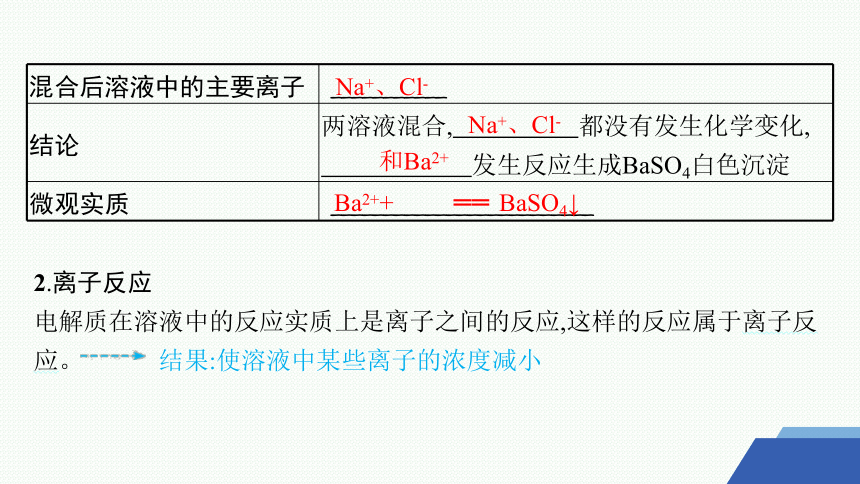
混合后溶液中的主要离子 ___________
结论 两溶液混合, 都没有发生化学变化,
发生反应生成BaSO4白色沉淀
微观实质 _________________________
2.离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。 结果:使溶液中某些离子的浓度减小
Na+、Cl-
Na+、Cl-
和Ba2+
Ba2++ ══ BaSO4↓
二、离子方程式
1.概念
用实际参加反应的 来表示反应的式子叫做离子
方程式。
离子符号
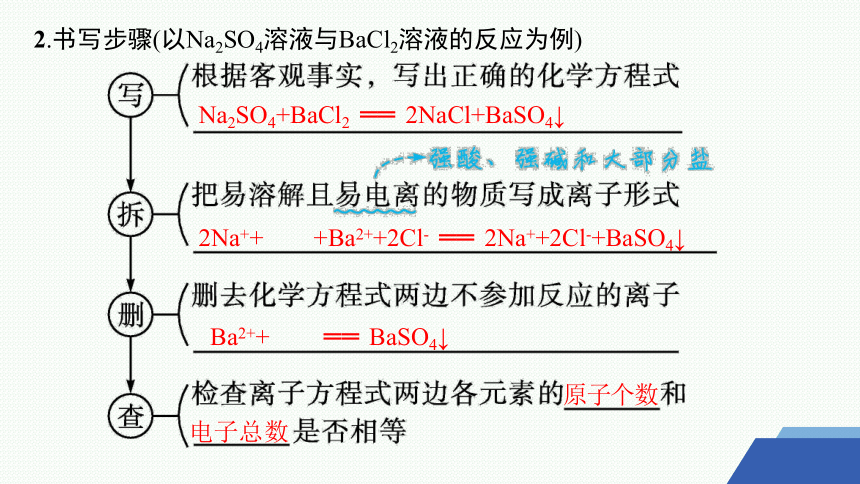
2.书写步骤(以Na2SO4溶液与BaCl2溶液的反应为例)
Na2SO4+BaCl2 ══ 2NaCl+BaSO4↓
2Na++ +Ba2++2Cl- ══ 2Na++2Cl-+BaSO4↓
Ba2++ ══ BaSO4↓
原子个数
电子总数
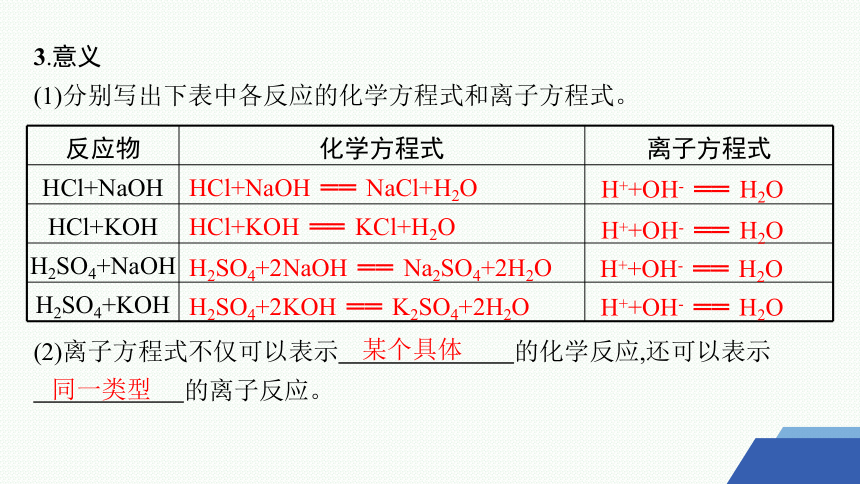
3.意义
(1)分别写出下表中各反应的化学方程式和离子方程式。
反应物 化学方程式 离子方程式
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
HCl+NaOH ══ NaCl+H2O
H++OH- ══ H2O
HCl+KOH ══ KCl+H2O
H++OH- ══ H2O
H2SO4+2NaOH ══ Na2SO4+2H2O
H++OH- ══ H2O
H2SO4+2KOH ══ K2SO4+2H2O
H++OH- ══ H2O
(2)离子方程式不仅可以表示 的化学反应,还可以表示
的离子反应。
某个具体
同一类型
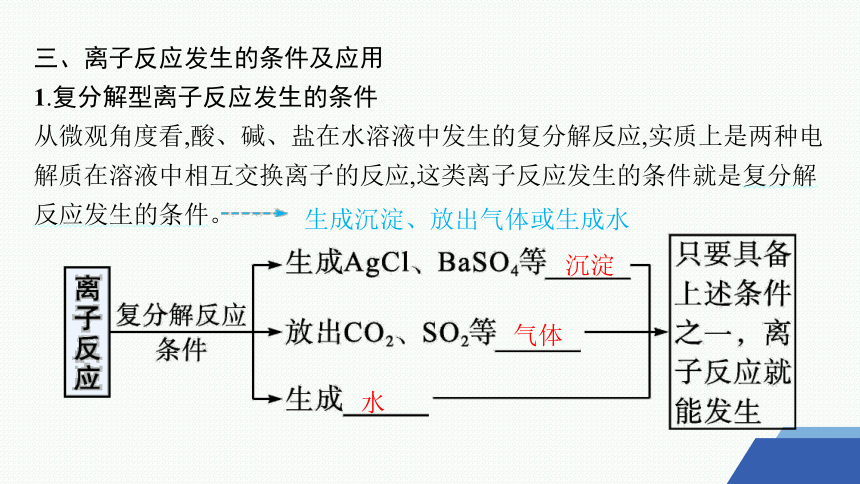
三、离子反应发生的条件及应用
1.复分解型离子反应发生的条件
从微观角度看,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应,这类离子反应发生的条件就是复分解反应发生的条件。
生成沉淀、放出气体或生成水
沉淀
气体
水
2.置换型离子反应发生的条件 依据金属活动性顺序进行分析
3.离子反应的应用
离子反应在物质制备和分离、物质提纯和鉴定,以及消除水中污染物等方面都有广泛的应用。
Zn+2H+ ══ Zn2++H2↑
Fe+Cu2+ ══ Fe2++Cu
深化理解
离子反应及其理解
(1)离子反应大多要在溶液中进行,在溶液中有离子参加或生成的化学反应统称为离子反应。
(2)酸、碱、盐在溶液中所发生的复分解反应实质上是一种离子反应。
特别提醒
判断离子之间是否发生反应
判断两溶液混合前后离子是否发生化学反应,要抓住两个要点:
①看离子种类是否变化;
②看离子数目是否变化。
深化理解
书写离子方程式的四个原则
(1)必须以客观事实为依据,不能臆造事实上不存在的物质、离子及离子
反应。
(2)必须遵循质量守恒定律(即原子守恒)。
(3)必须遵循电荷守恒。
(4)必须遵循得失电子守恒(下一节学习)。
记忆口诀
教材附录Ⅳ[部分酸、碱和盐的溶解性表(室温)]
钾钠铵硝皆可溶,
盐酸不溶银亚汞。
硫酸铅钡不溶解,
钙银亚汞是微溶。
可溶之碱有五位,
铵钾钠钡钙微溶。
还有一个碳酸盐,
铵钾钠溶镁微溶。
易错辨析
(1)KCl溶液和NaNO3溶液混合可发生离子反应。( )
(2)在溶液中,Mg2+与OH-能发生离子反应。( )
(3)“H++OH- ══ H2O”能表示所有的酸和碱的反应。( )
(4)AgNO3溶液与盐酸、NaCl溶液都可用“Ag++Cl- ══ AgCl↓”来表示。
( )
(5)“Fe+2H+ ══ Fe2++H2↑”中“H+”可代表稀盐酸、醋酸溶液等。( )
×
√
×
√
×
重难探究·能力素养全提升
探究一 探究离子反应及发生的条件
情境探究
某研究性小组设计如下实验,探究溶液中离子反应及发生的条件:
(1)实验①中NaOH溶液和CuSO4溶液发生反应的原因是什么 试写出反应的离子方程式。
(2)实验②是否发生反应 若发生反应,请结合离子方程式分析实验现象。
(3)写出实验③的离子方程式,并结合实验①~③总结酸、碱、盐溶液发生离子反应的条件。
提示 Cu2+和OH-反应生成Cu(OH)2沉淀;Cu2++2OH- ══ Cu(OH)2↓。
提示 是;发生离子反应H++OH- ══ H2O,反应消耗OH-,滴加酚酞后,溶液不变红色。
提示 +2H+ ══ CO2↑+H2O;生成沉淀、放出气体或生成水。
方法突破
1.复分解型离子反应发生的条件
2.置换型离子反应发生的条件
应用体验
1.[2023广东阳江四校高一联考]下列各组物质相互混合后,不会发生离子反应的是( )
A.Na2SO4溶液和MgCl2溶液 B.Na2CO3溶液和稀硫酸
C.NaOH溶液和Fe2(SO4)3溶液 D.Ca(OH)2溶液和盐酸
A
解析 Na2CO3溶液和稀硫酸混合,生成二氧化碳和水,能够发生离子反应,B错误;NaOH溶液和Fe2(SO4)3溶液混合,有氢氧化铁沉淀生成,能够发生离子反应,C错误;Ca(OH)2溶液和盐酸混合,有水生成,能够发生离子反应,D错误。
2.依据离子反应发生的条件分析,下列不能发生离子反应的是( )
A.AgNO3+KCl ══ KNO3+AgCl↓
B.BaCl2+2HNO3 ══ Ba(NO3)2+2HCl
C.CaCO3+2HCl ══ CaCl2+H2O+CO2↑
D.Fe+CuSO4 ══ FeSO4+Cu
B
解析 根据复分解反应的条件,A项生成AgCl沉淀,C项生成CO2气体,均能发生复分解型离子反应;Ba(NO3)2、HCl均易溶于水,B项反应不能发生;Fe比Cu活泼,Fe可与CuSO4发生置换型离子反应,D正确。
探究二 离子方程式的书写
情境探究
人体中胃酸对消化食物起着重要作用,其主要成分是HCl。若胃酸分泌过多,会出现灼烧感、反酸、恶心等症状,可服用碳酸氢钠片、复方氢氧化铝片等中和过多胃酸,以减轻胃部不适症状。
(1)胃溃疡患者服用碳酸氢钠片,产生CO2气体,胃部气压过大,
易引起胃穿孔,试写出该反应的离子方程式。
(2)氢氧化铝难溶于水,与胃酸反应生成可溶性铝盐和水,试写出该反应的离子方程式。
提示 +H+ ══ CO2↑+H2O
提示 Al(OH)3+3H+ ══ Al3++3H2O
方法突破
书写离子方程式时化学式的“拆”与“不拆”
应用体验
1.[教材改编题]根据题给信息,写出下列反应的离子方程式。
(1)Ba(OH)2溶液和CuSO4溶液反应:
。
(2)Na2CO3溶液和CaCl2溶液反应: 。
(3)铜与AgNO3溶液反应: 。
(4)Mg(OH)2和稀硝酸反应: 。
Ca2++ ══ CaCO3↓
Cu+2Ag+ ══ 2Ag+Cu2+
Mg(OH)2+2H+ ══ Mg2++2H2O
2.根据题给信息,写出下列反应的离子方程式。
(1)NaOH溶液与稀硝酸反应: 。
(2)BaCl2溶液与K2SO4溶液反应: 。
(3)CaCO3与醋酸(CH3COOH)溶液反应:
。
(4)稀硫酸与Ba(OH)2溶液反应:
。
OH-+H+ ══ H2O
Ba2++ ══ BaSO4↓
CaCO3+2CH3COOH ══ Ca2++2CH3COO-+CO2↑+H2O
2H++ +Ba2++2OH- ══ BaSO4↓+2H2O
学以致用·随堂检测全达标
1
2
3
4
1.将下列溶液混合时,不会发生反应的是( )
A.Na2CO3溶液和稀硝酸
B.NaOH溶液和稀盐酸
C.K2SO4溶液和NaCl溶液
D.AgNO3溶液和KCl溶液
C
解析 与H+反应生成CO2和H2O,A不符合题意;OH-与H+反应生成H2O, B不符合题意;K2SO4溶液和NaCl溶液混合,不发生反应,C符合题意; Ag+和Cl-反应生成AgCl沉淀,D不符合题意。
1
2
3
4
2.下列离子方程式书写正确的是( )
A.将铜片插入硝酸银溶液中:Cu+Ag+ ══ Cu2++Ag
B.将稀硫酸滴在铁片上:2Fe+6H+ ══ 2Fe3++3H2↑
C.将硫酸铜溶液和氢氧化钠溶液混合:Cu2++2OH- ══ Cu(OH)2↓
D.将少量碳酸钙粉末加入稀硝酸中: +2H+ ══ H2O+CO2↑
C
解析 不符合电荷守恒,正确应为Cu+2Ag+ ══ 2Ag+Cu2+,A错误;不符合反应事实,铁与稀硫酸反应生成FeSO4,正确应为Fe+2H+ ══ Fe2++H2↑,B错误;碳酸钙难溶于水,要用化学式表示,正确应为CaCO3+2H+ ══ Ca2++ CO2↑+H2O,D错误。
1
2
3
4
3.下列各组离子能在溶液中大量共存的是( )
B
解析 H+、OH-反应生成H2O,不能大量共存,A错误;H+、 反应生成CO2和H2O,不能大量共存,C错误;Mg2+与OH-反应生成Mg(OH)2沉淀,不能大量共存,D错误。
1
2
3
4
4.下列离子方程式中正确的是( )
B
1
2
3
4
解析 醋酸是弱酸,要用化学式表示,正确应为Fe+2CH3COOH ══ Fe2++2CH3COO-+H2↑,A错误;碳酸钙难溶于水,正确应为CaCO3+2H+ ══ Ca2++CO2↑+H2O,C错误;不符合电荷守恒,D错误。
本 课 结 束
第一章
第二节 第2课时 离子反应
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件,正确书写这些反应的离子方程式,形成宏观辨识与微观探析的核心素养。
2.通过实验了解常见离子的检验方法,进一步理解离子反应,形成科学探究与创新意识的核心素养。
基础落实·必备知识全过关
一、离子反应
1.实验探究[实验1-3]
实验操作
实验现象 有 生成
混合前溶液中的主要离子 BaCl2溶液中:
Na2SO4溶液中:
白色沉淀
Ba2+、Cl-
Na+、
混合后溶液中的主要离子 ___________
结论 两溶液混合, 都没有发生化学变化,
发生反应生成BaSO4白色沉淀
微观实质 _________________________
2.离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。 结果:使溶液中某些离子的浓度减小
Na+、Cl-
Na+、Cl-
和Ba2+
Ba2++ ══ BaSO4↓
二、离子方程式
1.概念
用实际参加反应的 来表示反应的式子叫做离子
方程式。
离子符号
2.书写步骤(以Na2SO4溶液与BaCl2溶液的反应为例)
Na2SO4+BaCl2 ══ 2NaCl+BaSO4↓
2Na++ +Ba2++2Cl- ══ 2Na++2Cl-+BaSO4↓
Ba2++ ══ BaSO4↓
原子个数
电子总数
3.意义
(1)分别写出下表中各反应的化学方程式和离子方程式。
反应物 化学方程式 离子方程式
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
HCl+NaOH ══ NaCl+H2O
H++OH- ══ H2O
HCl+KOH ══ KCl+H2O
H++OH- ══ H2O
H2SO4+2NaOH ══ Na2SO4+2H2O
H++OH- ══ H2O
H2SO4+2KOH ══ K2SO4+2H2O
H++OH- ══ H2O
(2)离子方程式不仅可以表示 的化学反应,还可以表示
的离子反应。
某个具体
同一类型
三、离子反应发生的条件及应用
1.复分解型离子反应发生的条件
从微观角度看,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应,这类离子反应发生的条件就是复分解反应发生的条件。
生成沉淀、放出气体或生成水
沉淀
气体
水
2.置换型离子反应发生的条件 依据金属活动性顺序进行分析
3.离子反应的应用
离子反应在物质制备和分离、物质提纯和鉴定,以及消除水中污染物等方面都有广泛的应用。
Zn+2H+ ══ Zn2++H2↑
Fe+Cu2+ ══ Fe2++Cu
深化理解
离子反应及其理解
(1)离子反应大多要在溶液中进行,在溶液中有离子参加或生成的化学反应统称为离子反应。
(2)酸、碱、盐在溶液中所发生的复分解反应实质上是一种离子反应。
特别提醒
判断离子之间是否发生反应
判断两溶液混合前后离子是否发生化学反应,要抓住两个要点:
①看离子种类是否变化;
②看离子数目是否变化。
深化理解
书写离子方程式的四个原则
(1)必须以客观事实为依据,不能臆造事实上不存在的物质、离子及离子
反应。
(2)必须遵循质量守恒定律(即原子守恒)。
(3)必须遵循电荷守恒。
(4)必须遵循得失电子守恒(下一节学习)。
记忆口诀
教材附录Ⅳ[部分酸、碱和盐的溶解性表(室温)]
钾钠铵硝皆可溶,
盐酸不溶银亚汞。
硫酸铅钡不溶解,
钙银亚汞是微溶。
可溶之碱有五位,
铵钾钠钡钙微溶。
还有一个碳酸盐,
铵钾钠溶镁微溶。
易错辨析
(1)KCl溶液和NaNO3溶液混合可发生离子反应。( )
(2)在溶液中,Mg2+与OH-能发生离子反应。( )
(3)“H++OH- ══ H2O”能表示所有的酸和碱的反应。( )
(4)AgNO3溶液与盐酸、NaCl溶液都可用“Ag++Cl- ══ AgCl↓”来表示。
( )
(5)“Fe+2H+ ══ Fe2++H2↑”中“H+”可代表稀盐酸、醋酸溶液等。( )
×
√
×
√
×
重难探究·能力素养全提升
探究一 探究离子反应及发生的条件
情境探究
某研究性小组设计如下实验,探究溶液中离子反应及发生的条件:
(1)实验①中NaOH溶液和CuSO4溶液发生反应的原因是什么 试写出反应的离子方程式。
(2)实验②是否发生反应 若发生反应,请结合离子方程式分析实验现象。
(3)写出实验③的离子方程式,并结合实验①~③总结酸、碱、盐溶液发生离子反应的条件。
提示 Cu2+和OH-反应生成Cu(OH)2沉淀;Cu2++2OH- ══ Cu(OH)2↓。
提示 是;发生离子反应H++OH- ══ H2O,反应消耗OH-,滴加酚酞后,溶液不变红色。
提示 +2H+ ══ CO2↑+H2O;生成沉淀、放出气体或生成水。
方法突破
1.复分解型离子反应发生的条件
2.置换型离子反应发生的条件
应用体验
1.[2023广东阳江四校高一联考]下列各组物质相互混合后,不会发生离子反应的是( )
A.Na2SO4溶液和MgCl2溶液 B.Na2CO3溶液和稀硫酸
C.NaOH溶液和Fe2(SO4)3溶液 D.Ca(OH)2溶液和盐酸
A
解析 Na2CO3溶液和稀硫酸混合,生成二氧化碳和水,能够发生离子反应,B错误;NaOH溶液和Fe2(SO4)3溶液混合,有氢氧化铁沉淀生成,能够发生离子反应,C错误;Ca(OH)2溶液和盐酸混合,有水生成,能够发生离子反应,D错误。
2.依据离子反应发生的条件分析,下列不能发生离子反应的是( )
A.AgNO3+KCl ══ KNO3+AgCl↓
B.BaCl2+2HNO3 ══ Ba(NO3)2+2HCl
C.CaCO3+2HCl ══ CaCl2+H2O+CO2↑
D.Fe+CuSO4 ══ FeSO4+Cu
B
解析 根据复分解反应的条件,A项生成AgCl沉淀,C项生成CO2气体,均能发生复分解型离子反应;Ba(NO3)2、HCl均易溶于水,B项反应不能发生;Fe比Cu活泼,Fe可与CuSO4发生置换型离子反应,D正确。
探究二 离子方程式的书写
情境探究
人体中胃酸对消化食物起着重要作用,其主要成分是HCl。若胃酸分泌过多,会出现灼烧感、反酸、恶心等症状,可服用碳酸氢钠片、复方氢氧化铝片等中和过多胃酸,以减轻胃部不适症状。
(1)胃溃疡患者服用碳酸氢钠片,产生CO2气体,胃部气压过大,
易引起胃穿孔,试写出该反应的离子方程式。
(2)氢氧化铝难溶于水,与胃酸反应生成可溶性铝盐和水,试写出该反应的离子方程式。
提示 +H+ ══ CO2↑+H2O
提示 Al(OH)3+3H+ ══ Al3++3H2O
方法突破
书写离子方程式时化学式的“拆”与“不拆”
应用体验
1.[教材改编题]根据题给信息,写出下列反应的离子方程式。
(1)Ba(OH)2溶液和CuSO4溶液反应:
。
(2)Na2CO3溶液和CaCl2溶液反应: 。
(3)铜与AgNO3溶液反应: 。
(4)Mg(OH)2和稀硝酸反应: 。
Ca2++ ══ CaCO3↓
Cu+2Ag+ ══ 2Ag+Cu2+
Mg(OH)2+2H+ ══ Mg2++2H2O
2.根据题给信息,写出下列反应的离子方程式。
(1)NaOH溶液与稀硝酸反应: 。
(2)BaCl2溶液与K2SO4溶液反应: 。
(3)CaCO3与醋酸(CH3COOH)溶液反应:
。
(4)稀硫酸与Ba(OH)2溶液反应:
。
OH-+H+ ══ H2O
Ba2++ ══ BaSO4↓
CaCO3+2CH3COOH ══ Ca2++2CH3COO-+CO2↑+H2O
2H++ +Ba2++2OH- ══ BaSO4↓+2H2O
学以致用·随堂检测全达标
1
2
3
4
1.将下列溶液混合时,不会发生反应的是( )
A.Na2CO3溶液和稀硝酸
B.NaOH溶液和稀盐酸
C.K2SO4溶液和NaCl溶液
D.AgNO3溶液和KCl溶液
C
解析 与H+反应生成CO2和H2O,A不符合题意;OH-与H+反应生成H2O, B不符合题意;K2SO4溶液和NaCl溶液混合,不发生反应,C符合题意; Ag+和Cl-反应生成AgCl沉淀,D不符合题意。
1
2
3
4
2.下列离子方程式书写正确的是( )
A.将铜片插入硝酸银溶液中:Cu+Ag+ ══ Cu2++Ag
B.将稀硫酸滴在铁片上:2Fe+6H+ ══ 2Fe3++3H2↑
C.将硫酸铜溶液和氢氧化钠溶液混合:Cu2++2OH- ══ Cu(OH)2↓
D.将少量碳酸钙粉末加入稀硝酸中: +2H+ ══ H2O+CO2↑
C
解析 不符合电荷守恒,正确应为Cu+2Ag+ ══ 2Ag+Cu2+,A错误;不符合反应事实,铁与稀硫酸反应生成FeSO4,正确应为Fe+2H+ ══ Fe2++H2↑,B错误;碳酸钙难溶于水,要用化学式表示,正确应为CaCO3+2H+ ══ Ca2++ CO2↑+H2O,D错误。
1
2
3
4
3.下列各组离子能在溶液中大量共存的是( )
B
解析 H+、OH-反应生成H2O,不能大量共存,A错误;H+、 反应生成CO2和H2O,不能大量共存,C错误;Mg2+与OH-反应生成Mg(OH)2沉淀,不能大量共存,D错误。
1
2
3
4
4.下列离子方程式中正确的是( )
B
1
2
3
4
解析 醋酸是弱酸,要用化学式表示,正确应为Fe+2CH3COOH ══ Fe2++2CH3COO-+H2↑,A错误;碳酸钙难溶于水,正确应为CaCO3+2H+ ══ Ca2++CO2↑+H2O,C错误;不符合电荷守恒,D错误。
本 课 结 束
