1.3.1 氧化还原反应课件(共34张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 1.3.1 氧化还原反应课件(共34张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
第一章
第三节 第1课时 氧化还原反应
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.通过对化合价的分析,认识氧化还原反应的规律,并对常见的化学反应进行分类,形成宏观辨识与微观探析的核心素养。
2.基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,能对其进行分析,形成宏观辨识与微观探析的核心素养。
基础落实·必备知识全过关
一、从宏观角度认识氧化还原反应
1.从得氧失氧角度认识氧化还原反应 (宏观角度——元素)
请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
化学反应 物质 反应物 发生的反应(氧化反应或还原反应) 结论
2CuO+C 2Cu+CO2↑ 得氧物质 C ①氧化反应和还原反应在同一个反应中 发生
②凡是有得氧和失氧的化学反应都是氧化还原反应
失氧物质 CuO
Fe2O3+3CO 2Fe+3CO2 得氧物质 CO
失氧物质 Fe2O3
氧化反应
还原反应
氧化反应
还原反应
同时
2.从元素化合价角度认识氧化还原反应
化学反应 2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
氧化反应 C→CO2 CO→CO2
C元素化合价
还原反应 CuO→Cu Fe2O3→Fe
Cu元素化合价 Fe元素化合价
结论 ①物质所含元素化合价升高,发生 反应;物质所含元素化合价降低,发生 反应 氧化还原反应的重要特征 ②凡是有元素化合价变化的化学反应都是氧化还原反应
升高
降低
降低
氧化
还原
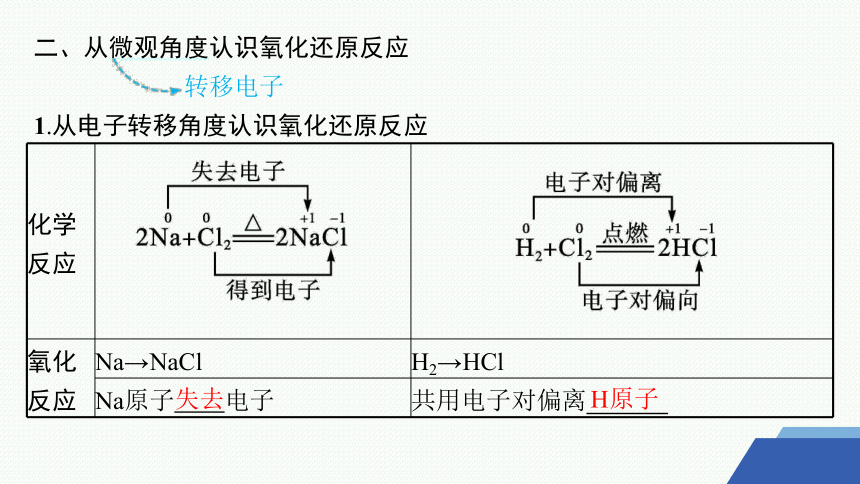
二、从微观角度认识氧化还原反应
转移电子
1.从电子转移角度认识氧化还原反应
化学 反应
氧化 反应 Na→NaCl H2→HCl
Na原子 电子 共用电子对偏离
失去
H原子
还原 反应 Cl2→NaCl Cl2→HCl
Cl原子 电子 共用电子对偏向Cl原子
结论 凡是有 (得失或偏移)的化学反应都是氧化还原反应
得到
电子转移
2.四种基本反应类型与氧化还原反应的关系
概念辨析
氧化反应和还原反应
(1)氧化反应:反应物所含某种(或某些)元素化合价升高的反应称为氧化
反应。
(2)还原反应:反应物所含某种(或某些)元素化合价降低的反应称为还原
反应。
(3)氧化还原反应:在反应过程中有元素化合价变化的化学反应称为氧化
还原反应。
深化理解
元素化合价变化与电子转移的关系
(1)元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化;
(2)元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原。
易错警示
(1)在氧化还原反应中,有元素化合价升高,必定有元素化合价降低,可以是同种元素,也可以是不同种元素。
(2)在氧化还原反应中,有物质发生氧化反应,必定有物质发生还原反应,可以是同种物质,也可以是不同种物质。
(3)有单质参加的反应不一定是氧化还原反应,如同素异形体之间的转化: 3O2 ══ 2O3,O元素化合价不变,不是氧化还原反应。
易错辨析
(1)反应SO2+H2O ══ H2SO3是化合反应,也是氧化还原反应。( )
(2)反应SO2+H2O2 ══ H2SO4是没有单质参加的化合反应,故不是氧化还原反应。( )
(3)反应2Na+2H2O ══ 2NaOH+H2↑中,被氧化的物质是Na,被还原的物质是H2O。( )
(4)没有单质生成的分解反应一定不是氧化还原反应。( )
×
×
√
×
重难探究·能力素养全提升
探究一 探究氧化还原反应的本质及特征
情境探究
某校研究性小组按照下图所示连接实验装置,完成铁与CuSO4溶液反应的实验,探究氧化还原反应的本质,实验中电流计的指针发生偏转。
铁与CuSO4溶液的反应
(1)写出Fe与CuSO4溶液反应的化学方程式,并判断该反应是否属于氧化还原反应。
(2)该实验现象对于你认识铁与CuSO4溶液反应的实质有什么启发 根据以上讨论和实验观察,据此推测铁与CuSO4溶液反应的实质。
提示 Fe+CuSO4 ══ FeSO4+Cu,属于氧化还原反应。
提示 电流计的指针发生偏转,说明有电流产生。Fe原子将电子转移给Cu2+并形成Fe2+,Cu2+得到电子变成Cu原子,故该反应是通过电子转移实现的。
方法突破
氧化还原反应
应用体验
1.[2023北京第四中学高一期中]矿泉水在开采过程中会含有少量溴化物(KBr),在后续生产过程中经臭氧(O3)处理逐渐转化成溴酸盐(KBrO3): KBr+O3 ══ KBrO3。下列有关该过程的认识不正确的是( )
A.该反应是氧化还原反应 B.该反应中臭氧(O3)得到电子
C.该反应中溴元素被氧化 D.该反应中O3发生氧化反应
D
解析 该反应中,Br元素由-1价升高到+5价,O元素由0价降低到-2价,Br和O元素化合价变化,故属于氧化还原反应,A正确;O3→KBrO3,O元素化合价降低,故臭氧(O3)得到电子,发生还原反应,B正确、D错误;KBr→KBrO3,Br元素化合价升高,故溴元素被氧化,C正确。
2.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素均显+3价,Al元素化合价未变化,A错误; C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子,转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
探究二 氧化还原反应中电子转移的表示方法
情境探究
碘被誉为“智力元素”,我国政府为消除碘缺乏病,推行食用“加碘食盐”,规定在食盐中必须加入适量碘酸钾(KIO3),并将每年的5月15日定为“全国碘缺乏病防治日”。
可利用淀粉-KI试纸和稀硫酸检验食盐中是否加碘,发生如下反应: KIO3+5KI+3H2SO4 ══ 3I2+3K2SO4+3H2O。若淀粉-KI试纸变蓝色,证明食盐中含有KIO3。
(1)上述反应中,发生还原反应的物质是 ,被氧化的物质是 。
KIO3
KI
(2)分别用“双线桥法”和“单线桥法”标出上述反应中电子转移的情况。
提示
方法突破
1.“双线桥法”
及表示方法
2.“单线桥法”及表示方法
应用体验
1.下列反应中电子转移表示正确的是( )
B
解析 电解水反应中,H原子得到4×e-,O原子失去2×2e-,A错误;KClO3分解反应中,Cl原子得到2×6e-,O原子失去6×2e-,C错误;表示电子转移的箭头由反应物指向生成物,D错误。
2.[2023广东阳江四校高一联考]下列电子转移表示不正确的是( )
B
解析 该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的表
示为 ,故B错误。
学以致用·随堂检测全达标
1
2
3
4
1.下列属于氧化还原反应的是( )
A.2NO+O2 ══ 2NO2
B.2Al(OH)3 Al2O3+3H2O
C.2HCl+Ca(OH)2 ══ CaCl2+2H2O
D.MgCl2+2AgNO3 ══ Mg(NO3)2+2AgCl↓
A
解析 NO和O2的反应中N、O元素的化合价发生变化,属于氧化还原反应,A正确;B、C、D项都是非氧化还原反应。
1
2
3
4
2.下列反应,氯元素被氧化的是( )
C
解析 KClO3→KCl,Cl元素由+5价变为-1价,被还原,A错误;Cl2→PCl5,Cl元素由0价变为-1价,被还原,B错误;HCl→Cl2,Cl元素由-1价变为0价,被氧化,C正确;Cl2→HCl,Cl元素由0价变为-1价,被还原,D错误。
1
2
3
4
1
2
3
4
3.[2023浙江绍兴高一期中]工业上以氮气为主要原料制备硝酸,其转化过程如下所示,其中氮元素只被还原的一步是( )(提示:3NO2+H2O ══ 2HNO3+NO)
A.① B.② C.③ D.④
A
解析 N2→NH3,N元素被还原;NH3→NO→NO2,N元素化合价升高,N元素被氧化。反应3NO2+H2O ══ 2HNO3+NO中,N元素既被氧化又被还原。
1
2
3
4
4.[2023山西吕梁高一期中]饮用水中的 对人体健康会产生危害,为了降低饮用水中 的浓度,某研究员提出,在碱性条件下用铝粉将水中的 消除,化学方程式为10Al+6NaNO3+4NaOH══10NaAlO2+3N2↑+2H2O。
(1)判断该反应属于氧化还原反应的依据是 。
(2)该反应中, 元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。
(3)该反应中,被还原的元素是 ,被氧化的物质是 。
(4)用双线桥法表示反应中电子转移的方向和数目:
。
答案 (1)Al、N元素化合价发生变化
(2)Al 失去 (3)N Al
(4)
1
2
3
4
本 课 结 束
第一章
第三节 第1课时 氧化还原反应
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.通过对化合价的分析,认识氧化还原反应的规律,并对常见的化学反应进行分类,形成宏观辨识与微观探析的核心素养。
2.基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,能对其进行分析,形成宏观辨识与微观探析的核心素养。
基础落实·必备知识全过关
一、从宏观角度认识氧化还原反应
1.从得氧失氧角度认识氧化还原反应 (宏观角度——元素)
请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
化学反应 物质 反应物 发生的反应(氧化反应或还原反应) 结论
2CuO+C 2Cu+CO2↑ 得氧物质 C ①氧化反应和还原反应在同一个反应中 发生
②凡是有得氧和失氧的化学反应都是氧化还原反应
失氧物质 CuO
Fe2O3+3CO 2Fe+3CO2 得氧物质 CO
失氧物质 Fe2O3
氧化反应
还原反应
氧化反应
还原反应
同时
2.从元素化合价角度认识氧化还原反应
化学反应 2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
氧化反应 C→CO2 CO→CO2
C元素化合价
还原反应 CuO→Cu Fe2O3→Fe
Cu元素化合价 Fe元素化合价
结论 ①物质所含元素化合价升高,发生 反应;物质所含元素化合价降低,发生 反应 氧化还原反应的重要特征 ②凡是有元素化合价变化的化学反应都是氧化还原反应
升高
降低
降低
氧化
还原
二、从微观角度认识氧化还原反应
转移电子
1.从电子转移角度认识氧化还原反应
化学 反应
氧化 反应 Na→NaCl H2→HCl
Na原子 电子 共用电子对偏离
失去
H原子
还原 反应 Cl2→NaCl Cl2→HCl
Cl原子 电子 共用电子对偏向Cl原子
结论 凡是有 (得失或偏移)的化学反应都是氧化还原反应
得到
电子转移
2.四种基本反应类型与氧化还原反应的关系
概念辨析
氧化反应和还原反应
(1)氧化反应:反应物所含某种(或某些)元素化合价升高的反应称为氧化
反应。
(2)还原反应:反应物所含某种(或某些)元素化合价降低的反应称为还原
反应。
(3)氧化还原反应:在反应过程中有元素化合价变化的化学反应称为氧化
还原反应。
深化理解
元素化合价变化与电子转移的关系
(1)元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化;
(2)元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原。
易错警示
(1)在氧化还原反应中,有元素化合价升高,必定有元素化合价降低,可以是同种元素,也可以是不同种元素。
(2)在氧化还原反应中,有物质发生氧化反应,必定有物质发生还原反应,可以是同种物质,也可以是不同种物质。
(3)有单质参加的反应不一定是氧化还原反应,如同素异形体之间的转化: 3O2 ══ 2O3,O元素化合价不变,不是氧化还原反应。
易错辨析
(1)反应SO2+H2O ══ H2SO3是化合反应,也是氧化还原反应。( )
(2)反应SO2+H2O2 ══ H2SO4是没有单质参加的化合反应,故不是氧化还原反应。( )
(3)反应2Na+2H2O ══ 2NaOH+H2↑中,被氧化的物质是Na,被还原的物质是H2O。( )
(4)没有单质生成的分解反应一定不是氧化还原反应。( )
×
×
√
×
重难探究·能力素养全提升
探究一 探究氧化还原反应的本质及特征
情境探究
某校研究性小组按照下图所示连接实验装置,完成铁与CuSO4溶液反应的实验,探究氧化还原反应的本质,实验中电流计的指针发生偏转。
铁与CuSO4溶液的反应
(1)写出Fe与CuSO4溶液反应的化学方程式,并判断该反应是否属于氧化还原反应。
(2)该实验现象对于你认识铁与CuSO4溶液反应的实质有什么启发 根据以上讨论和实验观察,据此推测铁与CuSO4溶液反应的实质。
提示 Fe+CuSO4 ══ FeSO4+Cu,属于氧化还原反应。
提示 电流计的指针发生偏转,说明有电流产生。Fe原子将电子转移给Cu2+并形成Fe2+,Cu2+得到电子变成Cu原子,故该反应是通过电子转移实现的。
方法突破
氧化还原反应
应用体验
1.[2023北京第四中学高一期中]矿泉水在开采过程中会含有少量溴化物(KBr),在后续生产过程中经臭氧(O3)处理逐渐转化成溴酸盐(KBrO3): KBr+O3 ══ KBrO3。下列有关该过程的认识不正确的是( )
A.该反应是氧化还原反应 B.该反应中臭氧(O3)得到电子
C.该反应中溴元素被氧化 D.该反应中O3发生氧化反应
D
解析 该反应中,Br元素由-1价升高到+5价,O元素由0价降低到-2价,Br和O元素化合价变化,故属于氧化还原反应,A正确;O3→KBrO3,O元素化合价降低,故臭氧(O3)得到电子,发生还原反应,B正确、D错误;KBr→KBrO3,Br元素化合价升高,故溴元素被氧化,C正确。
2.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素均显+3价,Al元素化合价未变化,A错误; C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子,转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
探究二 氧化还原反应中电子转移的表示方法
情境探究
碘被誉为“智力元素”,我国政府为消除碘缺乏病,推行食用“加碘食盐”,规定在食盐中必须加入适量碘酸钾(KIO3),并将每年的5月15日定为“全国碘缺乏病防治日”。
可利用淀粉-KI试纸和稀硫酸检验食盐中是否加碘,发生如下反应: KIO3+5KI+3H2SO4 ══ 3I2+3K2SO4+3H2O。若淀粉-KI试纸变蓝色,证明食盐中含有KIO3。
(1)上述反应中,发生还原反应的物质是 ,被氧化的物质是 。
KIO3
KI
(2)分别用“双线桥法”和“单线桥法”标出上述反应中电子转移的情况。
提示
方法突破
1.“双线桥法”
及表示方法
2.“单线桥法”及表示方法
应用体验
1.下列反应中电子转移表示正确的是( )
B
解析 电解水反应中,H原子得到4×e-,O原子失去2×2e-,A错误;KClO3分解反应中,Cl原子得到2×6e-,O原子失去6×2e-,C错误;表示电子转移的箭头由反应物指向生成物,D错误。
2.[2023广东阳江四校高一联考]下列电子转移表示不正确的是( )
B
解析 该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的表
示为 ,故B错误。
学以致用·随堂检测全达标
1
2
3
4
1.下列属于氧化还原反应的是( )
A.2NO+O2 ══ 2NO2
B.2Al(OH)3 Al2O3+3H2O
C.2HCl+Ca(OH)2 ══ CaCl2+2H2O
D.MgCl2+2AgNO3 ══ Mg(NO3)2+2AgCl↓
A
解析 NO和O2的反应中N、O元素的化合价发生变化,属于氧化还原反应,A正确;B、C、D项都是非氧化还原反应。
1
2
3
4
2.下列反应,氯元素被氧化的是( )
C
解析 KClO3→KCl,Cl元素由+5价变为-1价,被还原,A错误;Cl2→PCl5,Cl元素由0价变为-1价,被还原,B错误;HCl→Cl2,Cl元素由-1价变为0价,被氧化,C正确;Cl2→HCl,Cl元素由0价变为-1价,被还原,D错误。
1
2
3
4
1
2
3
4
3.[2023浙江绍兴高一期中]工业上以氮气为主要原料制备硝酸,其转化过程如下所示,其中氮元素只被还原的一步是( )(提示:3NO2+H2O ══ 2HNO3+NO)
A.① B.② C.③ D.④
A
解析 N2→NH3,N元素被还原;NH3→NO→NO2,N元素化合价升高,N元素被氧化。反应3NO2+H2O ══ 2HNO3+NO中,N元素既被氧化又被还原。
1
2
3
4
4.[2023山西吕梁高一期中]饮用水中的 对人体健康会产生危害,为了降低饮用水中 的浓度,某研究员提出,在碱性条件下用铝粉将水中的 消除,化学方程式为10Al+6NaNO3+4NaOH══10NaAlO2+3N2↑+2H2O。
(1)判断该反应属于氧化还原反应的依据是 。
(2)该反应中, 元素的化合价升高,则该元素的原子 (填“得到”或“失去”)电子。
(3)该反应中,被还原的元素是 ,被氧化的物质是 。
(4)用双线桥法表示反应中电子转移的方向和数目:
。
答案 (1)Al、N元素化合价发生变化
(2)Al 失去 (3)N Al
(4)
1
2
3
4
本 课 结 束
