1.3.2 氧化剂和还原剂 课件(共47张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 1.3.2 氧化剂和还原剂 课件(共47张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览






文档简介
(共47张PPT)
第一章
第三节 第2课时 氧化剂和还原剂
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂,形成证据推理与模型认知的核心素养。
2.充分发挥氧化还原反应的社会价值,从化学的视角分析和解决实际问题,体会化学对人类文明和社会发展的促进作用,形成科学态度与社会责任的核心素养。
基础落实·必备知识全过关
一、氧化剂和还原剂
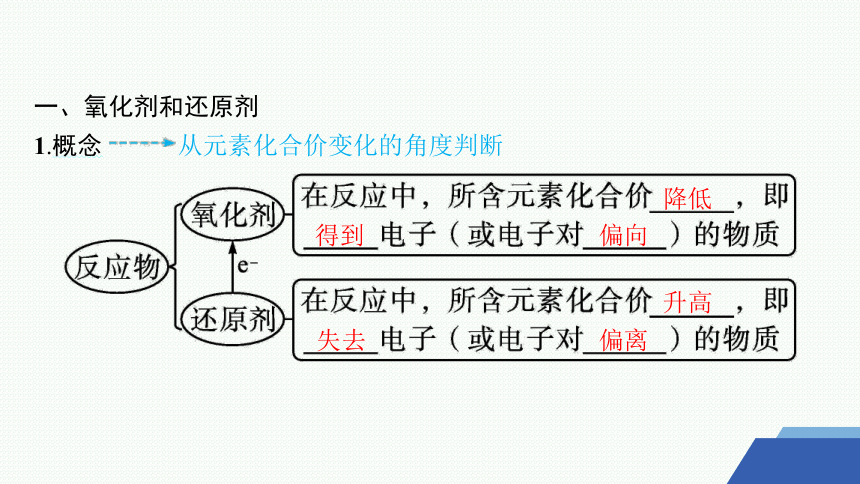
1.概念 从元素化合价变化的角度判断
降低
得到
偏向
升高
失去
偏离
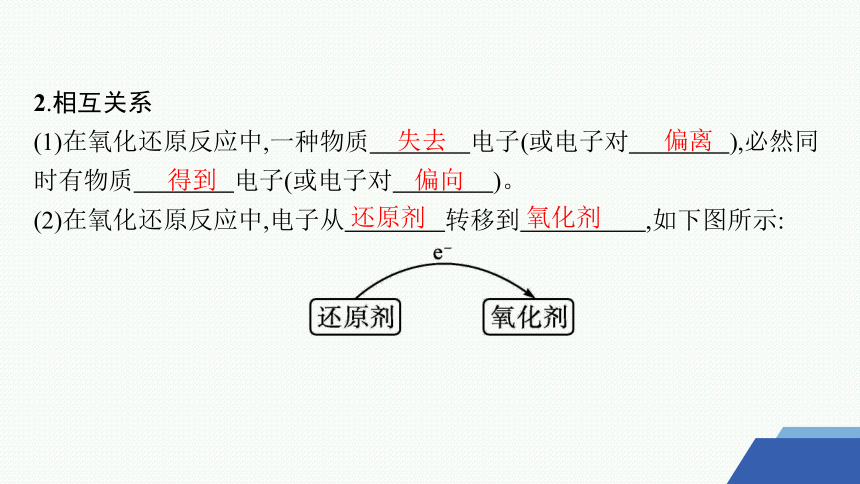
2.相互关系
(1)在氧化还原反应中,一种物质 电子(或电子对 ),必然同时有物质 电子(或电子对 )。
(2)在氧化还原反应中,电子从 转移到 ,如下图所示:
失去
偏离
得到
偏向
还原剂
氧化剂
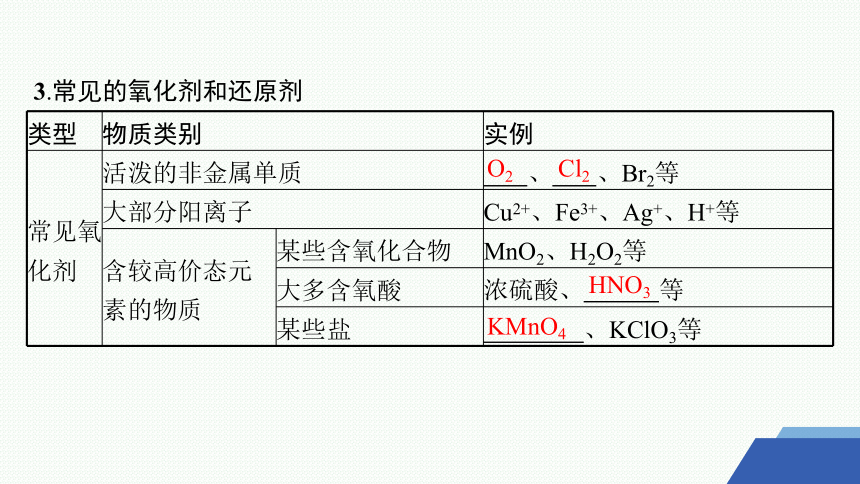
3.常见的氧化剂和还原剂
类型 物质类别 实例
常见氧化剂 活泼的非金属单质 、 、Br2等
大部分阳离子 Cu2+、Fe3+、Ag+、H+等
含较高价态元 素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、 等
某些盐 、KClO3等
O2
Cl2
HNO3
KMnO4
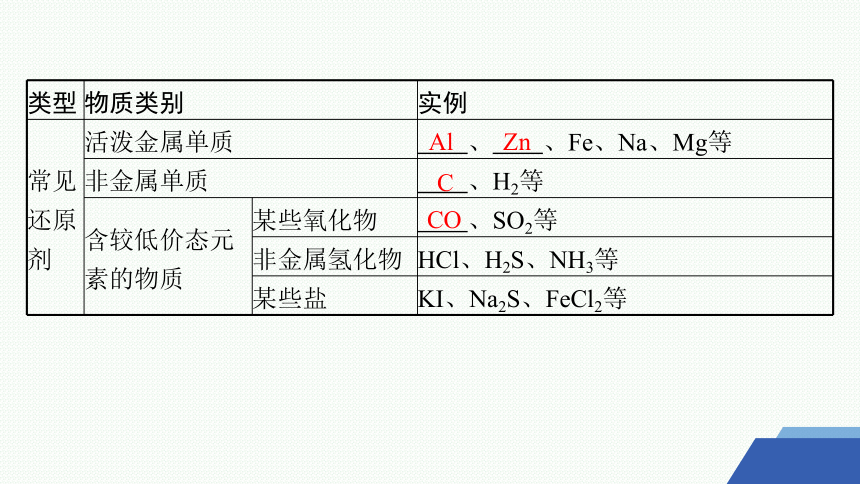
类型 物质类别 实例
常见还原剂 活泼金属单质 、 、Fe、Na、Mg等
非金属单质 、H2等
含较低价态元 素的物质 某些氧化物 、SO2等
非金属氢化物 HCl、H2S、NH3等
某些盐 KI、Na2S、FeCl2等
Al
Zn
C
CO
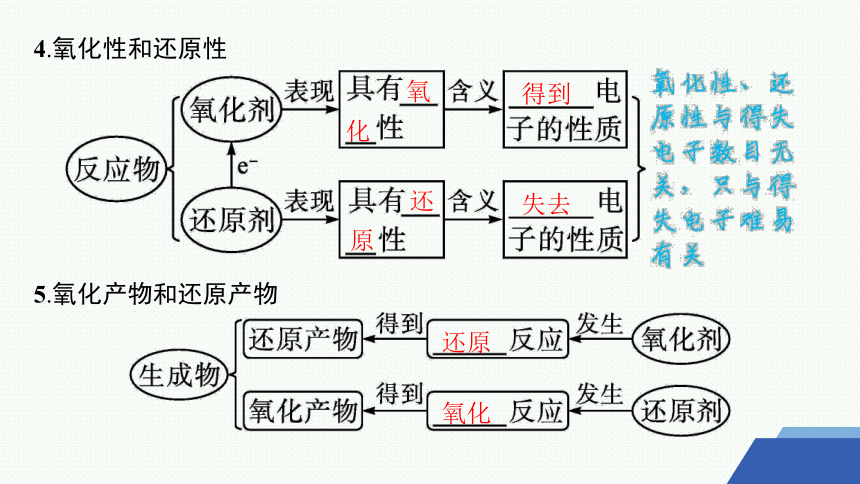
4.氧化性和还原性
5.氧化产物和还原产物
氧
化
得到
还
原
失去
还原
氧化
二、氧化还原反应的应用
1.生产、生活中的氧化还原反应
2.应用实例
(1)金属的冶炼:钛和钛的合金大量用于航空工业,金属钛可由反应TiCl4+4Na 4NaCl+Ti制得。该反应中, 是氧化剂,表现 性;
是还原剂,表现 性。
(2)燃料的燃烧:天然气的主要成分是CH4,燃烧时发生反应CH4+2O2 CO2+2H2O。该反应中,CH4发生 反应,还原产物是 。
(3)钢铁的腐蚀:钢铁腐蚀时发生反应4Fe+3O2+6H2O ══ 4Fe(OH)3, Fe(OH)3再分解生成铁锈(Fe2O3·xH2O)。该反应中,还原剂是 ,氧化产物是 ,还原产物是 。
TiCl4
氧化
Na
还原
氧化
CO2和H2O
Fe
Fe(OH)3
Fe(OH)3
深化理解
氧化剂和还原剂
(1)氧化剂和还原剂是针对反应物而言的。
(2)在氧化还原反应中,必定存在氧化剂和还原剂,可以是不同种物质,也可以是同种物质。
(3)多角度认识氧化剂和还原剂:
易错警示
氧化性和还原性
(1)在反应中,氧化剂表现氧化性,还原剂表现还原性。
(2)物质的氧化性、还原性的强弱与其得失电子的难易程度有关,与得失电子的数目多少无关。例如,Na、Mg、Al作还原剂时,失去电子数目依次增多,但其还原性依次减弱。
(3)物质越易得电子,其氧化性越强;物质越易失电子,其还原性越强。
易错辨析
(1)在反应2Na+Cl2 2NaCl中,Cl2得到电子,则Cl2是氧化剂。( )
(2)在反应中,氧化剂发生氧化反应,还原剂发生还原反应。( )
(3)在不同反应中,HCl既可以作氧化剂又可以作还原剂。( )
(4)在反应2H2O 2H2↑+O2中,氧化剂和还原剂都是H2O。( )
(5)在反应2H2S+SO2 ══ 3S+2H2O中,H2S表现氧化性,SO2表现还原性。
( )
√
×
√
√
×
重难探究·能力素养全提升
探究一 氧化剂、还原剂及相关概念
情境探究
人体内的铁元素大部分以FeSO4和FeCl2的形式存在。人体缺铁会造成缺铁性贫血,给贫血者补充铁时,常补充含Fe2+的亚铁盐,如硫酸亚铁等。
实验室中制取FeSO4的反应有:①Fe+H2SO4 ══ FeSO4+H2↑;②Fe(OH)2+H2SO4 ══ FeSO4+2H2O;③Fe2(SO4)3+Fe ══ 3FeSO4。
(1)反应②是否为氧化还原反应 (填“是”或“否”)。
(2)反应①中,氧化剂是 ,氧化产物是 。
(3)反应③中,Fe2(SO4)3表现 性,被还原的元素是 ,还原产物是 。
否
H2SO4
FeSO4
氧化
Fe
FeSO4
方法突破
1.氧化剂和还原剂的判断
2.氧化性和还原性的判断
3.氧化产物和还原产物的判断
4.氧化还原反应的概念之间的关系
应用体验
1.[2023南开大学附中高一期中]Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ══ 2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
[提示:Na2O2中O元素显-1价]
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.FeSO4作还原剂,表现还原性
D.2个FeSO4发生反应时,共有10个电子转移
A
解析 反应物6个过氧化钠分子中有2个过氧化钠分子中的氧元素化合价升高,作还原剂,其余作氧化剂,A错误;Na2FeO4中铁元素是化合价升高后生成的,氧元素是化合价降低后生成的,故Na2FeO4既是氧化产物又是还原产物,B正确;FeSO4→Na2FeO4,Fe元素由+2价升高到+6价,故FeSO4作还原剂,体现还原性,C正确;反应中的电子转移可以表示为,故2个FeSO4发生反应时,共有10个电子转移,D正确。
2.[2023天津八校高一联考]对于反应3Cl2+6NaOH 5NaCl+NaClO3 +3H2O,下列叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的个数之比为1∶5
C.H2O是还原产物
D.氧化剂的得电子数与还原剂的失电子数之比为5∶1
B
解析 反应中只有Cl元素价态发生改变,故Cl2既是氧化剂又是还原剂; NaOH中不存在价态发生改变的元素,NaOH既不是还原剂也不是氧化剂,A错误。由反应的化学方程式可知,被氧化的氯原子(生成NaClO3)和被还原的氯原子(生成NaCl)的个数之比为1∶5,B正确。H2O中不存在价态变化的元素,故H2O不是还原产物,C错误。依据得失电子守恒的原则,氧化剂的得电子数与还原剂的失电子数相等,二者得失电子数之比为1∶1,D错误。
探究二 物质的氧化性和还原性及比较
情境探究
高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于城市污水的处理、鱼塘水产养殖类水处理等,可直接将Cl2通入Fe(OH)3、KOH的混合物中制取,反应如下:3Cl2+2Fe(OH)3+10KOH ══ 2K2FeO4+6KCl+8H2O。
(1)K2FeO4中Fe元素的化合价是 价,据此推测具有较强 性。
(2)由上述反应可知,该条件下氧化性: > 。
+6
氧化
Cl2
K2FeO4
方法突破
1.从元素化合价角度认识物质的氧化性和还原性
2.比较物质的氧化性和还原性的三种方法
(1)依据氧化还原方程式比较
①氧化性:氧化剂>氧化产物;
②还原性:还原剂>还原产物。
(2)依据金属的活动性顺序比较
(3)依据产物中元素价态的高低比较
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如,
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如,
应用体验
D
【变式设问】
将SO2通入K2Cr2O7溶液中,能否发生氧化还原反应 判断的理由是什么
提示 能;由于还原性:SO2>Fe2+>Cr3+,SO2通入K2Cr2O7溶液中,发生氧化还原反应,生成 、Cr3+。
2.[2023湖北鄂州高一期中]常温下,在溶液中可以发生如下反应:
①2Fe2++Br2 ══ 2Fe3++2Br-;②2Br-+Cl2 ══ Br2+2Cl-;③2Fe3++2I- ══ 2Fe2++I2。由此判断下列说法不正确的是( )
A.氧化性:Cl2>Br2>Fe3+>I2
B.还原性:I->Fe2+>Br->Cl-
C.铁元素在反应①中被氧化,在③中被还原
D.FeCl3能将KBr氧化生成Br2
D
解析 据①可得,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;据②可得,氧化性:Cl2>Br2,还原性:Br->Cl-;据③可得,氧化性:Fe3+>I2,还原性:I->Fe2+,综合可得,氧化性: Cl2>Br2>Fe3+>I2,还原性:I->Fe2+>Br->Cl-,A、B正确。①中铁元素被氧化,③中铁元素被还原,C正确。由于Br2的氧化性强于Fe3+,故FeCl3与KBr不发生反应,D错误。
探究三 氧化还原反应方程式的书写及配平
情境探究
查阅资料:汽车尾气的主要成分为CO、O2和NOx(氮氧化物),在汽车尾气系统中安装三元催化转化器,可使汽车尾气中的NOx转化为无毒的N2,CO转化为无毒的CO2。
(1)若汽车尾气中含有CO和NO,配平化学方程式:CO+NO CO2+N2。
(2)若汽车尾气中含有CO和NO2,经催化后转化为N2和CO2,试写出反应的化学方程式。
提示 2CO+2NO 2CO2+N2
提示 4CO+2NO2 4CO2+N2
方法突破
1.配平三原则
2.配平五步骤(思维模板)
应用体验
[2023山东淄博实验中学高一期中]已知常温下可用Co2O3制备Cl2,其反应的化学方程式为Co2O3+HCl ―→ CoCl2+Cl2↑+H2O(未配平),下列叙述错误的是( )
A.氧化产物为Cl2,氧化性:Co2O3>Cl2
B.配平后H2O前面的化学计量数为3
C.HCl在该反应中只表现还原性
D.该反应中,生成1个Cl2时,转移2个电子
C
解析 结合得失电子守恒、质量守恒将该反应配平:Co2O3+6HCl ══ 2CoCl2+Cl2↑+3H2O。Co2O3是氧化剂,Cl2是氧化产物,结合氧化还原反应中,氧化剂氧化性>氧化产物氧化性可知,氧化性:Co2O3>Cl2,A正确;根据配平的化学方程式可知,H2O前面的化学计量数为3,B正确;只有一部分HCl中的氯离子转化成Cl2,故HCl表现出酸性和还原性,C错误;2HCl→Cl2,Cl元素由-1价升高到0价,故生成1个Cl2时转移2个电子,D正确。
学以致用·随堂检测全达标
1
2
3
4
1.2022年我国的“神舟十四号”宇宙飞船搭载3名航天员顺利升空,并成功实现航天员太空行走。火箭和飞船升空所需的巨大能量可由下列化学反应提供:C2H8N2+2N2O4 ══ 2CO2↑+3N2↑+4H2O。有关该反应的说法正确的是( )(提示:C2H8N2中N元素显-3价)
A.该反应是分解反应 B.反应中碳元素的化合价降低
C.氧化剂是N2O4 D.该反应不是氧化还原反应
C
解析 该反应的反应物有两种,不属于分解反应,A错误;C2H8N2→CO2,C元素由-1价升高到+4价,碳元素化合价升高,B错误;N2O4→N2,N元素化合价降低,则氧化剂是N2O4,C正确;该反应中C、N元素化合价发生变化,故属于氧化还原反应,D错误。
1
2
3
4
2.下列物质之间的转化,加入氧化剂能实现的是( )
A.SiO2 ―→ Si B.SO2 ―→ H2SO3
C.NaBr ―→ Br2 D.CO2 ―→ CO
D
解析 SiO2 ―→ Si,Si元素化合价降低,需要加入还原剂,A错误;SO2H2SO3,O、S元素化合价均不变,不需要加入氧化剂或还原剂,B错误;NaBr ―→ Br2,Br元素化合价升高,需要加入氧化剂,C正确;CO2 ―→ CO,C元素化合价降低,需要加入还原剂,D错误。
1
2
3
4
3.处理汽车尾气的反应为2NO+2CO 2CO2+N2,关于该反应的说法正确的是( )
A.NO发生氧化反应
B.CO2得到电子
C.CO被还原
D.NO是氧化剂
D
解析 NON2,N元素化合价降低,发生还原反应,则NO是氧化剂,A错误、D正确;CO ―→ CO2,C元素化合价升高,则CO被氧化,该反应中,CO2是氧化产物,未得到电子,B、C均错误。
1
2
3
4
4.[2023辽宁六校协作体高一联考]在稀盐酸中,NaNO2与Fe2+反应生成一种无色气体X,气体X对该反应有催化作用,其催化反应过程如图所示:
(1)反应Ⅱ中Fe元素的化合价未发生变化,则X的化学式为 ,该反应的离子方程式为 。
(2)根据图示信息,写出过程Ⅰ的离子方程式:
;
该反应中,氧化剂是 ,还原剂是 。
(3)根据图示信息判断,氧化性:O2 (填“>”或“<”)Fe3+。
1
2
3
4
解析 (1)反应Ⅱ中Fe元素的化合价未发生变化,结合元素守恒推知,X为NO;
(2)过程Ⅰ中,O2、H+、Fe(NO)2+反应生成Fe3+、NO,结合元素守恒推知还生成H2O,结合守恒规律配平可得:O2+4H++4Fe(NO)2+ ══ 4Fe3++4NO +2H2O。
答案 (1)NO Fe2++NO ══Fe(NO)2+
(2)O2+4H++4Fe(NO)2+ ══4Fe3++4NO+2H2O O2 Fe(NO)2+
(3)>
本 课 结 束
第一章
第三节 第2课时 氧化剂和还原剂
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养目标 1.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂,形成证据推理与模型认知的核心素养。
2.充分发挥氧化还原反应的社会价值,从化学的视角分析和解决实际问题,体会化学对人类文明和社会发展的促进作用,形成科学态度与社会责任的核心素养。
基础落实·必备知识全过关
一、氧化剂和还原剂
1.概念 从元素化合价变化的角度判断
降低
得到
偏向
升高
失去
偏离
2.相互关系
(1)在氧化还原反应中,一种物质 电子(或电子对 ),必然同时有物质 电子(或电子对 )。
(2)在氧化还原反应中,电子从 转移到 ,如下图所示:
失去
偏离
得到
偏向
还原剂
氧化剂
3.常见的氧化剂和还原剂
类型 物质类别 实例
常见氧化剂 活泼的非金属单质 、 、Br2等
大部分阳离子 Cu2+、Fe3+、Ag+、H+等
含较高价态元 素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、 等
某些盐 、KClO3等
O2
Cl2
HNO3
KMnO4
类型 物质类别 实例
常见还原剂 活泼金属单质 、 、Fe、Na、Mg等
非金属单质 、H2等
含较低价态元 素的物质 某些氧化物 、SO2等
非金属氢化物 HCl、H2S、NH3等
某些盐 KI、Na2S、FeCl2等
Al
Zn
C
CO
4.氧化性和还原性
5.氧化产物和还原产物
氧
化
得到
还
原
失去
还原
氧化
二、氧化还原反应的应用
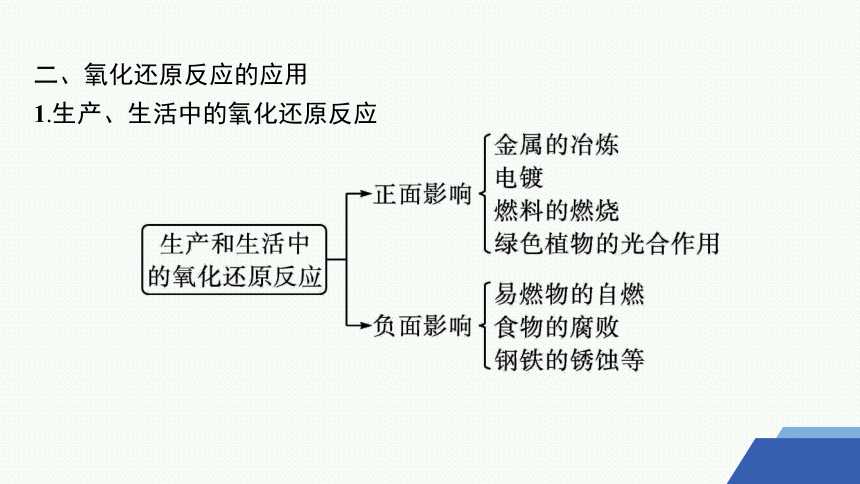
1.生产、生活中的氧化还原反应
2.应用实例
(1)金属的冶炼:钛和钛的合金大量用于航空工业,金属钛可由反应TiCl4+4Na 4NaCl+Ti制得。该反应中, 是氧化剂,表现 性;
是还原剂,表现 性。
(2)燃料的燃烧:天然气的主要成分是CH4,燃烧时发生反应CH4+2O2 CO2+2H2O。该反应中,CH4发生 反应,还原产物是 。
(3)钢铁的腐蚀:钢铁腐蚀时发生反应4Fe+3O2+6H2O ══ 4Fe(OH)3, Fe(OH)3再分解生成铁锈(Fe2O3·xH2O)。该反应中,还原剂是 ,氧化产物是 ,还原产物是 。
TiCl4
氧化
Na
还原
氧化
CO2和H2O
Fe
Fe(OH)3
Fe(OH)3
深化理解
氧化剂和还原剂
(1)氧化剂和还原剂是针对反应物而言的。
(2)在氧化还原反应中,必定存在氧化剂和还原剂,可以是不同种物质,也可以是同种物质。
(3)多角度认识氧化剂和还原剂:
易错警示
氧化性和还原性
(1)在反应中,氧化剂表现氧化性,还原剂表现还原性。
(2)物质的氧化性、还原性的强弱与其得失电子的难易程度有关,与得失电子的数目多少无关。例如,Na、Mg、Al作还原剂时,失去电子数目依次增多,但其还原性依次减弱。
(3)物质越易得电子,其氧化性越强;物质越易失电子,其还原性越强。
易错辨析
(1)在反应2Na+Cl2 2NaCl中,Cl2得到电子,则Cl2是氧化剂。( )
(2)在反应中,氧化剂发生氧化反应,还原剂发生还原反应。( )
(3)在不同反应中,HCl既可以作氧化剂又可以作还原剂。( )
(4)在反应2H2O 2H2↑+O2中,氧化剂和还原剂都是H2O。( )
(5)在反应2H2S+SO2 ══ 3S+2H2O中,H2S表现氧化性,SO2表现还原性。
( )
√
×
√
√
×
重难探究·能力素养全提升
探究一 氧化剂、还原剂及相关概念
情境探究
人体内的铁元素大部分以FeSO4和FeCl2的形式存在。人体缺铁会造成缺铁性贫血,给贫血者补充铁时,常补充含Fe2+的亚铁盐,如硫酸亚铁等。
实验室中制取FeSO4的反应有:①Fe+H2SO4 ══ FeSO4+H2↑;②Fe(OH)2+H2SO4 ══ FeSO4+2H2O;③Fe2(SO4)3+Fe ══ 3FeSO4。
(1)反应②是否为氧化还原反应 (填“是”或“否”)。
(2)反应①中,氧化剂是 ,氧化产物是 。
(3)反应③中,Fe2(SO4)3表现 性,被还原的元素是 ,还原产物是 。
否
H2SO4
FeSO4
氧化
Fe
FeSO4
方法突破
1.氧化剂和还原剂的判断
2.氧化性和还原性的判断
3.氧化产物和还原产物的判断
4.氧化还原反应的概念之间的关系
应用体验
1.[2023南开大学附中高一期中]Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ══ 2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
[提示:Na2O2中O元素显-1价]
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.FeSO4作还原剂,表现还原性
D.2个FeSO4发生反应时,共有10个电子转移
A
解析 反应物6个过氧化钠分子中有2个过氧化钠分子中的氧元素化合价升高,作还原剂,其余作氧化剂,A错误;Na2FeO4中铁元素是化合价升高后生成的,氧元素是化合价降低后生成的,故Na2FeO4既是氧化产物又是还原产物,B正确;FeSO4→Na2FeO4,Fe元素由+2价升高到+6价,故FeSO4作还原剂,体现还原性,C正确;反应中的电子转移可以表示为,故2个FeSO4发生反应时,共有10个电子转移,D正确。
2.[2023天津八校高一联考]对于反应3Cl2+6NaOH 5NaCl+NaClO3 +3H2O,下列叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的个数之比为1∶5
C.H2O是还原产物
D.氧化剂的得电子数与还原剂的失电子数之比为5∶1
B
解析 反应中只有Cl元素价态发生改变,故Cl2既是氧化剂又是还原剂; NaOH中不存在价态发生改变的元素,NaOH既不是还原剂也不是氧化剂,A错误。由反应的化学方程式可知,被氧化的氯原子(生成NaClO3)和被还原的氯原子(生成NaCl)的个数之比为1∶5,B正确。H2O中不存在价态变化的元素,故H2O不是还原产物,C错误。依据得失电子守恒的原则,氧化剂的得电子数与还原剂的失电子数相等,二者得失电子数之比为1∶1,D错误。
探究二 物质的氧化性和还原性及比较
情境探究
高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于城市污水的处理、鱼塘水产养殖类水处理等,可直接将Cl2通入Fe(OH)3、KOH的混合物中制取,反应如下:3Cl2+2Fe(OH)3+10KOH ══ 2K2FeO4+6KCl+8H2O。
(1)K2FeO4中Fe元素的化合价是 价,据此推测具有较强 性。
(2)由上述反应可知,该条件下氧化性: > 。
+6
氧化
Cl2
K2FeO4
方法突破
1.从元素化合价角度认识物质的氧化性和还原性
2.比较物质的氧化性和还原性的三种方法
(1)依据氧化还原方程式比较
①氧化性:氧化剂>氧化产物;
②还原性:还原剂>还原产物。
(2)依据金属的活动性顺序比较
(3)依据产物中元素价态的高低比较
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如,
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如,
应用体验
D
【变式设问】
将SO2通入K2Cr2O7溶液中,能否发生氧化还原反应 判断的理由是什么
提示 能;由于还原性:SO2>Fe2+>Cr3+,SO2通入K2Cr2O7溶液中,发生氧化还原反应,生成 、Cr3+。
2.[2023湖北鄂州高一期中]常温下,在溶液中可以发生如下反应:
①2Fe2++Br2 ══ 2Fe3++2Br-;②2Br-+Cl2 ══ Br2+2Cl-;③2Fe3++2I- ══ 2Fe2++I2。由此判断下列说法不正确的是( )
A.氧化性:Cl2>Br2>Fe3+>I2
B.还原性:I->Fe2+>Br->Cl-
C.铁元素在反应①中被氧化,在③中被还原
D.FeCl3能将KBr氧化生成Br2
D
解析 据①可得,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;据②可得,氧化性:Cl2>Br2,还原性:Br->Cl-;据③可得,氧化性:Fe3+>I2,还原性:I->Fe2+,综合可得,氧化性: Cl2>Br2>Fe3+>I2,还原性:I->Fe2+>Br->Cl-,A、B正确。①中铁元素被氧化,③中铁元素被还原,C正确。由于Br2的氧化性强于Fe3+,故FeCl3与KBr不发生反应,D错误。
探究三 氧化还原反应方程式的书写及配平
情境探究
查阅资料:汽车尾气的主要成分为CO、O2和NOx(氮氧化物),在汽车尾气系统中安装三元催化转化器,可使汽车尾气中的NOx转化为无毒的N2,CO转化为无毒的CO2。
(1)若汽车尾气中含有CO和NO,配平化学方程式:CO+NO CO2+N2。
(2)若汽车尾气中含有CO和NO2,经催化后转化为N2和CO2,试写出反应的化学方程式。
提示 2CO+2NO 2CO2+N2
提示 4CO+2NO2 4CO2+N2
方法突破
1.配平三原则
2.配平五步骤(思维模板)
应用体验
[2023山东淄博实验中学高一期中]已知常温下可用Co2O3制备Cl2,其反应的化学方程式为Co2O3+HCl ―→ CoCl2+Cl2↑+H2O(未配平),下列叙述错误的是( )
A.氧化产物为Cl2,氧化性:Co2O3>Cl2
B.配平后H2O前面的化学计量数为3
C.HCl在该反应中只表现还原性
D.该反应中,生成1个Cl2时,转移2个电子
C
解析 结合得失电子守恒、质量守恒将该反应配平:Co2O3+6HCl ══ 2CoCl2+Cl2↑+3H2O。Co2O3是氧化剂,Cl2是氧化产物,结合氧化还原反应中,氧化剂氧化性>氧化产物氧化性可知,氧化性:Co2O3>Cl2,A正确;根据配平的化学方程式可知,H2O前面的化学计量数为3,B正确;只有一部分HCl中的氯离子转化成Cl2,故HCl表现出酸性和还原性,C错误;2HCl→Cl2,Cl元素由-1价升高到0价,故生成1个Cl2时转移2个电子,D正确。
学以致用·随堂检测全达标
1
2
3
4
1.2022年我国的“神舟十四号”宇宙飞船搭载3名航天员顺利升空,并成功实现航天员太空行走。火箭和飞船升空所需的巨大能量可由下列化学反应提供:C2H8N2+2N2O4 ══ 2CO2↑+3N2↑+4H2O。有关该反应的说法正确的是( )(提示:C2H8N2中N元素显-3价)
A.该反应是分解反应 B.反应中碳元素的化合价降低
C.氧化剂是N2O4 D.该反应不是氧化还原反应
C
解析 该反应的反应物有两种,不属于分解反应,A错误;C2H8N2→CO2,C元素由-1价升高到+4价,碳元素化合价升高,B错误;N2O4→N2,N元素化合价降低,则氧化剂是N2O4,C正确;该反应中C、N元素化合价发生变化,故属于氧化还原反应,D错误。
1
2
3
4
2.下列物质之间的转化,加入氧化剂能实现的是( )
A.SiO2 ―→ Si B.SO2 ―→ H2SO3
C.NaBr ―→ Br2 D.CO2 ―→ CO
D
解析 SiO2 ―→ Si,Si元素化合价降低,需要加入还原剂,A错误;SO2H2SO3,O、S元素化合价均不变,不需要加入氧化剂或还原剂,B错误;NaBr ―→ Br2,Br元素化合价升高,需要加入氧化剂,C正确;CO2 ―→ CO,C元素化合价降低,需要加入还原剂,D错误。
1
2
3
4
3.处理汽车尾气的反应为2NO+2CO 2CO2+N2,关于该反应的说法正确的是( )
A.NO发生氧化反应
B.CO2得到电子
C.CO被还原
D.NO是氧化剂
D
解析 NON2,N元素化合价降低,发生还原反应,则NO是氧化剂,A错误、D正确;CO ―→ CO2,C元素化合价升高,则CO被氧化,该反应中,CO2是氧化产物,未得到电子,B、C均错误。
1
2
3
4
4.[2023辽宁六校协作体高一联考]在稀盐酸中,NaNO2与Fe2+反应生成一种无色气体X,气体X对该反应有催化作用,其催化反应过程如图所示:
(1)反应Ⅱ中Fe元素的化合价未发生变化,则X的化学式为 ,该反应的离子方程式为 。
(2)根据图示信息,写出过程Ⅰ的离子方程式:
;
该反应中,氧化剂是 ,还原剂是 。
(3)根据图示信息判断,氧化性:O2 (填“>”或“<”)Fe3+。
1
2
3
4
解析 (1)反应Ⅱ中Fe元素的化合价未发生变化,结合元素守恒推知,X为NO;
(2)过程Ⅰ中,O2、H+、Fe(NO)2+反应生成Fe3+、NO,结合元素守恒推知还生成H2O,结合守恒规律配平可得:O2+4H++4Fe(NO)2+ ══ 4Fe3++4NO +2H2O。
答案 (1)NO Fe2++NO ══Fe(NO)2+
(2)O2+4H++4Fe(NO)2+ ══4Fe3++4NO+2H2O O2 Fe(NO)2+
(3)>
本 课 结 束
