2.1.1 活泼的金属单质——钠 氧化钠和过氧化钠课件(共48张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 2.1.1 活泼的金属单质——钠 氧化钠和过氧化钠课件(共48张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:31:43 | ||
图片预览







文档简介
(共48张PPT)
第二章
第一节 第1课时 活泼的金属单质——钠 氧化钠和过氧化钠
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.结合真实情境中的应用实例或通过实验探究,了解钠及其氧化物的主要性质,能依据研究目的设计探究方案,发展科学探究与创新意识的学科核心素养。
2.了解钠及其氧化物在生产、生活中的应用,体会化学对社会进步和人类文明的重要贡献,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、活泼的金属单质——钠
1.自然界中钠元素的存在
钠元素在自然界中都以 的形式存在,如NaCl、Na2CO3、Na2SO4等。
2.钠的物理性质
颜色 密度 熔点 硬度
色,有金属光泽 密度 水的密度 97.8 ℃ 质地 ,能用小刀切割
化合物
银白
小于
较软
3.钠的化学性质
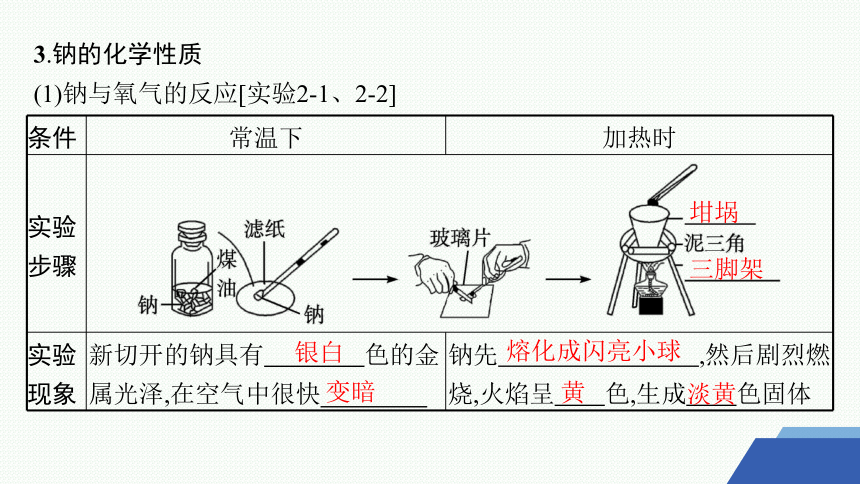
(1)钠与氧气的反应[实验2-1、2-2]
条件 常温下 加热时
实验 步骤
实验 现象 新切开的钠具有 色的金属光泽,在空气中很快 钠先 ,然后剧烈燃烧,火焰呈 色,生成 色固体
坩埚
三脚架
银白
变暗
熔化成闪亮小球
黄
淡黄
条件 常温下 加热时
化学 方程式
实验 结论 钠是非常活泼的金属,质软,易被O2氧化为Na2O或Na2O2
4Na+O2 ══ 2Na2O
2Na+O2 Na2O2
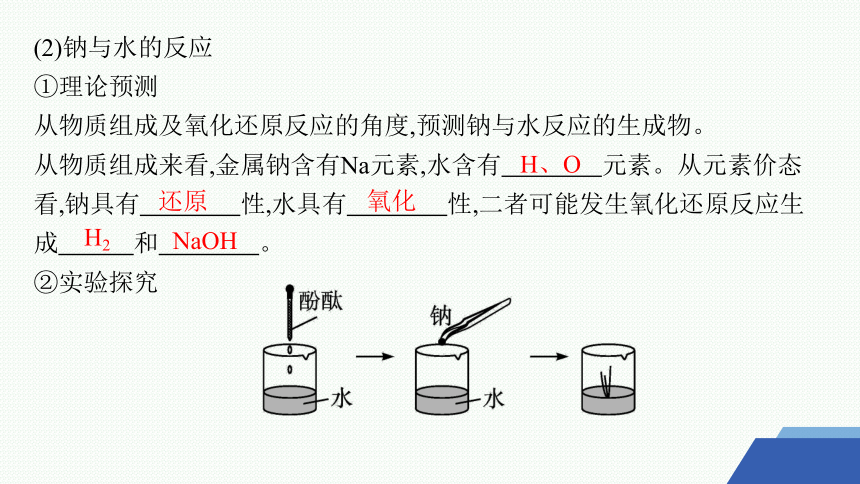
(2)钠与水的反应
①理论预测
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
从物质组成来看,金属钠含有Na元素,水含有 元素。从元素价态看,钠具有 性,水具有 性,二者可能发生氧化还原反应生成 和 。
②实验探究
H、O
还原
氧化
H2
NaOH
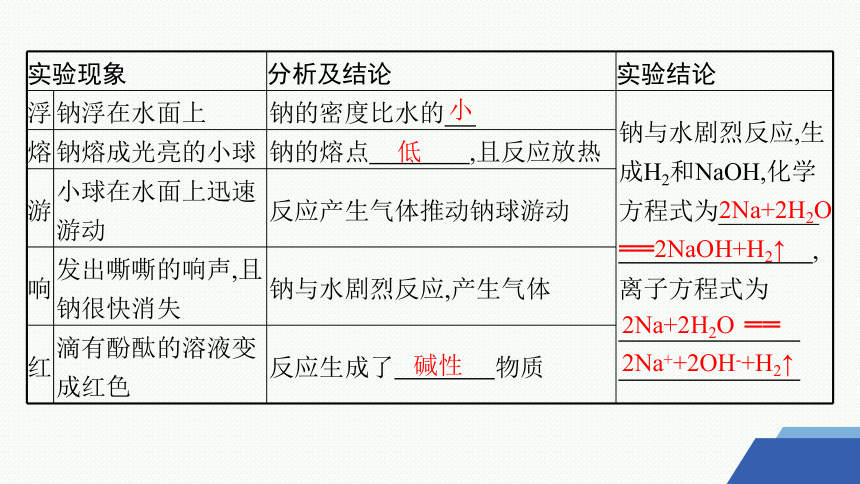
实验现象 分析及结论 实验结论
浮 钠浮在水面上 钠的密度比水的 钠与水剧烈反应,生成H2和NaOH,化学方程式为________
,离子方程式为
熔 钠熔成光亮的小球 钠的熔点 ,且反应放热
游 小球在水面上迅速游动 反应产生气体推动钠球游动
响 发出嘶嘶的响声,且钠很快消失 钠与水剧烈反应,产生气体
红 滴有酚酞的溶液变成红色 反应生成了 物质
小
低
碱性
2Na+2H2O ══2NaOH+H2↑
2Na+2H2O ══
2Na++2OH-+H2↑
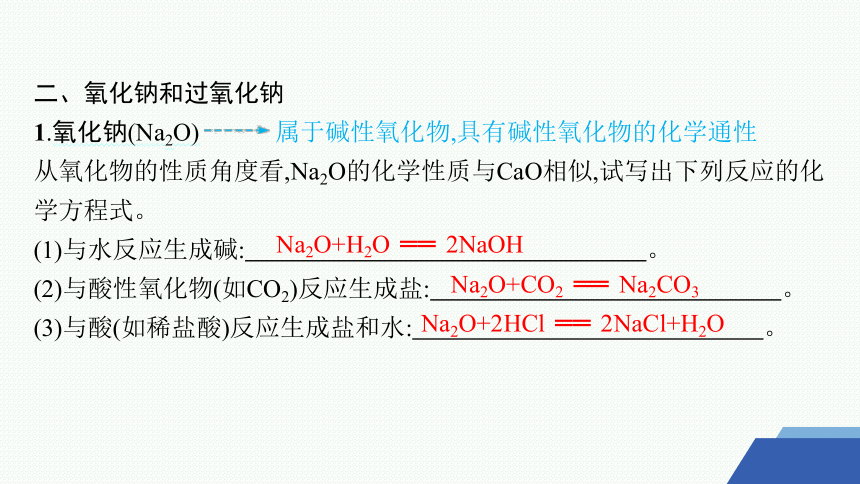
二、氧化钠和过氧化钠
1.氧化钠(Na2O) 属于碱性氧化物,具有碱性氧化物的化学通性
从氧化物的性质角度看,Na2O的化学性质与CaO相似,试写出下列反应的化学方程式。
(1)与水反应生成碱: 。
(2)与酸性氧化物(如CO2)反应生成盐: 。
(3)与酸(如稀盐酸)反应生成盐和水: 。
Na2O+H2O ══ 2NaOH
Na2O+CO2 ══ Na2CO3
Na2O+2HCl ══ 2NaCl+H2O
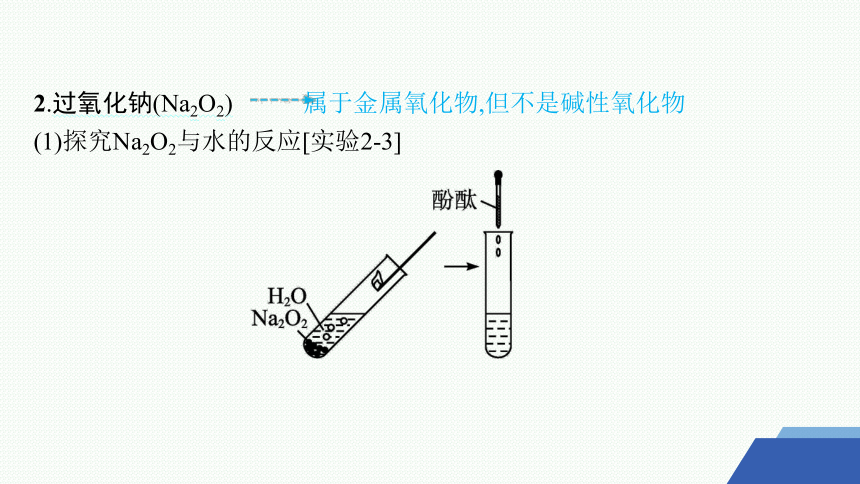
2.过氧化钠(Na2O2) 属于金属氧化物,但不是碱性氧化物
(1)探究Na2O2与水的反应[实验2-3]
归纳总结
从不同角度认识金属钠
(1)从物质分类角度:钠属于金属单质。
(2)从氧化还原角度:钠具有较强还原性。
(3)从金属活动性顺序角度:钠是很活泼的金属。
学法指导
从钠的原子结构角度认识钠的化学性质
钠原子的最外电子层上只有1个电子,在化学反应中易失去电子,故钠的化学性质非常活泼,具有很强的还原性。
归纳总结
(1)取用金属钠,要用镊子夹取,不能用手接触。
(2)剩余的金属钠要放回原试剂瓶,不能随意丢弃。
(3)钠与氧气反应时,条件不同,产物不同,与氧气的量无关。
(4)一定条件下,钠除了能与氧气反应外,还能与氯气等非金属单质反应。
归纳总结
钠与水的反应
(1)钠与水反应的现象可概括为“浮、熔、游、响、红”。若水中未滴加酚酞溶液,则无“红”这一现象。
(2)从不同角度认识钠与水的反应:属于置换反应、氧化还原反应、离子反应、放热反应。
教材拓展
钠露置于空气中的变化
金属钠长期露置于空气中,最终转化为Na2CO3粉末,该过程的主要变化及现象如下:
发生的反应:
①4Na+O2 ══ 2Na2O;
②Na2O+H2O ══ 2NaOH;
实验现象 实验结论 化学方程式
试管壁发热 反应
产生大量气泡且带火星的木条复燃 反应有 生成
滴加酚酞后,溶液变 色 反应有碱性物质生成
放热
氧气
红
2Na2O2+2H2O ══ 4NaOH+O2↑
(2)Na2O2与CO2的反应
Na2O2与CO2反应的化学方程式为 。
(3)Na2O2的用途
过氧化钠可在呼吸面具或潜水艇中作为 的来源。
④2NaOH+CO2+(x-1)H2O ══ Na2CO3·xH2O;
⑤Na2CO3·xH2O ══ Na2CO3+xH2O。
深度思考
结合Na2O2与水的反应,推测Na2O2与盐酸的反应及产物,试写出化学方程式。
2Na2O2+2CO2 ══ 2Na2CO3+O2
氧气
提示 2Na2O2+4HCl ══ 4NaCl+2H2O+O2↑
重难探究·能力素养全提升
探究一 钠与酸、碱、盐溶液的反应
情境探究
某研究性小组设计实验探究钠与酸、碱、盐溶液的反应,分别将一块绿豆粒大小的钠块投入盛有稀硫酸、饱和石灰水和硫酸铜溶液的三只烧杯中(如图所示),观察实验现象并分析。
(1)实验①中,钠与稀硫酸剧烈反应,发生轻微爆炸。试写出钠与稀硫酸反应的化学方程式。若稀硫酸不足量,金属钠能否剩余,为什么
(2)实验②中,观察到烧杯中出现白色浑浊,试结合离子方程式分析原因。
提示 2Na+H2SO4 ══ Na2SO4+H2↑。不能;稀硫酸不足,过量的钠会与溶剂水继续反应生成NaOH和H2。
提示 2Na+2H2O ══ 2Na++2OH-+H2↑;钠与水反应生成NaOH和H2,反应放出热量且消耗溶剂水,由于Ca(OH)2的溶解度随温度升高而降低,达到过饱和,析出Ca(OH)2固体,产生白色浑浊。
(3)实验③中,观察到烧杯中产生蓝色絮状沉淀。请结合化学方程式分析产生上述现象的原因。
提示 钠先与水发生反应:2Na+2H2O ══ 2NaOH+H2↑,NaOH再与CuSO4发生复分解反应生成Cu(OH)2蓝色絮状沉淀:2NaOH+CuSO4 ══ Cu(OH)2↓+Na2SO4。
方法突破
钠与酸、碱、盐溶液发生反应的规律
名师点拨 (1)钠投入碱溶液中,并非都产生浑浊,要看碱溶液是否饱和、反应消耗水的量等,若碱溶液不饱和,可能不产生浑浊。
(2)并非金属钠不能置换出金属单质。工业上常用钠作还原剂在高温下冶炼金属(如Ti等):TiCl4+4Na 4NaCl+Ti。
应用体验
1.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两种液体界面处反应,熔化成小球并上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层
变红
C
解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.971 g·cm-3,介于水和煤油的密度之间,故将绿豆大的钠块投入烧杯中,钠块在煤油、水两种液体界面处反应,钠的下半部分与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处反应并上下跳动,因反应生成NaOH,滴有少量酚酞的水变红。
2.[2023安徽淮北高一期中]按如图所示进行相应实验,下列有关它们反应现象的分析错误的是( )
A.均有可燃性气体生成
B.钠均浮在液面上反应,并四处游动
C.丙中钠能置换出单质铜
D.反应剧烈程度:乙>甲
C
解析 钠和水反应生成氢氧化钠和氢气,钠和盐酸反应生成氯化钠和氢气,钠和硫酸铜溶液反应生成硫酸钠、氢氧化铜、氢气,反应均有可燃性气体生成,A正确;钠的密度比水小,反应放出气体,所以钠均浮在液面上反应,并四处游动,B正确;钠放入硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,丙中钠不能置换出单质铜,C错误;乙中氢离子浓度大于甲,故反应剧烈程度:乙>甲,D正确。
探究二 探究过氧化钠与H2O、CO2的反应
情境探究
在学校师生联谊晚会上,化学老师表演了两个小魔术——“滴水生火”和“吹气生火”,他用胶头滴管向一团脱脂棉滴了几滴水,脱脂棉立刻着火燃烧。他又将一根长玻璃管插入另一团脱脂棉中吹气,稍后脱脂棉着火燃烧。在同学们的再三追问下,老师向同学们透露了小魔术的秘密,原来脱脂棉中包有过氧化钠粉末。
(1)请结合所学知识,解释化学老师小魔术中脱脂棉燃烧的原理。
(2)金属钠着火,能否用泡沫灭火器(灭火时喷出大量CO2和泡沫)灭火 请结合化学方程式予以分析。
提示 Na2O2与水反应生成NaOH和O2,同时放出大量的热,使脱脂棉达到着火点而着火燃烧;人呼出的气体中含有CO2、H2O(g),二者均与Na2O2反应生成O2,并放出大量的热,促使脱脂棉着火燃烧。
提示 不能;金属钠着火时燃烧生成Na2O2,Na2O2与CO2、H2O发生反应:2Na2O2+2CO2 ══ 2Na2CO3+O2、2Na2O2+2H2O ══ 4NaOH+O2↑,放出热量且生成O2。
方法突破
1.认识Na2O2与水、CO2的反应
2.基于氧元素的化合价,认识Na2O2的氧化性和还原性
应用体验
1.过氧化钠可在呼吸面具和潜水艇中作供氧剂,实验室可用如下装置进行验证(A是实验室中制取CO2的装置,C中盛放的是过氧化钠)。下列说法不正确的是( )
A.装置A中发生反应的离子方程式为CaCO3+2H+ ══ Ca2++CO2↑+H2O
B.装置B中盛放饱和NaHCO3溶液,目的是除去CO2中的HCl气体
C.装置C中消耗7.8 g Na2O2时,反应生成1.6 g O2
D.装置D是安全瓶,防止E中水倒流进入C中
D
解析 实验室利用CaCO3与稀盐酸反应制取CO2,反应的离子方程式为CaCO3+2H+ ══ Ca2++CO2↑+H2O,A正确;装置A中制得的CO2中混有挥发出的HCl,饱和NaHCO3溶液用于除去CO2中的HCl气体,B正确;根据反应2Na2O2+2CO2 ══ 2Na2CO3+O2,消耗2×78 g Na2O2时生成32 g O2,则消耗7.8 g Na2O2时,反应生成1.6 g O2,C正确;装置E用于收集反应生成的O2,装置D应盛有NaOH溶液,用于吸收C中未反应的CO2,D错误。
【变式设问】
根据装置E中收集O2的质量计算消耗Na2O2的质量,若缺少装置D,对计算结果有什么影响 为什么
提示 计算值偏大;缺少装置D,未反应的CO2进入装置E。
2.某兴趣小组欲探究:①干燥的CO2不与Na2O2反应;②有水条件下,CO2才能与Na2O2反应。设计实验装置如图所示,实验过程中先滴加稀盐酸,打开K1,关闭K2,一段时间后再加热铜丝;充分反应后,再关闭K1,打开K2,观察整个过程中铜丝的变化。
下列说法错误的是( )
A.先滴加稀盐酸后加热,目的是排除装置内的空气
B.饱和NaHCO3溶液的作用是除去CO2中的HCl
C.试剂X是浓硫酸
D.反应过程中铜丝先变黑后变红
D
解析 先滴加稀盐酸,利用产生的CO2排出装置内的空气,后加热,防止空气中O2对实验产生影响,A正确;石灰石与稀盐酸制取的CO2中混有HCl,饱和NaHCO3溶液的作用是除去CO2中的HCl,防止与Na2O2反应生成O2,B正确;试剂X是浓硫酸,打开K2,关闭K1时,含水蒸气的CO2进入Na2O2,打开K1,关闭K2时,干燥CO2进入Na2O2,可达到预期目的,C正确;反应产生的O2与Cu加热时生成CuO,铜丝由红色变为黑色,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.可作为呼吸面具中氧气来源的物质是( )
A.Na2O2 B.Na2CO3
C.NaHCO3 D.Na2SO4
A
解析 Na2O2可与人体呼出的CO2、H2O(g)发生反应且产生O2,故Na2O2可用作呼吸面具中氧气来源。
1
2
3
4
5
2.[2023广东阳江四校高一联考]在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是( )
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
C
解析 用镊子从煤油中取出一小块金属钠,可观察到钠的颜色和状态,用刀子切开,说明质软,在这一过程中钠的状态没有变化,仍为固体,不能得出熔点低的结论。
1
2
3
4
5
3.下列关于钠反应现象的叙述不正确的是( )
选项 操作内容 反应现象
A 切开钠,观察其颜色的变化 钠切面颜色迅速变暗,生成淡黄色固体
B 把小块钠投入硫酸铁溶液中 钠浮在水面上、在水面上四处游动,产生红褐色沉淀
C 把小块钠投入滴有紫色石蕊溶液的冷水中 钠熔化成闪亮的小球,在水面上四处游动,反应后溶液变蓝
D 把一小块钠迅速投入热坩埚中,继续加热坩埚片刻 钠受热后先熔化,然后剧烈燃烧,产生黄色火焰
A
1
2
3
4
5
解析 钠在空气中被O2氧化,切面由银白色迅速变暗,生成白色固体Na2O,A错误;小块钠投入硫酸铁溶液中,钠先与水反应生成NaOH和H2,NaOH再与Fe2(SO4)3发生反应生成Fe(OH)3红褐色沉淀,B正确;钠投入滴有紫色石蕊溶液的冷水中,Na与水反应生成NaOH和H2,溶液呈碱性,变成蓝色,C正确;钠迅速投入热坩埚中,钠受热后先熔化,变成光亮的小球,继续加热坩埚片刻,剧烈燃烧,产生黄色火焰,D正确。
1
2
3
4
5
4.[2023广东深圳实验学校高一阶段考]过氧化物常用作潜水器、航天器的供氧剂,下列有关Na2O和Na2O2两种钠的氧化物说法正确的是( )
A.钠与氧气反应时的产物主要取决于氧气的用量及纯度
B.等质量的两种氧化物中含有的离子总数相同
C.6.2 g Na2O和7.8 g Na2O2分别溶于等量水中,所得溶液中溶质的质量分数不同
D.Na2O属于碱性氧化物,Na2O2不属于碱性氧化物
D
解析 钠与氧气反应时的产物主要取决于反应条件,常温下反应生成Na2O,加热反应生成Na2O2,A错误;Na2O和Na2O2均由2个钠离子和1个阴离子构成,等质量时,含有的离子总数不相同,B错误;6.2 g Na2O和7.8 g Na2O2溶于等量水中发生反应,所得溶质均为8.0 g NaOH,且溶液质量相等,则所得溶液中溶质的质量分数相等,C错误;Na2O和酸反应生成盐和水,属于碱性氧化物,Na2O2和酸反应生成盐、水和氧气,不属于碱性氧化物,D正确。
1
2
3
4
5
1
2
3
4
5
5.如图是钠与水反应及产物验证的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,关闭活塞a后,迅速塞紧橡胶塞,反应开始,钠块脱离大头针。请回答下列问题:
(1)钠与水反应的离子方程式为
,
其中氧化剂的化学式为 。
(2)该反应中涉及的电解质为 (写化学式)。
(3)能证明有碱性物质生成的现象是 。
(4)能证明有气体产生的现象是:B端液面 (填“上升”“下降”或“不变”,下同),A端液面 。
答案 (1)2Na+2H2O ══ 2Na++2OH-+H2↑ H2O
(2)NaOH、H2O
(3)溶液变为红色
(4)下降 上升
1
2
3
4
5
本 课 结 束
第二章
第一节 第1课时 活泼的金属单质——钠 氧化钠和过氧化钠
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.结合真实情境中的应用实例或通过实验探究,了解钠及其氧化物的主要性质,能依据研究目的设计探究方案,发展科学探究与创新意识的学科核心素养。
2.了解钠及其氧化物在生产、生活中的应用,体会化学对社会进步和人类文明的重要贡献,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、活泼的金属单质——钠
1.自然界中钠元素的存在
钠元素在自然界中都以 的形式存在,如NaCl、Na2CO3、Na2SO4等。
2.钠的物理性质
颜色 密度 熔点 硬度
色,有金属光泽 密度 水的密度 97.8 ℃ 质地 ,能用小刀切割
化合物
银白
小于
较软
3.钠的化学性质
(1)钠与氧气的反应[实验2-1、2-2]
条件 常温下 加热时
实验 步骤
实验 现象 新切开的钠具有 色的金属光泽,在空气中很快 钠先 ,然后剧烈燃烧,火焰呈 色,生成 色固体
坩埚
三脚架
银白
变暗
熔化成闪亮小球
黄
淡黄
条件 常温下 加热时
化学 方程式
实验 结论 钠是非常活泼的金属,质软,易被O2氧化为Na2O或Na2O2
4Na+O2 ══ 2Na2O
2Na+O2 Na2O2
(2)钠与水的反应
①理论预测
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
从物质组成来看,金属钠含有Na元素,水含有 元素。从元素价态看,钠具有 性,水具有 性,二者可能发生氧化还原反应生成 和 。
②实验探究
H、O
还原
氧化
H2
NaOH
实验现象 分析及结论 实验结论
浮 钠浮在水面上 钠的密度比水的 钠与水剧烈反应,生成H2和NaOH,化学方程式为________
,离子方程式为
熔 钠熔成光亮的小球 钠的熔点 ,且反应放热
游 小球在水面上迅速游动 反应产生气体推动钠球游动
响 发出嘶嘶的响声,且钠很快消失 钠与水剧烈反应,产生气体
红 滴有酚酞的溶液变成红色 反应生成了 物质
小
低
碱性
2Na+2H2O ══2NaOH+H2↑
2Na+2H2O ══
2Na++2OH-+H2↑
二、氧化钠和过氧化钠
1.氧化钠(Na2O) 属于碱性氧化物,具有碱性氧化物的化学通性
从氧化物的性质角度看,Na2O的化学性质与CaO相似,试写出下列反应的化学方程式。
(1)与水反应生成碱: 。
(2)与酸性氧化物(如CO2)反应生成盐: 。
(3)与酸(如稀盐酸)反应生成盐和水: 。
Na2O+H2O ══ 2NaOH
Na2O+CO2 ══ Na2CO3
Na2O+2HCl ══ 2NaCl+H2O
2.过氧化钠(Na2O2) 属于金属氧化物,但不是碱性氧化物
(1)探究Na2O2与水的反应[实验2-3]
归纳总结
从不同角度认识金属钠
(1)从物质分类角度:钠属于金属单质。
(2)从氧化还原角度:钠具有较强还原性。
(3)从金属活动性顺序角度:钠是很活泼的金属。
学法指导
从钠的原子结构角度认识钠的化学性质
钠原子的最外电子层上只有1个电子,在化学反应中易失去电子,故钠的化学性质非常活泼,具有很强的还原性。
归纳总结
(1)取用金属钠,要用镊子夹取,不能用手接触。
(2)剩余的金属钠要放回原试剂瓶,不能随意丢弃。
(3)钠与氧气反应时,条件不同,产物不同,与氧气的量无关。
(4)一定条件下,钠除了能与氧气反应外,还能与氯气等非金属单质反应。
归纳总结
钠与水的反应
(1)钠与水反应的现象可概括为“浮、熔、游、响、红”。若水中未滴加酚酞溶液,则无“红”这一现象。
(2)从不同角度认识钠与水的反应:属于置换反应、氧化还原反应、离子反应、放热反应。
教材拓展
钠露置于空气中的变化
金属钠长期露置于空气中,最终转化为Na2CO3粉末,该过程的主要变化及现象如下:
发生的反应:
①4Na+O2 ══ 2Na2O;
②Na2O+H2O ══ 2NaOH;
实验现象 实验结论 化学方程式
试管壁发热 反应
产生大量气泡且带火星的木条复燃 反应有 生成
滴加酚酞后,溶液变 色 反应有碱性物质生成
放热
氧气
红
2Na2O2+2H2O ══ 4NaOH+O2↑
(2)Na2O2与CO2的反应
Na2O2与CO2反应的化学方程式为 。
(3)Na2O2的用途
过氧化钠可在呼吸面具或潜水艇中作为 的来源。
④2NaOH+CO2+(x-1)H2O ══ Na2CO3·xH2O;
⑤Na2CO3·xH2O ══ Na2CO3+xH2O。
深度思考
结合Na2O2与水的反应,推测Na2O2与盐酸的反应及产物,试写出化学方程式。
2Na2O2+2CO2 ══ 2Na2CO3+O2
氧气
提示 2Na2O2+4HCl ══ 4NaCl+2H2O+O2↑
重难探究·能力素养全提升
探究一 钠与酸、碱、盐溶液的反应
情境探究
某研究性小组设计实验探究钠与酸、碱、盐溶液的反应,分别将一块绿豆粒大小的钠块投入盛有稀硫酸、饱和石灰水和硫酸铜溶液的三只烧杯中(如图所示),观察实验现象并分析。
(1)实验①中,钠与稀硫酸剧烈反应,发生轻微爆炸。试写出钠与稀硫酸反应的化学方程式。若稀硫酸不足量,金属钠能否剩余,为什么
(2)实验②中,观察到烧杯中出现白色浑浊,试结合离子方程式分析原因。
提示 2Na+H2SO4 ══ Na2SO4+H2↑。不能;稀硫酸不足,过量的钠会与溶剂水继续反应生成NaOH和H2。
提示 2Na+2H2O ══ 2Na++2OH-+H2↑;钠与水反应生成NaOH和H2,反应放出热量且消耗溶剂水,由于Ca(OH)2的溶解度随温度升高而降低,达到过饱和,析出Ca(OH)2固体,产生白色浑浊。
(3)实验③中,观察到烧杯中产生蓝色絮状沉淀。请结合化学方程式分析产生上述现象的原因。
提示 钠先与水发生反应:2Na+2H2O ══ 2NaOH+H2↑,NaOH再与CuSO4发生复分解反应生成Cu(OH)2蓝色絮状沉淀:2NaOH+CuSO4 ══ Cu(OH)2↓+Na2SO4。
方法突破
钠与酸、碱、盐溶液发生反应的规律
名师点拨 (1)钠投入碱溶液中,并非都产生浑浊,要看碱溶液是否饱和、反应消耗水的量等,若碱溶液不饱和,可能不产生浑浊。
(2)并非金属钠不能置换出金属单质。工业上常用钠作还原剂在高温下冶炼金属(如Ti等):TiCl4+4Na 4NaCl+Ti。
应用体验
1.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两种液体界面处反应,熔化成小球并上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层
变红
C
解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.971 g·cm-3,介于水和煤油的密度之间,故将绿豆大的钠块投入烧杯中,钠块在煤油、水两种液体界面处反应,钠的下半部分与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处反应并上下跳动,因反应生成NaOH,滴有少量酚酞的水变红。
2.[2023安徽淮北高一期中]按如图所示进行相应实验,下列有关它们反应现象的分析错误的是( )
A.均有可燃性气体生成
B.钠均浮在液面上反应,并四处游动
C.丙中钠能置换出单质铜
D.反应剧烈程度:乙>甲
C
解析 钠和水反应生成氢氧化钠和氢气,钠和盐酸反应生成氯化钠和氢气,钠和硫酸铜溶液反应生成硫酸钠、氢氧化铜、氢气,反应均有可燃性气体生成,A正确;钠的密度比水小,反应放出气体,所以钠均浮在液面上反应,并四处游动,B正确;钠放入硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,丙中钠不能置换出单质铜,C错误;乙中氢离子浓度大于甲,故反应剧烈程度:乙>甲,D正确。
探究二 探究过氧化钠与H2O、CO2的反应
情境探究
在学校师生联谊晚会上,化学老师表演了两个小魔术——“滴水生火”和“吹气生火”,他用胶头滴管向一团脱脂棉滴了几滴水,脱脂棉立刻着火燃烧。他又将一根长玻璃管插入另一团脱脂棉中吹气,稍后脱脂棉着火燃烧。在同学们的再三追问下,老师向同学们透露了小魔术的秘密,原来脱脂棉中包有过氧化钠粉末。
(1)请结合所学知识,解释化学老师小魔术中脱脂棉燃烧的原理。
(2)金属钠着火,能否用泡沫灭火器(灭火时喷出大量CO2和泡沫)灭火 请结合化学方程式予以分析。
提示 Na2O2与水反应生成NaOH和O2,同时放出大量的热,使脱脂棉达到着火点而着火燃烧;人呼出的气体中含有CO2、H2O(g),二者均与Na2O2反应生成O2,并放出大量的热,促使脱脂棉着火燃烧。
提示 不能;金属钠着火时燃烧生成Na2O2,Na2O2与CO2、H2O发生反应:2Na2O2+2CO2 ══ 2Na2CO3+O2、2Na2O2+2H2O ══ 4NaOH+O2↑,放出热量且生成O2。
方法突破
1.认识Na2O2与水、CO2的反应
2.基于氧元素的化合价,认识Na2O2的氧化性和还原性
应用体验
1.过氧化钠可在呼吸面具和潜水艇中作供氧剂,实验室可用如下装置进行验证(A是实验室中制取CO2的装置,C中盛放的是过氧化钠)。下列说法不正确的是( )
A.装置A中发生反应的离子方程式为CaCO3+2H+ ══ Ca2++CO2↑+H2O
B.装置B中盛放饱和NaHCO3溶液,目的是除去CO2中的HCl气体
C.装置C中消耗7.8 g Na2O2时,反应生成1.6 g O2
D.装置D是安全瓶,防止E中水倒流进入C中
D
解析 实验室利用CaCO3与稀盐酸反应制取CO2,反应的离子方程式为CaCO3+2H+ ══ Ca2++CO2↑+H2O,A正确;装置A中制得的CO2中混有挥发出的HCl,饱和NaHCO3溶液用于除去CO2中的HCl气体,B正确;根据反应2Na2O2+2CO2 ══ 2Na2CO3+O2,消耗2×78 g Na2O2时生成32 g O2,则消耗7.8 g Na2O2时,反应生成1.6 g O2,C正确;装置E用于收集反应生成的O2,装置D应盛有NaOH溶液,用于吸收C中未反应的CO2,D错误。
【变式设问】
根据装置E中收集O2的质量计算消耗Na2O2的质量,若缺少装置D,对计算结果有什么影响 为什么
提示 计算值偏大;缺少装置D,未反应的CO2进入装置E。
2.某兴趣小组欲探究:①干燥的CO2不与Na2O2反应;②有水条件下,CO2才能与Na2O2反应。设计实验装置如图所示,实验过程中先滴加稀盐酸,打开K1,关闭K2,一段时间后再加热铜丝;充分反应后,再关闭K1,打开K2,观察整个过程中铜丝的变化。
下列说法错误的是( )
A.先滴加稀盐酸后加热,目的是排除装置内的空气
B.饱和NaHCO3溶液的作用是除去CO2中的HCl
C.试剂X是浓硫酸
D.反应过程中铜丝先变黑后变红
D
解析 先滴加稀盐酸,利用产生的CO2排出装置内的空气,后加热,防止空气中O2对实验产生影响,A正确;石灰石与稀盐酸制取的CO2中混有HCl,饱和NaHCO3溶液的作用是除去CO2中的HCl,防止与Na2O2反应生成O2,B正确;试剂X是浓硫酸,打开K2,关闭K1时,含水蒸气的CO2进入Na2O2,打开K1,关闭K2时,干燥CO2进入Na2O2,可达到预期目的,C正确;反应产生的O2与Cu加热时生成CuO,铜丝由红色变为黑色,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.可作为呼吸面具中氧气来源的物质是( )
A.Na2O2 B.Na2CO3
C.NaHCO3 D.Na2SO4
A
解析 Na2O2可与人体呼出的CO2、H2O(g)发生反应且产生O2,故Na2O2可用作呼吸面具中氧气来源。
1
2
3
4
5
2.[2023广东阳江四校高一联考]在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是( )
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
C
解析 用镊子从煤油中取出一小块金属钠,可观察到钠的颜色和状态,用刀子切开,说明质软,在这一过程中钠的状态没有变化,仍为固体,不能得出熔点低的结论。
1
2
3
4
5
3.下列关于钠反应现象的叙述不正确的是( )
选项 操作内容 反应现象
A 切开钠,观察其颜色的变化 钠切面颜色迅速变暗,生成淡黄色固体
B 把小块钠投入硫酸铁溶液中 钠浮在水面上、在水面上四处游动,产生红褐色沉淀
C 把小块钠投入滴有紫色石蕊溶液的冷水中 钠熔化成闪亮的小球,在水面上四处游动,反应后溶液变蓝
D 把一小块钠迅速投入热坩埚中,继续加热坩埚片刻 钠受热后先熔化,然后剧烈燃烧,产生黄色火焰
A
1
2
3
4
5
解析 钠在空气中被O2氧化,切面由银白色迅速变暗,生成白色固体Na2O,A错误;小块钠投入硫酸铁溶液中,钠先与水反应生成NaOH和H2,NaOH再与Fe2(SO4)3发生反应生成Fe(OH)3红褐色沉淀,B正确;钠投入滴有紫色石蕊溶液的冷水中,Na与水反应生成NaOH和H2,溶液呈碱性,变成蓝色,C正确;钠迅速投入热坩埚中,钠受热后先熔化,变成光亮的小球,继续加热坩埚片刻,剧烈燃烧,产生黄色火焰,D正确。
1
2
3
4
5
4.[2023广东深圳实验学校高一阶段考]过氧化物常用作潜水器、航天器的供氧剂,下列有关Na2O和Na2O2两种钠的氧化物说法正确的是( )
A.钠与氧气反应时的产物主要取决于氧气的用量及纯度
B.等质量的两种氧化物中含有的离子总数相同
C.6.2 g Na2O和7.8 g Na2O2分别溶于等量水中,所得溶液中溶质的质量分数不同
D.Na2O属于碱性氧化物,Na2O2不属于碱性氧化物
D
解析 钠与氧气反应时的产物主要取决于反应条件,常温下反应生成Na2O,加热反应生成Na2O2,A错误;Na2O和Na2O2均由2个钠离子和1个阴离子构成,等质量时,含有的离子总数不相同,B错误;6.2 g Na2O和7.8 g Na2O2溶于等量水中发生反应,所得溶质均为8.0 g NaOH,且溶液质量相等,则所得溶液中溶质的质量分数相等,C错误;Na2O和酸反应生成盐和水,属于碱性氧化物,Na2O2和酸反应生成盐、水和氧气,不属于碱性氧化物,D正确。
1
2
3
4
5
1
2
3
4
5
5.如图是钠与水反应及产物验证的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,关闭活塞a后,迅速塞紧橡胶塞,反应开始,钠块脱离大头针。请回答下列问题:
(1)钠与水反应的离子方程式为
,
其中氧化剂的化学式为 。
(2)该反应中涉及的电解质为 (写化学式)。
(3)能证明有碱性物质生成的现象是 。
(4)能证明有气体产生的现象是:B端液面 (填“上升”“下降”或“不变”,下同),A端液面 。
答案 (1)2Na+2H2O ══ 2Na++2OH-+H2↑ H2O
(2)NaOH、H2O
(3)溶液变为红色
(4)下降 上升
1
2
3
4
5
本 课 结 束
