2.2.1 氯气的性质 课件(共43张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 2.2.1 氯气的性质 课件(共43张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览










文档简介
(共43张PPT)
第二章
第二节 第1课时 氯气的性质
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.能通过实验探究氯气的物理性质、化学性质,体会实验对认识和研究物质性质的重要作用,发展科学探究与创新意识的学科核心素养。
2.结合真实情境中的应用实例或通过实验探究,了解氯气的主要性质及在生产中的应用和对生态环境的影响,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、氯元素的存在及氯气的发现
1.氯元素的存在
2.氯气的发现
18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是 )与________ 混合加热,产生了一种 色、有 气味的气体;直到1810年,英国化学家戴维确认这种气体是氯气。
化合物
NaCl、MgCl2、CaCl2
MnO2
浓盐酸
黄绿
刺激性
二、氯气的性质
1.物理性质
颜色 气味 密度 熔、沸点 溶解性
色 刺激性 气味 3.214 g·L-1(0 ℃)密度比空气 熔点:-101 ℃ 沸点:-34.6 ℃ 1体积的水溶解约
体积的氯气
黄绿
大
2
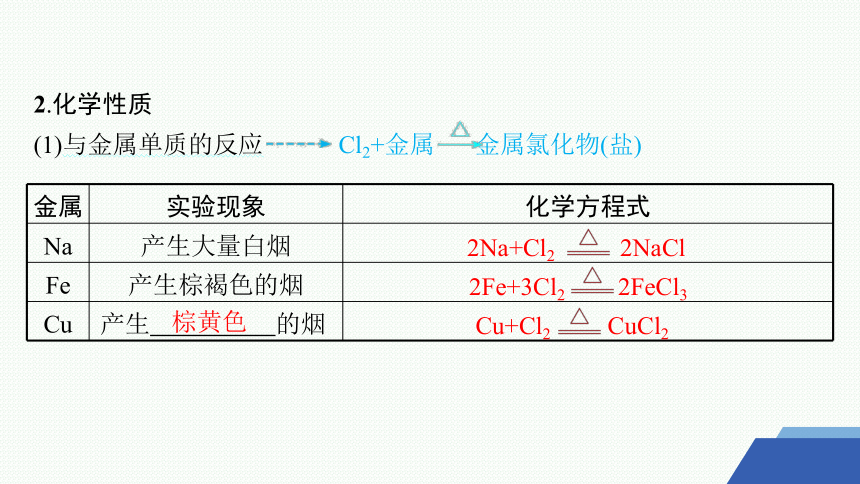
2.化学性质
(1)与金属单质的反应 Cl2+金属 金属氯化物(盐)
金属 实验现象 化学方程式
Na 产生大量白烟
Fe 产生棕褐色的烟
Cu 产生 的烟
2Na+Cl2 2NaCl
2Fe+3Cl2 2FeCl3
棕黄色
Cu+Cl2 CuCl2
(2)与非金属单质的反应
[实验2-7]H2在Cl2中燃烧 Cl2作氧化剂,H2作还原剂
实验操作 实验现象 实验结论
纯净的H2在Cl2中安静地燃烧,发出 色火焰,集气瓶口有 产生 化学方程式为
,
HCl溶于水得到
微点归纳 燃烧不一定要有氧气参加,物质并不是只有在氧气中才能燃烧。燃烧的本质是氧化还原反应,所有发光、发热的剧烈的氧化还原反应都称为燃烧。
苍白
白雾
H2+Cl2 2HCl
盐酸
(3)与水的反应
①氯水的形成
氯气的水溶液称为 。在常温下,溶于水的氯气部分与水反应生成了盐酸和次氯酸,化学方程式为Cl2+H2O HCl+HClO。
氧化还原反应,Cl2既是氧化剂又是还原剂
氯水
②探究干燥的氯气是否具有漂白性[实验2-8(1)]
实验操作 实验现象 结论
干燥有色布条 Cl2 漂白作用
湿润有色布条 湿润有色布条含有水,起漂白作用的是
不褪色
无
褪色
HClO
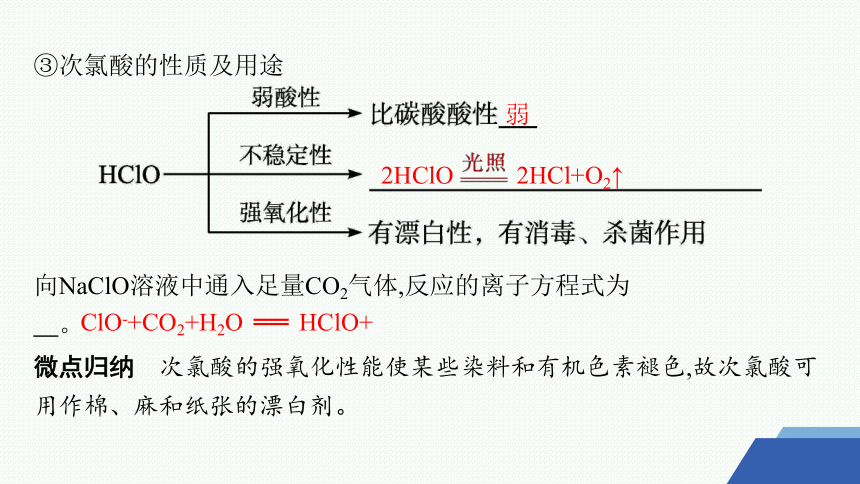
③次氯酸的性质及用途
向NaClO溶液中通入足量CO2气体,反应的离子方程式为 。
微点归纳 次氯酸的强氧化性能使某些染料和有机色素褪色,故次氯酸可用作棉、麻和纸张的漂白剂。
弱
2HClO 2HCl+O2↑
ClO-+CO2+H2O ══ HClO+
(4)与碱的反应
用途 制取方法 化学方程式 有效成分
制漂白液 常温下,将Cl2通入NaOH溶液中
制漂白粉 将Cl2通入冷的石灰乳中
制漂粉精 Cl2与Ca(OH)2充分反应,使 成为主要成分,则得到漂粉精 Ca(ClO)2
微点归纳 漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池等场所的消毒剂。
Cl2+2NaOH ══ NaCl+NaClO+H2O
NaClO
2Cl2+2Ca(OH)2 ══ Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2
Ca(ClO)2
教材拓展
实验室闻气体的操作
规范操作:打开瓶塞,用手在瓶口轻轻扇动,使极少量的气体飘进鼻孔。
学法指导
从原子结构角度认识氯气的化学性质
(1)氯原子的最外电子层上有7个电子,在化学反应中很容易得到1个电子,使最外层达到8个电子的稳定结构。
(2)推测氯气是很活泼的非金属单质,具有强氧化性。
归纳总结
氯气与金属的反应
(1)氯气与金属反应的规律:Cl2+变价金属(如Fe、Cu)→高价态金属氯化物(如FeCl3、CuCl2)。
(2)常温下,干燥的Cl2与Fe不反应,故工业上常用钢瓶储运液氯。
深度思考
能否用足量铁粉与Cl2反应制取FeCl2 为什么
提示 不能;Cl2具有强氧化性,与Fe反应只能生成FeCl3。
深度剖析
次氯酸的漂白性
(1)次氯酸具有漂白性,能使某些染料和有机色素褪色,只针对有机物而言,使无机物褪色不是漂白性。
(2)次氯酸的漂白是利用了其强氧化性,具有永久性、不可逆性。
(3)类似于次氯酸,具有强氧化性的Na2O2、H2O2、O3等物质都具有漂白性。
教材拓展
漂白粉的保存及失效
(1)漂白粉的有效成分是Ca(ClO)2,易吸收空气中H2O(g)、CO2,故应密封保存。
(2)漂白粉放置在空气中失效的原理是:Ca(ClO)2+CO2+H2O ══ CaCO3+2HClO,2HClO 2HCl+O2↑。
归纳总结
(1)常温下,氯气与碱溶液反应的规律:Cl2+碱―→次氯酸盐+盐酸盐(氯化物)+H2O。
(2)氯水、次氯酸盐溶液都具有强氧化性,可使pH试纸褪色,故不能用pH试纸测定氯水、次氯酸盐溶液的pH。
重难探究·能力素养全提升
探究一 氯气与水的反应
情境探究
据报道,挪威三文鱼生产商格里格海产(Grieg seafood)发表声明称,4 000加仑的氯气意外泄漏,导致挪威北部峡湾约9.6万条鲑鱼死亡,幸无人员伤亡。这次泄漏会对采集场附近水生生物造成短期且严重的影响。
(1)请结合化学方程式分析,氯气意外泄漏导致大量鲑鱼死亡的原因。
提示 氯气与水发生反应:Cl2+H2O HClO+HCl,引起水体变酸性,且HClO具有强氧化性,使鲑鱼无法生存而死亡。
(2)如何利用化学方法快速消除氯气泄漏对挪威北部峡湾海水产生的影响
提示 氯气泄漏引起水体呈酸性,可加入适量生石灰等中和酸,降低海水的酸性,改善海水的水质。
方法突破
名师点拨 (1)利用氯水代替氯气作氧化剂时,起作用的主要是Cl2,可将Fe2+、I-等还原性离子氧化,一般不考虑HClO、ClO-。
(2)氯水使有机色质褪色时,起作用的是HClO,可将有机色质(如石蕊、酚酞等)漂白褪色。
应用体验
1.向新制的饱和氯水中加入下列物质,表中现象及解释均正确的是( )
选项 加入物质 现象 解释
A HNO3酸化的AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
B 紫色石蕊溶液 显红色 氯水中有HCl、HClO
C CaCO3 有气体放出 HCl、HClO酸性比H2CO3强
D 有色布条 有色布条褪色 Cl2有漂白性
A
解析 向饱和氯水中加入HNO3酸化的AgNO3溶液,有白色沉淀生成,该沉淀为AgCl,则氯水中含有Cl-,A正确;向氯水中滴加紫色石蕊溶液,溶液先变红后褪色,说明氯水中含有H+、HClO,B错误;向氯水中加入CaCO3,发生反应: CaCO3+2H+ ══ Ca2++CO2↑+H2O,说明HCl的酸性强于碳酸,但HClO的酸性比碳酸弱,C错误;氯水中放入有色布条,布条褪色,起漂白作用的是HClO,Cl2无漂白性,D错误。
【变式设问】
向饱和氯水中滴加NaHCO3溶液,产生什么现象 写出反应的离子方程式。
提示 产生大量气泡; +H+ ══ CO2↑+H2O。
2.[2023河北衡水中学高一调研]下列是关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和HClO分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2
D.氯水放置数天后,pH将增大
B
解析 新制氯水中含有Cl2、H2O、HClO分子,还含有H+、Cl-、OH-、ClO-, A错误;新制氯水中含有HCl和次氯酸,HCl显酸性,可使蓝色石蕊试纸变红,次氯酸具有强氧化性,能使蓝色石蕊试纸褪色,B正确;光照氯水时发生反应2HClO 2HCl+O2↑,有气泡冒出,该气体为O2,C错误;氯水放置数天后,氯水转化为稀盐酸,溶液的酸性增强,pH将减小,D错误。
探究二 氯气与碱溶液的反应
情境探究
“84”消毒液是日常生活中广泛使用的消毒剂,其有效成分是NaClO。“84”消毒液可有效杀灭大肠杆菌,特别是各种物体表面以及环境,都可以用“84”消毒液进行消毒。
(1)将Cl2通入NaOH溶液中可制得“84”消毒液,写出反应的化学方程式,并从氧化还原反应角度描述Cl2的作用。
提示 Cl2+2NaOH ══ NaClO+NaCl+H2O;Cl2既是氧化剂又是还原剂。
(2)已知酸性:H2CO3>HClO,请结合化学方程式说明“84”消毒液在空气中敞口放置失效的原因。
(3)洁厕灵的有效成分是盐酸,室内扫除时,“84”消毒液不能与洁厕灵混合使用。请结合化学方程式分析其中原因。
提示 “84”消毒液的有效成分为NaClO,由于酸性:H2CO3>HClO,在空气中敞口放置易吸收CO2,发生反应:NaClO+CO2+H2O ══ NaHCO3+HClO, HClO不稳定,易发生分解反应而失效:2HClO 2HCl+O2↑。
提示 若混合使用,发生反应:NaClO+2HCl ══ NaCl+Cl2↑+H2O,产生有毒的Cl2,室内通风不畅,易造成中毒。
方法突破
氯气与碱的反应规律及次氯酸盐的漂白性
应用体验
1.[2023重庆南开中学高一调研]漂白粉是生产生活中常用的消毒剂。下列有关漂白粉的说法中,错误的是( )
①漂白粉是混合物,其有效成分是氯化钙和次氯酸钙
②为了提高漂白粉的漂白效果,使用时可加少量盐酸
③漂白粉性质稳定,可以敞口存放
④工业上利用氯气与石灰乳的反应制备漂白粉,要适当控制反应温度
A.①② B.②③
C.①③ D.①④
C
解析 漂白粉是混合物,其主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,①错误;使用漂白粉时可加少量盐酸增加次氯酸浓度,可以提高漂白粉的漂白效果,②正确;漂白粉中次氯酸钙会与空气中二氧化碳和水反应,故漂白粉应密封保存,③错误;工业上利用氯气与石灰乳的反应制备漂白粉,要适当控制反应温度,避免生成氯酸钙,④正确。
2.[2023吉林白山高一期中]为抗击病毒,“84”消毒液成为人们居家生活的必需品。下列有关说法正确的是( )
A.将Cl2通入石灰乳中可制得“84”消毒液
B.“84”消毒液的有效成分为NaClO
C.“84”消毒液可与稀盐酸混合使用
D.“84”消毒液的主要成分为HClO的水溶液
B
解析 将Cl2通入石灰乳中制得漂白粉,Cl2通入NaOH溶液可制得“84”消毒液,A错误;“84”消毒液若与稀盐酸混合使用,可发生反应:NaClO+2HCl ══ NaCl+Cl2↑+H2O,释放出有毒的Cl2,易引起中毒,C错误;“84”消毒液的主要成分为NaCl和NaClO,有效成分为NaClO,B正确、D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列气体中,呈黄绿色的是( )
A.H2 B.Cl2
C.NH3 D.CH4
B
解析 Cl2是黄绿色气体,H2、NH3和CH4都是无色气体。
1
2
3
4
5
2.下列关于HClO的性质叙述错误的是( )
A.HClO是一元弱酸
B.HClO不稳定,见光易分解
C.HClO具有强氧化性
D.HClO中氯元素的化合价为-1价
D
解析 HClO中H元素显+1价,O元素显-2价,根据各元素化合价代数和为0推知,Cl元素显+1价。
1
2
3
4
5
3.下列物质能使紫色石蕊溶液先变红后褪色的是( )
①Cl2 ②敞口瓶中的久置氯水 ③盐酸 ④Na2O2 ⑤活性炭
A.只有① B.只有①②
C.只有②③④ D.只有②④⑤
A
解析 Cl2与水反应生成HCl、HClO,紫色石蕊溶液先变红后褪色,①正确;氯水久置过程中,HClO分解生成HCl和O2,久置氯水相当于稀盐酸,使紫色石蕊溶液只变红不褪色,②、③错误;Na2O2加入紫色石蕊溶液中,溶液先变成蓝色后褪色,④错误;活性炭具有吸附作用,加入紫色石蕊溶液中,溶液褪色,⑤错误。
1
2
3
4
5
4.如图所示,从a处通入新制取的未经干燥的Cl2,关闭b处弹簧夹时,c处的干燥红色布条看不到明显现象;当打开b处弹簧夹后,c处红色布条逐渐褪色,d瓶中装的是( )
①浓硫酸 ②NaOH溶液
③H2O ④饱和NaCl溶液
A.①③ B.②④
C.①② D.③④
C
解析 关闭b处弹簧夹时,c处的干燥红色布条看不到明显现象,则d瓶中可能盛有浓硫酸,干燥Cl2不能使干燥红色布条褪色,或盛有NaOH等碱溶液,与Cl2反应,Cl2不能进入试管c,故干燥红色布条不褪色,①②正确。Cl2通过盛有H2O或饱和NaCl溶液的锥形瓶,会带出水蒸气,可使干燥红色布条褪色,③④错误。
1
2
3
4
5
1
2
3
4
5
5.生活中常用“84”消毒液杀菌消毒。化学课外小组用Cl2和NaOH溶液制取“84”消毒液。请回答下列问题:
(1)制取“84”消毒液的化学方程式为 。
(2)制取“84”消毒液需要配制200 g质量分数为10%的NaOH溶液,配制时称取NaOH固体的质量为 ,配制过程中使用的玻璃仪器有 、 、量筒、胶头滴管等。
(3)该消毒液也用于漂白,为增强漂白性,向消毒液中滴加几滴稀盐酸,写出反应的化学方程式: 。
(4)“84”消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,化学课外小组同学向溶液中滴加紫色石蕊溶液,出现 现象,证明消毒液已失效。
1
2
3
4
5
答案 (1)Cl2+2NaOH ══ NaCl+NaClO+H2O (2)20.0 g 烧杯 玻璃棒 (3)NaClO+HCl ══ NaCl+HClO (4)紫色石蕊溶液只变红不褪色
解析 (2)配制200 g质量分数为10%的NaOH溶液,称取NaOH固体的质量为200 g×10%=20.0 g。配制过程中,要将称量的NaOH固体在烧杯中溶解,并用量筒量取180.0 mL蒸馏水,用玻璃棒不断搅拌、加速溶解。
(3)消毒液起漂白作用的是HClO,滴加几滴稀盐酸,发生反应:NaClO+HCl ══ NaCl+HClO,生成HClO使漂白效果增强。
(4)“84”消毒液在空气中久置,NaClO与CO2、H2O反应生成HClO,而HClO具有漂白作用,滴加紫色石蕊溶液,若溶液只变成红色不褪色,则不含HClO,证明消毒液已失效。
本 课 结 束
第二章
第二节 第1课时 氯气的性质
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.能通过实验探究氯气的物理性质、化学性质,体会实验对认识和研究物质性质的重要作用,发展科学探究与创新意识的学科核心素养。
2.结合真实情境中的应用实例或通过实验探究,了解氯气的主要性质及在生产中的应用和对生态环境的影响,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、氯元素的存在及氯气的发现
1.氯元素的存在
2.氯气的发现
18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分是 )与________ 混合加热,产生了一种 色、有 气味的气体;直到1810年,英国化学家戴维确认这种气体是氯气。
化合物
NaCl、MgCl2、CaCl2
MnO2
浓盐酸
黄绿
刺激性
二、氯气的性质
1.物理性质
颜色 气味 密度 熔、沸点 溶解性
色 刺激性 气味 3.214 g·L-1(0 ℃)密度比空气 熔点:-101 ℃ 沸点:-34.6 ℃ 1体积的水溶解约
体积的氯气
黄绿
大
2
2.化学性质
(1)与金属单质的反应 Cl2+金属 金属氯化物(盐)
金属 实验现象 化学方程式
Na 产生大量白烟
Fe 产生棕褐色的烟
Cu 产生 的烟
2Na+Cl2 2NaCl
2Fe+3Cl2 2FeCl3
棕黄色
Cu+Cl2 CuCl2
(2)与非金属单质的反应
[实验2-7]H2在Cl2中燃烧 Cl2作氧化剂,H2作还原剂
实验操作 实验现象 实验结论
纯净的H2在Cl2中安静地燃烧,发出 色火焰,集气瓶口有 产生 化学方程式为
,
HCl溶于水得到
微点归纳 燃烧不一定要有氧气参加,物质并不是只有在氧气中才能燃烧。燃烧的本质是氧化还原反应,所有发光、发热的剧烈的氧化还原反应都称为燃烧。
苍白
白雾
H2+Cl2 2HCl
盐酸
(3)与水的反应
①氯水的形成
氯气的水溶液称为 。在常温下,溶于水的氯气部分与水反应生成了盐酸和次氯酸,化学方程式为Cl2+H2O HCl+HClO。
氧化还原反应,Cl2既是氧化剂又是还原剂
氯水
②探究干燥的氯气是否具有漂白性[实验2-8(1)]
实验操作 实验现象 结论
干燥有色布条 Cl2 漂白作用
湿润有色布条 湿润有色布条含有水,起漂白作用的是
不褪色
无
褪色
HClO
③次氯酸的性质及用途
向NaClO溶液中通入足量CO2气体,反应的离子方程式为 。
微点归纳 次氯酸的强氧化性能使某些染料和有机色素褪色,故次氯酸可用作棉、麻和纸张的漂白剂。
弱
2HClO 2HCl+O2↑
ClO-+CO2+H2O ══ HClO+
(4)与碱的反应
用途 制取方法 化学方程式 有效成分
制漂白液 常温下,将Cl2通入NaOH溶液中
制漂白粉 将Cl2通入冷的石灰乳中
制漂粉精 Cl2与Ca(OH)2充分反应,使 成为主要成分,则得到漂粉精 Ca(ClO)2
微点归纳 漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池等场所的消毒剂。
Cl2+2NaOH ══ NaCl+NaClO+H2O
NaClO
2Cl2+2Ca(OH)2 ══ Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2
Ca(ClO)2
教材拓展
实验室闻气体的操作
规范操作:打开瓶塞,用手在瓶口轻轻扇动,使极少量的气体飘进鼻孔。
学法指导
从原子结构角度认识氯气的化学性质
(1)氯原子的最外电子层上有7个电子,在化学反应中很容易得到1个电子,使最外层达到8个电子的稳定结构。
(2)推测氯气是很活泼的非金属单质,具有强氧化性。
归纳总结
氯气与金属的反应
(1)氯气与金属反应的规律:Cl2+变价金属(如Fe、Cu)→高价态金属氯化物(如FeCl3、CuCl2)。
(2)常温下,干燥的Cl2与Fe不反应,故工业上常用钢瓶储运液氯。
深度思考
能否用足量铁粉与Cl2反应制取FeCl2 为什么
提示 不能;Cl2具有强氧化性,与Fe反应只能生成FeCl3。
深度剖析
次氯酸的漂白性
(1)次氯酸具有漂白性,能使某些染料和有机色素褪色,只针对有机物而言,使无机物褪色不是漂白性。
(2)次氯酸的漂白是利用了其强氧化性,具有永久性、不可逆性。
(3)类似于次氯酸,具有强氧化性的Na2O2、H2O2、O3等物质都具有漂白性。
教材拓展
漂白粉的保存及失效
(1)漂白粉的有效成分是Ca(ClO)2,易吸收空气中H2O(g)、CO2,故应密封保存。
(2)漂白粉放置在空气中失效的原理是:Ca(ClO)2+CO2+H2O ══ CaCO3+2HClO,2HClO 2HCl+O2↑。
归纳总结
(1)常温下,氯气与碱溶液反应的规律:Cl2+碱―→次氯酸盐+盐酸盐(氯化物)+H2O。
(2)氯水、次氯酸盐溶液都具有强氧化性,可使pH试纸褪色,故不能用pH试纸测定氯水、次氯酸盐溶液的pH。
重难探究·能力素养全提升
探究一 氯气与水的反应
情境探究
据报道,挪威三文鱼生产商格里格海产(Grieg seafood)发表声明称,4 000加仑的氯气意外泄漏,导致挪威北部峡湾约9.6万条鲑鱼死亡,幸无人员伤亡。这次泄漏会对采集场附近水生生物造成短期且严重的影响。
(1)请结合化学方程式分析,氯气意外泄漏导致大量鲑鱼死亡的原因。
提示 氯气与水发生反应:Cl2+H2O HClO+HCl,引起水体变酸性,且HClO具有强氧化性,使鲑鱼无法生存而死亡。
(2)如何利用化学方法快速消除氯气泄漏对挪威北部峡湾海水产生的影响
提示 氯气泄漏引起水体呈酸性,可加入适量生石灰等中和酸,降低海水的酸性,改善海水的水质。
方法突破
名师点拨 (1)利用氯水代替氯气作氧化剂时,起作用的主要是Cl2,可将Fe2+、I-等还原性离子氧化,一般不考虑HClO、ClO-。
(2)氯水使有机色质褪色时,起作用的是HClO,可将有机色质(如石蕊、酚酞等)漂白褪色。
应用体验
1.向新制的饱和氯水中加入下列物质,表中现象及解释均正确的是( )
选项 加入物质 现象 解释
A HNO3酸化的AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
B 紫色石蕊溶液 显红色 氯水中有HCl、HClO
C CaCO3 有气体放出 HCl、HClO酸性比H2CO3强
D 有色布条 有色布条褪色 Cl2有漂白性
A
解析 向饱和氯水中加入HNO3酸化的AgNO3溶液,有白色沉淀生成,该沉淀为AgCl,则氯水中含有Cl-,A正确;向氯水中滴加紫色石蕊溶液,溶液先变红后褪色,说明氯水中含有H+、HClO,B错误;向氯水中加入CaCO3,发生反应: CaCO3+2H+ ══ Ca2++CO2↑+H2O,说明HCl的酸性强于碳酸,但HClO的酸性比碳酸弱,C错误;氯水中放入有色布条,布条褪色,起漂白作用的是HClO,Cl2无漂白性,D错误。
【变式设问】
向饱和氯水中滴加NaHCO3溶液,产生什么现象 写出反应的离子方程式。
提示 产生大量气泡; +H+ ══ CO2↑+H2O。
2.[2023河北衡水中学高一调研]下列是关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和HClO分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2
D.氯水放置数天后,pH将增大
B
解析 新制氯水中含有Cl2、H2O、HClO分子,还含有H+、Cl-、OH-、ClO-, A错误;新制氯水中含有HCl和次氯酸,HCl显酸性,可使蓝色石蕊试纸变红,次氯酸具有强氧化性,能使蓝色石蕊试纸褪色,B正确;光照氯水时发生反应2HClO 2HCl+O2↑,有气泡冒出,该气体为O2,C错误;氯水放置数天后,氯水转化为稀盐酸,溶液的酸性增强,pH将减小,D错误。
探究二 氯气与碱溶液的反应
情境探究
“84”消毒液是日常生活中广泛使用的消毒剂,其有效成分是NaClO。“84”消毒液可有效杀灭大肠杆菌,特别是各种物体表面以及环境,都可以用“84”消毒液进行消毒。
(1)将Cl2通入NaOH溶液中可制得“84”消毒液,写出反应的化学方程式,并从氧化还原反应角度描述Cl2的作用。
提示 Cl2+2NaOH ══ NaClO+NaCl+H2O;Cl2既是氧化剂又是还原剂。
(2)已知酸性:H2CO3>HClO,请结合化学方程式说明“84”消毒液在空气中敞口放置失效的原因。
(3)洁厕灵的有效成分是盐酸,室内扫除时,“84”消毒液不能与洁厕灵混合使用。请结合化学方程式分析其中原因。
提示 “84”消毒液的有效成分为NaClO,由于酸性:H2CO3>HClO,在空气中敞口放置易吸收CO2,发生反应:NaClO+CO2+H2O ══ NaHCO3+HClO, HClO不稳定,易发生分解反应而失效:2HClO 2HCl+O2↑。
提示 若混合使用,发生反应:NaClO+2HCl ══ NaCl+Cl2↑+H2O,产生有毒的Cl2,室内通风不畅,易造成中毒。
方法突破
氯气与碱的反应规律及次氯酸盐的漂白性
应用体验
1.[2023重庆南开中学高一调研]漂白粉是生产生活中常用的消毒剂。下列有关漂白粉的说法中,错误的是( )
①漂白粉是混合物,其有效成分是氯化钙和次氯酸钙
②为了提高漂白粉的漂白效果,使用时可加少量盐酸
③漂白粉性质稳定,可以敞口存放
④工业上利用氯气与石灰乳的反应制备漂白粉,要适当控制反应温度
A.①② B.②③
C.①③ D.①④
C
解析 漂白粉是混合物,其主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,①错误;使用漂白粉时可加少量盐酸增加次氯酸浓度,可以提高漂白粉的漂白效果,②正确;漂白粉中次氯酸钙会与空气中二氧化碳和水反应,故漂白粉应密封保存,③错误;工业上利用氯气与石灰乳的反应制备漂白粉,要适当控制反应温度,避免生成氯酸钙,④正确。
2.[2023吉林白山高一期中]为抗击病毒,“84”消毒液成为人们居家生活的必需品。下列有关说法正确的是( )
A.将Cl2通入石灰乳中可制得“84”消毒液
B.“84”消毒液的有效成分为NaClO
C.“84”消毒液可与稀盐酸混合使用
D.“84”消毒液的主要成分为HClO的水溶液
B
解析 将Cl2通入石灰乳中制得漂白粉,Cl2通入NaOH溶液可制得“84”消毒液,A错误;“84”消毒液若与稀盐酸混合使用,可发生反应:NaClO+2HCl ══ NaCl+Cl2↑+H2O,释放出有毒的Cl2,易引起中毒,C错误;“84”消毒液的主要成分为NaCl和NaClO,有效成分为NaClO,B正确、D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列气体中,呈黄绿色的是( )
A.H2 B.Cl2
C.NH3 D.CH4
B
解析 Cl2是黄绿色气体,H2、NH3和CH4都是无色气体。
1
2
3
4
5
2.下列关于HClO的性质叙述错误的是( )
A.HClO是一元弱酸
B.HClO不稳定,见光易分解
C.HClO具有强氧化性
D.HClO中氯元素的化合价为-1价
D
解析 HClO中H元素显+1价,O元素显-2价,根据各元素化合价代数和为0推知,Cl元素显+1价。
1
2
3
4
5
3.下列物质能使紫色石蕊溶液先变红后褪色的是( )
①Cl2 ②敞口瓶中的久置氯水 ③盐酸 ④Na2O2 ⑤活性炭
A.只有① B.只有①②
C.只有②③④ D.只有②④⑤
A
解析 Cl2与水反应生成HCl、HClO,紫色石蕊溶液先变红后褪色,①正确;氯水久置过程中,HClO分解生成HCl和O2,久置氯水相当于稀盐酸,使紫色石蕊溶液只变红不褪色,②、③错误;Na2O2加入紫色石蕊溶液中,溶液先变成蓝色后褪色,④错误;活性炭具有吸附作用,加入紫色石蕊溶液中,溶液褪色,⑤错误。
1
2
3
4
5
4.如图所示,从a处通入新制取的未经干燥的Cl2,关闭b处弹簧夹时,c处的干燥红色布条看不到明显现象;当打开b处弹簧夹后,c处红色布条逐渐褪色,d瓶中装的是( )
①浓硫酸 ②NaOH溶液
③H2O ④饱和NaCl溶液
A.①③ B.②④
C.①② D.③④
C
解析 关闭b处弹簧夹时,c处的干燥红色布条看不到明显现象,则d瓶中可能盛有浓硫酸,干燥Cl2不能使干燥红色布条褪色,或盛有NaOH等碱溶液,与Cl2反应,Cl2不能进入试管c,故干燥红色布条不褪色,①②正确。Cl2通过盛有H2O或饱和NaCl溶液的锥形瓶,会带出水蒸气,可使干燥红色布条褪色,③④错误。
1
2
3
4
5
1
2
3
4
5
5.生活中常用“84”消毒液杀菌消毒。化学课外小组用Cl2和NaOH溶液制取“84”消毒液。请回答下列问题:
(1)制取“84”消毒液的化学方程式为 。
(2)制取“84”消毒液需要配制200 g质量分数为10%的NaOH溶液,配制时称取NaOH固体的质量为 ,配制过程中使用的玻璃仪器有 、 、量筒、胶头滴管等。
(3)该消毒液也用于漂白,为增强漂白性,向消毒液中滴加几滴稀盐酸,写出反应的化学方程式: 。
(4)“84”消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,化学课外小组同学向溶液中滴加紫色石蕊溶液,出现 现象,证明消毒液已失效。
1
2
3
4
5
答案 (1)Cl2+2NaOH ══ NaCl+NaClO+H2O (2)20.0 g 烧杯 玻璃棒 (3)NaClO+HCl ══ NaCl+HClO (4)紫色石蕊溶液只变红不褪色
解析 (2)配制200 g质量分数为10%的NaOH溶液,称取NaOH固体的质量为200 g×10%=20.0 g。配制过程中,要将称量的NaOH固体在烧杯中溶解,并用量筒量取180.0 mL蒸馏水,用玻璃棒不断搅拌、加速溶解。
(3)消毒液起漂白作用的是HClO,滴加几滴稀盐酸,发生反应:NaClO+HCl ══ NaCl+HClO,生成HClO使漂白效果增强。
(4)“84”消毒液在空气中久置,NaClO与CO2、H2O反应生成HClO,而HClO具有漂白作用,滴加紫色石蕊溶液,若溶液只变成红色不褪色,则不含HClO,证明消毒液已失效。
本 课 结 束
