2.3.2 气体摩尔体积 课件(共37张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 2.3.2 气体摩尔体积 课件(共37张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
第二章
第三节 第2课时 气体摩尔体积
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.了解气体摩尔体积的含义,体会从物质的量层次定量研究化学问题的意义,发展宏观辨识与微观探析的学科核心素养。
2.能够利用物质的量、气体摩尔体积、在标准状况下气体的体积三者之间的关系,进行简单的计算,发展宏观辨识与微观探析的学科核心素养。
基础落实·必备知识全过关
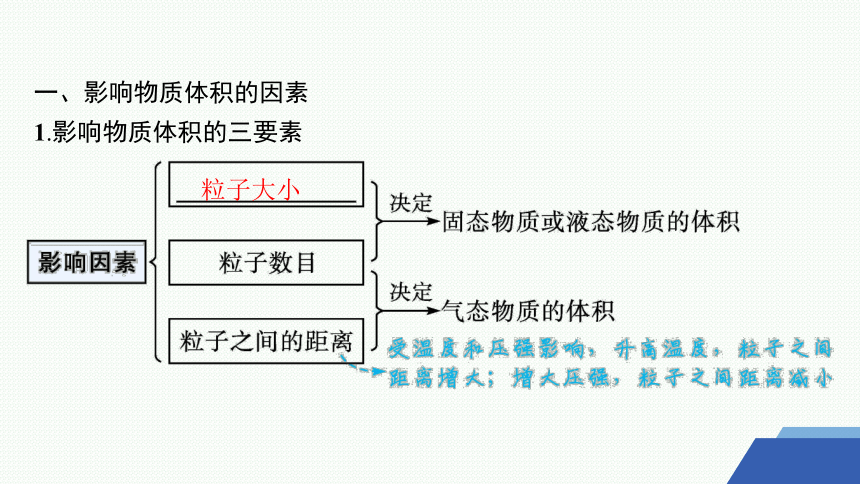
一、影响物质体积的因素
1.影响物质体积的三要素
粒子大小
2.具体分析
(1)1 mol任何物质中的粒子数目都是相同的,均约为 ,因此,在粒子数目相同时,物质体积的大小取决于构成物质的粒子的 和粒子之间的 。
(2)对于气体来说,粒子之间的距离远远大于粒子本身的直径。当粒子数相同时,气体的体积主要取决于气体 。
(3)在相同的温度和压强下,任何气体粒子之间的距离可以看成是
的,因此,粒子数相同的任何气体都具有相同的 。
6.02×1023
大小
距离
粒子之间的距离
相等
体积
二、气体摩尔体积
1.气体摩尔体积
物质的量
标准状况
22.4
温度
压强
2.阿伏加德罗定律
在相同的 和 下,相同体积的任何气体都含有相同数目的粒子,这就是阿伏加德罗定律。
这里“粒子”是指构成气体的分子,不代表原子
温度
压强
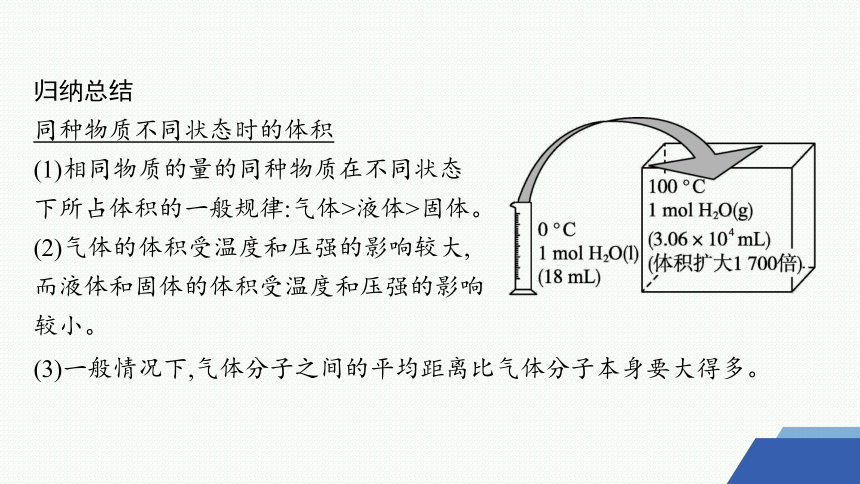
归纳总结
同种物质不同状态时的体积
(1)相同物质的量的同种物质在不同状态下所占体积的一般规律:气体>液体>固体。
(2)气体的体积受温度和压强的影响较大,而液体和固体的体积受温度和压强的影响较小。
(3)一般情况下,气体分子之间的平均距离比气体分子本身要大得多。
归纳总结
气体摩尔体积及应用
(1)气体摩尔体积的研究对象是气体。
(2)气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体(不反应),与气体的种类无关。
(3)标准状况下,任何气体的气体摩尔体积都约为22.4 L·mol-1,但非标准状况下的气体摩尔体积也可能是22.4 L·mol-1。
深度思考
2 mol H2的体积一定大于1 mol H2的体积,该观点是否正确 为什么
提示 不正确;H2的体积受温度和压强影响,同温同压下2 mol H2的体积一定大于1 mol H2的体积,不同温度和压强下则不一定。
重难探究·能力素养全提升
探究一 气体摩尔体积及相关计算
情境探究
在相同的温度和压强下,1 mol任何气体含有的分子数都相同,分子之间的平均距离也近似相等,其体积基本相同。实验测得1 mol三种气体处于不同温度和压强下的体积如下表:
化学式 体积
0 ℃,101 kPa 20 ℃,101 kPa 0 ℃,202 kPa
H2 22.4 L 24.0 L 11.2 L
O2 22.4 L 24.0 L 11.2 L
CO2 22.3 L 23.9 L 11.2 L
(1)分析表中数据,判断温度、压强对气体摩尔体积(Vm)的影响。
(2)结合表中信息分析,某温度和压强下,11.2 L CO2气体所含分子数是否一定为0.5NA 为什么
提示 升高温度,气体摩尔体积增大;增大压强,气体摩尔体积减小。
提示 不一定;若CO2处于0 ℃、202 kPa下,11.2 L CO2为1.0 mol,所含分子数为NA。
方法突破
1.标准状况下对气体摩尔体积的理解
2.气体摩尔体积
的相关计算
应用体验
1.[2023山东烟台高一期中]已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
( )
A
2.某O2和N2的混合气体m g含有b个分子,则n g该混合气体在标准状况下的体积是(NA表示阿伏加德罗常数的值)( )
A
探究二 阿伏加德罗定律及推理
情境探究
某校元旦联欢会上,小倩同学表演的节目是猜气球,她在实验室中预先将等质量的H2、CH4、CO2和O2分别充入四个气球中(如图所示),在晚会现场小倩让大家结合所学化学知识推测四个气球中分别充入何种气体。
(1)假如你在晚会现场,你能推测出四个气球中分别充入何种气体吗
甲 (填化学式,下同);乙 ;丙 ;丁 。
(2)请你向其他同学解释你的推测依据:
。
提示 H2 CH4 O2 CO2
提示 同温同压下,气体的体积与其物质的量成正比。由于摩尔质量: CO2>O2>CH4>H2,则等质量时,四种气体的物质的量:H2>CH4>O2>CO2,而气体的物质的量越大,气球的体积越大,从而推知甲、乙、丙、丁中分别充入H2、CH4、O2、CO2。
方法突破
1.阿伏加德罗定律及理解
2.阿伏加德罗定律的三条重要推论
应用体验
1.下面关于同温同压下的一氧化碳和氮气的判断不正确的是( )
A.体积相等时密度不相等
B.体积相等时分子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的原子数相等
A
解析 设NA为阿伏加德罗常数的值。同温同压下,气体的密度之比等于其摩尔质量之比,一氧化碳和氮气的摩尔质量相等,则密度相等,A错误;根据阿伏加德罗定律,同温、同压、同体积的气体,分子数一定相等,B正确;根据阿伏加德罗定律,同温、同压、同体积的气体,分子数一定相等,CO的电子数为14,N2的电子数为14,故电子数相等,C正确;设质量都是1 g,物质的量都是 mol,具有的原子数都是 mol×2×NA mol-1= ,故质量相等时具有的原子数相等,D正确。
2.[2023山东德州高一期中]下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积CH4和CO2的质量之比为11∶4
A
学以致用·随堂检测全达标
1
2
3
4
5
1.在标准状况下,22.4 L N2的物质的量是( )
A.0.25 mol B.0.50 mol
C.1.0 mol D.1.5 mol
C
1
2
3
4
5
2.[2023湖南邵阳高一期中]设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol任何气体的摩尔体积都约是22.4 L
B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数
C.标准状况下,0.1NA个水分子所占的体积约为2.24 L
D.标准状况时,2 mol任何物质的体积均约为44.8 L
B
1
2
3
4
5
解析 标准状况1 mol任何气体都约是22.4 L,温度、压强不同,体积不同,A错误;标准状况时,体积均为22.4 L的O2与CO2,气体物质的量都是1 mol,故含有相同的分子数NA,B正确;水在标准状况下是非气体,0.1 mol水体积不是22.4 L,C错误;标准状况下1 mol任何气体的体积为22.4 L,固体和液体不符合,D错误。
1
2
3
4
5
3.甲烷与氧气的质量比为1∶4时爆炸威力最强,此时甲烷与氧气的体积比为( )
A.1∶2 B.1∶1
C.2∶1 D.1∶4
A
解析 甲烷与氧气的质量比为1∶4,则二者的物质的量之比为 =1∶2。根据阿伏加德罗定律可知,相同温度和压强下,甲烷与氧气的体积之比等于其物质的量之比,故此时甲烷与氧气的体积比为1∶2。
1
2
3
4
5
4.[2023广东广雅中学高一期中]在通常条件下,分别向三个气球(同一规格,忽略气球自身的质量)吹进两种按体积比1∶1混合的气体,吹出体积相等的①②③三个气球。下列判断不正确的是( )
A.三个气球中所含气体的分子数相等
B.三个气球中所含气体的原子数不相等
C.三个气球中气体分子间的平均距离相等
D.三个气球放在空气中,只有一个往下沉
D
解析 相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子, A正确;三个气球中有单原子分子、双原子分子和多原子分子,分子数相同,但原子数不相等,B正确;相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的,C正确;三个等体积的气球含有的是两种按体积比1∶1混
合的气体, ,②和③的平均摩尔质量分别是30 g·mol-1和36.5 g·mol-1,都大于空气的29 g·mol-1,故三个气球放在空气中,有两个往下沉,D错误。
1
2
3
4
5
1
2
3
4
5
5.CH4和H2是两种重要的气体燃料。
(1)标准状况下,5.6 L 的CH4的质量为 。
(2)4 g H2在标准状况下的体积为 ,所含的氢原子数约为 。
(3)相同质量的CH4和H2,所含的原子数之比为 。
(4)含6.02×1023个电子的CH4在标准状况下的体积为 。
(5)0.5 mol H2完全燃烧生成的水的质量为 。
答案 (1)4 g (2)44.8 L 2.408×1024 (3)5∶16 (4)2.24 L (5)9 g
1
2
3
4
5
1
2
3
4
5
(5)氢气燃烧的化学方程式为2H2+O2 2H2O,则0.5 mol H2完全燃烧生成的水的物质的量为0.5 mol,根据m=nM可知,其质量为0.5 mol×18 g·mol-1=9 g。
本 课 结 束
第二章
第三节 第2课时 气体摩尔体积
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.了解气体摩尔体积的含义,体会从物质的量层次定量研究化学问题的意义,发展宏观辨识与微观探析的学科核心素养。
2.能够利用物质的量、气体摩尔体积、在标准状况下气体的体积三者之间的关系,进行简单的计算,发展宏观辨识与微观探析的学科核心素养。
基础落实·必备知识全过关
一、影响物质体积的因素
1.影响物质体积的三要素
粒子大小
2.具体分析
(1)1 mol任何物质中的粒子数目都是相同的,均约为 ,因此,在粒子数目相同时,物质体积的大小取决于构成物质的粒子的 和粒子之间的 。
(2)对于气体来说,粒子之间的距离远远大于粒子本身的直径。当粒子数相同时,气体的体积主要取决于气体 。
(3)在相同的温度和压强下,任何气体粒子之间的距离可以看成是
的,因此,粒子数相同的任何气体都具有相同的 。
6.02×1023
大小
距离
粒子之间的距离
相等
体积
二、气体摩尔体积
1.气体摩尔体积
物质的量
标准状况
22.4
温度
压强
2.阿伏加德罗定律
在相同的 和 下,相同体积的任何气体都含有相同数目的粒子,这就是阿伏加德罗定律。
这里“粒子”是指构成气体的分子,不代表原子
温度
压强
归纳总结
同种物质不同状态时的体积
(1)相同物质的量的同种物质在不同状态下所占体积的一般规律:气体>液体>固体。
(2)气体的体积受温度和压强的影响较大,而液体和固体的体积受温度和压强的影响较小。
(3)一般情况下,气体分子之间的平均距离比气体分子本身要大得多。
归纳总结
气体摩尔体积及应用
(1)气体摩尔体积的研究对象是气体。
(2)气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体(不反应),与气体的种类无关。
(3)标准状况下,任何气体的气体摩尔体积都约为22.4 L·mol-1,但非标准状况下的气体摩尔体积也可能是22.4 L·mol-1。
深度思考
2 mol H2的体积一定大于1 mol H2的体积,该观点是否正确 为什么
提示 不正确;H2的体积受温度和压强影响,同温同压下2 mol H2的体积一定大于1 mol H2的体积,不同温度和压强下则不一定。
重难探究·能力素养全提升
探究一 气体摩尔体积及相关计算
情境探究
在相同的温度和压强下,1 mol任何气体含有的分子数都相同,分子之间的平均距离也近似相等,其体积基本相同。实验测得1 mol三种气体处于不同温度和压强下的体积如下表:
化学式 体积
0 ℃,101 kPa 20 ℃,101 kPa 0 ℃,202 kPa
H2 22.4 L 24.0 L 11.2 L
O2 22.4 L 24.0 L 11.2 L
CO2 22.3 L 23.9 L 11.2 L
(1)分析表中数据,判断温度、压强对气体摩尔体积(Vm)的影响。
(2)结合表中信息分析,某温度和压强下,11.2 L CO2气体所含分子数是否一定为0.5NA 为什么
提示 升高温度,气体摩尔体积增大;增大压强,气体摩尔体积减小。
提示 不一定;若CO2处于0 ℃、202 kPa下,11.2 L CO2为1.0 mol,所含分子数为NA。
方法突破
1.标准状况下对气体摩尔体积的理解
2.气体摩尔体积
的相关计算
应用体验
1.[2023山东烟台高一期中]已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
( )
A
2.某O2和N2的混合气体m g含有b个分子,则n g该混合气体在标准状况下的体积是(NA表示阿伏加德罗常数的值)( )
A
探究二 阿伏加德罗定律及推理
情境探究
某校元旦联欢会上,小倩同学表演的节目是猜气球,她在实验室中预先将等质量的H2、CH4、CO2和O2分别充入四个气球中(如图所示),在晚会现场小倩让大家结合所学化学知识推测四个气球中分别充入何种气体。
(1)假如你在晚会现场,你能推测出四个气球中分别充入何种气体吗
甲 (填化学式,下同);乙 ;丙 ;丁 。
(2)请你向其他同学解释你的推测依据:
。
提示 H2 CH4 O2 CO2
提示 同温同压下,气体的体积与其物质的量成正比。由于摩尔质量: CO2>O2>CH4>H2,则等质量时,四种气体的物质的量:H2>CH4>O2>CO2,而气体的物质的量越大,气球的体积越大,从而推知甲、乙、丙、丁中分别充入H2、CH4、O2、CO2。
方法突破
1.阿伏加德罗定律及理解
2.阿伏加德罗定律的三条重要推论
应用体验
1.下面关于同温同压下的一氧化碳和氮气的判断不正确的是( )
A.体积相等时密度不相等
B.体积相等时分子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的原子数相等
A
解析 设NA为阿伏加德罗常数的值。同温同压下,气体的密度之比等于其摩尔质量之比,一氧化碳和氮气的摩尔质量相等,则密度相等,A错误;根据阿伏加德罗定律,同温、同压、同体积的气体,分子数一定相等,B正确;根据阿伏加德罗定律,同温、同压、同体积的气体,分子数一定相等,CO的电子数为14,N2的电子数为14,故电子数相等,C正确;设质量都是1 g,物质的量都是 mol,具有的原子数都是 mol×2×NA mol-1= ,故质量相等时具有的原子数相等,D正确。
2.[2023山东德州高一期中]下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积CH4和CO2的质量之比为11∶4
A
学以致用·随堂检测全达标
1
2
3
4
5
1.在标准状况下,22.4 L N2的物质的量是( )
A.0.25 mol B.0.50 mol
C.1.0 mol D.1.5 mol
C
1
2
3
4
5
2.[2023湖南邵阳高一期中]设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol任何气体的摩尔体积都约是22.4 L
B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数
C.标准状况下,0.1NA个水分子所占的体积约为2.24 L
D.标准状况时,2 mol任何物质的体积均约为44.8 L
B
1
2
3
4
5
解析 标准状况1 mol任何气体都约是22.4 L,温度、压强不同,体积不同,A错误;标准状况时,体积均为22.4 L的O2与CO2,气体物质的量都是1 mol,故含有相同的分子数NA,B正确;水在标准状况下是非气体,0.1 mol水体积不是22.4 L,C错误;标准状况下1 mol任何气体的体积为22.4 L,固体和液体不符合,D错误。
1
2
3
4
5
3.甲烷与氧气的质量比为1∶4时爆炸威力最强,此时甲烷与氧气的体积比为( )
A.1∶2 B.1∶1
C.2∶1 D.1∶4
A
解析 甲烷与氧气的质量比为1∶4,则二者的物质的量之比为 =1∶2。根据阿伏加德罗定律可知,相同温度和压强下,甲烷与氧气的体积之比等于其物质的量之比,故此时甲烷与氧气的体积比为1∶2。
1
2
3
4
5
4.[2023广东广雅中学高一期中]在通常条件下,分别向三个气球(同一规格,忽略气球自身的质量)吹进两种按体积比1∶1混合的气体,吹出体积相等的①②③三个气球。下列判断不正确的是( )
A.三个气球中所含气体的分子数相等
B.三个气球中所含气体的原子数不相等
C.三个气球中气体分子间的平均距离相等
D.三个气球放在空气中,只有一个往下沉
D
解析 相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子, A正确;三个气球中有单原子分子、双原子分子和多原子分子,分子数相同,但原子数不相等,B正确;相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的,C正确;三个等体积的气球含有的是两种按体积比1∶1混
合的气体, ,②和③的平均摩尔质量分别是30 g·mol-1和36.5 g·mol-1,都大于空气的29 g·mol-1,故三个气球放在空气中,有两个往下沉,D错误。
1
2
3
4
5
1
2
3
4
5
5.CH4和H2是两种重要的气体燃料。
(1)标准状况下,5.6 L 的CH4的质量为 。
(2)4 g H2在标准状况下的体积为 ,所含的氢原子数约为 。
(3)相同质量的CH4和H2,所含的原子数之比为 。
(4)含6.02×1023个电子的CH4在标准状况下的体积为 。
(5)0.5 mol H2完全燃烧生成的水的质量为 。
答案 (1)4 g (2)44.8 L 2.408×1024 (3)5∶16 (4)2.24 L (5)9 g
1
2
3
4
5
1
2
3
4
5
(5)氢气燃烧的化学方程式为2H2+O2 2H2O,则0.5 mol H2完全燃烧生成的水的物质的量为0.5 mol,根据m=nM可知,其质量为0.5 mol×18 g·mol-1=9 g。
本 课 结 束
