2.3.3 物质的量浓度 课件(共50张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 2.3.3 物质的量浓度 课件(共50张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:37:21 | ||
图片预览









文档简介
(共50张PPT)
第二章
第三节 第3课时 物质的量浓度
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.了解物质的量浓度的含义,基于物质的量认识物质的组成和变化,体会从物质的量层次定量研究化学问题的意义,发展宏观辨识与微观探析的学科核心素养。
2.初步学会配制一定物质的量浓度溶液的方法和技能,通过对实验细节的分析,发展定量研究的意识,发展科学探究与创新意识的学科核心素养。
基础落实·必备知识全过关
一、物质的量浓度
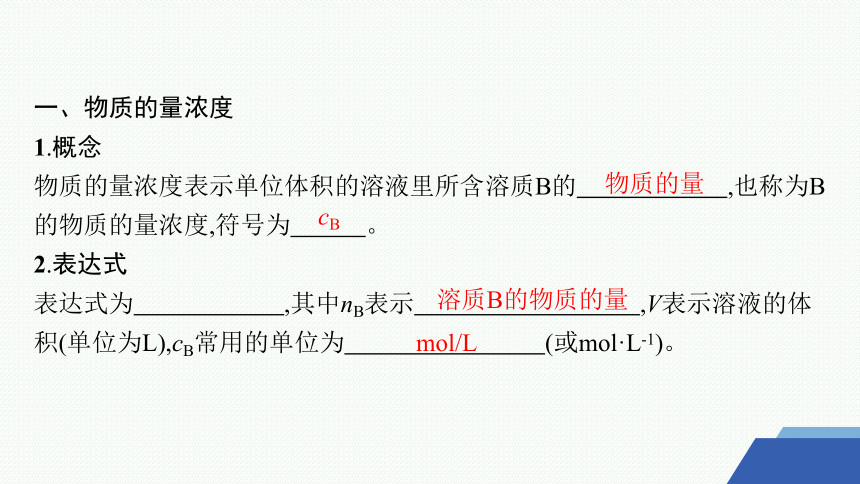
1.概念
物质的量浓度表示单位体积的溶液里所含溶质B的 ,也称为B的物质的量浓度,符号为 。
2.表达式
表达式为 ,其中nB表示 ,V表示溶液的体积(单位为L),cB常用的单位为 (或mol·L-1)。
物质的量
cB
溶质B的物质的量
mol/L
微点归纳 (1)上述表达式中,溶质B表示溶液中的任意溶质,可以是分子,也可以是离子或其他特定组合;V是溶液的体积,而不是溶剂的体积。
(2)溶质B用物质的量表示,而不是质量,若给出溶质的质量或气体溶质在标准状况下的体积时,要借助 换算成物质的量。
3.溶质的物质的量浓度与溶质的质量分数的区别
类型 溶质的物质的量浓度 溶质的质量分数
表示溶质 的物理量 (mol) (g、kg等)
计算公式
单位 mol·L-1 1(是质量比)
物质的量
质量
类型 溶质的物质的量浓度 溶质的质量分数
特点 相同物质的量浓度、相同体积的不同溶液,所含溶质的物质的量 ,但溶质的质量可能不同 相同质量分数、相同质量的不同溶液,所含溶质的质量 ,但溶质的物质的量可能不同
二者的 换算关系
相同
相同
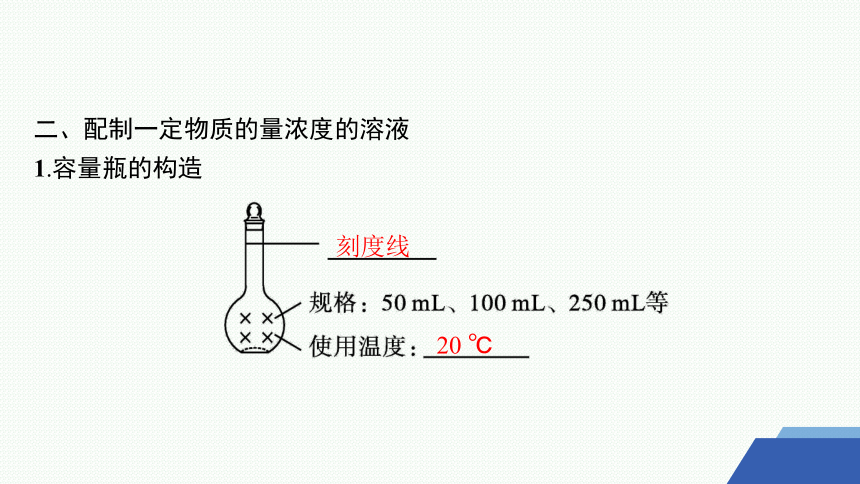
二、配制一定物质的量浓度的溶液
1.容量瓶的构造
刻度线
20 ℃
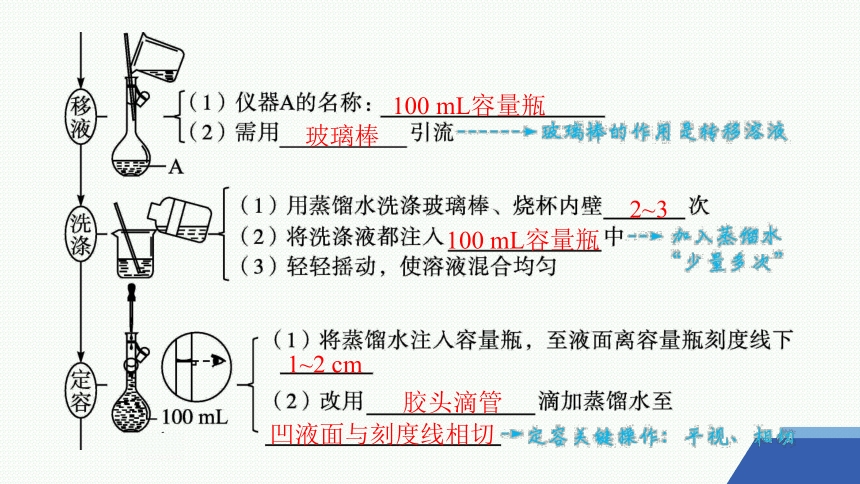
2.配制一定物质的量浓度的溶液
(以配制100 mL 1.00 mol·L-1NaCl溶液为例)[实验2-10]
5.85 g
5.9 g
烧杯
玻璃棒
100 mL容量瓶
玻璃棒
2~3
100 mL容量瓶
1~2 cm
胶头滴管
凹液面与刻度线相切
3.稀释定律
在用浓溶液配制稀溶液时,溶液的体积发生了变化,但溶液中溶质的
不变,即在溶液稀释前后,溶液中溶质的 相等,常用下面的式子计算有关的量:
c(浓溶液)·V(浓溶液)= 。
物质的量
物质的量
c(稀溶液)·V(稀溶液)
(2)容量瓶使用的四个“不能”
归纳总结
正确判断溶液中的溶质
(1)含有结晶水的物质溶于水,溶质是不含结晶水的化合物。例如, CuSO4·5H2O溶于水形成CuSO4溶液,溶质是CuSO4。
(2)某些物质溶于水,与水发生化学反应,则溶质为反应后的生成物。例如,
(3)NH3溶于水所得氨水的成分复杂,一般仍以NH3为溶质计算其物质的量浓度。
归纳总结
理解物质的量浓度的两个要点
(1)一定物质的量浓度的溶液中取出任意体积的溶液,其物质的量浓度不变,但所含溶质的物质的量随所取溶液的体积变化而改变。
(2) 中,V是指溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。
(3)溶质溶于一定体积的溶液时,溶液的体积要发生变化,不等于原溶剂的体积。
教材拓展
容量瓶的使用
(1)容量瓶使用的四个“操作”
归纳总结
(1)托盘天平的精确度是0.1 g,记录数据只能保留小数点后一位。
(2)选择容量瓶依据“大而近”的原则:若没有所配溶液体积相匹配的容量瓶,要选用容积稍大且最接近的容量瓶。
(3)配制过程中若出现操作失误,导致所配溶液浓度不准确,需要重新配制溶液。
深度思考
将标准状况下11.2 L HCl气体溶于1 L水中,所得溶液的物质的量浓度为
0.5 mol·L-1,该结论是否合理 为什么
提示 不合理;HCl气体溶于水得到盐酸,其体积不等于原溶剂1 L水的体积。
重难探究·能力素养全提升
探究一 物质的量浓度及相关计算
情境探究
研究表明,“84”消毒液能有效杀灭病毒,因此被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某品牌“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释至体积为原来的100倍(体积之比)后使用。
“84”消毒液
【有效成分】NaClO
【规格】1 000 mL
【质量分数】25%
【密度】1.19 g·cm-3
(1)该“84”消毒液中c(NaClO)约为 mol·L-1。
(2)若取10 mL该“84”消毒液,稀释后用于消毒,稀释后溶液中c(Na+)= mol·L-1。
(3)欲用NaClO固体配制250 mL含NaClO质量分数为25%的消毒液,称取NaClO固体的质量为 。
4.0
0.04
74.4 g
(3)称取NaClO固体的质量为250 mL×1.19 g·cm-3×25%≈74.4 g。
方法突破 有关物质的量浓度的计算类型及方法
应用体验
1.现有硫酸钠溶液V mL,密度是ρ g·mL-1,其中钠离子的质量分数是2a%,则有关该溶液的说法不正确的是( )
C
2.[2023山东青岛高一期中]若将m g NaOH固体溶于水恰好配成200 mL饱和溶液,其密度为ρ g·cm-3,则下列说法正确的是( )
C
解析 m g NaOH固体溶于水配成200 mL饱和溶液,其密度为ρ g·cm-3,则溶液的质量为m(溶液)=200 mL×ρ g·cm-3=200ρ g,故NaOH的质量分数为
探究二 一定物质的量浓度溶液的配制及误差分析
情境探究
某植物营养液的主要成分及含量如表:
成分 含量/(mg·L-1)
硫酸钾 250
磷酸二氢铵(NH4H2PO4)M=115 g·mol-1 345
硫酸镁 537
某同学利用三种盐固体配制500 mL该营养液,实验步骤如下:
①利用分析天平(灵敏度为0.000 1)分别称取0.125 0 g K2SO4、0.172 5 g NH4H2PO4和0.268 5 g MgSO4。
②将称量的固体转移到烧杯中并加适量蒸馏水溶解,恢复到室温后,转移到500 mL容量瓶中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液倒入指定废液回收容器中。
④加水定容,液面超过了刻度线,又用胶头滴管吸出少量液体,至凹液面最低处与刻度线相切。
⑤加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线。
⑥将配好的溶液分装到试剂瓶,贴标签。
(1)上述操作步骤中存在明显错误的是 (填序号,下同),引起所配营养液的浓度偏低的是 。
(2)步骤④定容时液面超过了刻度线,应如何处理
。
③④⑤
③④⑤
重新配制
方法突破
1.配制一定物质的量浓度溶液的操作流程图示
2.一定物质的量浓度溶液的配制误差分析
(1)分析依据及读数误差
(2)应用示例(以配制一定物质的量浓度的NaOH溶液为例)
类型 可能引起误差的一些操作 过程分析 对c(NaOH)
的影响
m V
称量 误差 分析 称量时间过长 减小 不变 偏低
用滤纸称NaOH固体 减小 不变 偏低
物质、砝码位置放反(使用了游码) 减小 不变 偏低
类型 可能引起误差的一些操作 过程分析 对c(NaOH)
的影响
m V
配制 过程 误差 分析 移液前容量瓶内有少量水 不变 不变 无影响
转移液体时有少量洒落 减小 不变 偏低
未洗涤烧杯和玻璃棒 减小 不变 偏低
未冷却到室温就移液定容 不变 减小 偏高
定容时水加多后用滴管吸出 减小 不变 偏低
定容摇匀后液面下降再加水 不变 增大 偏低
应用体验
1.[2023湖北襄阳高一期中]配制一定物质的量浓度的Na2CO3溶液的操作过程如图所示,下列说法中错误的是( )
A.“操作1”中烧杯洗涤液也要转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.所配制的Na2CO3溶液中c(Na+)为2 mol·L-1
D.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D
解析 溶解得到的溶液及洗涤烧杯和玻璃棒2~3次的洗涤液均需转移到容量瓶中,A正确;“操作2”中用玻璃棒是引导液体的流向,防止外流,起着引流的作用,B正确;由图可知,所配溶液的体积为100 mL,10.6 g碳酸钠的物质的
量为 =0.1 mol,所配碳酸钠溶液的浓度为 =1 mol·L-1,
c(Na+)=2c(Na2CO3)=2 mol·L-1,C正确;定容时若俯视刻度线,水的量不足,溶液体积减小,造成所配溶液浓度偏大,D错误。
2.配制0.100 0 mol·L-1 H2SO4溶液250 mL,下列有关说法错误的是( )
A.在配制过程中玻璃棒的作用是搅拌和引流
B.用到的仪器有250 mL容量瓶、托盘天平、量筒、烧杯、玻璃棒和胶头滴管
C.浓硫酸稀释后,立即转移到容量瓶进行后续操作,所配溶液浓度偏高
D.定容时,液面位于容量瓶刻度线下1~2 cm时,应改用胶头滴管滴加水
B
解析 在配制过程中溶解时玻璃棒的作用是搅拌,转移时玻璃棒的作用是引流,A正确;配制硫酸是浓溶液配稀溶液,因此不使用托盘天平,B错误;浓硫酸稀释后,立即转移到容量瓶进行后续操作,冷却后,溶液体积偏小,则所配溶液浓度偏高,C正确;定容时,液面位于容量瓶刻度线下1~2 cm时,应改用胶头滴管滴加水,滴加至溶液凹液面与刻度线相切为止,D正确。
学以致用·随堂检测全达标
1
2
3
4
5
1.欲配制浓度为1.00 mol·L-1的碳酸钾溶液100 mL,用不到的仪器是( )
A.容量瓶 B.分液漏斗
C.玻璃棒 D.烧杯
B
解析 结合溶液配制步骤可知,实验中需要容量瓶、玻璃棒和烧杯,不需要分液漏斗。
1
2
3
4
5
2.下列关于配制100 mL 1.00 mol·L-1 NaCl溶液过程的叙述正确的是( )
A.选择规格为50 mL的容量瓶
B.在容量瓶中溶解NaCl固体
C.加水时超过了刻度线,用胶头滴管吸出多余液体
D.容量瓶使用完毕后,洗净、晾干,在瓶塞与瓶口处垫一张纸条
D
解析 要选用规格为100 mL的容量瓶配制溶液,A错误;NaCl固体在烧杯中溶解,再转移至容量瓶中,不能直接在容量瓶中溶解固体,B错误;加水时超过了刻度线,用胶头滴管吸出多余液体,损失溶质,所配溶液的浓度偏低,C错误。
1
2
3
4
5
3.[2023江苏苏州高一调研]下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和 的总物质的量为0.9 mol
B.50 mL 1 mol·L-1的KCl溶液和100 mL 0.25 mol·L-1MgCl2溶液中,Cl-物质的量浓度相等
C.将10 mL 1 mol·L-1的H2SO4加水稀释至100 mL,溶液的物质的量浓度变为0.1 mol·L-1
D.20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液中加入5 g生石灰,恢复至 20 ℃,溶液的物质的量浓度将变大
C
1
2
3
4
5
解析 只有溶液浓度,缺少溶液体积,不能计算微粒的物质的量,A错误。50 mL 1 mol·L-1的KCl溶液中Cl-的浓度c(Cl-)=1 mol·L-1;100 mL 0.25 mol·L-1 MgCl2溶液中,Cl-物质的量浓度c(Cl-)=0.25 mol·L-1×2=0.5 mol·L-1,两种溶液中Cl-物质的量浓度不相等,B错误。溶液在稀释前后溶质的物质的量不变,则根据稀释公式,可得稀释后溶液的物质的量浓度为 ,C正确。在同一温度下,同一物质的溶解度不变,则其形成的饱和溶液浓度不变,则20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液中加入5 g生石灰,再恢复至20 ℃,溶液的物质的量浓度将不变,D错误。
1
2
3
4
5
4.配制100 mL 1.00 mol·L-1的NaCl溶液,下列说法不正确的是( )
A.上述实验操作步骤的正确顺序为④②①③
B.用容量瓶配制溶液时,若加水超过刻度线,则需要重新配制
C.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
D.容量瓶需要用蒸馏水洗涤、干燥后才可用
D
解析 配制溶液的先后步骤:称量、溶解、转移、定容,故正确顺序为④②①③,A正确;用容量瓶配制溶液时,若加水超过刻度线,导致溶液浓度偏小,只能重新配制,B正确;定容时,仰视容量瓶的刻度线,定容结束后液面高于刻度线,使配得的NaCl溶液浓度偏低,C正确;容量瓶用蒸馏水洗涤后,不需要干燥可直接使用,D错误。
1
2
3
4
5
1
2
3
4
5
5.实验室配制500 mL 0.2 mol·L-1的NaCl溶液。
(1)请根据溶液的配制过程完成下列填空:
①计算:所需NaCl固体质量为 g。
②称量:用电子天平准确称量NaCl固体的质量。
③溶解:将NaCl固体放入小烧杯中,加适量蒸馏水溶解,为了加快NaCl溶解,可采取的措施有 。
④转移:用玻璃棒小心地将溶液引流到500 mL容量瓶中,用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将每次洗涤的溶液都注入容量瓶中,轻轻振荡容量瓶,使溶液混合均匀。
⑤定容:缓缓地将蒸馏水注入容量瓶中,直到 ,改用 滴加蒸馏水至溶液的凹液面正好与刻度线相切,再将容量瓶塞盖好,反复上下颠倒,摇匀。
1
2
3
4
5
(2)若实验时遇到下列情况,对所配制NaCl溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未用蒸馏水洗涤烧杯和玻璃棒: 。
②定容时俯视刻度线: 。
③配制溶液前容量瓶中有少量蒸馏水: 。
答案 (1)①5.85 ③用玻璃棒搅拌加速溶解 ⑤容量瓶中的液面距离容量瓶的刻度线1~2 cm 胶头滴管
(2)①偏低 ②偏高 ③无影响
本 课 结 束
第二章
第三节 第3课时 物质的量浓度
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.了解物质的量浓度的含义,基于物质的量认识物质的组成和变化,体会从物质的量层次定量研究化学问题的意义,发展宏观辨识与微观探析的学科核心素养。
2.初步学会配制一定物质的量浓度溶液的方法和技能,通过对实验细节的分析,发展定量研究的意识,发展科学探究与创新意识的学科核心素养。
基础落实·必备知识全过关
一、物质的量浓度
1.概念
物质的量浓度表示单位体积的溶液里所含溶质B的 ,也称为B的物质的量浓度,符号为 。
2.表达式
表达式为 ,其中nB表示 ,V表示溶液的体积(单位为L),cB常用的单位为 (或mol·L-1)。
物质的量
cB
溶质B的物质的量
mol/L
微点归纳 (1)上述表达式中,溶质B表示溶液中的任意溶质,可以是分子,也可以是离子或其他特定组合;V是溶液的体积,而不是溶剂的体积。
(2)溶质B用物质的量表示,而不是质量,若给出溶质的质量或气体溶质在标准状况下的体积时,要借助 换算成物质的量。
3.溶质的物质的量浓度与溶质的质量分数的区别
类型 溶质的物质的量浓度 溶质的质量分数
表示溶质 的物理量 (mol) (g、kg等)
计算公式
单位 mol·L-1 1(是质量比)
物质的量
质量
类型 溶质的物质的量浓度 溶质的质量分数
特点 相同物质的量浓度、相同体积的不同溶液,所含溶质的物质的量 ,但溶质的质量可能不同 相同质量分数、相同质量的不同溶液,所含溶质的质量 ,但溶质的物质的量可能不同
二者的 换算关系
相同
相同
二、配制一定物质的量浓度的溶液
1.容量瓶的构造
刻度线
20 ℃
2.配制一定物质的量浓度的溶液
(以配制100 mL 1.00 mol·L-1NaCl溶液为例)[实验2-10]
5.85 g
5.9 g
烧杯
玻璃棒
100 mL容量瓶
玻璃棒
2~3
100 mL容量瓶
1~2 cm
胶头滴管
凹液面与刻度线相切
3.稀释定律
在用浓溶液配制稀溶液时,溶液的体积发生了变化,但溶液中溶质的
不变,即在溶液稀释前后,溶液中溶质的 相等,常用下面的式子计算有关的量:
c(浓溶液)·V(浓溶液)= 。
物质的量
物质的量
c(稀溶液)·V(稀溶液)
(2)容量瓶使用的四个“不能”
归纳总结
正确判断溶液中的溶质
(1)含有结晶水的物质溶于水,溶质是不含结晶水的化合物。例如, CuSO4·5H2O溶于水形成CuSO4溶液,溶质是CuSO4。
(2)某些物质溶于水,与水发生化学反应,则溶质为反应后的生成物。例如,
(3)NH3溶于水所得氨水的成分复杂,一般仍以NH3为溶质计算其物质的量浓度。
归纳总结
理解物质的量浓度的两个要点
(1)一定物质的量浓度的溶液中取出任意体积的溶液,其物质的量浓度不变,但所含溶质的物质的量随所取溶液的体积变化而改变。
(2) 中,V是指溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。
(3)溶质溶于一定体积的溶液时,溶液的体积要发生变化,不等于原溶剂的体积。
教材拓展
容量瓶的使用
(1)容量瓶使用的四个“操作”
归纳总结
(1)托盘天平的精确度是0.1 g,记录数据只能保留小数点后一位。
(2)选择容量瓶依据“大而近”的原则:若没有所配溶液体积相匹配的容量瓶,要选用容积稍大且最接近的容量瓶。
(3)配制过程中若出现操作失误,导致所配溶液浓度不准确,需要重新配制溶液。
深度思考
将标准状况下11.2 L HCl气体溶于1 L水中,所得溶液的物质的量浓度为
0.5 mol·L-1,该结论是否合理 为什么
提示 不合理;HCl气体溶于水得到盐酸,其体积不等于原溶剂1 L水的体积。
重难探究·能力素养全提升
探究一 物质的量浓度及相关计算
情境探究
研究表明,“84”消毒液能有效杀灭病毒,因此被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某品牌“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释至体积为原来的100倍(体积之比)后使用。
“84”消毒液
【有效成分】NaClO
【规格】1 000 mL
【质量分数】25%
【密度】1.19 g·cm-3
(1)该“84”消毒液中c(NaClO)约为 mol·L-1。
(2)若取10 mL该“84”消毒液,稀释后用于消毒,稀释后溶液中c(Na+)= mol·L-1。
(3)欲用NaClO固体配制250 mL含NaClO质量分数为25%的消毒液,称取NaClO固体的质量为 。
4.0
0.04
74.4 g
(3)称取NaClO固体的质量为250 mL×1.19 g·cm-3×25%≈74.4 g。
方法突破 有关物质的量浓度的计算类型及方法
应用体验
1.现有硫酸钠溶液V mL,密度是ρ g·mL-1,其中钠离子的质量分数是2a%,则有关该溶液的说法不正确的是( )
C
2.[2023山东青岛高一期中]若将m g NaOH固体溶于水恰好配成200 mL饱和溶液,其密度为ρ g·cm-3,则下列说法正确的是( )
C
解析 m g NaOH固体溶于水配成200 mL饱和溶液,其密度为ρ g·cm-3,则溶液的质量为m(溶液)=200 mL×ρ g·cm-3=200ρ g,故NaOH的质量分数为
探究二 一定物质的量浓度溶液的配制及误差分析
情境探究
某植物营养液的主要成分及含量如表:
成分 含量/(mg·L-1)
硫酸钾 250
磷酸二氢铵(NH4H2PO4)M=115 g·mol-1 345
硫酸镁 537
某同学利用三种盐固体配制500 mL该营养液,实验步骤如下:
①利用分析天平(灵敏度为0.000 1)分别称取0.125 0 g K2SO4、0.172 5 g NH4H2PO4和0.268 5 g MgSO4。
②将称量的固体转移到烧杯中并加适量蒸馏水溶解,恢复到室温后,转移到500 mL容量瓶中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液倒入指定废液回收容器中。
④加水定容,液面超过了刻度线,又用胶头滴管吸出少量液体,至凹液面最低处与刻度线相切。
⑤加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线。
⑥将配好的溶液分装到试剂瓶,贴标签。
(1)上述操作步骤中存在明显错误的是 (填序号,下同),引起所配营养液的浓度偏低的是 。
(2)步骤④定容时液面超过了刻度线,应如何处理
。
③④⑤
③④⑤
重新配制
方法突破
1.配制一定物质的量浓度溶液的操作流程图示
2.一定物质的量浓度溶液的配制误差分析
(1)分析依据及读数误差
(2)应用示例(以配制一定物质的量浓度的NaOH溶液为例)
类型 可能引起误差的一些操作 过程分析 对c(NaOH)
的影响
m V
称量 误差 分析 称量时间过长 减小 不变 偏低
用滤纸称NaOH固体 减小 不变 偏低
物质、砝码位置放反(使用了游码) 减小 不变 偏低
类型 可能引起误差的一些操作 过程分析 对c(NaOH)
的影响
m V
配制 过程 误差 分析 移液前容量瓶内有少量水 不变 不变 无影响
转移液体时有少量洒落 减小 不变 偏低
未洗涤烧杯和玻璃棒 减小 不变 偏低
未冷却到室温就移液定容 不变 减小 偏高
定容时水加多后用滴管吸出 减小 不变 偏低
定容摇匀后液面下降再加水 不变 增大 偏低
应用体验
1.[2023湖北襄阳高一期中]配制一定物质的量浓度的Na2CO3溶液的操作过程如图所示,下列说法中错误的是( )
A.“操作1”中烧杯洗涤液也要转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.所配制的Na2CO3溶液中c(Na+)为2 mol·L-1
D.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D
解析 溶解得到的溶液及洗涤烧杯和玻璃棒2~3次的洗涤液均需转移到容量瓶中,A正确;“操作2”中用玻璃棒是引导液体的流向,防止外流,起着引流的作用,B正确;由图可知,所配溶液的体积为100 mL,10.6 g碳酸钠的物质的
量为 =0.1 mol,所配碳酸钠溶液的浓度为 =1 mol·L-1,
c(Na+)=2c(Na2CO3)=2 mol·L-1,C正确;定容时若俯视刻度线,水的量不足,溶液体积减小,造成所配溶液浓度偏大,D错误。
2.配制0.100 0 mol·L-1 H2SO4溶液250 mL,下列有关说法错误的是( )
A.在配制过程中玻璃棒的作用是搅拌和引流
B.用到的仪器有250 mL容量瓶、托盘天平、量筒、烧杯、玻璃棒和胶头滴管
C.浓硫酸稀释后,立即转移到容量瓶进行后续操作,所配溶液浓度偏高
D.定容时,液面位于容量瓶刻度线下1~2 cm时,应改用胶头滴管滴加水
B
解析 在配制过程中溶解时玻璃棒的作用是搅拌,转移时玻璃棒的作用是引流,A正确;配制硫酸是浓溶液配稀溶液,因此不使用托盘天平,B错误;浓硫酸稀释后,立即转移到容量瓶进行后续操作,冷却后,溶液体积偏小,则所配溶液浓度偏高,C正确;定容时,液面位于容量瓶刻度线下1~2 cm时,应改用胶头滴管滴加水,滴加至溶液凹液面与刻度线相切为止,D正确。
学以致用·随堂检测全达标
1
2
3
4
5
1.欲配制浓度为1.00 mol·L-1的碳酸钾溶液100 mL,用不到的仪器是( )
A.容量瓶 B.分液漏斗
C.玻璃棒 D.烧杯
B
解析 结合溶液配制步骤可知,实验中需要容量瓶、玻璃棒和烧杯,不需要分液漏斗。
1
2
3
4
5
2.下列关于配制100 mL 1.00 mol·L-1 NaCl溶液过程的叙述正确的是( )
A.选择规格为50 mL的容量瓶
B.在容量瓶中溶解NaCl固体
C.加水时超过了刻度线,用胶头滴管吸出多余液体
D.容量瓶使用完毕后,洗净、晾干,在瓶塞与瓶口处垫一张纸条
D
解析 要选用规格为100 mL的容量瓶配制溶液,A错误;NaCl固体在烧杯中溶解,再转移至容量瓶中,不能直接在容量瓶中溶解固体,B错误;加水时超过了刻度线,用胶头滴管吸出多余液体,损失溶质,所配溶液的浓度偏低,C错误。
1
2
3
4
5
3.[2023江苏苏州高一调研]下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和 的总物质的量为0.9 mol
B.50 mL 1 mol·L-1的KCl溶液和100 mL 0.25 mol·L-1MgCl2溶液中,Cl-物质的量浓度相等
C.将10 mL 1 mol·L-1的H2SO4加水稀释至100 mL,溶液的物质的量浓度变为0.1 mol·L-1
D.20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液中加入5 g生石灰,恢复至 20 ℃,溶液的物质的量浓度将变大
C
1
2
3
4
5
解析 只有溶液浓度,缺少溶液体积,不能计算微粒的物质的量,A错误。50 mL 1 mol·L-1的KCl溶液中Cl-的浓度c(Cl-)=1 mol·L-1;100 mL 0.25 mol·L-1 MgCl2溶液中,Cl-物质的量浓度c(Cl-)=0.25 mol·L-1×2=0.5 mol·L-1,两种溶液中Cl-物质的量浓度不相等,B错误。溶液在稀释前后溶质的物质的量不变,则根据稀释公式,可得稀释后溶液的物质的量浓度为 ,C正确。在同一温度下,同一物质的溶解度不变,则其形成的饱和溶液浓度不变,则20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液中加入5 g生石灰,再恢复至20 ℃,溶液的物质的量浓度将不变,D错误。
1
2
3
4
5
4.配制100 mL 1.00 mol·L-1的NaCl溶液,下列说法不正确的是( )
A.上述实验操作步骤的正确顺序为④②①③
B.用容量瓶配制溶液时,若加水超过刻度线,则需要重新配制
C.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
D.容量瓶需要用蒸馏水洗涤、干燥后才可用
D
解析 配制溶液的先后步骤:称量、溶解、转移、定容,故正确顺序为④②①③,A正确;用容量瓶配制溶液时,若加水超过刻度线,导致溶液浓度偏小,只能重新配制,B正确;定容时,仰视容量瓶的刻度线,定容结束后液面高于刻度线,使配得的NaCl溶液浓度偏低,C正确;容量瓶用蒸馏水洗涤后,不需要干燥可直接使用,D错误。
1
2
3
4
5
1
2
3
4
5
5.实验室配制500 mL 0.2 mol·L-1的NaCl溶液。
(1)请根据溶液的配制过程完成下列填空:
①计算:所需NaCl固体质量为 g。
②称量:用电子天平准确称量NaCl固体的质量。
③溶解:将NaCl固体放入小烧杯中,加适量蒸馏水溶解,为了加快NaCl溶解,可采取的措施有 。
④转移:用玻璃棒小心地将溶液引流到500 mL容量瓶中,用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将每次洗涤的溶液都注入容量瓶中,轻轻振荡容量瓶,使溶液混合均匀。
⑤定容:缓缓地将蒸馏水注入容量瓶中,直到 ,改用 滴加蒸馏水至溶液的凹液面正好与刻度线相切,再将容量瓶塞盖好,反复上下颠倒,摇匀。
1
2
3
4
5
(2)若实验时遇到下列情况,对所配制NaCl溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未用蒸馏水洗涤烧杯和玻璃棒: 。
②定容时俯视刻度线: 。
③配制溶液前容量瓶中有少量蒸馏水: 。
答案 (1)①5.85 ③用玻璃棒搅拌加速溶解 ⑤容量瓶中的液面距离容量瓶的刻度线1~2 cm 胶头滴管
(2)①偏低 ②偏高 ③无影响
本 课 结 束
