3.1.1 铁的单质 铁的氧化物课件(共35张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 3.1.1 铁的单质 铁的氧化物课件(共35张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:37:55 | ||
图片预览








文档简介
(共35张PPT)
第三章
第一节 第1课时 铁的单质 铁的氧化物
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.从氧化还原反应和离子反应的视角,基于实验事实写出铁与水蒸气反应的化学方程式,提升对铁及其化合物知识的认识,发展宏观辨识与微观探析的学科核心素养。
2.了解铁元素在自然界中的存在形态,了解铁元素与人体健康的关系,体会化学对人类生活的重要意义;从我国古代用铁的化学史感受中华民族在科技发展进程中的贡献,增强文化自信,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、铁的单质
1.自然界中铁元素的存在
(1)铁在自然界中可以像陨铁中的铁那样以 形态存在,但主要以
价和 价化合物的形态存在于矿石中。
(2)工业炼铁的原理是用 的方法把铁从铁矿石中提炼出来。炼铁高炉中发生的主要反应有 。
2.铁的物理性质
延展性 导热性 导电性 熔点 沸点 密度 特性
有 有 能导电, 不如 1 535 ℃ 2 750 ℃ 7.86 g·cm-3 能被 吸引
单质
+2
+3
还原
Fe2O3+3CO 2Fe+3CO2
铜和铝
磁铁
3.铁的化学性质
(1)铁与某些非金属单质、酸和盐溶液反应
化学性质 化学方程式
铁与某些非金属单质反应 铁与O2反应: ;
铁与Cl2反应:
铁与酸溶液的反应 铁与稀硫酸反应: ;
铁与稀盐酸反应:
铁与盐溶液的反应 铁与AgNO3溶液反应: ;
铁与CuSO4溶液反应:
3Fe+2O2 Fe3O4
2Fe+3Cl2 2FeCl3
Fe+H2SO4 ══ FeSO4+H2↑
Fe+2HCl ══ FeCl2+H2↑
2AgNO3+Fe ══ Fe(NO3)2+2Ag
Fe+CuSO4 ══ FeSO4+Cu
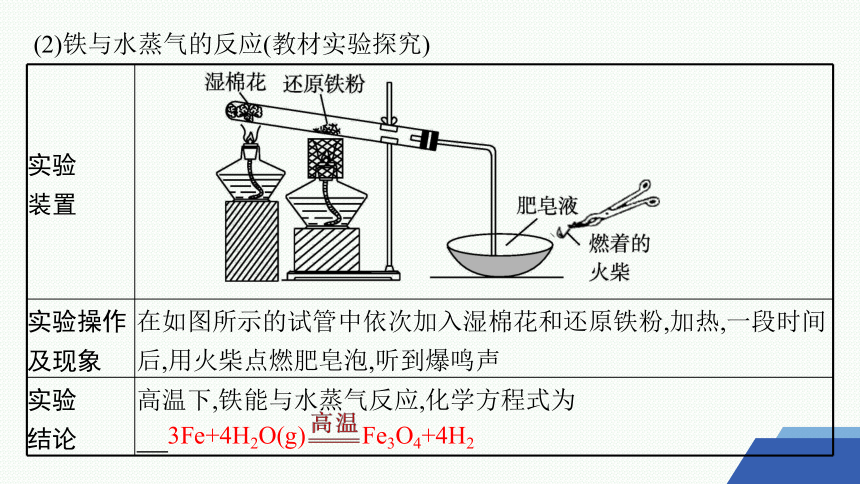
(2)铁与水蒸气的反应(教材实验探究)
实验 装置
实验操作 及现象 在如图所示的试管中依次加入湿棉花和还原铁粉,加热,一段时间后,用火柴点燃肥皂泡,听到爆鸣声
实验 结论 高温下,铁能与水蒸气反应,化学方程式为
3Fe+4H2O(g) Fe3O4+4H2
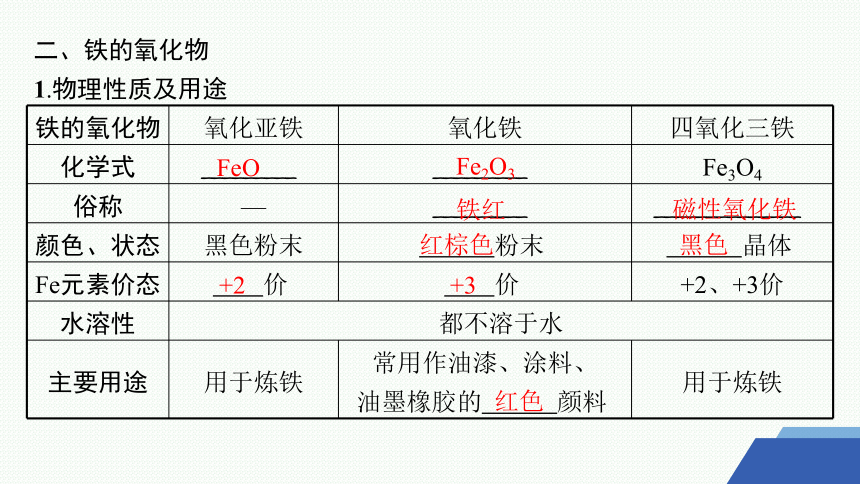
二、铁的氧化物
1.物理性质及用途
铁的氧化物 氧化亚铁 氧化铁 四氧化三铁
化学式 _________ _________ Fe3O4
俗称 — _________ ______________
颜色、状态 黑色粉末 粉末 晶体
Fe元素价态 价 价 +2、+3价
水溶性 都不溶于水
主要用途 用于炼铁 常用作油漆、涂料、 油墨橡胶的 颜料 用于炼铁
FeO
Fe2O3
铁红
磁性氧化铁
红棕色
黑色
+2
+3
红色
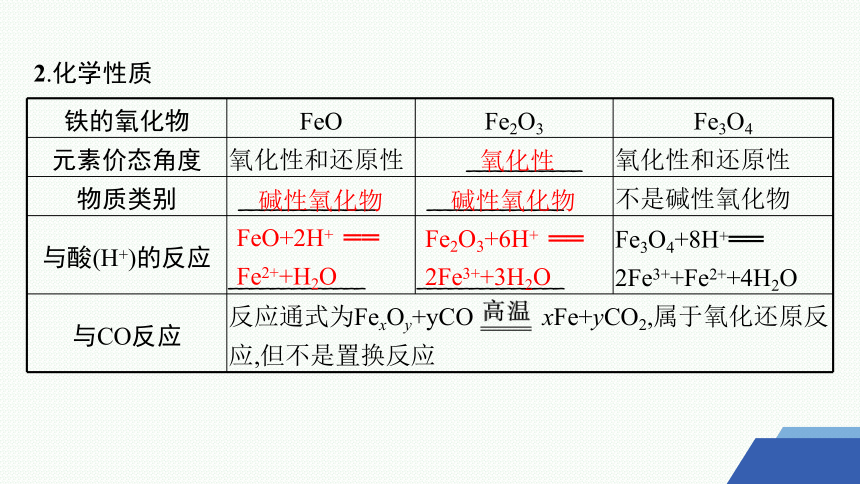
2.化学性质
铁的氧化物 FeO Fe2O3 Fe3O4
元素价态角度 氧化性和还原性 ___________ 氧化性和还原性
物质类别 _____________ _____________ 不是碱性氧化物
与酸(H+)的反应 _____________ ______________ Fe3O4+8H+══
2Fe3++Fe2++4H2O
与CO反应 反应通式为FexOy+yCO xFe+yCO2,属于氧化还原反应,但不是置换反应
氧化性
碱性氧化物
碱性氧化物
FeO+2H+ ══ Fe2++H2O
Fe2O3+6H+ ══ 2Fe3++3H2O
温故知新
自然界中元素的含量
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
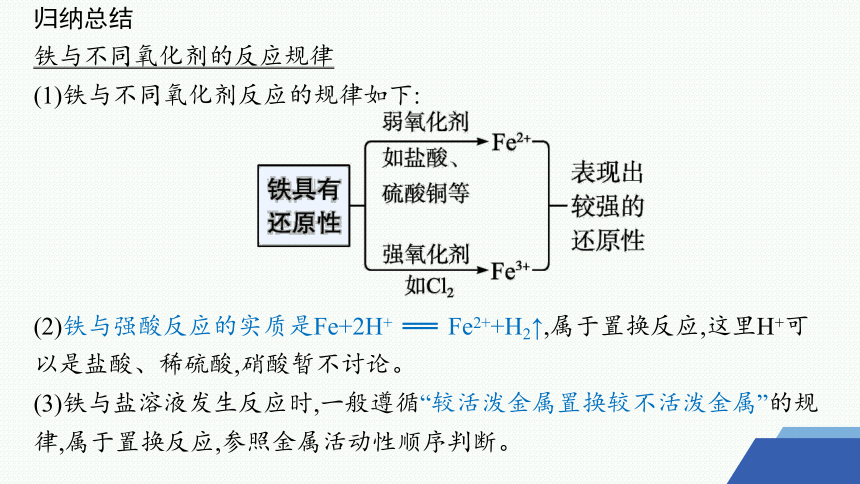
归纳总结
铁与不同氧化剂的反应规律
(1)铁与不同氧化剂反应的规律如下:
(2)铁与强酸反应的实质是Fe+2H+ ══ Fe2++H2↑,属于置换反应,这里H+可以是盐酸、稀硫酸,硝酸暂不讨论。
(3)铁与盐溶液发生反应时,一般遵循“较活泼金属置换较不活泼金属”的规律,属于置换反应,参照金属活动性顺序判断。
实验延伸
铁与水蒸气的反应
(1)湿棉花的作用是受热时提供反应所需水蒸气。
(2)酒精灯火焰的防风罩可以使加热效果更好,减少热量散失。
(3)肥皂液起到“收集”氢气的作用。
易错辨析
(1)整套装置试管口略低于试管底部,其目的是防止试管炸裂。( )
(2)实验时先加热湿棉花,提供水蒸气,再加热还原铁粉。( )
(3)待反应后蒸发皿中产生足够多的气泡,再用燃着的火柴去点燃,可听到“爆鸣声”。( )
(4)该反应中,生成1 mol Fe3O4,转移电子为9 mol。( )
√
√
√
×
提示 (4)Fe3O4中Fe元素显+2、+3价,生成1 mol Fe3O4,同时生成4 mol H2,转移8 mol电子。
归纳总结
铁的不同氧化物
(1)生成Fe3O4的两种方法:
①铁与O2反应生成Fe3O4;
②铁与水蒸气反应生成Fe3O4。
(2)Fe3O4有固定组成,属于纯净物,可表示为FeO·Fe2O3。
(3)FeO不稳定,在空气中受热,能迅速被氧化生成Fe3O4。
深度思考
已知HI是强酸,Fe3+可与I-反应生成Fe2+和I2,试写出Fe2O3与HI溶液反应的离子方程式。
提示 Fe2O3+6H++2I- ══ 2Fe2++I2+3H2O
重难探究·能力素养全提升
探究一 铁与酸、盐溶液及水的反应
情境探究
方法突破
1.从物质类别
角度认识铁的
化学性质
2.从元素价态角度认识铁的化学性质
应用体验
1.把铁粉放入下列溶液中,铁片溶解,溶液质量减小,但没有气体放出的是
( )
A.稀硫酸 B.NaHSO4溶液 C.CuSO4溶液 D.NaCl溶液
C
解析 Fe与稀硫酸发生的反应为Fe+H2SO4 ══ FeSO4+H2↑,铁片溶解,溶液的质量增加,有气体放出,A错误;NaHSO4在水溶液中能电离出H+,加入铁粉,生成FeSO4和H2,有气体放出,B错误;Fe与CuSO4溶液发生的反应为Fe+CuSO4 ══ FeSO4+Cu,溶解56 g Fe的同时析出64 g Cu,溶液的质量减小,不产生气体,C正确;Fe投入NaCl溶液中,不发生反应,D错误。
【变式设问】
若将铁粉投入AgNO3溶液中,铁粉和溶液的质量会发生怎样的变化 写出反应的离子方程式。
提示 铁粉质量减小,溶液质量减小;Fe+2Ag+ ══ Fe2++2Ag。
2.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸
B.醋酸溶液
C.氢氧化钠溶液
D.硫酸铜溶液
C
解析 铁是活泼金属,能与稀硫酸、醋酸溶液等酸溶液发生反应,能与硫酸铜溶液等不活泼金属的盐溶液发生反应,不能与NaOH溶液反应。
探究二 探究铁的氧化物的性质
情境探究
红壤是在亚热带生物、气候条件下形成的土壤,我国长江以南的低山丘陵区普遍存在着红色土壤,这种土壤含铁、铝成分较多,有机质少,酸性强,土质黏重,是我国南方的低产土壤之一。
(1)据东川红土地的颜色判断,土壤中可能含有铁的氧化物是______。
(2)若发生硫酸型酸雨,红土地表面会被腐蚀,试结合离子方程式分析其中
原因。
氧化铁(Fe2O3)
提示 土壤中Fe2O3发生反应:Fe2O3+6H+ ══ 2Fe3++3H2O,生成易溶于水的铁盐,红土地表面被腐蚀。
方法突破 从物质类别和元素价态两个维度认识铁的氧化物
应用体验
1.纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如图所示。下列说法不正确的是( )
A.过程Ⅰ的反应:2Fe3O4 ══ 6FeO+O2↑, Fe3O4表现氧化性和还原性
B.过程Ⅱ的反应:2H2O ══ 2H2↑+O2↑,FeO表现还原性
C.两个转化过程都发生了氧化还原反应
D.过程Ⅰ中FeO是还原产物,过程Ⅱ中FeO是还原剂
B
解析 由题图可知,过程Ⅰ中Fe3O4分解为FeO和O2,发生反应:2Fe3O4 ══ 6FeO+O2↑,A正确;过程Ⅱ中FeO和H2O反应生成Fe3O4和H2,发生反应: 6FeO+2H2O ══ 2Fe3O4+2H2↑,B错误;过程Ⅰ中Fe、O元素化合价发生变化,过程Ⅱ中Fe、H元素化合价发生变化,故均为氧化还原反应,C正确;过程Ⅰ中部分Fe元素由+3价变为+2价,则FeO是还原产物,过程Ⅱ中部分Fe元素由+2价变为+3价,则FeO是还原剂,D正确。
2.[2023湖北黄冈中学高一调研]在中学化学中经常提到的铁的氧化物有FeO、Fe2O3和Fe3O4,在一定条件下它们之间可以相互转化,在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4。下列有关说法错误的是( )
A.热稳定性:Fe3O4>Fe2O3
B.FeO和Fe2O3都是碱性氧化物,都能与稀盐酸反应
C.Fe3O4为黑色固体,其中+2价铁与+3价铁的物质的量之比为1∶2
D.由FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量比可能为7∶3
D
解析 在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4,则热稳定性:Fe3O4>Fe2O3,A正确;Fe3O4为黑色固体,可以写成FeO·Fe2O3,则+2价铁与+3价铁的物质的量之比为1∶2,C正确;在FeO中,铁元素与氧元素的质量比为7∶2,在Fe2O3中,铁元素与氧元素的质量比为7∶3,则FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量比可能在7∶2和7∶3之间,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.对于Fe2O3,从物质类别来看,它属于( )
A.盐 B.碱
C.金属氧化物 D.非金属氧化物
C
解析 Fe2O3由Fe和O元素组成,属于金属氧化物,属于碱性氧化物。
1
2
3
4
5
2.日常生活中铁制品生锈是常见现象,铁锈的主要成分是Fe2O3·xH2O。我们可以从商店购买除锈剂来除去衣服上沾有的铁锈,你认为除锈剂中有效成分不可能是( )
A.醋酸
B.草酸
C.氢氧化钠
D.柠檬酸
C
解析 铁锈的主要成分是Fe2O3·xH2O,Fe2O3是碱性氧化物,能与酸反应生成可溶性铁盐,但不能与NaOH溶液反应。
1
2
3
4
5
3.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+2价的是
( )
①醋酸 ②稀盐酸 ③ZnCl2溶液
④CuCl2溶液 ⑤Hg(NO3)2溶液
A.①③④ B.①②④⑤
C.②③④⑤ D.①②③⑤
B
解析 铁与稀盐酸、醋酸、不活泼金属的盐溶液等弱氧化剂反应,均生成Fe2+。
1
2
3
4
5
4.[2023河北沧州高一期中]下列有关铁及其化合物的说法错误的是( )
A.陨铁中存在游离态的铁
B.铁能与水蒸气反应,生成氧化铁和氢气
C.铁的氧化物都不溶于水,也不与水反应
D.四氧化三铁与稀盐酸反应生成两种盐
B
解析 游离态的铁主要存在于陨铁中,A正确;铁能与水蒸气反应,生成四氧化三铁和氢气,B错误;铁的氧化物性质稳定,不溶于水,也不与水反应,C正确;四氧化三铁与稀盐酸反应生成FeCl2、FeCl3两种盐,D正确。
1
2
3
4
5
5.[2023湖南怀化高一期中]某化学兴趣小组利用如图所示装置进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是 ,B中反应的化学方程式为 。
(2)D的作用是 。
(3)E中的现象是 。
(4)A、B两个装置中应先点燃 处的酒精灯,点燃E处酒精灯之前应进行的操作是 。
1
2
3
4
5
答案 (1)提供水蒸气 3Fe+4H2O(g) Fe3O4+4H2 (2)干燥H2,除去水蒸气
(3)黑色固体变为红色,右端管壁有水珠生成
(4)A 收集H2,并检验其纯度
解析 (1)B中进行的反应为3Fe+4H2O(g) Fe3O4+4H2,故A为提供水蒸气的装置。
(2)D的作用是除去水蒸气,干燥H2。
(3)E中反应为H2+CuO Cu+H2O,故黑色粉末变红,同时硬质玻璃管右端会有水珠生成。
(4)应先点燃A处酒精灯,若先点燃B处酒精灯,则B中的Fe会与空气中的O2反应生成Fe3O4,点燃E处酒精灯前要收集H2,检验其纯度。
本 课 结 束
第三章
第一节 第1课时 铁的单质 铁的氧化物
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.从氧化还原反应和离子反应的视角,基于实验事实写出铁与水蒸气反应的化学方程式,提升对铁及其化合物知识的认识,发展宏观辨识与微观探析的学科核心素养。
2.了解铁元素在自然界中的存在形态,了解铁元素与人体健康的关系,体会化学对人类生活的重要意义;从我国古代用铁的化学史感受中华民族在科技发展进程中的贡献,增强文化自信,发展科学态度与社会责任的学科核心素养。
基础落实·必备知识全过关
一、铁的单质
1.自然界中铁元素的存在
(1)铁在自然界中可以像陨铁中的铁那样以 形态存在,但主要以
价和 价化合物的形态存在于矿石中。
(2)工业炼铁的原理是用 的方法把铁从铁矿石中提炼出来。炼铁高炉中发生的主要反应有 。
2.铁的物理性质
延展性 导热性 导电性 熔点 沸点 密度 特性
有 有 能导电, 不如 1 535 ℃ 2 750 ℃ 7.86 g·cm-3 能被 吸引
单质
+2
+3
还原
Fe2O3+3CO 2Fe+3CO2
铜和铝
磁铁
3.铁的化学性质
(1)铁与某些非金属单质、酸和盐溶液反应
化学性质 化学方程式
铁与某些非金属单质反应 铁与O2反应: ;
铁与Cl2反应:
铁与酸溶液的反应 铁与稀硫酸反应: ;
铁与稀盐酸反应:
铁与盐溶液的反应 铁与AgNO3溶液反应: ;
铁与CuSO4溶液反应:
3Fe+2O2 Fe3O4
2Fe+3Cl2 2FeCl3
Fe+H2SO4 ══ FeSO4+H2↑
Fe+2HCl ══ FeCl2+H2↑
2AgNO3+Fe ══ Fe(NO3)2+2Ag
Fe+CuSO4 ══ FeSO4+Cu
(2)铁与水蒸气的反应(教材实验探究)
实验 装置
实验操作 及现象 在如图所示的试管中依次加入湿棉花和还原铁粉,加热,一段时间后,用火柴点燃肥皂泡,听到爆鸣声
实验 结论 高温下,铁能与水蒸气反应,化学方程式为
3Fe+4H2O(g) Fe3O4+4H2
二、铁的氧化物
1.物理性质及用途
铁的氧化物 氧化亚铁 氧化铁 四氧化三铁
化学式 _________ _________ Fe3O4
俗称 — _________ ______________
颜色、状态 黑色粉末 粉末 晶体
Fe元素价态 价 价 +2、+3价
水溶性 都不溶于水
主要用途 用于炼铁 常用作油漆、涂料、 油墨橡胶的 颜料 用于炼铁
FeO
Fe2O3
铁红
磁性氧化铁
红棕色
黑色
+2
+3
红色
2.化学性质
铁的氧化物 FeO Fe2O3 Fe3O4
元素价态角度 氧化性和还原性 ___________ 氧化性和还原性
物质类别 _____________ _____________ 不是碱性氧化物
与酸(H+)的反应 _____________ ______________ Fe3O4+8H+══
2Fe3++Fe2++4H2O
与CO反应 反应通式为FexOy+yCO xFe+yCO2,属于氧化还原反应,但不是置换反应
氧化性
碱性氧化物
碱性氧化物
FeO+2H+ ══ Fe2++H2O
Fe2O3+6H+ ══ 2Fe3++3H2O
温故知新
自然界中元素的含量
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
归纳总结
铁与不同氧化剂的反应规律
(1)铁与不同氧化剂反应的规律如下:
(2)铁与强酸反应的实质是Fe+2H+ ══ Fe2++H2↑,属于置换反应,这里H+可以是盐酸、稀硫酸,硝酸暂不讨论。
(3)铁与盐溶液发生反应时,一般遵循“较活泼金属置换较不活泼金属”的规律,属于置换反应,参照金属活动性顺序判断。
实验延伸
铁与水蒸气的反应
(1)湿棉花的作用是受热时提供反应所需水蒸气。
(2)酒精灯火焰的防风罩可以使加热效果更好,减少热量散失。
(3)肥皂液起到“收集”氢气的作用。
易错辨析
(1)整套装置试管口略低于试管底部,其目的是防止试管炸裂。( )
(2)实验时先加热湿棉花,提供水蒸气,再加热还原铁粉。( )
(3)待反应后蒸发皿中产生足够多的气泡,再用燃着的火柴去点燃,可听到“爆鸣声”。( )
(4)该反应中,生成1 mol Fe3O4,转移电子为9 mol。( )
√
√
√
×
提示 (4)Fe3O4中Fe元素显+2、+3价,生成1 mol Fe3O4,同时生成4 mol H2,转移8 mol电子。
归纳总结
铁的不同氧化物
(1)生成Fe3O4的两种方法:
①铁与O2反应生成Fe3O4;
②铁与水蒸气反应生成Fe3O4。
(2)Fe3O4有固定组成,属于纯净物,可表示为FeO·Fe2O3。
(3)FeO不稳定,在空气中受热,能迅速被氧化生成Fe3O4。
深度思考
已知HI是强酸,Fe3+可与I-反应生成Fe2+和I2,试写出Fe2O3与HI溶液反应的离子方程式。
提示 Fe2O3+6H++2I- ══ 2Fe2++I2+3H2O
重难探究·能力素养全提升
探究一 铁与酸、盐溶液及水的反应
情境探究
方法突破
1.从物质类别
角度认识铁的
化学性质
2.从元素价态角度认识铁的化学性质
应用体验
1.把铁粉放入下列溶液中,铁片溶解,溶液质量减小,但没有气体放出的是
( )
A.稀硫酸 B.NaHSO4溶液 C.CuSO4溶液 D.NaCl溶液
C
解析 Fe与稀硫酸发生的反应为Fe+H2SO4 ══ FeSO4+H2↑,铁片溶解,溶液的质量增加,有气体放出,A错误;NaHSO4在水溶液中能电离出H+,加入铁粉,生成FeSO4和H2,有气体放出,B错误;Fe与CuSO4溶液发生的反应为Fe+CuSO4 ══ FeSO4+Cu,溶解56 g Fe的同时析出64 g Cu,溶液的质量减小,不产生气体,C正确;Fe投入NaCl溶液中,不发生反应,D错误。
【变式设问】
若将铁粉投入AgNO3溶液中,铁粉和溶液的质量会发生怎样的变化 写出反应的离子方程式。
提示 铁粉质量减小,溶液质量减小;Fe+2Ag+ ══ Fe2++2Ag。
2.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸
B.醋酸溶液
C.氢氧化钠溶液
D.硫酸铜溶液
C
解析 铁是活泼金属,能与稀硫酸、醋酸溶液等酸溶液发生反应,能与硫酸铜溶液等不活泼金属的盐溶液发生反应,不能与NaOH溶液反应。
探究二 探究铁的氧化物的性质
情境探究
红壤是在亚热带生物、气候条件下形成的土壤,我国长江以南的低山丘陵区普遍存在着红色土壤,这种土壤含铁、铝成分较多,有机质少,酸性强,土质黏重,是我国南方的低产土壤之一。
(1)据东川红土地的颜色判断,土壤中可能含有铁的氧化物是______。
(2)若发生硫酸型酸雨,红土地表面会被腐蚀,试结合离子方程式分析其中
原因。
氧化铁(Fe2O3)
提示 土壤中Fe2O3发生反应:Fe2O3+6H+ ══ 2Fe3++3H2O,生成易溶于水的铁盐,红土地表面被腐蚀。
方法突破 从物质类别和元素价态两个维度认识铁的氧化物
应用体验
1.纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如图所示。下列说法不正确的是( )
A.过程Ⅰ的反应:2Fe3O4 ══ 6FeO+O2↑, Fe3O4表现氧化性和还原性
B.过程Ⅱ的反应:2H2O ══ 2H2↑+O2↑,FeO表现还原性
C.两个转化过程都发生了氧化还原反应
D.过程Ⅰ中FeO是还原产物,过程Ⅱ中FeO是还原剂
B
解析 由题图可知,过程Ⅰ中Fe3O4分解为FeO和O2,发生反应:2Fe3O4 ══ 6FeO+O2↑,A正确;过程Ⅱ中FeO和H2O反应生成Fe3O4和H2,发生反应: 6FeO+2H2O ══ 2Fe3O4+2H2↑,B错误;过程Ⅰ中Fe、O元素化合价发生变化,过程Ⅱ中Fe、H元素化合价发生变化,故均为氧化还原反应,C正确;过程Ⅰ中部分Fe元素由+3价变为+2价,则FeO是还原产物,过程Ⅱ中部分Fe元素由+2价变为+3价,则FeO是还原剂,D正确。
2.[2023湖北黄冈中学高一调研]在中学化学中经常提到的铁的氧化物有FeO、Fe2O3和Fe3O4,在一定条件下它们之间可以相互转化,在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4。下列有关说法错误的是( )
A.热稳定性:Fe3O4>Fe2O3
B.FeO和Fe2O3都是碱性氧化物,都能与稀盐酸反应
C.Fe3O4为黑色固体,其中+2价铁与+3价铁的物质的量之比为1∶2
D.由FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量比可能为7∶3
D
解析 在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4,则热稳定性:Fe3O4>Fe2O3,A正确;Fe3O4为黑色固体,可以写成FeO·Fe2O3,则+2价铁与+3价铁的物质的量之比为1∶2,C正确;在FeO中,铁元素与氧元素的质量比为7∶2,在Fe2O3中,铁元素与氧元素的质量比为7∶3,则FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量比可能在7∶2和7∶3之间,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.对于Fe2O3,从物质类别来看,它属于( )
A.盐 B.碱
C.金属氧化物 D.非金属氧化物
C
解析 Fe2O3由Fe和O元素组成,属于金属氧化物,属于碱性氧化物。
1
2
3
4
5
2.日常生活中铁制品生锈是常见现象,铁锈的主要成分是Fe2O3·xH2O。我们可以从商店购买除锈剂来除去衣服上沾有的铁锈,你认为除锈剂中有效成分不可能是( )
A.醋酸
B.草酸
C.氢氧化钠
D.柠檬酸
C
解析 铁锈的主要成分是Fe2O3·xH2O,Fe2O3是碱性氧化物,能与酸反应生成可溶性铁盐,但不能与NaOH溶液反应。
1
2
3
4
5
3.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+2价的是
( )
①醋酸 ②稀盐酸 ③ZnCl2溶液
④CuCl2溶液 ⑤Hg(NO3)2溶液
A.①③④ B.①②④⑤
C.②③④⑤ D.①②③⑤
B
解析 铁与稀盐酸、醋酸、不活泼金属的盐溶液等弱氧化剂反应,均生成Fe2+。
1
2
3
4
5
4.[2023河北沧州高一期中]下列有关铁及其化合物的说法错误的是( )
A.陨铁中存在游离态的铁
B.铁能与水蒸气反应,生成氧化铁和氢气
C.铁的氧化物都不溶于水,也不与水反应
D.四氧化三铁与稀盐酸反应生成两种盐
B
解析 游离态的铁主要存在于陨铁中,A正确;铁能与水蒸气反应,生成四氧化三铁和氢气,B错误;铁的氧化物性质稳定,不溶于水,也不与水反应,C正确;四氧化三铁与稀盐酸反应生成FeCl2、FeCl3两种盐,D正确。
1
2
3
4
5
5.[2023湖南怀化高一期中]某化学兴趣小组利用如图所示装置进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是 ,B中反应的化学方程式为 。
(2)D的作用是 。
(3)E中的现象是 。
(4)A、B两个装置中应先点燃 处的酒精灯,点燃E处酒精灯之前应进行的操作是 。
1
2
3
4
5
答案 (1)提供水蒸气 3Fe+4H2O(g) Fe3O4+4H2 (2)干燥H2,除去水蒸气
(3)黑色固体变为红色,右端管壁有水珠生成
(4)A 收集H2,并检验其纯度
解析 (1)B中进行的反应为3Fe+4H2O(g) Fe3O4+4H2,故A为提供水蒸气的装置。
(2)D的作用是除去水蒸气,干燥H2。
(3)E中反应为H2+CuO Cu+H2O,故黑色粉末变红,同时硬质玻璃管右端会有水珠生成。
(4)应先点燃A处酒精灯,若先点燃B处酒精灯,则B中的Fe会与空气中的O2反应生成Fe3O4,点燃E处酒精灯前要收集H2,检验其纯度。
本 课 结 束
