3.2..2 物质的量在化学方程式计算中的应用课件(共36张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 3.2..2 物质的量在化学方程式计算中的应用课件(共36张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览









文档简介
(共36张PPT)
第三章
第二节 第2课时 物质的量在化学方程式计算中的应用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 基于物质的量认识化学变化,运用物质的量及相关物理量根据化学方程式进行简单计算,感受定量研究对化学科学的重要作用,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、物质的构成及发生的反应
1.物质是由 、 、 等粒子构成的,物质之间的化学反应是这些粒子按一定的 进行的。
原子
分子
离子
数目关系
2.从物质的量角度认识化学方程式
化学反应中物质之间按一定质量关系(宏观)和粒子数目关系(微观)进行反应
化学方程式中的化学计量数可以明确地表示出化学反应中粒子之间的 。例如:
2Na + 2H2O ══ 2NaOH + H2↑
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大6.02×1023倍 (2×6.02×1023)∶(2×6.02×1023)∶(2×6.02×1023)∶(1×6.02×1023)
物质的量之比 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
得出结论:化学方程式中各物质的化学计量数之比等于各物质的__________
之比。
数量关系
物质的量
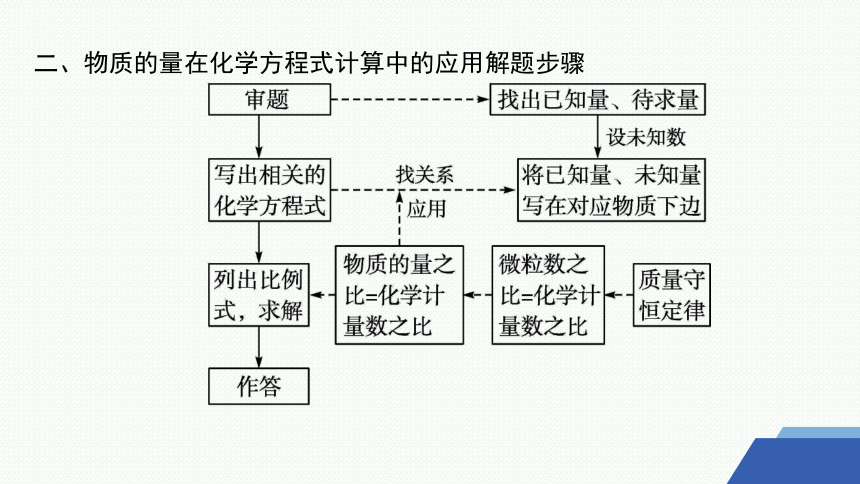
二、物质的量在化学方程式计算中的应用解题步骤
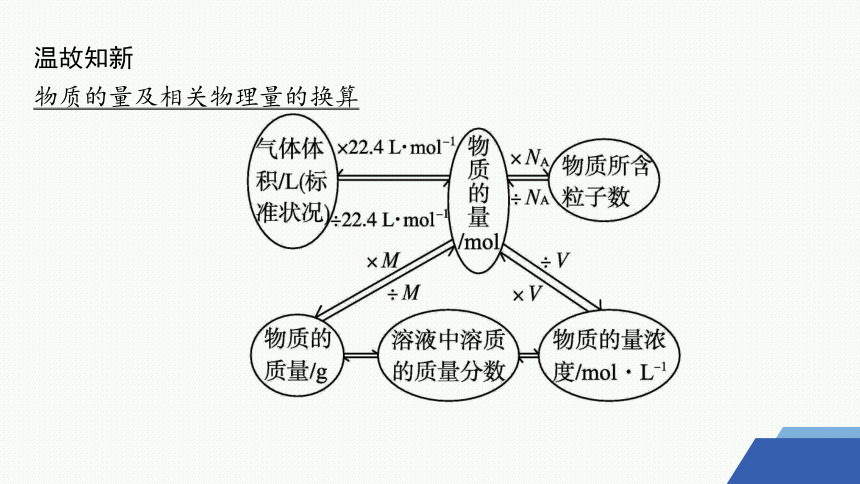
温故知新
物质的量及相关物理量的换算
归纳总结
(1)根据化学方程式进行计算时,已知物质的其他物理量可先换算成物质的量,再根据化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,列出比例关系。
(2)各物理量及单位、公式等尽量用符号表示,各物理量要注明所表示的物质(或微粒)的符号。例如,H2的物质的量表示为n(H2)。
(3)将已知物理量代入比例式计算时,都要代入单位计算。
重难探究·能力素养全提升
探究一 物质的量在化学方程式计算中的应用
情境探究
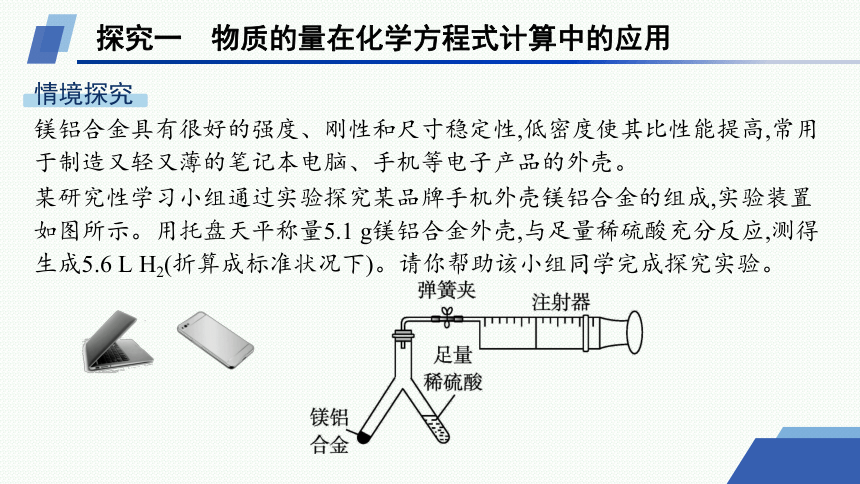
镁铝合金具有很好的强度、刚性和尺寸稳定性,低密度使其比性能提高,常用于制造又轻又薄的笔记本电脑、手机等电子产品的外壳。
某研究性学习小组通过实验探究某品牌手机外壳镁铝合金的组成,实验装置如图所示。用托盘天平称量5.1 g镁铝合金外壳,与足量稀硫酸充分反应,测得生成5.6 L H2(折算成标准状况下)。请你帮助该小组同学完成探究实验。
(1)写出上述实验中发生反应的化学方程式。
(2)通过计算求出该镁铝合金外壳中铝和镁的物质的量之比及该合金中铝的质量分数。
提示 Mg+H2SO4 ══ MgSO4+H2↑、2Al+3H2SO4 ══ Al2(SO4)3+3H2↑
提示 1∶1 52.9%
解析 镁铝合金粉末的质量为5.1 g,则有
n(Mg)×24 g·mol-1+n(Al)×27 g·mol-1=5.1 g①
Mg + H2SO4══MgSO4+H2↑
1 mol 22.4 L
n(Mg) 22.4n(Mg) L
2Al+3H2SO4 ══ Al2(SO4)3+3H2↑
2 mol 67.2 L
n(Al) 33.6n(Al) L
生成H2的体积为5.6 L(标准状况),则有
22.4n(Mg) L+33.6n(Al) L=5.6 L②
联立①和②解得:n(Mg)=0.1 mol,n(Al)=0.1 mol,故合金中铝和镁的物质的量之比为0.1 mol∶0.1 mol=1∶1。
合金中铝的质量为m(Al)=0.1 mol×27 g·mol-1=2.7 g,故合金中铝的质量分数为 ×100%≈52.9%。
方法突破
1.物质的量应用于化学方程式计算的基本步骤
2.物质的量应用于化学方程式的计算“三化”
(1)书写格式规范化
计算的过程中,各物理量、物质对象、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化
计算时,如果已知的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)过量判断简捷化
如果两种反应物的量都是已知的,用已知量与对应计量数比值(比值大过量)先判断哪种物质过量,然后根据不足量的物质求解某种产物的量。
应用体验
将足量铁粉投入100 mL 1 mol·L-1 H2SO4和1 mol·L-1 CuSO4混合液中,充分反应,消耗铁粉的总质量为( )
A.5.6 g B.11.2 g C.16.8 g D.2.8 g
B
解析 100 mL 1 mol·L-1 H2SO4和1 mol·L-1 CuSO4混合液中n(H2SO4)=n(CuSO4)=0.1 L×1 mol·L-1=0.1 mol,则有
Fe + H2SO4 ══ FeSO4+H2↑
0.1 mol 0.1 mol
Fe + CuSO4 ══ FeSO4+Cu
0.1 mol 0.1 mol
则消耗铁粉的总质量为(0.1 mol+0.1 mol)×56 g·mol-1=11.2 g。
探究二 物质的量在化学方程式计算中的应用常用技巧
情境探究
在葡萄酒酿制过程中,葡萄汁中某些细菌的繁殖会影响发酵,添加适量的二氧化硫可以起到杀菌的作用,又能防止葡萄酒中的一些成分被氧化,起到保质作用。
某校研究性小组为测定葡萄酒中SO2的含量,设计了如图所示的装置(夹持装置已略去):
实验步骤如下:在圆底烧瓶中加入300 mL葡萄酒及适量稀硫酸,加热使SO2全部逸出,并与锥形瓶中H2O2溶液完全反应,除去剩余的H2O2后,用0.10 mol·L-1 NaOH溶液测定反应生成的H2SO4,消耗25.0 mL NaOH溶液。
(1)锥形瓶中SO2与H2O2发生反应的化学方程式为 。
(2)该葡萄酒中SO2的含量为 (保留4位有效数字)mg·L-1。
SO2+H2O2 ══ H2SO4
266.7
方法突破 物质的量在化学方程式计算中的应用常用技巧
差量法
差量法
应用体验
1.[2023湖北宜昌高一期末]13.7 g Na2CO3和NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12 L,则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A.1∶1
B.2∶1
C.1∶2
D.3∶1
C
解析 混合物充分加热,NaHCO3分解生成Na2CO3、CO2和H2O,则有
2NaHCO3Na2 CO3+CO2↑+H2O
2 mol 22.4 L
n(NaHCO3) 1.12 L
2.[2023黑龙江哈尔滨高一期末]将足量锌粉投入100 mL 2 mol·L-1 HCl和
1 mol·L-1 CuCl2混合液中,充分反应,消耗锌粉的总质量为( )
A.6.5 g
B.13 g
C.16.8 g
D.2.8 g
B
解析 100 mL 2 mol·L-1 HCl和1 mol·L-1 CuCl2混合液中n(HCl)=0.2 mol,n(CuCl2)=0.1 mol,则有
Zn + 2HCl ══ ZnCl2+H2↑
1 2
n1(Zn) 0.2 mol
Zn + CuCl2 ══ ZnCl2+Cu
1 1
n2(Zn) 0.1 mol
则消耗锌粉的总质量为(0.1 mol+0.1 mol)×65 g·mol-1=13 g。
学以致用·随堂检测全达标
1
2
3
4
5
1.在200 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体13.44 L,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
1
2
3
4
5
2.将足量铁粉加入100 mL 0.1 mol·L-1 CuSO4溶液中,充分反应后析出铜的质量为( )
A.32 g B.6.4 g C.0.64 g D.3.2 g
C
解析 100 mL 0.1 mol·L-1 CuSO4溶液中,n(CuSO4)=0.1 L×0.1 mol·L-1
=0.01 mol,则有
Fe+CuSO4 ══ Cu+FeSO4
1 mol 64 g
0.01 mol m(Cu)
1
2
3
4
5
3.[2023江西赣州高一期中]在100 mL 1.00 mol·L-1稀硫酸中加入足量铁屑,生成气体在标准状况下的体积约为( )
A.11.2 L B.6.72 L C.4.48 L D.2.24 L
D
解析 100 mL 1.00 mol·L-1稀硫酸中,n(H2SO4)=0.1 L×1.00 mol·L-1=0.1 mol,则有
Fe+H2SO4 ══ FeSO4+H2↑
1 mol 22.4 L
0.1 mol V(H2)
1
2
3
4
5
4.将13.7 g Mg、Al和Zn的混合物溶于足量盐酸中,共收集到标准状况下的气体11.2 L,向所得溶液中逐滴加入NaOH溶液,最多得到沉淀的质量为
( )
A.19.7 g
B.22.3 g
C.30.7 g
D.39.2 g
C
解析 反应中,金属失电子被氧化生成金属阳离子(Mg2+、Al3+、Zn2+),H+得电子被还原生成H2,遵循得失电子守恒规律,则金属失去电子的物质的量等于 ×2=1 mol。金属阳离子与OH-反应生成氢氧化物沉淀,则金属失去电子的物质的量等于沉淀时消耗OH-的物质的量,故得到沉淀的最大质量为13.7 g+1 mol×17 g·mol-1=30.7 g。
1
2
3
4
5
5.将一定量的铁粉投入CuSO4溶液中,若反应后溶液的体积为1 L,生成的铜的质量为32 g。求:
(1)反应消耗的Fe的质量为 。
(2)反应后溶液中FeSO4的物质的量浓度为 。
答案 (1)28 g (2)0.5 mol·L-1
解析 生成32 g铜的物质的量为 =0.5 mol,则有:
Fe+CuSO4 ══ FeSO4 + Cu
1 1 1
0.5 mol 0.5 mol 0.5 mol
故有m(Fe)=0.5 mol×56 g·mol-1=28 g,c(FeSO4)= =0.5 mol·L-1。
本 课 结 束
第三章
第二节 第2课时 物质的量在化学方程式计算中的应用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 基于物质的量认识化学变化,运用物质的量及相关物理量根据化学方程式进行简单计算,感受定量研究对化学科学的重要作用,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、物质的构成及发生的反应
1.物质是由 、 、 等粒子构成的,物质之间的化学反应是这些粒子按一定的 进行的。
原子
分子
离子
数目关系
2.从物质的量角度认识化学方程式
化学反应中物质之间按一定质量关系(宏观)和粒子数目关系(微观)进行反应
化学方程式中的化学计量数可以明确地表示出化学反应中粒子之间的 。例如:
2Na + 2H2O ══ 2NaOH + H2↑
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大6.02×1023倍 (2×6.02×1023)∶(2×6.02×1023)∶(2×6.02×1023)∶(1×6.02×1023)
物质的量之比 2 mol ∶ 2 mol ∶ 2 mol ∶ 1 mol
得出结论:化学方程式中各物质的化学计量数之比等于各物质的__________
之比。
数量关系
物质的量
二、物质的量在化学方程式计算中的应用解题步骤
温故知新
物质的量及相关物理量的换算
归纳总结
(1)根据化学方程式进行计算时,已知物质的其他物理量可先换算成物质的量,再根据化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,列出比例关系。
(2)各物理量及单位、公式等尽量用符号表示,各物理量要注明所表示的物质(或微粒)的符号。例如,H2的物质的量表示为n(H2)。
(3)将已知物理量代入比例式计算时,都要代入单位计算。
重难探究·能力素养全提升
探究一 物质的量在化学方程式计算中的应用
情境探究
镁铝合金具有很好的强度、刚性和尺寸稳定性,低密度使其比性能提高,常用于制造又轻又薄的笔记本电脑、手机等电子产品的外壳。
某研究性学习小组通过实验探究某品牌手机外壳镁铝合金的组成,实验装置如图所示。用托盘天平称量5.1 g镁铝合金外壳,与足量稀硫酸充分反应,测得生成5.6 L H2(折算成标准状况下)。请你帮助该小组同学完成探究实验。
(1)写出上述实验中发生反应的化学方程式。
(2)通过计算求出该镁铝合金外壳中铝和镁的物质的量之比及该合金中铝的质量分数。
提示 Mg+H2SO4 ══ MgSO4+H2↑、2Al+3H2SO4 ══ Al2(SO4)3+3H2↑
提示 1∶1 52.9%
解析 镁铝合金粉末的质量为5.1 g,则有
n(Mg)×24 g·mol-1+n(Al)×27 g·mol-1=5.1 g①
Mg + H2SO4══MgSO4+H2↑
1 mol 22.4 L
n(Mg) 22.4n(Mg) L
2Al+3H2SO4 ══ Al2(SO4)3+3H2↑
2 mol 67.2 L
n(Al) 33.6n(Al) L
生成H2的体积为5.6 L(标准状况),则有
22.4n(Mg) L+33.6n(Al) L=5.6 L②
联立①和②解得:n(Mg)=0.1 mol,n(Al)=0.1 mol,故合金中铝和镁的物质的量之比为0.1 mol∶0.1 mol=1∶1。
合金中铝的质量为m(Al)=0.1 mol×27 g·mol-1=2.7 g,故合金中铝的质量分数为 ×100%≈52.9%。
方法突破
1.物质的量应用于化学方程式计算的基本步骤
2.物质的量应用于化学方程式的计算“三化”
(1)书写格式规范化
计算的过程中,各物理量、物质对象、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化
计算时,如果已知的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)过量判断简捷化
如果两种反应物的量都是已知的,用已知量与对应计量数比值(比值大过量)先判断哪种物质过量,然后根据不足量的物质求解某种产物的量。
应用体验
将足量铁粉投入100 mL 1 mol·L-1 H2SO4和1 mol·L-1 CuSO4混合液中,充分反应,消耗铁粉的总质量为( )
A.5.6 g B.11.2 g C.16.8 g D.2.8 g
B
解析 100 mL 1 mol·L-1 H2SO4和1 mol·L-1 CuSO4混合液中n(H2SO4)=n(CuSO4)=0.1 L×1 mol·L-1=0.1 mol,则有
Fe + H2SO4 ══ FeSO4+H2↑
0.1 mol 0.1 mol
Fe + CuSO4 ══ FeSO4+Cu
0.1 mol 0.1 mol
则消耗铁粉的总质量为(0.1 mol+0.1 mol)×56 g·mol-1=11.2 g。
探究二 物质的量在化学方程式计算中的应用常用技巧
情境探究
在葡萄酒酿制过程中,葡萄汁中某些细菌的繁殖会影响发酵,添加适量的二氧化硫可以起到杀菌的作用,又能防止葡萄酒中的一些成分被氧化,起到保质作用。
某校研究性小组为测定葡萄酒中SO2的含量,设计了如图所示的装置(夹持装置已略去):
实验步骤如下:在圆底烧瓶中加入300 mL葡萄酒及适量稀硫酸,加热使SO2全部逸出,并与锥形瓶中H2O2溶液完全反应,除去剩余的H2O2后,用0.10 mol·L-1 NaOH溶液测定反应生成的H2SO4,消耗25.0 mL NaOH溶液。
(1)锥形瓶中SO2与H2O2发生反应的化学方程式为 。
(2)该葡萄酒中SO2的含量为 (保留4位有效数字)mg·L-1。
SO2+H2O2 ══ H2SO4
266.7
方法突破 物质的量在化学方程式计算中的应用常用技巧
差量法
差量法
应用体验
1.[2023湖北宜昌高一期末]13.7 g Na2CO3和NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12 L,则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A.1∶1
B.2∶1
C.1∶2
D.3∶1
C
解析 混合物充分加热,NaHCO3分解生成Na2CO3、CO2和H2O,则有
2NaHCO3Na2 CO3+CO2↑+H2O
2 mol 22.4 L
n(NaHCO3) 1.12 L
2.[2023黑龙江哈尔滨高一期末]将足量锌粉投入100 mL 2 mol·L-1 HCl和
1 mol·L-1 CuCl2混合液中,充分反应,消耗锌粉的总质量为( )
A.6.5 g
B.13 g
C.16.8 g
D.2.8 g
B
解析 100 mL 2 mol·L-1 HCl和1 mol·L-1 CuCl2混合液中n(HCl)=0.2 mol,n(CuCl2)=0.1 mol,则有
Zn + 2HCl ══ ZnCl2+H2↑
1 2
n1(Zn) 0.2 mol
Zn + CuCl2 ══ ZnCl2+Cu
1 1
n2(Zn) 0.1 mol
则消耗锌粉的总质量为(0.1 mol+0.1 mol)×65 g·mol-1=13 g。
学以致用·随堂检测全达标
1
2
3
4
5
1.在200 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体13.44 L,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
1
2
3
4
5
2.将足量铁粉加入100 mL 0.1 mol·L-1 CuSO4溶液中,充分反应后析出铜的质量为( )
A.32 g B.6.4 g C.0.64 g D.3.2 g
C
解析 100 mL 0.1 mol·L-1 CuSO4溶液中,n(CuSO4)=0.1 L×0.1 mol·L-1
=0.01 mol,则有
Fe+CuSO4 ══ Cu+FeSO4
1 mol 64 g
0.01 mol m(Cu)
1
2
3
4
5
3.[2023江西赣州高一期中]在100 mL 1.00 mol·L-1稀硫酸中加入足量铁屑,生成气体在标准状况下的体积约为( )
A.11.2 L B.6.72 L C.4.48 L D.2.24 L
D
解析 100 mL 1.00 mol·L-1稀硫酸中,n(H2SO4)=0.1 L×1.00 mol·L-1=0.1 mol,则有
Fe+H2SO4 ══ FeSO4+H2↑
1 mol 22.4 L
0.1 mol V(H2)
1
2
3
4
5
4.将13.7 g Mg、Al和Zn的混合物溶于足量盐酸中,共收集到标准状况下的气体11.2 L,向所得溶液中逐滴加入NaOH溶液,最多得到沉淀的质量为
( )
A.19.7 g
B.22.3 g
C.30.7 g
D.39.2 g
C
解析 反应中,金属失电子被氧化生成金属阳离子(Mg2+、Al3+、Zn2+),H+得电子被还原生成H2,遵循得失电子守恒规律,则金属失去电子的物质的量等于 ×2=1 mol。金属阳离子与OH-反应生成氢氧化物沉淀,则金属失去电子的物质的量等于沉淀时消耗OH-的物质的量,故得到沉淀的最大质量为13.7 g+1 mol×17 g·mol-1=30.7 g。
1
2
3
4
5
5.将一定量的铁粉投入CuSO4溶液中,若反应后溶液的体积为1 L,生成的铜的质量为32 g。求:
(1)反应消耗的Fe的质量为 。
(2)反应后溶液中FeSO4的物质的量浓度为 。
答案 (1)28 g (2)0.5 mol·L-1
解析 生成32 g铜的物质的量为 =0.5 mol,则有:
Fe+CuSO4 ══ FeSO4 + Cu
1 1 1
0.5 mol 0.5 mol 0.5 mol
故有m(Fe)=0.5 mol×56 g·mol-1=28 g,c(FeSO4)= =0.5 mol·L-1。
本 课 结 束
