3.2.1 铁合金 铝和铝合金 新型合金课件(共46张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 3.2.1 铁合金 铝和铝合金 新型合金课件(共46张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:39:48 | ||
图片预览







文档简介
(共46张PPT)
第三章
第二节 第1课时 铁合金 铝和铝合金 新型合金
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.以铁合金、铝合金为例,能从元素组成上对合金进行分类,并认识不同类型金属材料组成、性能与应用的联系,强化性能决定用途的观念,发展科学态度与社会责任的学科核心素养。
2.通过实验探究铝和氧化铝的性质及转化,认识两性氧化物,丰富对金属多样性的认识,体会实验对认识和研究物质性质的重要作用,发展科学探究与创新意识的学科核心素养。
基础落实·必备知识全过关
一、合金 铁合金
1.合金及特性
(1)含义
合金是由两种或两种以上的金属(或金属与非金属)高温熔合而形成的具有 的混合物。
(2)合金的特点
①一般情况下,合金的硬度比其成分金属的 ,熔点比其成分金属的 。
②一般来说,合金的性能并不是各成分金属性能的总和,合金的物理、化学及机械性能优于各成分金属。
③合金的性能可以通过所添加的合金元素的 、 和生成合金的 等来加以调节。
金属特性
大
低
种类
含量
条件
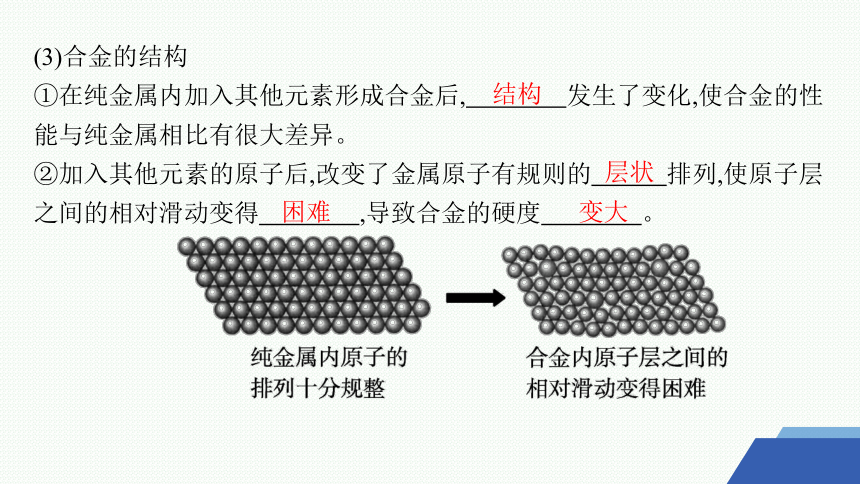
(3)合金的结构
①在纯金属内加入其他元素形成合金后, 发生了变化,使合金的性能与纯金属相比有很大差异。
②加入其他元素的原子后,改变了金属原子有规则的 排列,使原子层之间的相对滑动变得 ,导致合金的硬度 。
结构
层状
困难
变大
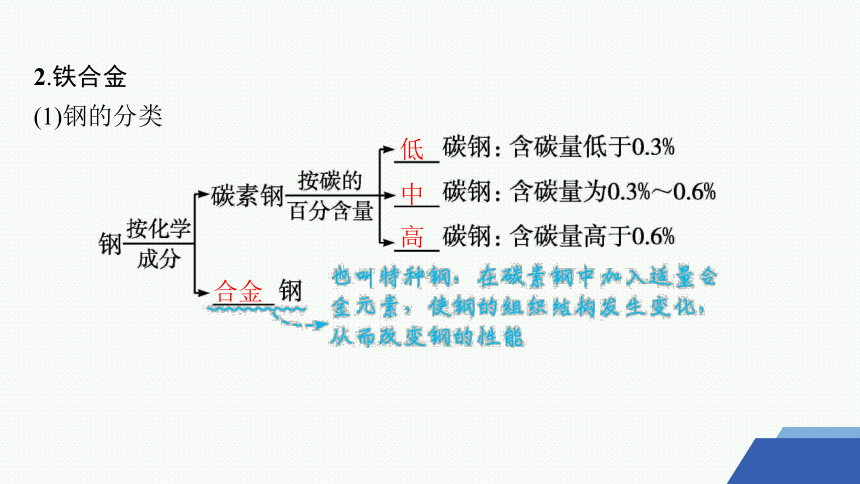
2.铁合金
(1)钢的分类
合金
低
中
高
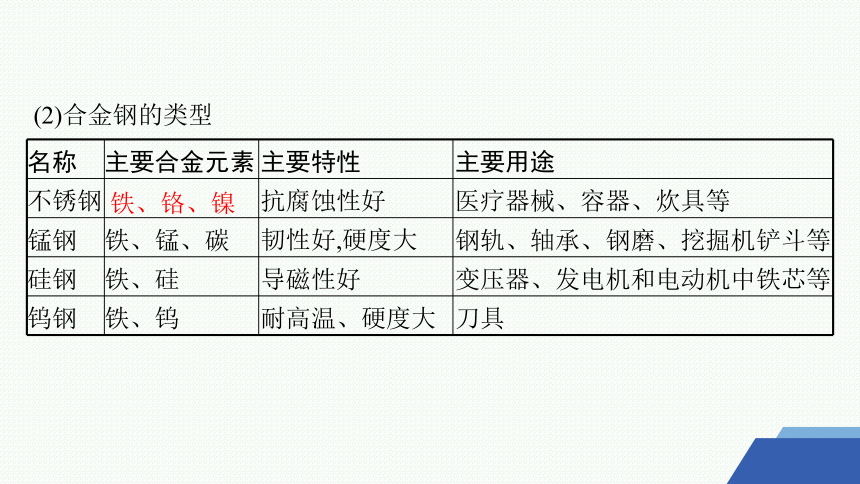
(2)合金钢的类型
名称 主要合金元素 主要特性 主要用途
不锈钢 抗腐蚀性好 医疗器械、容器、炊具等
锰钢 铁、锰、碳 韧性好,硬度大 钢轨、轴承、钢磨、挖掘机铲斗等
硅钢 铁、硅 导磁性好 变压器、发电机和电动机中铁芯等
钨钢 铁、钨 耐高温、硬度大 刀具
铁、铬、镍
二、铝和铝合金
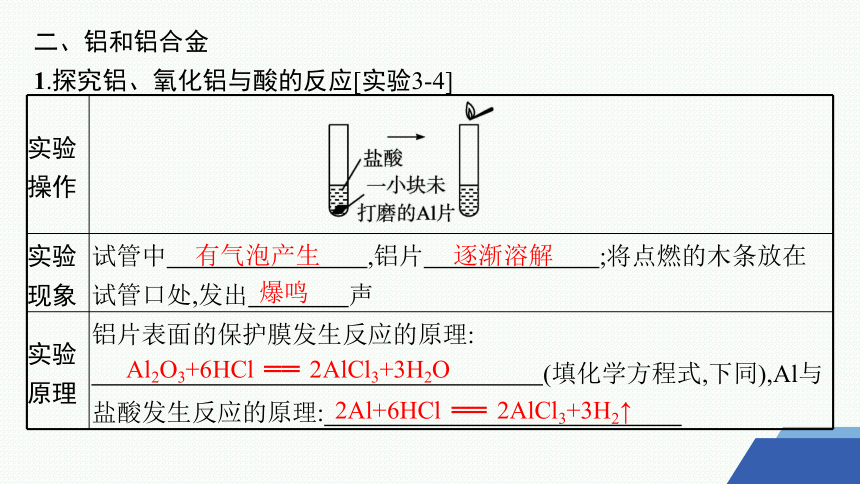
1.探究铝、氧化铝与酸的反应[实验3-4]
实验 操作
实验 现象 试管中 ,铝片 ;将点燃的木条放在试管口处,发出 声
实验 原理 铝片表面的保护膜发生反应的原理:
(填化学方程式,下同),Al与盐酸发生反应的原理:
有气泡产生
逐渐溶解
爆鸣
Al2O3+6HCl ══ 2AlCl3+3H2O
2Al+6HCl ══ 2AlCl3+3H2↑
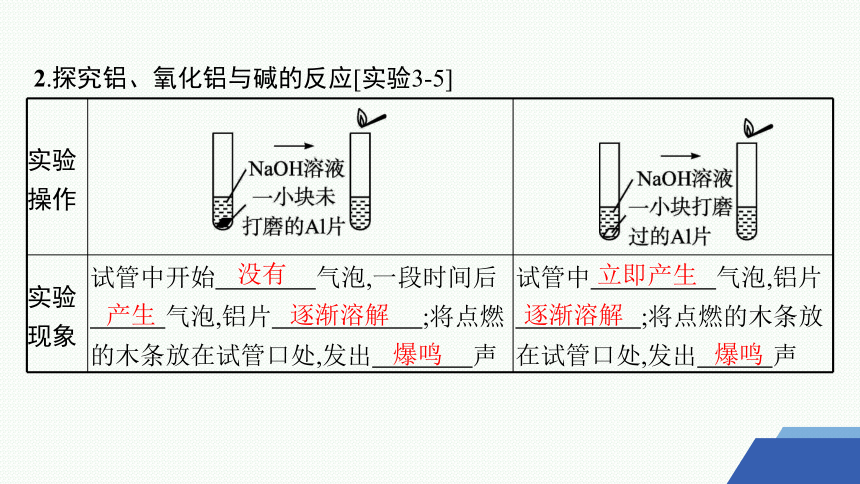
2.探究铝、氧化铝与碱的反应[实验3-5]
实验 操作
实验 现象 试管中开始 气泡,一段时间后 气泡,铝片 ;将点燃的木条放在试管口处,发出 声 试管中 气泡,铝片
;将点燃的木条放在试管口处,发出 声
没有
产生
逐渐溶解
爆鸣
立即产生
逐渐溶解
爆鸣
实验 原理 反应的化学方程式: 、 反应的化学方程式:
实验 结论 铝和氧化铝都既能与盐酸反应,又能与NaOH溶液反应;Al2O3是 氧化物
Al2O3+2NaOH+3H2O══ 2Na[Al(OH)4]
2Al+2NaOH+6H2O══2Na[Al(OH)4] +3H2↑
2Al+2NaOH+6H2O══ 2Na[Al(OH)4] +3H2↑
两性
3.铝合金
(1)纯铝的硬度和强度 ,不适合制造机器零件。向铝中加入少量的合金元素,如 、 、Si、Mn、Zn及稀土元素等,可制成铝合金。
(2)硬铝密度 、强度 ,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
较小
Cu
Mg
小
高
三、新型合金
1.储氢合金
(1)储氢合金是一类能够大量吸收H2,并与H2结合成 的材料。
(2)具有实用价值的储氢合金要求储氢量 、金属氢化物既容易形成,稍稍加热又容易 ,室温下吸、放氢的速率 ,如Ti-Fe合金、La-Ni合金等。
金属氢化物
大
分解
快
2.其他新型合金
合金 名称 主要性质 主要用途
钛合 金 熔点高、密度小、可塑性好、易于加工、机械性能好、抗腐蚀性能强等 广泛用于火箭、导弹、航天飞机、船舶、化工和通信设备等
耐热 合金 高温下具有高的抗氧化性、抗蠕变性与持久强度 主要应用于航空、舰艇、火箭等领域
形状 记忆 合金 在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前的原始形状 在航空航天、临床医疗等领域有着广泛的应用,如宇宙飞船的天线、人造骨骼、心脏修补器、手术缝合线等
归纳总结
关于合金的理解
(1)合金是混合物,但不是其成分的简单混合,而是经高温熔合形成。
(2)并不是所有金属均可熔合形成合金,合金中各成分金属的熔点应相差不大。
(3)合金中一定含有金属元素,可能含有非金属元素,如生铁中含有铁、碳元素。
(4)一般来说,合金中各成分金属仍保持其原有的化学性质。
(5)合金的种类远多于纯金属的种类,合金的用途比纯金属的用途更广泛。
(6)常温下,大多数合金呈固态,但钠钾合金呈液态,常用作原子反应堆的导热剂。
归纳总结
关于铁合金的解读
(1)钢是目前用量最大、用途最广泛的合金。
(2)钢的硬度、韧性与含碳量有关,一般来说,含碳量越高,硬度越大,韧性越差;相反,含碳量越低,硬度越小,韧性越好。
(3)大多数合金钢具有强度、硬度大,可塑性、韧性好,耐磨、耐腐蚀等性能。
(4)向碳素钢中加入不同的合金元素(如Cr、Ni、Mn、Mo、W等),可制得不同性能的合金钢。
教材拓展
(1)铝箔在空气中加热,不燃烧,铝箔只熔化成液体但不滴落,其原因是铝箔表面生成氧化铝的熔点高于被包裹住内层铝的熔点。
(2)Al、Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
归纳总结
(1)Al、Al2O3能与NaOH、KOH等强碱溶液反应,不易与氨水等弱碱发生
反应。
(2)既能与酸反应,又能与碱反应的物质有:①Al、②Al2O3、③弱酸的酸式盐(如NaHCO3)等。
(3)判断两性氧化物的两个要点:①氧化物与酸或碱溶液反应只生成一种盐和水;②发生非氧化还原反应,元素化合价不变。
(4)铝与盐酸、NaOH溶液反应中存在定量关系:2Al~6HCl~3H2↑、2Al~2NaOH~3H2↑,故反应中消耗等量铝,必然产生等量的H2。
归纳总结
(1)氢能是人类未来的理想能源之一,氢能利用存在两大难题——制取和储存。
(2)我国“蛟龙号”载人潜水器的耐压球壳采用钛合金制造。
(3)喷气式飞机的发动机叶片是由镍、铁、碳和钴组成的镍钴合金制造。
深度思考
将镁铝合金投入足量NaOH溶液中,产生什么现象
提示 合金部分溶解,表面产生大量气泡。
易错辨析
(1)对铝制品的表面进行处理,常采用化学方法,如增加膜的厚度、对氧化膜进行着色等。( )
(2)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,其原因是Al和Al2O3都能与酸、碱反应。( )
(3)铝制品使用一段时间后表面变暗,使用砂纸擦除表面氧化膜,对铝制品不产生影响。( )
√
√
×
提示 (3)使用砂纸擦除表面氧化膜,内层铝会被空气中O2氧化,使铝制品逐渐变薄。
重难探究·能力素养全提升
探究一 探究合金的组成及性质
情境探究
2022年11月29日23时08分,搭载神舟十五号载人飞船的“长征二号F遥十五”运载火箭,在甘肃酒泉卫星发射中心点火发射,约10分钟后,进入预定轨道,发射取得圆满成功。11月30日7时33分,神舟十五号3名航天员顺利进驻中国空间站,与神舟十四号航天员乘组首次实现“太空会师”。
我国空间站的建设使用了大量的合金材料,如铝合金材料、镁合金材料、钛合金材料、耐热合金材料等。
(1)我国空间站“天和核心舱”主体建设选择铝合金、镁合金材料,这些材料具有哪些特殊性能
(2)铝合金、镁合金是金属铝、镁与其他金属(或非金属)反应形成的化合物吗
提示 具有密度小、硬度大、强度高、抗腐蚀能力强等特性。
提示 铝合金、镁合金是金属铝、镁与其他金属(或非金属)经高温熔化而形成的具有金属特性的物质,属于混合物,铝、镁仍具有原有的化学性质。
方法突破
名师点拨 (1)并非所有的金属都能形成合金,两种金属形成合金,其熔点不能相差很大;若一种金属的熔点高于另一种金属的沸点,则不能形成合金。
(2)金属与金属(或金属与非金属)形成合金时,要经高温熔合过程,但并非发生化学反应,故合金是混合物,不是化合物。
应用体验
1.[2023陕西榆林高一期末]我国已成功完成某种性能优异的超级钢的研制,这一突破性的科技成果登上了著名学术期刊《科学》杂志。下列关于合金说法正确的是( )
A.用于铸造硬币的合金需耐磨损、抗腐蚀且具有一定的硬度
B.合金中只含有金属元素
C.合金都比纯金属的熔点更高,硬度更大
D.我国最早使用的合金是黄铜
A
解析 铸造硬币的合金需耐磨损、抗腐蚀,具有一定的硬度,A正确;合金中可以含有非金属元素,如钢中含有碳元素,B错误;一般情况下,合金的熔点比纯金属的低,C错误;我国最早使用的合金是青铜,D错误。
2.2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀鞋的冰刀可用不锈钢制成。下列叙述错误的是( )
A.不锈钢是最常见的一种合金钢
B.不锈钢中常添加镍(Ni)和铬(Cr)元素,从而使其具有特殊性能
C.不锈钢中只含有金属元素,不含有非金属元素
D.不锈钢是通过增加原子层之间的相对滑动难度,导致合金的硬度变大
C
解析 不锈钢一般是在普通钢中添加了合金元素镍、铬等,不锈钢中除含有Fe、Ni、Cr等金属元素外,还含碳元素。
探究二 铝与酸、碱、盐溶液的反应及计算
情境探究
管道疏通剂又称管道疏通颗粒,是一种新型厨卫管道深层清洁产品,主要是针对厨卫管道内的油脂、毛发、菜渣、纸棉纤维等各种有机物质造成的堵塞进行疏通。管道疏通剂大致分为两类,一类是固体,主要成分是苛性钠、铝粉;另一类是液体,物理形态是凝胶,主要成分是表面活性剂。
(1)固体管道疏通剂的主要成分是苛性钠、铝粉,使用时发生反应的离子方程式为 。
(2)若每瓶固体管道疏通剂中含有81.0 g铝粉,理论上产生氢气的最大体积(标准状况)为 L。若铝与稀硫酸反应产生相同体积(标准状况)的氢气,消耗5.0 mol·L-1稀硫酸的体积为 L。
2Al+2OH-+6H2O ══ 2[Al(OH)4] -+3H2↑
100.8
0.9
方法突破 铝与酸(盐酸、稀硫酸)、NaOH溶液的反应及定量关系
应用体验
1.[2023江西九江高一期末]甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
A
解析 100 mL 3 mol·L-1的盐酸和NaOH溶液中n(HCl)=n(NaOH)=
0.1 L×3 mol·L-1=0.3 mol,分别加入等质量的铝粉,发生反应:2Al+6HCl ══ 2AlCl3+3H2↑、2Al+2NaOH+6H2O ══ 2Na[Al(OH)4] +3H2↑,若铝粉完全反应,则生成等体积的H2。测得生成的气体体积比为V(甲)∶V(乙)=1∶2,说明盐酸中铝粉剩余,则HCl完全反应,生成的H2的物质的量为0.3 mol× =0.15 mol,从而推知NaOH溶液中生成0.3 mol H2,反应消耗Al的物质的量为0.2 mol,其质量为0.2 mol×27 g·mol-1=5.4 g,故加入铝粉质量为5.4 g。
2.用砂纸仔细打磨铝片后,称取质量均为2.7 g的两块铝片,将其中一铝片迅速放入120 mL 2 mol·L-1 NaOH溶液中,另一铝片在空气中放置一段时间后,再放入等浓度等体积的NaOH溶液中。下列说法不正确的是( )
A.均有氧化还原反应发生
B.消耗NaOH的物质的量相同
C.均有气体生成,且体积相同
D.均有Na[Al(OH)4]生成,且质量相同
C
解析 2.7 g铝的物质的量为0.1 mol,120 mL 2 mol·L-1 NaOH溶液中含NaOH为0.12 L×2 mol·L-1=0.24 mol,二者发生反应:2Al+2NaOH+6H2O ══ 2Na[Al(OH)4] +3H2↑。铝片在空气中放置一段时间,表面被氧化生成Al2O3,放入NaOH溶液中,表面的Al2O3先发生反应,随后Al与NaOH溶液反应,A正确。无论Al还是Al2O3,与NaOH溶液反应均生成Na[Al(OH)4],据Na、Al守恒可知,消耗NaOH的物质的量相等,且生成Na[Al(OH)4]的质量相等,B、D正确。两片铝片与NaOH溶液反应均有H2生成,放置在空气中一段时间的铝片,表面覆有Al2O3,与NaOH溶液反应均生成Na[Al(OH)4],则内层铝与NaOH反应放出H2的体积减小,故两片铝与NaOH溶液反应产生氢气的体积不同,C错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.目前世界上用量最大、用途最广泛的合金是( )
A.铁合金 B.铝合金
C.铜合金 D.钛合金
A
解析 目前世界上用量最大、用途最广泛的合金是钢,属于铁合金。
1
2
3
4
5
2.我国自主研发的新一代动车组在京沪高铁上跑出过486.1 km·h-1的世界列车最高速度,这得益于全路铺设的优质无缝平滑的超长钢轨。下列有关说法不正确的是( )
A.制造钢轨的材料是钢,钢是用量最大的合金
B.在空气中将金属钛、铝混合后熔化可制得铝合金,强度、硬度比铝大
C.在我国使用最早的合金是铜合金
D.不锈钢的合金元素主要是铬和镍
B
解析 钢是用量最大、用途最广泛的合金,属于铁合金,A正确;在空气中将金属钛、铝混合后熔化,钛、铝与空气中O2反应生成相应氧化物,不能制得铝合金,应隔绝空气,B错误;我国使用最早的合金是青铜,是铜锡合金,C正确;不锈钢是一种合金钢,其合金元素主要是铬和镍,D正确。
1
2
3
4
5
1
2
3
4
5
3.[2023湖北十堰高一期末]下列关于铝及其化合物的叙述错误的是( )
A.铝粉和氢氧化钠混合物可用作下水道疏通剂
B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
D.氧化铝熔点高,可用作耐高温材料
B
解析 铝和NaOH遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,故铝粉和氢氧化钠混合物可用作下水道疏通剂,A正确;铝制品在空气中有很强的抗腐蚀性是因为铝在空气中形成了致密的氧化膜,B错误;Al2O3和NaOH溶液反应生成可溶性偏铝酸钠,故可用NaOH溶液除去Fe2O3粉末中少量的Al2O3,C正确;具有高熔点的物质可以用作耐高温材料,氧化铝熔点高,可用作耐高温材料,D正确。
1
2
3
4
5
1
2
3
4
5
4.[2023广东珠海高一调研]我国古代劳动人民对钢铁冶炼技术有重大贡献,其中“灌钢法”是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
C
解析 钢是含碳量低的铁合金,A正确;钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,B正确;由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,C错误;赤铁矿的主要成分是Fe2O3,可用于冶炼铁,D正确。
1
2
3
4
5
1
2
3
4
5
5.合金是重要的金属材料,在生产、生活中有着广泛的应用。
(1)下列物品所使用的主要材料属于合金的是 (填字母)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 。
1
2
3
4
5
(4)黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4 ══ ZnSO4+H2O;CuO+H2SO4 ══ CuSO4+H2O。
①Ⅱ中反应的化学方程式为 。
②下列说法正确的是 (填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
答案 (1)C (2)混合物 (3)黄铜的硬度比纯铜的硬度大
(4)①Zn+H2SO4 ══ ZnSO4+H2↑,Zn+CuSO4 ══ ZnSO4+Cu ②ab
解析 (1)青花瓷瓶使用的主要材料属于无机非金属材料;橡胶充气艇使用的主要材料属于有机高分子材料;不锈钢锅使用的主要材料属于合金。
(3)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜大。
(4)①由于锌排在氢和铜的前面,故锌既可以与酸反应,也可以与硫酸铜反应,反应的化学方程式分别为Zn+H2SO4 ══ ZnSO4+H2↑,Zn+CuSO4 ══ ZnSO4+Cu。②由题中流程可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤除去锌和置换出的铜。因氧化锌的质量大于氧化铜,且锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜。
1
2
3
4
5
本 课 结 束
第三章
第二节 第1课时 铁合金 铝和铝合金 新型合金
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.以铁合金、铝合金为例,能从元素组成上对合金进行分类,并认识不同类型金属材料组成、性能与应用的联系,强化性能决定用途的观念,发展科学态度与社会责任的学科核心素养。
2.通过实验探究铝和氧化铝的性质及转化,认识两性氧化物,丰富对金属多样性的认识,体会实验对认识和研究物质性质的重要作用,发展科学探究与创新意识的学科核心素养。
基础落实·必备知识全过关
一、合金 铁合金
1.合金及特性
(1)含义
合金是由两种或两种以上的金属(或金属与非金属)高温熔合而形成的具有 的混合物。
(2)合金的特点
①一般情况下,合金的硬度比其成分金属的 ,熔点比其成分金属的 。
②一般来说,合金的性能并不是各成分金属性能的总和,合金的物理、化学及机械性能优于各成分金属。
③合金的性能可以通过所添加的合金元素的 、 和生成合金的 等来加以调节。
金属特性
大
低
种类
含量
条件
(3)合金的结构
①在纯金属内加入其他元素形成合金后, 发生了变化,使合金的性能与纯金属相比有很大差异。
②加入其他元素的原子后,改变了金属原子有规则的 排列,使原子层之间的相对滑动变得 ,导致合金的硬度 。
结构
层状
困难
变大
2.铁合金
(1)钢的分类
合金
低
中
高
(2)合金钢的类型
名称 主要合金元素 主要特性 主要用途
不锈钢 抗腐蚀性好 医疗器械、容器、炊具等
锰钢 铁、锰、碳 韧性好,硬度大 钢轨、轴承、钢磨、挖掘机铲斗等
硅钢 铁、硅 导磁性好 变压器、发电机和电动机中铁芯等
钨钢 铁、钨 耐高温、硬度大 刀具
铁、铬、镍
二、铝和铝合金
1.探究铝、氧化铝与酸的反应[实验3-4]
实验 操作
实验 现象 试管中 ,铝片 ;将点燃的木条放在试管口处,发出 声
实验 原理 铝片表面的保护膜发生反应的原理:
(填化学方程式,下同),Al与盐酸发生反应的原理:
有气泡产生
逐渐溶解
爆鸣
Al2O3+6HCl ══ 2AlCl3+3H2O
2Al+6HCl ══ 2AlCl3+3H2↑
2.探究铝、氧化铝与碱的反应[实验3-5]
实验 操作
实验 现象 试管中开始 气泡,一段时间后 气泡,铝片 ;将点燃的木条放在试管口处,发出 声 试管中 气泡,铝片
;将点燃的木条放在试管口处,发出 声
没有
产生
逐渐溶解
爆鸣
立即产生
逐渐溶解
爆鸣
实验 原理 反应的化学方程式: 、 反应的化学方程式:
实验 结论 铝和氧化铝都既能与盐酸反应,又能与NaOH溶液反应;Al2O3是 氧化物
Al2O3+2NaOH+3H2O══ 2Na[Al(OH)4]
2Al+2NaOH+6H2O══2Na[Al(OH)4] +3H2↑
2Al+2NaOH+6H2O══ 2Na[Al(OH)4] +3H2↑
两性
3.铝合金
(1)纯铝的硬度和强度 ,不适合制造机器零件。向铝中加入少量的合金元素,如 、 、Si、Mn、Zn及稀土元素等,可制成铝合金。
(2)硬铝密度 、强度 ,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
较小
Cu
Mg
小
高
三、新型合金
1.储氢合金
(1)储氢合金是一类能够大量吸收H2,并与H2结合成 的材料。
(2)具有实用价值的储氢合金要求储氢量 、金属氢化物既容易形成,稍稍加热又容易 ,室温下吸、放氢的速率 ,如Ti-Fe合金、La-Ni合金等。
金属氢化物
大
分解
快
2.其他新型合金
合金 名称 主要性质 主要用途
钛合 金 熔点高、密度小、可塑性好、易于加工、机械性能好、抗腐蚀性能强等 广泛用于火箭、导弹、航天飞机、船舶、化工和通信设备等
耐热 合金 高温下具有高的抗氧化性、抗蠕变性与持久强度 主要应用于航空、舰艇、火箭等领域
形状 记忆 合金 在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前的原始形状 在航空航天、临床医疗等领域有着广泛的应用,如宇宙飞船的天线、人造骨骼、心脏修补器、手术缝合线等
归纳总结
关于合金的理解
(1)合金是混合物,但不是其成分的简单混合,而是经高温熔合形成。
(2)并不是所有金属均可熔合形成合金,合金中各成分金属的熔点应相差不大。
(3)合金中一定含有金属元素,可能含有非金属元素,如生铁中含有铁、碳元素。
(4)一般来说,合金中各成分金属仍保持其原有的化学性质。
(5)合金的种类远多于纯金属的种类,合金的用途比纯金属的用途更广泛。
(6)常温下,大多数合金呈固态,但钠钾合金呈液态,常用作原子反应堆的导热剂。
归纳总结
关于铁合金的解读
(1)钢是目前用量最大、用途最广泛的合金。
(2)钢的硬度、韧性与含碳量有关,一般来说,含碳量越高,硬度越大,韧性越差;相反,含碳量越低,硬度越小,韧性越好。
(3)大多数合金钢具有强度、硬度大,可塑性、韧性好,耐磨、耐腐蚀等性能。
(4)向碳素钢中加入不同的合金元素(如Cr、Ni、Mn、Mo、W等),可制得不同性能的合金钢。
教材拓展
(1)铝箔在空气中加热,不燃烧,铝箔只熔化成液体但不滴落,其原因是铝箔表面生成氧化铝的熔点高于被包裹住内层铝的熔点。
(2)Al、Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
归纳总结
(1)Al、Al2O3能与NaOH、KOH等强碱溶液反应,不易与氨水等弱碱发生
反应。
(2)既能与酸反应,又能与碱反应的物质有:①Al、②Al2O3、③弱酸的酸式盐(如NaHCO3)等。
(3)判断两性氧化物的两个要点:①氧化物与酸或碱溶液反应只生成一种盐和水;②发生非氧化还原反应,元素化合价不变。
(4)铝与盐酸、NaOH溶液反应中存在定量关系:2Al~6HCl~3H2↑、2Al~2NaOH~3H2↑,故反应中消耗等量铝,必然产生等量的H2。
归纳总结
(1)氢能是人类未来的理想能源之一,氢能利用存在两大难题——制取和储存。
(2)我国“蛟龙号”载人潜水器的耐压球壳采用钛合金制造。
(3)喷气式飞机的发动机叶片是由镍、铁、碳和钴组成的镍钴合金制造。
深度思考
将镁铝合金投入足量NaOH溶液中,产生什么现象
提示 合金部分溶解,表面产生大量气泡。
易错辨析
(1)对铝制品的表面进行处理,常采用化学方法,如增加膜的厚度、对氧化膜进行着色等。( )
(2)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,其原因是Al和Al2O3都能与酸、碱反应。( )
(3)铝制品使用一段时间后表面变暗,使用砂纸擦除表面氧化膜,对铝制品不产生影响。( )
√
√
×
提示 (3)使用砂纸擦除表面氧化膜,内层铝会被空气中O2氧化,使铝制品逐渐变薄。
重难探究·能力素养全提升
探究一 探究合金的组成及性质
情境探究
2022年11月29日23时08分,搭载神舟十五号载人飞船的“长征二号F遥十五”运载火箭,在甘肃酒泉卫星发射中心点火发射,约10分钟后,进入预定轨道,发射取得圆满成功。11月30日7时33分,神舟十五号3名航天员顺利进驻中国空间站,与神舟十四号航天员乘组首次实现“太空会师”。
我国空间站的建设使用了大量的合金材料,如铝合金材料、镁合金材料、钛合金材料、耐热合金材料等。
(1)我国空间站“天和核心舱”主体建设选择铝合金、镁合金材料,这些材料具有哪些特殊性能
(2)铝合金、镁合金是金属铝、镁与其他金属(或非金属)反应形成的化合物吗
提示 具有密度小、硬度大、强度高、抗腐蚀能力强等特性。
提示 铝合金、镁合金是金属铝、镁与其他金属(或非金属)经高温熔化而形成的具有金属特性的物质,属于混合物,铝、镁仍具有原有的化学性质。
方法突破
名师点拨 (1)并非所有的金属都能形成合金,两种金属形成合金,其熔点不能相差很大;若一种金属的熔点高于另一种金属的沸点,则不能形成合金。
(2)金属与金属(或金属与非金属)形成合金时,要经高温熔合过程,但并非发生化学反应,故合金是混合物,不是化合物。
应用体验
1.[2023陕西榆林高一期末]我国已成功完成某种性能优异的超级钢的研制,这一突破性的科技成果登上了著名学术期刊《科学》杂志。下列关于合金说法正确的是( )
A.用于铸造硬币的合金需耐磨损、抗腐蚀且具有一定的硬度
B.合金中只含有金属元素
C.合金都比纯金属的熔点更高,硬度更大
D.我国最早使用的合金是黄铜
A
解析 铸造硬币的合金需耐磨损、抗腐蚀,具有一定的硬度,A正确;合金中可以含有非金属元素,如钢中含有碳元素,B错误;一般情况下,合金的熔点比纯金属的低,C错误;我国最早使用的合金是青铜,D错误。
2.2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀鞋的冰刀可用不锈钢制成。下列叙述错误的是( )
A.不锈钢是最常见的一种合金钢
B.不锈钢中常添加镍(Ni)和铬(Cr)元素,从而使其具有特殊性能
C.不锈钢中只含有金属元素,不含有非金属元素
D.不锈钢是通过增加原子层之间的相对滑动难度,导致合金的硬度变大
C
解析 不锈钢一般是在普通钢中添加了合金元素镍、铬等,不锈钢中除含有Fe、Ni、Cr等金属元素外,还含碳元素。
探究二 铝与酸、碱、盐溶液的反应及计算
情境探究
管道疏通剂又称管道疏通颗粒,是一种新型厨卫管道深层清洁产品,主要是针对厨卫管道内的油脂、毛发、菜渣、纸棉纤维等各种有机物质造成的堵塞进行疏通。管道疏通剂大致分为两类,一类是固体,主要成分是苛性钠、铝粉;另一类是液体,物理形态是凝胶,主要成分是表面活性剂。
(1)固体管道疏通剂的主要成分是苛性钠、铝粉,使用时发生反应的离子方程式为 。
(2)若每瓶固体管道疏通剂中含有81.0 g铝粉,理论上产生氢气的最大体积(标准状况)为 L。若铝与稀硫酸反应产生相同体积(标准状况)的氢气,消耗5.0 mol·L-1稀硫酸的体积为 L。
2Al+2OH-+6H2O ══ 2[Al(OH)4] -+3H2↑
100.8
0.9
方法突破 铝与酸(盐酸、稀硫酸)、NaOH溶液的反应及定量关系
应用体验
1.[2023江西九江高一期末]甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
A
解析 100 mL 3 mol·L-1的盐酸和NaOH溶液中n(HCl)=n(NaOH)=
0.1 L×3 mol·L-1=0.3 mol,分别加入等质量的铝粉,发生反应:2Al+6HCl ══ 2AlCl3+3H2↑、2Al+2NaOH+6H2O ══ 2Na[Al(OH)4] +3H2↑,若铝粉完全反应,则生成等体积的H2。测得生成的气体体积比为V(甲)∶V(乙)=1∶2,说明盐酸中铝粉剩余,则HCl完全反应,生成的H2的物质的量为0.3 mol× =0.15 mol,从而推知NaOH溶液中生成0.3 mol H2,反应消耗Al的物质的量为0.2 mol,其质量为0.2 mol×27 g·mol-1=5.4 g,故加入铝粉质量为5.4 g。
2.用砂纸仔细打磨铝片后,称取质量均为2.7 g的两块铝片,将其中一铝片迅速放入120 mL 2 mol·L-1 NaOH溶液中,另一铝片在空气中放置一段时间后,再放入等浓度等体积的NaOH溶液中。下列说法不正确的是( )
A.均有氧化还原反应发生
B.消耗NaOH的物质的量相同
C.均有气体生成,且体积相同
D.均有Na[Al(OH)4]生成,且质量相同
C
解析 2.7 g铝的物质的量为0.1 mol,120 mL 2 mol·L-1 NaOH溶液中含NaOH为0.12 L×2 mol·L-1=0.24 mol,二者发生反应:2Al+2NaOH+6H2O ══ 2Na[Al(OH)4] +3H2↑。铝片在空气中放置一段时间,表面被氧化生成Al2O3,放入NaOH溶液中,表面的Al2O3先发生反应,随后Al与NaOH溶液反应,A正确。无论Al还是Al2O3,与NaOH溶液反应均生成Na[Al(OH)4],据Na、Al守恒可知,消耗NaOH的物质的量相等,且生成Na[Al(OH)4]的质量相等,B、D正确。两片铝片与NaOH溶液反应均有H2生成,放置在空气中一段时间的铝片,表面覆有Al2O3,与NaOH溶液反应均生成Na[Al(OH)4],则内层铝与NaOH反应放出H2的体积减小,故两片铝与NaOH溶液反应产生氢气的体积不同,C错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.目前世界上用量最大、用途最广泛的合金是( )
A.铁合金 B.铝合金
C.铜合金 D.钛合金
A
解析 目前世界上用量最大、用途最广泛的合金是钢,属于铁合金。
1
2
3
4
5
2.我国自主研发的新一代动车组在京沪高铁上跑出过486.1 km·h-1的世界列车最高速度,这得益于全路铺设的优质无缝平滑的超长钢轨。下列有关说法不正确的是( )
A.制造钢轨的材料是钢,钢是用量最大的合金
B.在空气中将金属钛、铝混合后熔化可制得铝合金,强度、硬度比铝大
C.在我国使用最早的合金是铜合金
D.不锈钢的合金元素主要是铬和镍
B
解析 钢是用量最大、用途最广泛的合金,属于铁合金,A正确;在空气中将金属钛、铝混合后熔化,钛、铝与空气中O2反应生成相应氧化物,不能制得铝合金,应隔绝空气,B错误;我国使用最早的合金是青铜,是铜锡合金,C正确;不锈钢是一种合金钢,其合金元素主要是铬和镍,D正确。
1
2
3
4
5
1
2
3
4
5
3.[2023湖北十堰高一期末]下列关于铝及其化合物的叙述错误的是( )
A.铝粉和氢氧化钠混合物可用作下水道疏通剂
B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
D.氧化铝熔点高,可用作耐高温材料
B
解析 铝和NaOH遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,故铝粉和氢氧化钠混合物可用作下水道疏通剂,A正确;铝制品在空气中有很强的抗腐蚀性是因为铝在空气中形成了致密的氧化膜,B错误;Al2O3和NaOH溶液反应生成可溶性偏铝酸钠,故可用NaOH溶液除去Fe2O3粉末中少量的Al2O3,C正确;具有高熔点的物质可以用作耐高温材料,氧化铝熔点高,可用作耐高温材料,D正确。
1
2
3
4
5
1
2
3
4
5
4.[2023广东珠海高一调研]我国古代劳动人民对钢铁冶炼技术有重大贡献,其中“灌钢法”是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
C
解析 钢是含碳量低的铁合金,A正确;钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,B正确;由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,C错误;赤铁矿的主要成分是Fe2O3,可用于冶炼铁,D正确。
1
2
3
4
5
1
2
3
4
5
5.合金是重要的金属材料,在生产、生活中有着广泛的应用。
(1)下列物品所使用的主要材料属于合金的是 (填字母)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 。
1
2
3
4
5
(4)黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4 ══ ZnSO4+H2O;CuO+H2SO4 ══ CuSO4+H2O。
①Ⅱ中反应的化学方程式为 。
②下列说法正确的是 (填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
答案 (1)C (2)混合物 (3)黄铜的硬度比纯铜的硬度大
(4)①Zn+H2SO4 ══ ZnSO4+H2↑,Zn+CuSO4 ══ ZnSO4+Cu ②ab
解析 (1)青花瓷瓶使用的主要材料属于无机非金属材料;橡胶充气艇使用的主要材料属于有机高分子材料;不锈钢锅使用的主要材料属于合金。
(3)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜大。
(4)①由于锌排在氢和铜的前面,故锌既可以与酸反应,也可以与硫酸铜反应,反应的化学方程式分别为Zn+H2SO4 ══ ZnSO4+H2↑,Zn+CuSO4 ══ ZnSO4+Cu。②由题中流程可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤除去锌和置换出的铜。因氧化锌的质量大于氧化铜,且锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜。
1
2
3
4
5
本 课 结 束
