4.1.3 原子结构与元素的性质 课件(共56张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 4.1.3 原子结构与元素的性质 课件(共56张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览







文档简介
(共56张PPT)
第四章
第一节 第3课时 原子结构与元素的性质
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.以第ⅠA族和第ⅦA族元素为例,探究认识同主族元素性质的递变规律,并能用原子结构理论初步加以解释,发展科学探究与创新意识的学科核心素养。
2.通过认识原子结构与元素性质的关系,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、碱金属元素
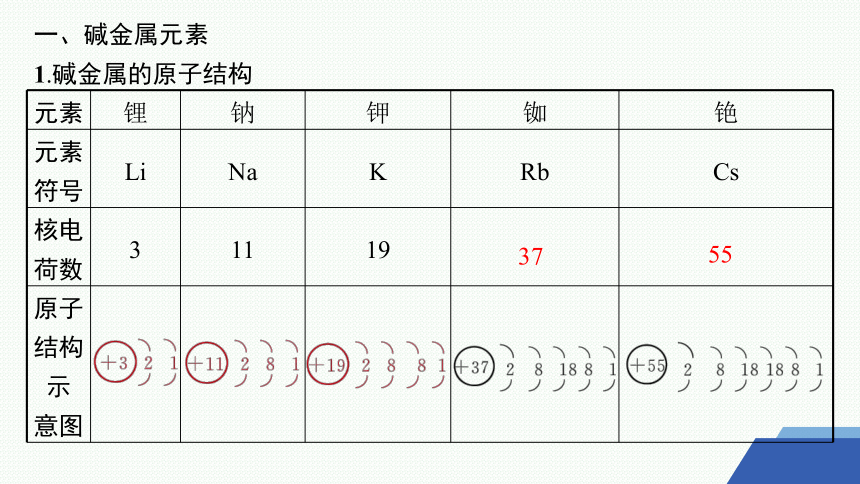
1.碱金属的原子结构
元素 锂 钠 钾 铷 铯
元素符号 Li Na K Rb Cs
核电荷数 3 11 19
原子结构示 意图
37
55
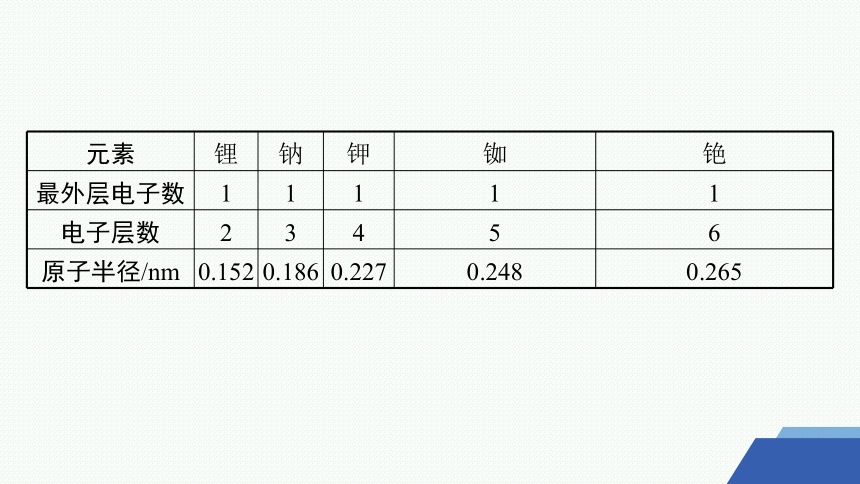
元素 锂 钠 钾 铷 铯
最外层电子数 1 1 1 1 1
电子层数 2 3 4 5 6
原子半径/nm 0.152 0.186 0.227 0.248 0.265
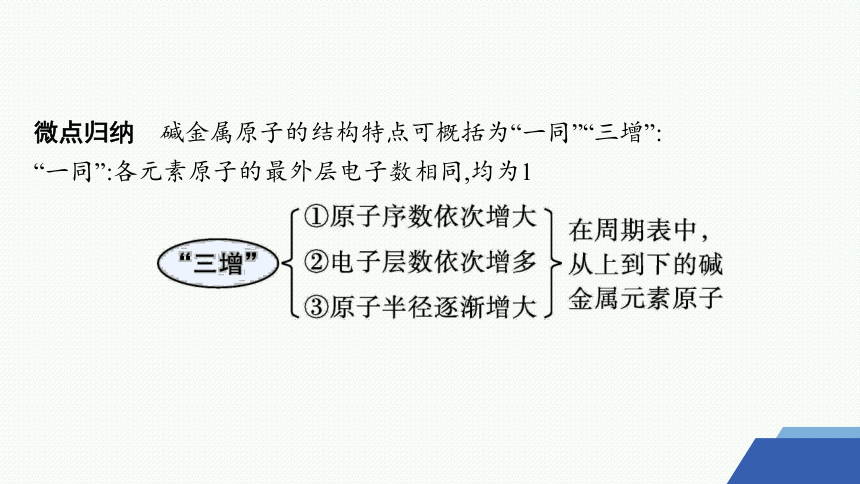
微点归纳 碱金属原子的结构特点可概括为“一同”“三增”:
“一同”:各元素原子的最外层电子数相同,均为1
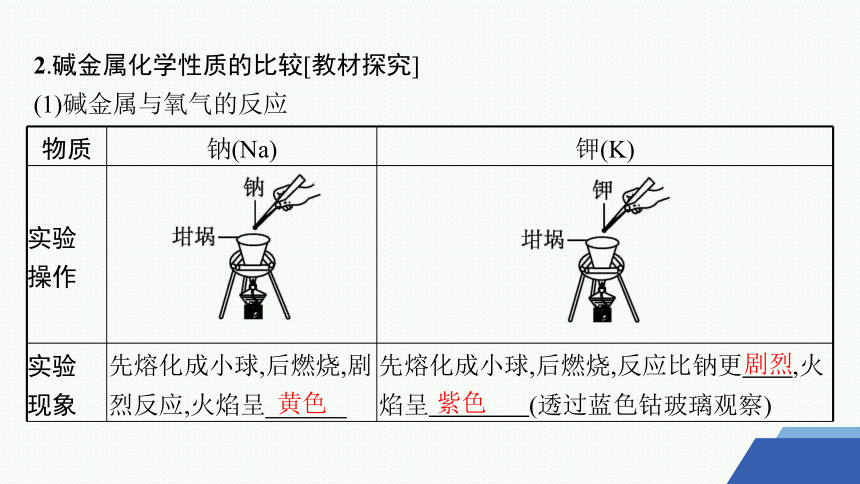
2.碱金属化学性质的比较[教材探究]
(1)碱金属与氧气的反应
物质 钠(Na) 钾(K)
实验 操作
实验 现象 先熔化成小球,后燃烧,剧烈反应,火焰呈 先熔化成小球,后燃烧,反应比钠更 ,火焰呈 (透过蓝色钴玻璃观察)
黄色
剧烈
紫色
物质 钠(Na) 钾(K)
结论 金属性:K (填“>”或“<”)Na
实验 原理 (反应放热) K+O2 KO2(超氧化钾)(反应放热)
>
2Na+O2 Na2O2
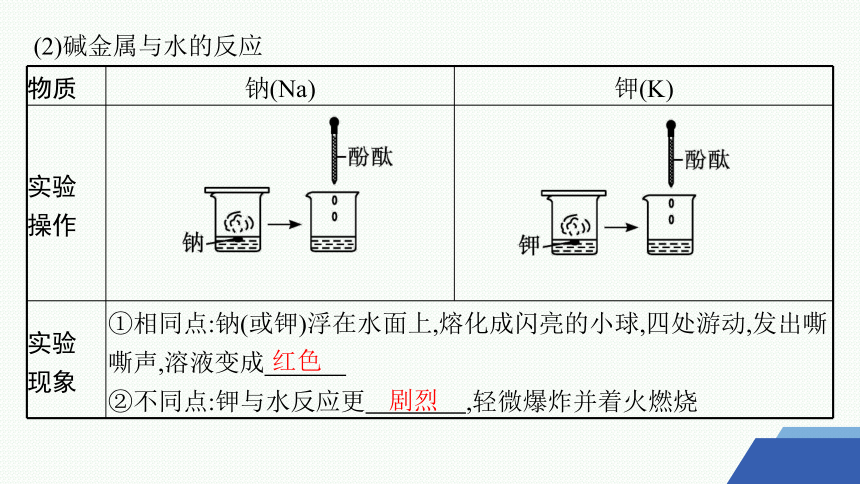
(2)碱金属与水的反应
物质 钠(Na) 钾(K)
实验 操作
实验 现象 ①相同点:钠(或钾)浮在水面上,熔化成闪亮的小球,四处游动,发出嘶嘶声,溶液变成 ②不同点:钾与水反应更 ,轻微爆炸并着火燃烧
红色
剧烈
物质 钠(Na) 钾(K)
结论 ①与水反应的剧烈程度:K (填“>”或“<”,下同)Na ②金属性:K Na
实验 原理
>
>
2Na+2H2O ══ 2NaOH+H2↑
2K+2H2O ══ 2KOH+H2↑
3.碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相似性 除铯外,其余都呈 色,它们都比较软,有延展性,密度较
,熔点较 ,导电、导热性强
递变 规律 密度 逐渐 (钠、钾反常)
熔点 逐渐
沸点 逐渐降低
个性 特点 ①铯略带金色光泽;②锂的密度比煤油的小;③钠的密度比钾的大
银白
小
低
增大
降低
二、卤族元素
1.卤素单质的物理性质
物质 F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 色液体 色固体
密度 从F2→I2,密度逐渐
熔点、沸点 从F2→I2,熔点、沸点逐渐
深红棕
紫黑
增大
升高
2.卤族元素的原子结构
元素 F Cl Br I
原子结构 示意图
结构 特点 相同点 原子最外层都有 个电子
递变性 从F→I,随着核电荷数的递增,电子层数逐渐 ,原子半径逐渐
7
增多
增大
3.卤素单质的化学性质
(1)卤素单质与H2的反应
物质 反应条件 化学方程式 产物稳定性
F2 暗处 很稳定
Cl2 光照或点燃 较稳定
Br2 加热 不如氯化氢稳定
I2 不断加热 不稳定
结论 从F2到I2,与H2反应所需要的条件逐渐 ,反应剧烈程度依次 ,生成气态氢化物的稳定性依次
H2+F2 ══ 2HF
H2+Cl2 2HCl
H2+Br2 2HBr
H2+I2 2HI
升高
减弱
减弱
(2)卤素单质间的置换反应[实验4-1]
实验操作 实验现象 化学方程式
静置后,液体呈橙色
静置后,液体呈褐色
Cl2+2NaBr ══ Br2+2NaCl
Cl2+2KI ══ I2+2KCl
实验操作 实验现象 化学方程式
静置后,液体呈褐色
实验结论 ①从Cl2→I2,随着核电荷数的增加,卤素单质的氧化性逐渐 ,对应卤素离子的还原性逐渐 ; ②卤素的非金属性:Cl>Br>I
Br2+2KI ══ I2+2KBr
减弱
增强
4.同主族元素性质的递变规律
在元素周期表中,同主族元素从上到下原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,故金属性逐渐 ,非金属性逐渐 。
增多
增大
增强
减弱
增强
减弱
概念辨析
元素的金属性和非金属性
(1)金属性是指元素原子失去电子的性质(或能力),非金属性是指元素原子得到电子的性质(或能力)。
(2)金属元素的原子最外层电子一般少于4个,在反应中易失去电子,具有金属性。
(3)非金属元素的原子最外层电子一般多于4个,在反应中易得到电子,具有非金属性。
(4)金属性和非金属性与得失电子的数目无关,与得失电子的难易程度有关。
归纳总结
碱金属与氧气的反应及分析
(1)在碱金属中,Li与O2反应的产物只有Li2O。
(2)碱金属与O2反应的产物不相同,越活泼产物越复杂:Na与O2在常温下生成Na2O,燃烧时生成Na2O2;K燃烧时生成KO2;Rb、Cs燃烧时生成更复杂的氧化物。
归纳总结
碱金属与水反应的规律
(1)碱金属均与H2O反应生成相应的碱和H2:2R+2H2O ══ 2ROH+H2↑(R=碱金属)。
(2)从Li到Cs,与水反应越来越剧烈,Rb、Cs遇水甚至发生爆炸。
(3)碱金属都不能从盐溶液中置换出金属来。
(4)碱金属的最高价氧化物对应水化物中,只有LiOH微溶,其他均为易溶于水的强碱。
易错提醒
(1)单质Na、K通常保存在煤油或石蜡油中,Li通常用固体石蜡密封。
(2)从Li到Cs,碱金属单质的密度呈增大趋势,K出现反常。
易错辨析
(1)金属锂、钠在空气中燃烧均生成相应的过氧化物。( )
(2)碱金属与水反应都生成相应碱和H2,可用通式表示为2R+2H2O ══ 2ROH+H2↑(R代表碱金属元素)。( )
(3)铷和铯的反应更剧烈,遇到空气或水都会立即燃烧,遇水甚至会爆炸。
( )
(4)从锂到铯,电子层数增多,原子半径增大,碱金属元素的金属性逐渐增强。
( )
×
√
√
√
提示 (1)锂的金属性较弱,在空气中燃烧生成Li2O。
教材拓展
卤素单质的物理特性
(1)Cl2易液化,液溴易挥发,碘易升华。
(2)Cl2、Br2、I2都易溶于苯、CCl4等有机溶剂中。
(3)淀粉遇I2显蓝色,故可用淀粉溶液检验I2的存在。
(4)保存液溴时,要盛放在棕色细口瓶中,并加水水封,暗处避光保存。
归纳总结
卤素单质的化学性质及分析
(1)常温下,卤素单质与水反应生成氢卤酸和次卤酸:X2+H2O ══ HX+HXO(X=Cl、Br、I),但F2与H2O发生反应:2F2+2H2O ══ 4HF+O2。
(2)变价金属(Fe、Cu)与卤素单质反应生成高价态金属卤化物:2Fe+3X2 ══ 2FeX3(X=F、Cl、Br),但I2的氧化性较弱,与Fe反应生成FeI2。
(3)卤素单质之间可以发生置换反应,较活泼的卤素单质可以将较不活泼的卤素单质从其盐溶液中置换出来,但F2除外。
(4)HF是弱酸,HCl、HBr、HI都是强酸,且酸性:HF深度思考
(1)K的金属性强于Na,将金属K投入NaCl溶液中能否置换出Na 为什么
(2)对于卤族元素,非金属性越强,对应氢化物的酸性越强吗
提示 不能;K和Na都是活泼金属,都与水剧烈反应生成碱和H2。
提示 不是;卤素的非金属性越强,其氢化物的稳定性越强,酸性反而越弱。
重难探究·能力素养全提升
探究一 碱金属元素性质的相似性和递变性
情境探究
中国北斗卫星导航系统(BDS)是中国自行研制的全球卫星导航系统,是继GPS、GLONASS之后的第三个成熟的卫星导航系统,北斗卫星导航系统发展离不开精准的时间频率体系。目前我国研制并正在使用的铯原子喷泉钟,测量精度可以达到3 000万年不差一秒。
铯(Cs)原子喷泉钟
(1)铯(Cs)与钠、钾属于同族元素,其单质与水剧烈反应,甚至爆炸,所得溶液使酚酞显 色,反应的化学方程式为 。
(2)单质的还原性:Na (填“>”或“<”,下同)Cs;离子的氧化性:
Na+ Cs+。
红
2Cs+2H2O ══ 2CsOH+H2↑
<
>
方法突破
碱金属单质
化学性质的
相似性和
递变性
应用体验
1.下列有关碱金属元素性质的递变规律不正确的是( )
A.Na、K、Rb、Cs单质的失电子能力逐渐增强
B.Na、K、Rb、Cs的原子半径依次增大
C.NaOH、KOH、RbOH、CsOH碱性依次增强
D.Na、K、Rb、Cs最外层电子数依次增多
D
解析 Na、K、Rb、Cs电子层数依次增多,原子半径依次增大,则Na、K、Rb、Cs单质的失电子能力逐渐增强,对应碱的碱性逐渐增强,A、B、C均正确;Na、K、Rb、Cs原子的最外层电子数均为1,D错误。
2.[2023陕西汉中高一期末]下列对碱金属的叙述正确的是( )
①K通常保存在煤油中以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最弱的是锂
④碱金属阳离子中氧化性最强的是Li+
⑤碱金属的原子半径随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越低
A.①③④⑤ B.②③⑤⑥
C.①②③④ D.①④⑤⑥
A
解析 钾和空气中的水蒸气、氧气等发生反应,金属钾密度比煤油大,所以钾通常保存在煤油中以隔绝与空气的接触,①正确;碱金属的活泼性较强,会和皮肤中的水反应生成碱,具有强腐蚀性,故取用时不能直接用手拿,②错误;依据同主族元素性质递变规律,碱金属中还原性最弱的是锂,③正确;元素金属性越弱,对应阳离子的氧化性越强,所以碱金属阳离子中氧化性最强的是Li+,④正确;同主族元素原子的最外层电子数相同,电子层数逐渐增多,随着核电荷数的增大,碱金属的原子半径逐渐增大,⑤正确;从Li到Cs,碱金属的熔、沸点逐渐降低,密度呈增大趋势,钾反常,⑥错误。
探究二 卤族元素化学性质的相似性和递变性
情境探究
某研究性学习小组通过实验探究卤素的化学性质:
[实验1]分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。
[实验2]向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。
(1)实验1中,向KBr溶液中加入氯水,溶液由无色变为橙红色;向KI溶液中加入氯水,溶液由无色变为褐色;上述颜色变化的原因是什么 写出反应的离子方程式。
提示 Cl2与KBr反应生成Br2,溴水的颜色为橙红色,比氯水颜色深,离子方程式为Cl2+2Br- ══ Br2+2Cl-。Cl2与KI反应生成I2,碘水的颜色为褐色,比氯水颜色深,离子方程式为Cl2+2I- ══ I2+2Cl-。
(2)实验2中,向KI溶液中加入溴水,溶液变为褐色,该反应中颜色变化的原因是什么 写出反应的离子方程式。
(3)通过上述实验,你能得出Cl2、Br2、I2氧化性强弱顺序是什么 Cl、Br、I非金属性强弱顺序是什么
提示 Br2与KI反应生成I2,碘水的颜色为褐色,比溴水的颜色深,离子方程式为Br2+2I- ══ I2+2Br-。
提示 氧化性强弱顺序:Cl2>Br2>I2;非金属性强弱顺序:Cl>Br>I。
方法突破 卤族元素化学性质的相似性和递变性
应用体验
下列有关F、Cl、Br、I四种元素的说法错误的是( )
A.随着原子序数的增大,单质的颜色逐渐加深
B.随着原子序数的增大,单质的熔、沸点逐渐升高
C.气态氢化物稳定性:HFD.氢化物还原性:HFC
解析 F、Cl、Br、I的非金属性逐渐减弱,则气态氢化物的稳定性逐渐减弱,则稳定性:HF>HCl>HBr>HI,C错误;一般来说,元素的非金属性越强,单质的氧化性越强,氢化物的还原性越弱,故氢化物的还原性:HF探究三 认识同主族元素性质的相似性和递变性
情境探究
元素周期表是化学史上的伟大创举。右图是“国际化学元素周期表年”发行的纪念邮票之一,门捷列夫周期表上留下的空位元素“类铝”由法国化学家布瓦博德朗1875年在巴黎发现,并命名为“镓(Ga)”。Ga与B、Al元素是同族元素,处于元素周期表的第四周期。
(1)根据Ga和B、Al元素在周期表中的位置,推测三种元素的金属性强弱。
提示 金属性:B(2)镓和铝的化学性质相似,试写出镓单质与稀盐酸、NaOH溶液反应的化学方程式。
提示 2Ga+6HCl ══ 2GaCl3+3H2↑、2Ga+2NaOH+6H2O ══ 2Na[Ga(OH)4] +3H2↑。
方法突破
1.同主族元素的性质与原子结构的关系
2.同主族元素的原子结构与元素性质的递变规律
原子结构或元素性质 递变规律(从上到下)
原子结构 电子层数 逐渐增多
原子半径 逐渐增大
元素性质 金属性 逐渐增强
非金属性 逐渐减弱
单质性质 还原性 逐渐增强
氧化性 逐渐减弱
氢化物 稳定性 逐渐减弱
还原性 逐渐增强
最高价氧化物对应水化物 碱性 逐渐增强
酸性 逐渐减弱
应用体验
1.门捷列夫研究元素周期表时,科学地预测了铝的下方有一种与铝类似的“类铝”元素,1875年法国化学家布瓦博德朗发现了这种元素,命名为“镓(Ga)”,它的性质和门捷列夫的预测相吻合。镓与铝是同主族元素,下列叙述不正确的是( )
A.镓的金属性比铝的强
B.镓的原子半径比铝的小
C.镓原子的最外层有3个电子
D.氧化镓的化学式是Ga2O3
B
解析 镓和铝是同主族元素,镓位于铝的下方,同主族元素从上到下,元素的金属性逐渐增强,则镓的金属性比铝的强。镓原子比铝原子多1个电子层,镓的原子半径比铝的大。镓和铝是同主族元素,则镓原子的最外层也有3个电子。镓原子的最外层有3个电子,形成化合物时显+3价,则氧化镓的化学式为Ga2O3。
2.[2023辽宁锦州高一期末]已知锶(Sr)元素位于周期表中第五周期第ⅡA族,结合同族元素性质的递变规律判断,下列有关Sr的说法不正确的是
( )
A.最高化合价为+2价
B 的中子数为38
C.Sr的原子半径大于Ca原子
D.最高价氧化物对应水化物为强碱
B
解析 Sr处于第ⅡA族,原子最外层有2个电子,Sr原子半径比较大,容易失去最外层电子,故最高化合价为+2价,A正确 的质子数为38,质量数为88,故 的中子数为88-38=50,B错误;根据同主族原子半径递变规律,Sr的原子半径大于Ca原子,C正确;由于金属性:Be学以致用·随堂检测全达标
1
2
3
4
5
1.下列元素中,金属性最强的是( )
A.Li B.Na C.K D.Rb
D
解析 碱金属元素自上而下,元素的金属性逐渐增强,即金属性:Li1
2
3
4
5
2.[2023四川学业水平考试]按F2、Cl2、Br2、I2顺序,下列说法错误的是
( )
A.颜色由深变浅
B.氧化性逐渐减弱
C.与氢气化合由易变难
D.密度逐渐增大
A
解析 F2是淡黄绿色气体,Cl2是黄绿色气体,Br2是深红棕色液体,I2是紫黑色固体,可见按F2、Cl2、Br2、I2顺序,物质颜色由浅变深,A错误;F2、Cl2、Br2、I2是同一主族元素的单质,由于从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,故卤素单质的氧化性逐渐减弱,B正确;F2、Cl2、Br2、I2的氧化性逐渐减弱,单质的氧化性越弱,其与H2化合的能力逐渐减弱,故与氢气化合由易变难,C正确;F2、Cl2是气体物质,Br2是液态物质,而I2是固体物质,故卤素单质的密度逐渐增大,D正确。
1
2
3
4
5
1
2
3
4
5
3.下列有关碱金属元素和卤素的说法错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随着核电荷数的增加,碱金属元素和卤素单质的熔、沸点都逐渐降低
D
解析 Br2的氧化性强于I2,则Br2与H2的反应更剧烈,A正确;碱金属中Li原子半径最小,原子核对最外层电子引力强,失电子能力最弱,卤素中F原子半径最小,原子核对最外层电子引力强,得电子能力最强,B正确;K的活泼性强于Na,则K与水反应更剧烈,C正确;随着核电荷数的增加,碱金属元素单质的熔、沸点逐渐降低,卤素单质的熔、沸点逐渐升高,D错误。
1
2
3
4
5
1
2
3
4
5
4.[2023河北保定高一期末]已知:34Se(硒)与S为同族元素。下列说法错误的是( )
A.Se原子核外最外层有6个电子
B.H2Se的稳定性比H2O弱
C.原子半径:Se>S
D.非金属性:Se>S
D
解析 同主族元素最外层电子数相同,Se原子核外最外层有6个电子,A正确;非金属性:SeS,C正确。
1
2
3
4
5
5.部分碱金属元素和卤族元素在周期表中的位置如图所示。
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
一 ①
二 ② ⑤
三 ③ ⑥
四 ④ ⑦
结合以上信息回答下列问题:
(1)表中元素 (填写元素符号,下同)的非金属性最强,元素
的金属性最强,元素 的单质在室温下呈液态。
(2)表中元素③的原子结构示意图是 。
(3)表中元素⑥、⑦氢化物的稳定性顺序为 > (填写化学式)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的化学式为 。
1
2
3
4
5
1
2
3
4
5
答案 (1)F K Br (2) (3)HCl HBr (4)HClO4
解析 (1)据元素周期表中同主族元素性质递变规律可知,F的非金属性最强,K的金属性最强,单质在室温下呈液态的是Br2。
(2)元素③为Na,原子结构示意图为 。
(3)元素⑥、⑦分别为Cl、Br,其非金属性:Cl>Br,故氢化物的稳定性: HCl>HBr。
(4)F无正化合价,最高价氧化物对应水化物酸性最强的酸是HClO4。
本 课 结 束
更多精彩内容请登录 志鸿优化网
http://www.zhyh.org/
第四章
第一节 第3课时 原子结构与元素的性质
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.以第ⅠA族和第ⅦA族元素为例,探究认识同主族元素性质的递变规律,并能用原子结构理论初步加以解释,发展科学探究与创新意识的学科核心素养。
2.通过认识原子结构与元素性质的关系,培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、碱金属元素
1.碱金属的原子结构
元素 锂 钠 钾 铷 铯
元素符号 Li Na K Rb Cs
核电荷数 3 11 19
原子结构示 意图
37
55
元素 锂 钠 钾 铷 铯
最外层电子数 1 1 1 1 1
电子层数 2 3 4 5 6
原子半径/nm 0.152 0.186 0.227 0.248 0.265
微点归纳 碱金属原子的结构特点可概括为“一同”“三增”:
“一同”:各元素原子的最外层电子数相同,均为1
2.碱金属化学性质的比较[教材探究]
(1)碱金属与氧气的反应
物质 钠(Na) 钾(K)
实验 操作
实验 现象 先熔化成小球,后燃烧,剧烈反应,火焰呈 先熔化成小球,后燃烧,反应比钠更 ,火焰呈 (透过蓝色钴玻璃观察)
黄色
剧烈
紫色
物质 钠(Na) 钾(K)
结论 金属性:K (填“>”或“<”)Na
实验 原理 (反应放热) K+O2 KO2(超氧化钾)(反应放热)
>
2Na+O2 Na2O2
(2)碱金属与水的反应
物质 钠(Na) 钾(K)
实验 操作
实验 现象 ①相同点:钠(或钾)浮在水面上,熔化成闪亮的小球,四处游动,发出嘶嘶声,溶液变成 ②不同点:钾与水反应更 ,轻微爆炸并着火燃烧
红色
剧烈
物质 钠(Na) 钾(K)
结论 ①与水反应的剧烈程度:K (填“>”或“<”,下同)Na ②金属性:K Na
实验 原理
>
>
2Na+2H2O ══ 2NaOH+H2↑
2K+2H2O ══ 2KOH+H2↑
3.碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相似性 除铯外,其余都呈 色,它们都比较软,有延展性,密度较
,熔点较 ,导电、导热性强
递变 规律 密度 逐渐 (钠、钾反常)
熔点 逐渐
沸点 逐渐降低
个性 特点 ①铯略带金色光泽;②锂的密度比煤油的小;③钠的密度比钾的大
银白
小
低
增大
降低
二、卤族元素
1.卤素单质的物理性质
物质 F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 色液体 色固体
密度 从F2→I2,密度逐渐
熔点、沸点 从F2→I2,熔点、沸点逐渐
深红棕
紫黑
增大
升高
2.卤族元素的原子结构
元素 F Cl Br I
原子结构 示意图
结构 特点 相同点 原子最外层都有 个电子
递变性 从F→I,随着核电荷数的递增,电子层数逐渐 ,原子半径逐渐
7
增多
增大
3.卤素单质的化学性质
(1)卤素单质与H2的反应
物质 反应条件 化学方程式 产物稳定性
F2 暗处 很稳定
Cl2 光照或点燃 较稳定
Br2 加热 不如氯化氢稳定
I2 不断加热 不稳定
结论 从F2到I2,与H2反应所需要的条件逐渐 ,反应剧烈程度依次 ,生成气态氢化物的稳定性依次
H2+F2 ══ 2HF
H2+Cl2 2HCl
H2+Br2 2HBr
H2+I2 2HI
升高
减弱
减弱
(2)卤素单质间的置换反应[实验4-1]
实验操作 实验现象 化学方程式
静置后,液体呈橙色
静置后,液体呈褐色
Cl2+2NaBr ══ Br2+2NaCl
Cl2+2KI ══ I2+2KCl
实验操作 实验现象 化学方程式
静置后,液体呈褐色
实验结论 ①从Cl2→I2,随着核电荷数的增加,卤素单质的氧化性逐渐 ,对应卤素离子的还原性逐渐 ; ②卤素的非金属性:Cl>Br>I
Br2+2KI ══ I2+2KBr
减弱
增强
4.同主族元素性质的递变规律
在元素周期表中,同主族元素从上到下原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,故金属性逐渐 ,非金属性逐渐 。
增多
增大
增强
减弱
增强
减弱
概念辨析
元素的金属性和非金属性
(1)金属性是指元素原子失去电子的性质(或能力),非金属性是指元素原子得到电子的性质(或能力)。
(2)金属元素的原子最外层电子一般少于4个,在反应中易失去电子,具有金属性。
(3)非金属元素的原子最外层电子一般多于4个,在反应中易得到电子,具有非金属性。
(4)金属性和非金属性与得失电子的数目无关,与得失电子的难易程度有关。
归纳总结
碱金属与氧气的反应及分析
(1)在碱金属中,Li与O2反应的产物只有Li2O。
(2)碱金属与O2反应的产物不相同,越活泼产物越复杂:Na与O2在常温下生成Na2O,燃烧时生成Na2O2;K燃烧时生成KO2;Rb、Cs燃烧时生成更复杂的氧化物。
归纳总结
碱金属与水反应的规律
(1)碱金属均与H2O反应生成相应的碱和H2:2R+2H2O ══ 2ROH+H2↑(R=碱金属)。
(2)从Li到Cs,与水反应越来越剧烈,Rb、Cs遇水甚至发生爆炸。
(3)碱金属都不能从盐溶液中置换出金属来。
(4)碱金属的最高价氧化物对应水化物中,只有LiOH微溶,其他均为易溶于水的强碱。
易错提醒
(1)单质Na、K通常保存在煤油或石蜡油中,Li通常用固体石蜡密封。
(2)从Li到Cs,碱金属单质的密度呈增大趋势,K出现反常。
易错辨析
(1)金属锂、钠在空气中燃烧均生成相应的过氧化物。( )
(2)碱金属与水反应都生成相应碱和H2,可用通式表示为2R+2H2O ══ 2ROH+H2↑(R代表碱金属元素)。( )
(3)铷和铯的反应更剧烈,遇到空气或水都会立即燃烧,遇水甚至会爆炸。
( )
(4)从锂到铯,电子层数增多,原子半径增大,碱金属元素的金属性逐渐增强。
( )
×
√
√
√
提示 (1)锂的金属性较弱,在空气中燃烧生成Li2O。
教材拓展
卤素单质的物理特性
(1)Cl2易液化,液溴易挥发,碘易升华。
(2)Cl2、Br2、I2都易溶于苯、CCl4等有机溶剂中。
(3)淀粉遇I2显蓝色,故可用淀粉溶液检验I2的存在。
(4)保存液溴时,要盛放在棕色细口瓶中,并加水水封,暗处避光保存。
归纳总结
卤素单质的化学性质及分析
(1)常温下,卤素单质与水反应生成氢卤酸和次卤酸:X2+H2O ══ HX+HXO(X=Cl、Br、I),但F2与H2O发生反应:2F2+2H2O ══ 4HF+O2。
(2)变价金属(Fe、Cu)与卤素单质反应生成高价态金属卤化物:2Fe+3X2 ══ 2FeX3(X=F、Cl、Br),但I2的氧化性较弱,与Fe反应生成FeI2。
(3)卤素单质之间可以发生置换反应,较活泼的卤素单质可以将较不活泼的卤素单质从其盐溶液中置换出来,但F2除外。
(4)HF是弱酸,HCl、HBr、HI都是强酸,且酸性:HF
(1)K的金属性强于Na,将金属K投入NaCl溶液中能否置换出Na 为什么
(2)对于卤族元素,非金属性越强,对应氢化物的酸性越强吗
提示 不能;K和Na都是活泼金属,都与水剧烈反应生成碱和H2。
提示 不是;卤素的非金属性越强,其氢化物的稳定性越强,酸性反而越弱。
重难探究·能力素养全提升
探究一 碱金属元素性质的相似性和递变性
情境探究
中国北斗卫星导航系统(BDS)是中国自行研制的全球卫星导航系统,是继GPS、GLONASS之后的第三个成熟的卫星导航系统,北斗卫星导航系统发展离不开精准的时间频率体系。目前我国研制并正在使用的铯原子喷泉钟,测量精度可以达到3 000万年不差一秒。
铯(Cs)原子喷泉钟
(1)铯(Cs)与钠、钾属于同族元素,其单质与水剧烈反应,甚至爆炸,所得溶液使酚酞显 色,反应的化学方程式为 。
(2)单质的还原性:Na (填“>”或“<”,下同)Cs;离子的氧化性:
Na+ Cs+。
红
2Cs+2H2O ══ 2CsOH+H2↑
<
>
方法突破
碱金属单质
化学性质的
相似性和
递变性
应用体验
1.下列有关碱金属元素性质的递变规律不正确的是( )
A.Na、K、Rb、Cs单质的失电子能力逐渐增强
B.Na、K、Rb、Cs的原子半径依次增大
C.NaOH、KOH、RbOH、CsOH碱性依次增强
D.Na、K、Rb、Cs最外层电子数依次增多
D
解析 Na、K、Rb、Cs电子层数依次增多,原子半径依次增大,则Na、K、Rb、Cs单质的失电子能力逐渐增强,对应碱的碱性逐渐增强,A、B、C均正确;Na、K、Rb、Cs原子的最外层电子数均为1,D错误。
2.[2023陕西汉中高一期末]下列对碱金属的叙述正确的是( )
①K通常保存在煤油中以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最弱的是锂
④碱金属阳离子中氧化性最强的是Li+
⑤碱金属的原子半径随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越低
A.①③④⑤ B.②③⑤⑥
C.①②③④ D.①④⑤⑥
A
解析 钾和空气中的水蒸气、氧气等发生反应,金属钾密度比煤油大,所以钾通常保存在煤油中以隔绝与空气的接触,①正确;碱金属的活泼性较强,会和皮肤中的水反应生成碱,具有强腐蚀性,故取用时不能直接用手拿,②错误;依据同主族元素性质递变规律,碱金属中还原性最弱的是锂,③正确;元素金属性越弱,对应阳离子的氧化性越强,所以碱金属阳离子中氧化性最强的是Li+,④正确;同主族元素原子的最外层电子数相同,电子层数逐渐增多,随着核电荷数的增大,碱金属的原子半径逐渐增大,⑤正确;从Li到Cs,碱金属的熔、沸点逐渐降低,密度呈增大趋势,钾反常,⑥错误。
探究二 卤族元素化学性质的相似性和递变性
情境探究
某研究性学习小组通过实验探究卤素的化学性质:
[实验1]分别向盛有4 mL KBr溶液和4 mL KI溶液的两支试管中加入1 mL氯水,振荡,观察溶液的颜色变化,并与氯水的颜色进行比较。
[实验2]向盛有4 mL KI溶液的试管中加入1 mL溴水,振荡,观察溶液的颜色变化,并与溴水的颜色进行比较。
(1)实验1中,向KBr溶液中加入氯水,溶液由无色变为橙红色;向KI溶液中加入氯水,溶液由无色变为褐色;上述颜色变化的原因是什么 写出反应的离子方程式。
提示 Cl2与KBr反应生成Br2,溴水的颜色为橙红色,比氯水颜色深,离子方程式为Cl2+2Br- ══ Br2+2Cl-。Cl2与KI反应生成I2,碘水的颜色为褐色,比氯水颜色深,离子方程式为Cl2+2I- ══ I2+2Cl-。
(2)实验2中,向KI溶液中加入溴水,溶液变为褐色,该反应中颜色变化的原因是什么 写出反应的离子方程式。
(3)通过上述实验,你能得出Cl2、Br2、I2氧化性强弱顺序是什么 Cl、Br、I非金属性强弱顺序是什么
提示 Br2与KI反应生成I2,碘水的颜色为褐色,比溴水的颜色深,离子方程式为Br2+2I- ══ I2+2Br-。
提示 氧化性强弱顺序:Cl2>Br2>I2;非金属性强弱顺序:Cl>Br>I。
方法突破 卤族元素化学性质的相似性和递变性
应用体验
下列有关F、Cl、Br、I四种元素的说法错误的是( )
A.随着原子序数的增大,单质的颜色逐渐加深
B.随着原子序数的增大,单质的熔、沸点逐渐升高
C.气态氢化物稳定性:HF
解析 F、Cl、Br、I的非金属性逐渐减弱,则气态氢化物的稳定性逐渐减弱,则稳定性:HF>HCl>HBr>HI,C错误;一般来说,元素的非金属性越强,单质的氧化性越强,氢化物的还原性越弱,故氢化物的还原性:HF
情境探究
元素周期表是化学史上的伟大创举。右图是“国际化学元素周期表年”发行的纪念邮票之一,门捷列夫周期表上留下的空位元素“类铝”由法国化学家布瓦博德朗1875年在巴黎发现,并命名为“镓(Ga)”。Ga与B、Al元素是同族元素,处于元素周期表的第四周期。
(1)根据Ga和B、Al元素在周期表中的位置,推测三种元素的金属性强弱。
提示 金属性:B
提示 2Ga+6HCl ══ 2GaCl3+3H2↑、2Ga+2NaOH+6H2O ══ 2Na[Ga(OH)4] +3H2↑。
方法突破
1.同主族元素的性质与原子结构的关系
2.同主族元素的原子结构与元素性质的递变规律
原子结构或元素性质 递变规律(从上到下)
原子结构 电子层数 逐渐增多
原子半径 逐渐增大
元素性质 金属性 逐渐增强
非金属性 逐渐减弱
单质性质 还原性 逐渐增强
氧化性 逐渐减弱
氢化物 稳定性 逐渐减弱
还原性 逐渐增强
最高价氧化物对应水化物 碱性 逐渐增强
酸性 逐渐减弱
应用体验
1.门捷列夫研究元素周期表时,科学地预测了铝的下方有一种与铝类似的“类铝”元素,1875年法国化学家布瓦博德朗发现了这种元素,命名为“镓(Ga)”,它的性质和门捷列夫的预测相吻合。镓与铝是同主族元素,下列叙述不正确的是( )
A.镓的金属性比铝的强
B.镓的原子半径比铝的小
C.镓原子的最外层有3个电子
D.氧化镓的化学式是Ga2O3
B
解析 镓和铝是同主族元素,镓位于铝的下方,同主族元素从上到下,元素的金属性逐渐增强,则镓的金属性比铝的强。镓原子比铝原子多1个电子层,镓的原子半径比铝的大。镓和铝是同主族元素,则镓原子的最外层也有3个电子。镓原子的最外层有3个电子,形成化合物时显+3价,则氧化镓的化学式为Ga2O3。
2.[2023辽宁锦州高一期末]已知锶(Sr)元素位于周期表中第五周期第ⅡA族,结合同族元素性质的递变规律判断,下列有关Sr的说法不正确的是
( )
A.最高化合价为+2价
B 的中子数为38
C.Sr的原子半径大于Ca原子
D.最高价氧化物对应水化物为强碱
B
解析 Sr处于第ⅡA族,原子最外层有2个电子,Sr原子半径比较大,容易失去最外层电子,故最高化合价为+2价,A正确 的质子数为38,质量数为88,故 的中子数为88-38=50,B错误;根据同主族原子半径递变规律,Sr的原子半径大于Ca原子,C正确;由于金属性:Be
1
2
3
4
5
1.下列元素中,金属性最强的是( )
A.Li B.Na C.K D.Rb
D
解析 碱金属元素自上而下,元素的金属性逐渐增强,即金属性:Li
2
3
4
5
2.[2023四川学业水平考试]按F2、Cl2、Br2、I2顺序,下列说法错误的是
( )
A.颜色由深变浅
B.氧化性逐渐减弱
C.与氢气化合由易变难
D.密度逐渐增大
A
解析 F2是淡黄绿色气体,Cl2是黄绿色气体,Br2是深红棕色液体,I2是紫黑色固体,可见按F2、Cl2、Br2、I2顺序,物质颜色由浅变深,A错误;F2、Cl2、Br2、I2是同一主族元素的单质,由于从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,故卤素单质的氧化性逐渐减弱,B正确;F2、Cl2、Br2、I2的氧化性逐渐减弱,单质的氧化性越弱,其与H2化合的能力逐渐减弱,故与氢气化合由易变难,C正确;F2、Cl2是气体物质,Br2是液态物质,而I2是固体物质,故卤素单质的密度逐渐增大,D正确。
1
2
3
4
5
1
2
3
4
5
3.下列有关碱金属元素和卤素的说法错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随着核电荷数的增加,碱金属元素和卤素单质的熔、沸点都逐渐降低
D
解析 Br2的氧化性强于I2,则Br2与H2的反应更剧烈,A正确;碱金属中Li原子半径最小,原子核对最外层电子引力强,失电子能力最弱,卤素中F原子半径最小,原子核对最外层电子引力强,得电子能力最强,B正确;K的活泼性强于Na,则K与水反应更剧烈,C正确;随着核电荷数的增加,碱金属元素单质的熔、沸点逐渐降低,卤素单质的熔、沸点逐渐升高,D错误。
1
2
3
4
5
1
2
3
4
5
4.[2023河北保定高一期末]已知:34Se(硒)与S为同族元素。下列说法错误的是( )
A.Se原子核外最外层有6个电子
B.H2Se的稳定性比H2O弱
C.原子半径:Se>S
D.非金属性:Se>S
D
解析 同主族元素最外层电子数相同,Se原子核外最外层有6个电子,A正确;非金属性:Se
1
2
3
4
5
5.部分碱金属元素和卤族元素在周期表中的位置如图所示。
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
一 ①
二 ② ⑤
三 ③ ⑥
四 ④ ⑦
结合以上信息回答下列问题:
(1)表中元素 (填写元素符号,下同)的非金属性最强,元素
的金属性最强,元素 的单质在室温下呈液态。
(2)表中元素③的原子结构示意图是 。
(3)表中元素⑥、⑦氢化物的稳定性顺序为 > (填写化学式)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的化学式为 。
1
2
3
4
5
1
2
3
4
5
答案 (1)F K Br (2) (3)HCl HBr (4)HClO4
解析 (1)据元素周期表中同主族元素性质递变规律可知,F的非金属性最强,K的金属性最强,单质在室温下呈液态的是Br2。
(2)元素③为Na,原子结构示意图为 。
(3)元素⑥、⑦分别为Cl、Br,其非金属性:Cl>Br,故氢化物的稳定性: HCl>HBr。
(4)F无正化合价,最高价氧化物对应水化物酸性最强的酸是HClO4。
本 课 结 束
更多精彩内容请登录 志鸿优化网
http://www.zhyh.org/
