4.2.1 元素性质的周期性变化规律课件(共54张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 4.2.1 元素性质的周期性变化规律课件(共54张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:41:23 | ||
图片预览






文档简介
(共54张PPT)
第四章
第二节 第1课时 元素性质的周期性变化规律
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随原子序数递增而呈周期性变化的规律,发展证据推理与模型认知的学科核心素养。
2.以第三周期元素为例,认识同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、元素性质的周期性变化规律
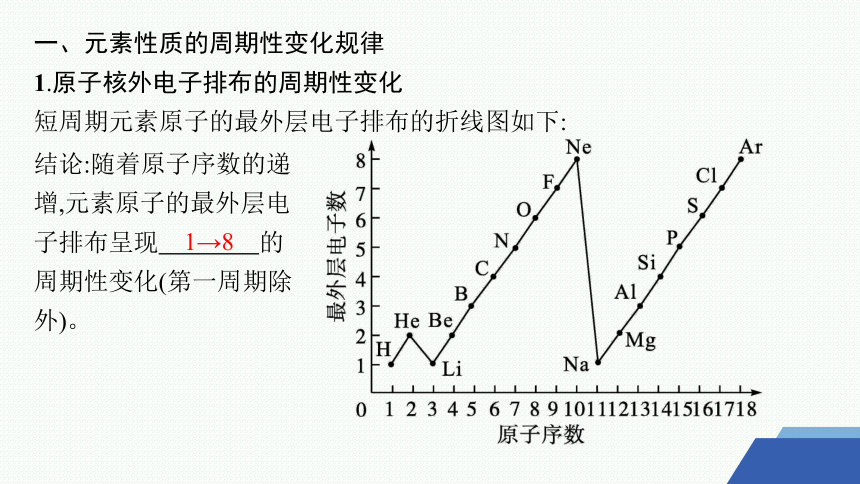
1.原子核外电子排布的周期性变化
短周期元素原子的最外层电子排布的折线图如下:
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 的周期性变化(第一周期除外)。
1→8
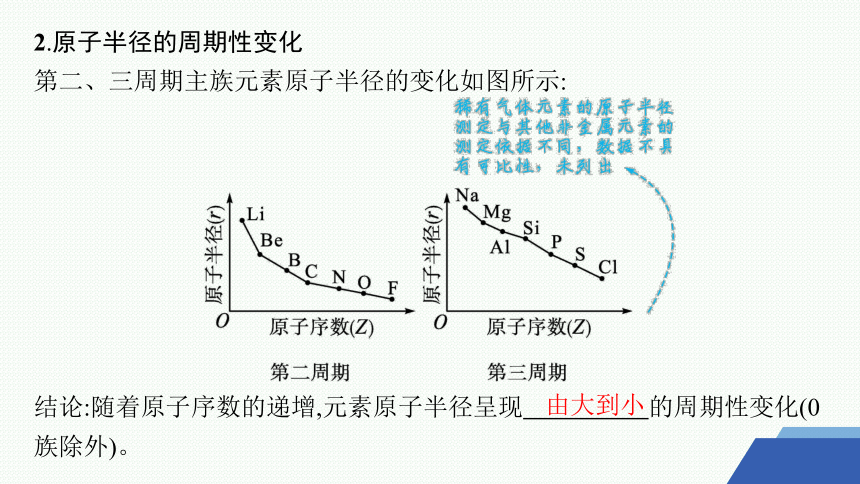
2.原子半径的周期性变化
第二、三周期主族元素原子半径的变化如图所示:
结论:随着原子序数的递增,元素原子半径呈现 的周期性变化(0族除外)。
由大到小
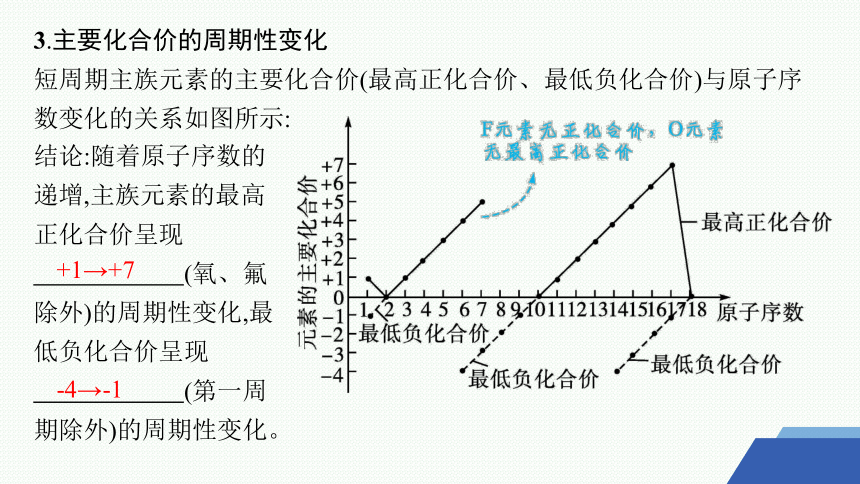
3.主要化合价的周期性变化
短周期主族元素的主要化合价(最高正化合价、最低负化合价)与原子序数变化的关系如图所示:
结论:随着原子序数的递增,主族元素的最高正化合价呈现
(氧、氟除外)的周期性变化,最低负化合价呈现
(第一周期除外)的周期性变化。
+1→+7
-4→-1
二、第三周期元素性质的递变[教材探究]
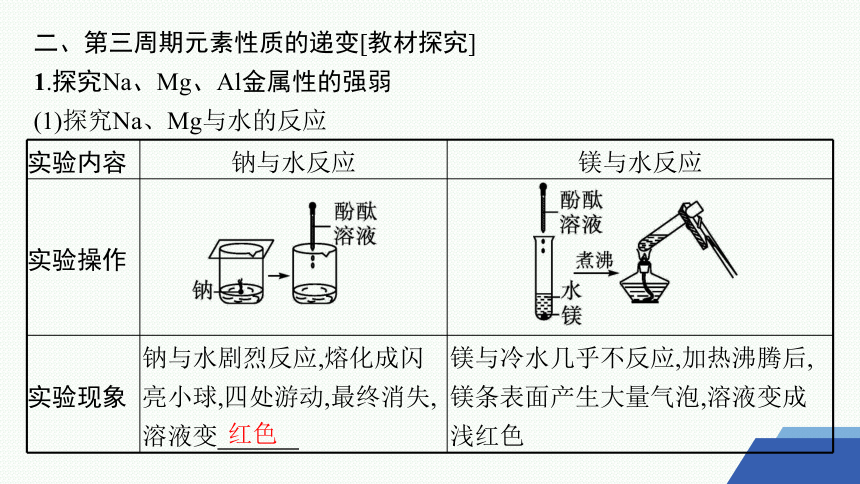
1.探究Na、Mg、Al金属性的强弱
(1)探究Na、Mg与水的反应
实验内容 钠与水反应 镁与水反应
实验操作
实验现象 钠与水剧烈反应,熔化成闪亮小球,四处游动,最终消失,溶液变 镁与冷水几乎不反应,加热沸腾后,镁条表面产生大量气泡,溶液变成浅红色
红色
实验 内容 钠与水反应 镁与水反应
反应 原理 Mg+2H2O Mg(OH)2↓+H2↑
实验 结论 ①钠、镁都能与水反应,钠比镁更活泼; ②碱性强弱: > ; ③金属性强弱:
2Na+2H2O ══ 2NaOH+H2↑
NaOH
Mg(OH)2
Na>Mg
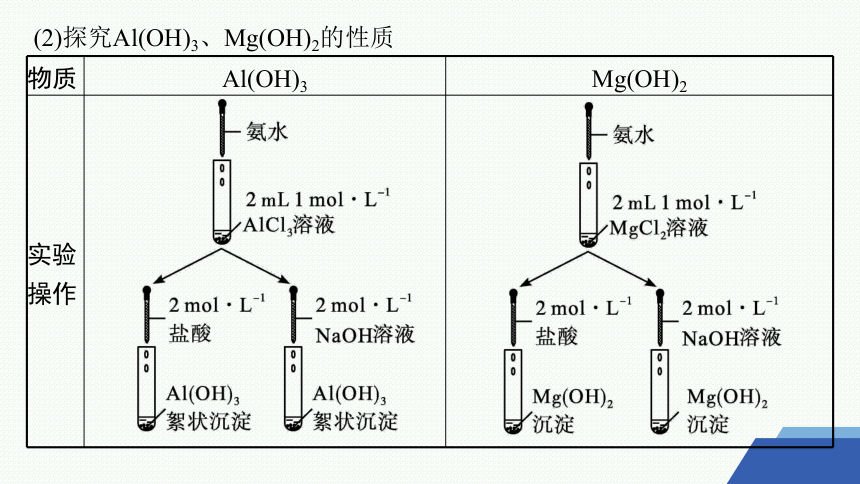
(2)探究Al(OH)3、Mg(OH)2的性质
物质 Al(OH)3 Mg(OH)2
实验 操作
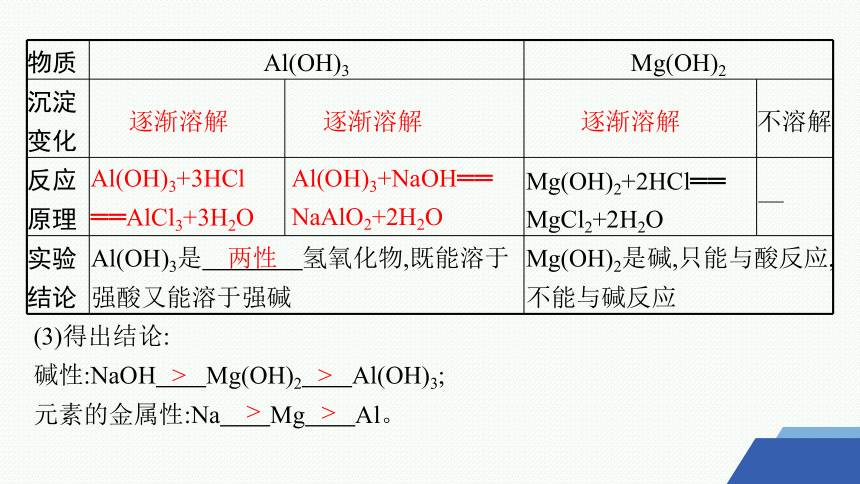
物质 Al(OH)3 Mg(OH)2
沉淀 变化 不溶解
反应 原理 Mg(OH)2+2HCl══ MgCl2+2H2O —
实验 结论 Al(OH)3是 氢氧化物,既能溶于强酸又能溶于强碱 Mg(OH)2是碱,只能与酸反应,不能与碱反应
(3)得出结论:
碱性:NaOH Mg(OH)2 Al(OH)3;
元素的金属性:Na Mg Al。
逐渐溶解
逐渐溶解
逐渐溶解
Al(OH)3+3HCl ══AlCl3+3H2O
Al(OH)3+NaOH══ NaAlO2+2H2O
两性
>
>
>
>
2.Si、P、S、Cl非金属性强弱的比较
硅、磷、硫、氯是非金属元素,其最高价氧化物对应的水化物(含氧酸)的酸性强弱如下表:
元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱 (硅酸)弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 (高氯酸)强酸(酸性比H2SO4强)
结论 非金属性强弱:SiH2SiO3
HClO4
3.同周期主族元素性质的递变规律
同周期主族元素从左到右,核电荷数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此元素的金属性逐渐 ,非金属性逐渐 。
增大
减小
减弱
增强
减弱
增强
三、元素周期律
1.具体内容
元素的性质随着原子序数的递增而呈现 的变化,这一规律叫做元素周期律。这里元素的性质包括元素的主要化合价、金属性、非金属性等。
2.实质
元素性质的周期性变化是元素原子的 周期性变化的必然结果。
周期性
核外电子排布
教材拓展
影响原子半径大小的因素
影响原子半径大小的因素有电子层数和核电荷数。
(1)电子层数:一般电子层数越多,原子半径越大。
(2)核电荷数:电子层数相同时,核电荷数越多,原子半径越小。
归纳总结
元素的主要化合价及分析
(1)短周期主族元素中,原子的最外层电子数=元素所在的主族序数=元素最高正化合价(O、F除外)。
(2)金属元素无负化合价,只有0价和正化合价。
(3)F元素无正价,O元素无最高正化合价。
(4)短周期主族元素中,非金属元素都有负化合价,且存在关系:最低负化合价=原子最外层电子数-8(H、B除外)。
易错辨析
(1)原子的最外层电子数:F>Si>Al>H。( )
(2)原子半径:B>C>N>F。( )
(3)元素的最高正化合价:F>O>P>Mg。( )
(4)电子层数:Cl=P>B>H。( )
√
√
×
√
提示 (3)F元素无正化合价,O元素无最高正化合价。
实验探究
镁与水的反应
(1)镁与水反应产生的氢气量较少,不易点燃。为清楚地看到生成物产生的气泡,而不是加热时由于水沸腾而产生的气泡,应该在停止加热、水不再沸腾时立即观察。
(2)镁与水的反应,看不到产生的Mg(OH)2,可通过酚酞指示剂的变色确定Mg(OH)2的生成。
归纳总结
Al(OH)3、Mg(OH)2的性质
(1)NaOH溶液与MgCl2溶液反应可生成Mg(OH)2沉淀,但不能据此证明NaOH的碱性比Mg(OH)2强。
(2)Al(OH)3是两性氢氧化物,这说明铝虽是金属,但已表现出一定的非金属性。
(3)Al(OH)3只能溶于强碱(如NaOH、KOH等)溶液,不能溶于氨水等弱碱溶液。
温馨提示
金属性和非金属性与单质及其化合物性质的对应关系
教材拓展
非金属氢化物的书写方式
(1)第ⅢA、ⅣA、ⅤA族元素氢化物分子式的书写,习惯上将氢元素写在后面,非金属元素写在前面,如BH3、CH4、NH3等。
(2)第ⅥA、ⅦA族元素氢化物分子式的书写,符合正价元素在前,负价元素在后的一般规律,如H2O、HCl等。
深度思考
(1)Si、P4、S、Cl2分别与H2反应,哪种物质最容易,哪种物质最困难
为什么
(2)将H2S、SiH4、PH3、HCl按稳定性由强到弱的顺序排列,并描述判断
依据。
提示 Cl2最容易,Si最困难;元素的非金属性:Si提示 稳定性:HCl>H2S>PH3>SiH4;元素的非金属性越强,简单氢化物的稳定性越强。
重难探究·能力素养全提升
探究一 元素周期表中主族元素性质的递变规律
情境探究
2023年1月13日15时00分,我国在酒泉卫星发射中心使用长征二号丁运载火箭,成功将遥感三十七号卫星和搭载的试验二十二号A/B星发射升空,卫星顺利进入预定轨道,发射任务获得圆满成功。
长征系列运载火箭常用的液体推进剂有偏二甲肼(C2H8N2)和N2O4、液氢和液氧等,完全燃烧生成CO2、N2和H2O等,对环境的影响较小。
(1)根据周期表中元素性质的递变规律判断(填“>”或“<”):
①C、O、N、H的原子半径: ;
②稳定性:H2O NH3 CH4。
(2)已知C和Si、N和P、O和S均是同主族元素,试判断(填“>”或“<”):
①元素的非金属性:C Si。
②最高价氧化物对应水化物的酸性:HNO3 H3PO4;
③阴离子的还原性:O2- S2-。
C>N>O>H
>
>
>
>
<
方法突破
元素周期表中原子结构与元素性质的周期性变化规律
递变方向 同周期(左→右) 同主族(上→下)
原子 结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
递变方向 同周期(左→右) 同主族(上→下)
元素 性质 主要化合价 最高正化合价由+1→+7(O、F除外);最低负化合价=-(8-主族序数)(H、B除外) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱,非金属性逐渐增强 金属性逐渐增强,非金属性逐渐减弱
离子的氧化性和还原性 阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱 阳离子的氧化性逐渐减弱,阴离子的还原性逐渐增强
递变方向 同周期(左→右) 同主族(上→下)
元素 性质 气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
应用体验
1.[2023湖南郴州高一期末]短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,四种原子最外层电子数之和为24。下列说法正确的是
( )
A.元素X和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为r(W)>r(X)
C.气态简单氢化物的热稳定性顺序为YD.元素Z的氧化物对应水化物都是强酸
C
解析 由四种元素在周期表中相对位置可知,X、W处于第二周期,Y、Z处于第三周期。设X、Z原子最外层电子数为x,则Y、W原子的最外层电子数分别为x-1、x+1,又知四种元素原子最外层电子数之和为24,则有x-1+2x+x+1=24,解得x=6,从而推知元素X、Y、Z、W分别为O、P、S、F。X是O元素,无最高正化合价;Z是S元素,最高正化合价为+6价,A错误。电子层结构相同的阴离子,其核电荷数越小,离子半径越大,则阴离子半径:r(O2-) >r(F-),B错误。根据元素周期律,元素的非金属性:P思路分析 推断四种元素的思路如下:
(1)分析元素在周期表中相对位置 X、W处于第二周期,Y、Z处于第三周期。
(2)四种原子最外层电子数之和为24 各原子最外层电子数,结合所在周期序数 X、Y、Z、W元素的名称。
2.[2023吉林梅河口五中高一期末]下列各组元素性质的递变规律错误的是
( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
C
解析 Li、Be、B元素处于第二周期,原子序数依次增大,原子最外层电子数依次增多,A正确;P、S、Cl元素处于第三周期,原子序数依次增大,最高正化合价依次为+5、+6、+7,依次升高,B正确;B、C、N、O、F元素处于第二周期,原子序数依次增大,原子半径依次减小,C错误;Li、Na、K、Rb元素处于同一主族,从上到下,原子半径依次增大,金属性依次增强,D正确。
探究二 原子(或离子)半径的大小比较
情境探究
元素周期表中,部分主族元素的原子半径如图所示:
[查阅资料]原子半径的大小取决于两个相反的因素:一是电子层数,电子层数越多,原子半径越大;二是核电荷数,核电荷数越大,原子半径越小。
(1)结合上述材料,比较O和N、O和S原子半径的大小,并指出判断的理由。
(2)结合上述材料,比较Cl-和Na+、Na+和Mg2+离子半径的大小,并指出判断的依据。
提示 O和N处于第二周期,O的核电荷数大于N,则N原子半径大于O。O和S处于第ⅥA族,S的电子层数大于O,则S原子半径大于O。
提示 Cl-比Na+多一个电子层,则Cl-半径大于Na+;Na+和Mg2+的电子层数相同,Mg2+的核电荷数比Na+大,则Na+半径大于Mg2+。
方法突破 依据“四同”规律比较原子(或离子)半径的大小
应用体验
1.下列各组微粒,按半径由大到小顺序排列正确的是( )
A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S D.Na+、Al3+、Cl-、F-
B
解析 K、Ca分别比Na、Mg多1个电子层,故有r(K)>r(Ca)>r(Na)>r(Mg),A错误;S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大,又因K+比Na+多1个电子层,故有r(S2-)>r(Cl-)>r(K+)>r(Na+),B正确;Br-比Br多1个电子,Br比Cl多1个电子层,故r(Br-)>r(Br)>r(Cl),但r(Cl)r(F-)>r(Na+)>r(Al3+),D错误。
2.[2023四川内江高一期末]X元素形成的阳离子(Xm+)和Y元素形成的阴离子(Yn-)的核外电子层结构相同,下列叙述正确的是( )
A.离子半径:X>Y B.原子半径:XC.原子序数:XD
解析 阳离子(Xm+)和阴离子(Yn-)的核外电子层结构相同,则X、Y处于相邻周期,X是下周期靠前的金属元素,Y是上周期靠后的非金属元素,则原子序数:X>Y,最外层电子数:XY,B错误。
探究三 元素的金属性和非金属性的强弱比较
问题探究
(1)已知硫酸与(NH4)2S反应产生H2S气体,试写出反应的化学方程式:
,据此得出酸性:H2SO4 (填“>”或“<”)H2S。
(NH4)2S+H2SO4 ══ H2S↑+(NH4)2SO4
>
(2)结合硫、氯元素在元素周期表中的位置,下列能说明S的非金属性比Cl弱的是 (填字母)。
A.相同条件下,H2S的酸性比HCl弱
B.H2S在500 ℃左右分解,HCl在1 500 ℃以上发生分解
C.相同条件下,H2SO4的酸性比HClO4的弱
D.相同条件下,H2S的溶解度小于HCl
BC
提示 一般情况下,元素的非金属性越弱,对应氢化物的稳定性越弱,最高价含氧酸的酸性越弱。氢化物的酸性及溶解度等与元素的非金属性无关。
方法突破
1.判断元素金属性强弱的方法
判断依据 基本规律
单质 的还 原性 单质与水或酸反应置换出氢气的难易程度 单质与水或酸(非氧化性酸)反应置换出氢气越容易(即反应越剧烈),表明元素金属性越强
金属单质之间的置换反应 一种金属能把另一种金属从它的化合物中置换出来,表明前一种金属元素的金属性较强
与同一种非金属单质反应 反应条件越苛刻,金属元素的金属性越弱
在其他条件相同的前提下,反应越剧烈,金属元素的金属性越强
判断依据 基本规律
金属阳离子的氧化性 金属阳离子(该金属只有一种阳离子)的氧化性越弱,其对应的金属元素的金属性越强
最高价氧化物对应水化物的碱性 最高价氧化物对应水化物的碱性越强,元素的金属性越强
元素在周期表中的位置 同一周期从左到右,金属性逐渐减弱
同一主族从上到下,金属性逐渐增强
2.判断元素非金属性强弱的方法
判断依据 基本规律
单质的氧化性 单质与氢气化合的难易程度 非金属单质与氢气化合越容易,元素的非金属性越强
非金属单质之间的置换反应 一种非金属单质能把另一种非金属元素从它的化合物中置换出来,表明前一种元素的非金属性较强
在其他条件相同时,与同一种金属单质反应 反应条件越苛刻,元素的非金属性越弱;反应越剧烈,元素的非金属性越强
与同种变价金属的反应 金属被氧化后的价态越高,则元素的非金属性越强
判断依据 基本规律
气态氢化物的稳定性 气态氢化物越稳定,元素的非金属性越强
气态氢化物或非金属阴离子的还原性 气态氢化物或非金属阴离子的还原性越弱,元素的非金属性越强
最高价氧化物对应水化物的酸性 最高价氧化物对应水化物的酸性越强,表明元素的非金属性越强
元素在周期表中的位置 同一周期从左到右,非金属性逐渐增强;同一主族从上到下,非金属性逐渐减弱
应用体验
1.[2023湖南怀化高一期末]下列事实不能用于比较元素金属性或非金属性强弱的是( )
A.Na与冷水反应比Mg剧烈,金属性Na>Mg
B.F2比Cl2更容易与H2化合,非金属性F>Cl
C.KOH的碱性强于NaOH,金属性K>Na
D.盐酸的酸性强于H2CO3,非金属性Cl>C
D
解析 依据元素周期律,金属与水反应越剧烈,失电子能力越强,金属性越强,Na与冷水反应比Mg剧烈,则金属性Na>Mg,A正确;非金属性越强,非金属单质与氢气化合越剧烈,F2比Cl2更容易与H2化合,则非金属性F>Cl,B正确;金属性越强,其最高价氧化物对应水化物的碱性越强,KOH的碱性强于NaOH,则金属性K>Na,C正确;非金属性越强,最高价氧化物对应水化物的酸性越强,虽然HCl的酸性强于H2CO3,但盐酸是无氧酸,故不能得出结论:非金属性Cl>C,D错误。
2.下列叙述中,不能肯定金属A比金属B的活泼性强的是( )
A.A能与热水反应产生H2,B必须与水蒸气反应才产生H2
B.A和B都是元素周期表的主族金属元素,A在B的左下方
C.1 mol A能从酸中置换出1.5 mol H2,1 mol B能从酸中置换出1 mol H2
D.常温时,A能与B的硝酸盐溶液反应得到B
C
解析 A能与热水反应产生H2,B必须与水蒸气反应才产生H2,说明前者比后者容易与水反应置换出氢气,则金属A的金属性比B强,A正确;根据同周期元素从左到右金属性递减、同主族元素从上到下金属性递增可得,左下方金属的金属性肯定比右上方金属的强,B正确;金属性的强弱由失去电子的难易程度决定,而不是由金属失去电子的多少决定,失去电子多的金属的金属性不一定较强,C错误;活泼性强的金属置换出活泼性弱的金属,说明A比B的金属性强,D正确。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列各项比较,符合相关性质递变规律的是( )
A.氧化性:O2>N2 B.金属性:NaC.酸性:H2SO4>HClO4 D.碱性:NaOHA
解析 一般元素的非金属性越强,单质的氧化性越强,由于非金属性:O>N,则氧化性:O2>N2,A正确;同周期主族元素从左到右,金属性逐渐减弱,则金属性:Na>Mg,B错误;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:SMg,则碱性:NaOH>Mg(OH)2,D错误。
1
2
3
4
5
2.下列元素中,非金属性最强的是( )
A.C B.Si
C.P D.Cl
D
解析 同周期主族元素从左到右,元素的非金属性逐渐增强,则非金属性:Si1
2
3
4
5
3.[2023山东聊城高一期末]下列说法正确的是( )
A.从Li→F、Na→Cl,元素的最高化合价呈现从+1→+7价的变化
B.同周期元素的原子半径从左至右一定依次减小
C.同周期中,第ⅠA族元素(H除外)金属性最强,第ⅦA族元素非金属性最强
D.HF、NH3、SiH4的稳定性依次增强
C
解析 O无最高正价,F无正价,A错误;稀有气体元素原子半径测定方式与其他元素的不同,没有可比性,B错误;F、N、Si三种元素的非金属性依次减弱,其对应氢化物的稳定性也依次减弱,D错误。
1
2
3
4
5
4.下列关于物质性质的比较,正确的是( )
A.酸性:HClO4B.碱性:NaOHC.氧化性:Cl2>Br2>I2
D.金属性:Li>Na>K
C
解析 非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,A错误;金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,B错误;非金属性:Cl>Br>I,则单质的氧化性:Cl2>Br2>I2,C正确;同主族元素自上而下,金属性逐渐增强,则金属性:Li1
2
3
4
5
5.元素周期表反映了元素性质的变化规律,是学习、研究和应用化学的重要工具。下表为元素周期表的一部分,回答下列问题:
(1)Mg和Al都是制造飞机和宇宙飞船的重要材料。Mg和Al属于同周期
(填“金属”或“非金属”)元素,但Mg的原子半径比Al的 。
(2)C的非金属性比同主族Si的非金属性 。
(3)Cl的最高价氧化物对应的水化物属于 (填“酸”或“碱”)。
(4)Mg、Al、Cl元素的简单离子半径由大到小的顺序为 。
金属
大
强
酸
Cl->Mg2+>Al3+
本 课 结 束
更多精彩内容请登录 志鸿优化网
http://www.zhyh.org/
第四章
第二节 第1课时 元素性质的周期性变化规律
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随原子序数递增而呈周期性变化的规律,发展证据推理与模型认知的学科核心素养。
2.以第三周期元素为例,认识同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、元素性质的周期性变化规律
1.原子核外电子排布的周期性变化
短周期元素原子的最外层电子排布的折线图如下:
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 的周期性变化(第一周期除外)。
1→8
2.原子半径的周期性变化
第二、三周期主族元素原子半径的变化如图所示:
结论:随着原子序数的递增,元素原子半径呈现 的周期性变化(0族除外)。
由大到小
3.主要化合价的周期性变化
短周期主族元素的主要化合价(最高正化合价、最低负化合价)与原子序数变化的关系如图所示:
结论:随着原子序数的递增,主族元素的最高正化合价呈现
(氧、氟除外)的周期性变化,最低负化合价呈现
(第一周期除外)的周期性变化。
+1→+7
-4→-1
二、第三周期元素性质的递变[教材探究]
1.探究Na、Mg、Al金属性的强弱
(1)探究Na、Mg与水的反应
实验内容 钠与水反应 镁与水反应
实验操作
实验现象 钠与水剧烈反应,熔化成闪亮小球,四处游动,最终消失,溶液变 镁与冷水几乎不反应,加热沸腾后,镁条表面产生大量气泡,溶液变成浅红色
红色
实验 内容 钠与水反应 镁与水反应
反应 原理 Mg+2H2O Mg(OH)2↓+H2↑
实验 结论 ①钠、镁都能与水反应,钠比镁更活泼; ②碱性强弱: > ; ③金属性强弱:
2Na+2H2O ══ 2NaOH+H2↑
NaOH
Mg(OH)2
Na>Mg
(2)探究Al(OH)3、Mg(OH)2的性质
物质 Al(OH)3 Mg(OH)2
实验 操作
物质 Al(OH)3 Mg(OH)2
沉淀 变化 不溶解
反应 原理 Mg(OH)2+2HCl══ MgCl2+2H2O —
实验 结论 Al(OH)3是 氢氧化物,既能溶于强酸又能溶于强碱 Mg(OH)2是碱,只能与酸反应,不能与碱反应
(3)得出结论:
碱性:NaOH Mg(OH)2 Al(OH)3;
元素的金属性:Na Mg Al。
逐渐溶解
逐渐溶解
逐渐溶解
Al(OH)3+3HCl ══AlCl3+3H2O
Al(OH)3+NaOH══ NaAlO2+2H2O
两性
>
>
>
>
2.Si、P、S、Cl非金属性强弱的比较
硅、磷、硫、氯是非金属元素,其最高价氧化物对应的水化物(含氧酸)的酸性强弱如下表:
元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱 (硅酸)弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 (高氯酸)强酸(酸性比H2SO4强)
结论 非金属性强弱:Si
HClO4
3.同周期主族元素性质的递变规律
同周期主族元素从左到右,核电荷数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此元素的金属性逐渐 ,非金属性逐渐 。
增大
减小
减弱
增强
减弱
增强
三、元素周期律
1.具体内容
元素的性质随着原子序数的递增而呈现 的变化,这一规律叫做元素周期律。这里元素的性质包括元素的主要化合价、金属性、非金属性等。
2.实质
元素性质的周期性变化是元素原子的 周期性变化的必然结果。
周期性
核外电子排布
教材拓展
影响原子半径大小的因素
影响原子半径大小的因素有电子层数和核电荷数。
(1)电子层数:一般电子层数越多,原子半径越大。
(2)核电荷数:电子层数相同时,核电荷数越多,原子半径越小。
归纳总结
元素的主要化合价及分析
(1)短周期主族元素中,原子的最外层电子数=元素所在的主族序数=元素最高正化合价(O、F除外)。
(2)金属元素无负化合价,只有0价和正化合价。
(3)F元素无正价,O元素无最高正化合价。
(4)短周期主族元素中,非金属元素都有负化合价,且存在关系:最低负化合价=原子最外层电子数-8(H、B除外)。
易错辨析
(1)原子的最外层电子数:F>Si>Al>H。( )
(2)原子半径:B>C>N>F。( )
(3)元素的最高正化合价:F>O>P>Mg。( )
(4)电子层数:Cl=P>B>H。( )
√
√
×
√
提示 (3)F元素无正化合价,O元素无最高正化合价。
实验探究
镁与水的反应
(1)镁与水反应产生的氢气量较少,不易点燃。为清楚地看到生成物产生的气泡,而不是加热时由于水沸腾而产生的气泡,应该在停止加热、水不再沸腾时立即观察。
(2)镁与水的反应,看不到产生的Mg(OH)2,可通过酚酞指示剂的变色确定Mg(OH)2的生成。
归纳总结
Al(OH)3、Mg(OH)2的性质
(1)NaOH溶液与MgCl2溶液反应可生成Mg(OH)2沉淀,但不能据此证明NaOH的碱性比Mg(OH)2强。
(2)Al(OH)3是两性氢氧化物,这说明铝虽是金属,但已表现出一定的非金属性。
(3)Al(OH)3只能溶于强碱(如NaOH、KOH等)溶液,不能溶于氨水等弱碱溶液。
温馨提示
金属性和非金属性与单质及其化合物性质的对应关系
教材拓展
非金属氢化物的书写方式
(1)第ⅢA、ⅣA、ⅤA族元素氢化物分子式的书写,习惯上将氢元素写在后面,非金属元素写在前面,如BH3、CH4、NH3等。
(2)第ⅥA、ⅦA族元素氢化物分子式的书写,符合正价元素在前,负价元素在后的一般规律,如H2O、HCl等。
深度思考
(1)Si、P4、S、Cl2分别与H2反应,哪种物质最容易,哪种物质最困难
为什么
(2)将H2S、SiH4、PH3、HCl按稳定性由强到弱的顺序排列,并描述判断
依据。
提示 Cl2最容易,Si最困难;元素的非金属性:Si
重难探究·能力素养全提升
探究一 元素周期表中主族元素性质的递变规律
情境探究
2023年1月13日15时00分,我国在酒泉卫星发射中心使用长征二号丁运载火箭,成功将遥感三十七号卫星和搭载的试验二十二号A/B星发射升空,卫星顺利进入预定轨道,发射任务获得圆满成功。
长征系列运载火箭常用的液体推进剂有偏二甲肼(C2H8N2)和N2O4、液氢和液氧等,完全燃烧生成CO2、N2和H2O等,对环境的影响较小。
(1)根据周期表中元素性质的递变规律判断(填“>”或“<”):
①C、O、N、H的原子半径: ;
②稳定性:H2O NH3 CH4。
(2)已知C和Si、N和P、O和S均是同主族元素,试判断(填“>”或“<”):
①元素的非金属性:C Si。
②最高价氧化物对应水化物的酸性:HNO3 H3PO4;
③阴离子的还原性:O2- S2-。
C>N>O>H
>
>
>
>
<
方法突破
元素周期表中原子结构与元素性质的周期性变化规律
递变方向 同周期(左→右) 同主族(上→下)
原子 结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
递变方向 同周期(左→右) 同主族(上→下)
元素 性质 主要化合价 最高正化合价由+1→+7(O、F除外);最低负化合价=-(8-主族序数)(H、B除外) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱,非金属性逐渐增强 金属性逐渐增强,非金属性逐渐减弱
离子的氧化性和还原性 阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱 阳离子的氧化性逐渐减弱,阴离子的还原性逐渐增强
递变方向 同周期(左→右) 同主族(上→下)
元素 性质 气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
应用体验
1.[2023湖南郴州高一期末]短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,四种原子最外层电子数之和为24。下列说法正确的是
( )
A.元素X和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为r(W)>r(X)
C.气态简单氢化物的热稳定性顺序为Y
C
解析 由四种元素在周期表中相对位置可知,X、W处于第二周期,Y、Z处于第三周期。设X、Z原子最外层电子数为x,则Y、W原子的最外层电子数分别为x-1、x+1,又知四种元素原子最外层电子数之和为24,则有x-1+2x+x+1=24,解得x=6,从而推知元素X、Y、Z、W分别为O、P、S、F。X是O元素,无最高正化合价;Z是S元素,最高正化合价为+6价,A错误。电子层结构相同的阴离子,其核电荷数越小,离子半径越大,则阴离子半径:r(O2-) >r(F-),B错误。根据元素周期律,元素的非金属性:P
(1)分析元素在周期表中相对位置 X、W处于第二周期,Y、Z处于第三周期。
(2)四种原子最外层电子数之和为24 各原子最外层电子数,结合所在周期序数 X、Y、Z、W元素的名称。
2.[2023吉林梅河口五中高一期末]下列各组元素性质的递变规律错误的是
( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
C
解析 Li、Be、B元素处于第二周期,原子序数依次增大,原子最外层电子数依次增多,A正确;P、S、Cl元素处于第三周期,原子序数依次增大,最高正化合价依次为+5、+6、+7,依次升高,B正确;B、C、N、O、F元素处于第二周期,原子序数依次增大,原子半径依次减小,C错误;Li、Na、K、Rb元素处于同一主族,从上到下,原子半径依次增大,金属性依次增强,D正确。
探究二 原子(或离子)半径的大小比较
情境探究
元素周期表中,部分主族元素的原子半径如图所示:
[查阅资料]原子半径的大小取决于两个相反的因素:一是电子层数,电子层数越多,原子半径越大;二是核电荷数,核电荷数越大,原子半径越小。
(1)结合上述材料,比较O和N、O和S原子半径的大小,并指出判断的理由。
(2)结合上述材料,比较Cl-和Na+、Na+和Mg2+离子半径的大小,并指出判断的依据。
提示 O和N处于第二周期,O的核电荷数大于N,则N原子半径大于O。O和S处于第ⅥA族,S的电子层数大于O,则S原子半径大于O。
提示 Cl-比Na+多一个电子层,则Cl-半径大于Na+;Na+和Mg2+的电子层数相同,Mg2+的核电荷数比Na+大,则Na+半径大于Mg2+。
方法突破 依据“四同”规律比较原子(或离子)半径的大小
应用体验
1.下列各组微粒,按半径由大到小顺序排列正确的是( )
A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S D.Na+、Al3+、Cl-、F-
B
解析 K、Ca分别比Na、Mg多1个电子层,故有r(K)>r(Ca)>r(Na)>r(Mg),A错误;S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大,又因K+比Na+多1个电子层,故有r(S2-)>r(Cl-)>r(K+)>r(Na+),B正确;Br-比Br多1个电子,Br比Cl多1个电子层,故r(Br-)>r(Br)>r(Cl),但r(Cl)
2.[2023四川内江高一期末]X元素形成的阳离子(Xm+)和Y元素形成的阴离子(Yn-)的核外电子层结构相同,下列叙述正确的是( )
A.离子半径:X>Y B.原子半径:X
解析 阳离子(Xm+)和阴离子(Yn-)的核外电子层结构相同,则X、Y处于相邻周期,X是下周期靠前的金属元素,Y是上周期靠后的非金属元素,则原子序数:X>Y,最外层电子数:X
探究三 元素的金属性和非金属性的强弱比较
问题探究
(1)已知硫酸与(NH4)2S反应产生H2S气体,试写出反应的化学方程式:
,据此得出酸性:H2SO4 (填“>”或“<”)H2S。
(NH4)2S+H2SO4 ══ H2S↑+(NH4)2SO4
>
(2)结合硫、氯元素在元素周期表中的位置,下列能说明S的非金属性比Cl弱的是 (填字母)。
A.相同条件下,H2S的酸性比HCl弱
B.H2S在500 ℃左右分解,HCl在1 500 ℃以上发生分解
C.相同条件下,H2SO4的酸性比HClO4的弱
D.相同条件下,H2S的溶解度小于HCl
BC
提示 一般情况下,元素的非金属性越弱,对应氢化物的稳定性越弱,最高价含氧酸的酸性越弱。氢化物的酸性及溶解度等与元素的非金属性无关。
方法突破
1.判断元素金属性强弱的方法
判断依据 基本规律
单质 的还 原性 单质与水或酸反应置换出氢气的难易程度 单质与水或酸(非氧化性酸)反应置换出氢气越容易(即反应越剧烈),表明元素金属性越强
金属单质之间的置换反应 一种金属能把另一种金属从它的化合物中置换出来,表明前一种金属元素的金属性较强
与同一种非金属单质反应 反应条件越苛刻,金属元素的金属性越弱
在其他条件相同的前提下,反应越剧烈,金属元素的金属性越强
判断依据 基本规律
金属阳离子的氧化性 金属阳离子(该金属只有一种阳离子)的氧化性越弱,其对应的金属元素的金属性越强
最高价氧化物对应水化物的碱性 最高价氧化物对应水化物的碱性越强,元素的金属性越强
元素在周期表中的位置 同一周期从左到右,金属性逐渐减弱
同一主族从上到下,金属性逐渐增强
2.判断元素非金属性强弱的方法
判断依据 基本规律
单质的氧化性 单质与氢气化合的难易程度 非金属单质与氢气化合越容易,元素的非金属性越强
非金属单质之间的置换反应 一种非金属单质能把另一种非金属元素从它的化合物中置换出来,表明前一种元素的非金属性较强
在其他条件相同时,与同一种金属单质反应 反应条件越苛刻,元素的非金属性越弱;反应越剧烈,元素的非金属性越强
与同种变价金属的反应 金属被氧化后的价态越高,则元素的非金属性越强
判断依据 基本规律
气态氢化物的稳定性 气态氢化物越稳定,元素的非金属性越强
气态氢化物或非金属阴离子的还原性 气态氢化物或非金属阴离子的还原性越弱,元素的非金属性越强
最高价氧化物对应水化物的酸性 最高价氧化物对应水化物的酸性越强,表明元素的非金属性越强
元素在周期表中的位置 同一周期从左到右,非金属性逐渐增强;同一主族从上到下,非金属性逐渐减弱
应用体验
1.[2023湖南怀化高一期末]下列事实不能用于比较元素金属性或非金属性强弱的是( )
A.Na与冷水反应比Mg剧烈,金属性Na>Mg
B.F2比Cl2更容易与H2化合,非金属性F>Cl
C.KOH的碱性强于NaOH,金属性K>Na
D.盐酸的酸性强于H2CO3,非金属性Cl>C
D
解析 依据元素周期律,金属与水反应越剧烈,失电子能力越强,金属性越强,Na与冷水反应比Mg剧烈,则金属性Na>Mg,A正确;非金属性越强,非金属单质与氢气化合越剧烈,F2比Cl2更容易与H2化合,则非金属性F>Cl,B正确;金属性越强,其最高价氧化物对应水化物的碱性越强,KOH的碱性强于NaOH,则金属性K>Na,C正确;非金属性越强,最高价氧化物对应水化物的酸性越强,虽然HCl的酸性强于H2CO3,但盐酸是无氧酸,故不能得出结论:非金属性Cl>C,D错误。
2.下列叙述中,不能肯定金属A比金属B的活泼性强的是( )
A.A能与热水反应产生H2,B必须与水蒸气反应才产生H2
B.A和B都是元素周期表的主族金属元素,A在B的左下方
C.1 mol A能从酸中置换出1.5 mol H2,1 mol B能从酸中置换出1 mol H2
D.常温时,A能与B的硝酸盐溶液反应得到B
C
解析 A能与热水反应产生H2,B必须与水蒸气反应才产生H2,说明前者比后者容易与水反应置换出氢气,则金属A的金属性比B强,A正确;根据同周期元素从左到右金属性递减、同主族元素从上到下金属性递增可得,左下方金属的金属性肯定比右上方金属的强,B正确;金属性的强弱由失去电子的难易程度决定,而不是由金属失去电子的多少决定,失去电子多的金属的金属性不一定较强,C错误;活泼性强的金属置换出活泼性弱的金属,说明A比B的金属性强,D正确。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列各项比较,符合相关性质递变规律的是( )
A.氧化性:O2>N2 B.金属性:Na
解析 一般元素的非金属性越强,单质的氧化性越强,由于非金属性:O>N,则氧化性:O2>N2,A正确;同周期主族元素从左到右,金属性逐渐减弱,则金属性:Na>Mg,B错误;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:S
1
2
3
4
5
2.下列元素中,非金属性最强的是( )
A.C B.Si
C.P D.Cl
D
解析 同周期主族元素从左到右,元素的非金属性逐渐增强,则非金属性:Si
2
3
4
5
3.[2023山东聊城高一期末]下列说法正确的是( )
A.从Li→F、Na→Cl,元素的最高化合价呈现从+1→+7价的变化
B.同周期元素的原子半径从左至右一定依次减小
C.同周期中,第ⅠA族元素(H除外)金属性最强,第ⅦA族元素非金属性最强
D.HF、NH3、SiH4的稳定性依次增强
C
解析 O无最高正价,F无正价,A错误;稀有气体元素原子半径测定方式与其他元素的不同,没有可比性,B错误;F、N、Si三种元素的非金属性依次减弱,其对应氢化物的稳定性也依次减弱,D错误。
1
2
3
4
5
4.下列关于物质性质的比较,正确的是( )
A.酸性:HClO4
D.金属性:Li>Na>K
C
解析 非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,A错误;金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,B错误;非金属性:Cl>Br>I,则单质的氧化性:Cl2>Br2>I2,C正确;同主族元素自上而下,金属性逐渐增强,则金属性:Li
2
3
4
5
5.元素周期表反映了元素性质的变化规律,是学习、研究和应用化学的重要工具。下表为元素周期表的一部分,回答下列问题:
(1)Mg和Al都是制造飞机和宇宙飞船的重要材料。Mg和Al属于同周期
(填“金属”或“非金属”)元素,但Mg的原子半径比Al的 。
(2)C的非金属性比同主族Si的非金属性 。
(3)Cl的最高价氧化物对应的水化物属于 (填“酸”或“碱”)。
(4)Mg、Al、Cl元素的简单离子半径由大到小的顺序为 。
金属
大
强
酸
Cl->Mg2+>Al3+
本 课 结 束
更多精彩内容请登录 志鸿优化网
http://www.zhyh.org/
