第3章微专题5 “铁三角”的相互转化及应用课件(共17张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 第3章微专题5 “铁三角”的相互转化及应用课件(共17张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:46:56 | ||
图片预览


文档简介
(共17张PPT)
第三章
微专题5 “铁三角”的相互转化及应用
专题阐释
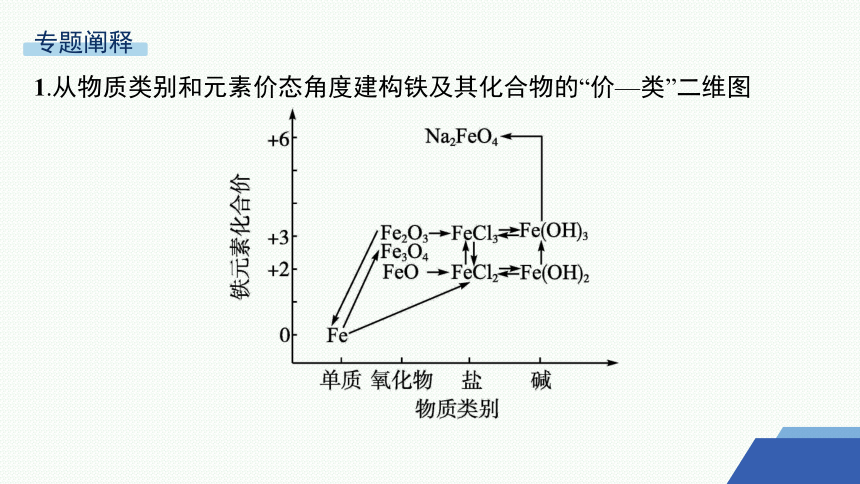
1.从物质类别和元素价态角度建构铁及其化合物的“价—类”二维图
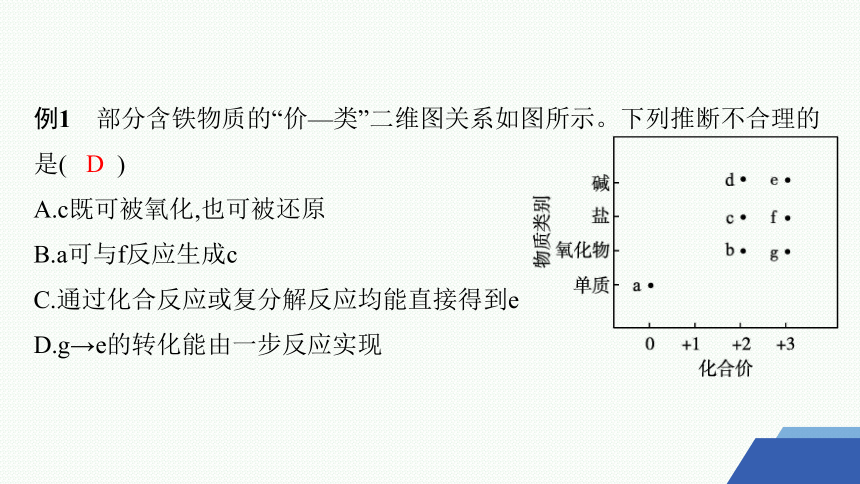
例1 部分含铁物质的“价—类”二维图关系如图所示。下列推断不合理的是( )
A.c既可被氧化,也可被还原
B.a可与f反应生成c
C.通过化合反应或复分解反应均能直接得到e
D.g→e的转化能由一步反应实现
D
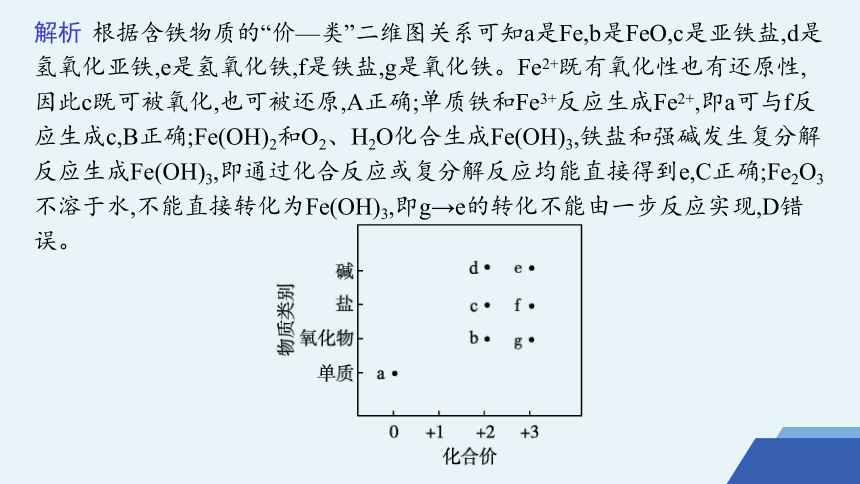
解析 根据含铁物质的“价—类”二维图关系可知a是Fe,b是FeO,c是亚铁盐,d是氢氧化亚铁,e是氢氧化铁,f是铁盐,g是氧化铁。Fe2+既有氧化性也有还原性,因此c既可被氧化,也可被还原,A正确;单质铁和Fe3+反应生成Fe2+,即a可与f反应生成c,B正确;Fe(OH)2和O2、H2O化合生成Fe(OH)3,铁盐和强碱发生复分解反应生成Fe(OH)3,即通过化合反应或复分解反应均能直接得到e,C正确;Fe2O3不溶于水,不能直接转化为Fe(OH)3,即g→e的转化不能由一步反应实现,D错误。
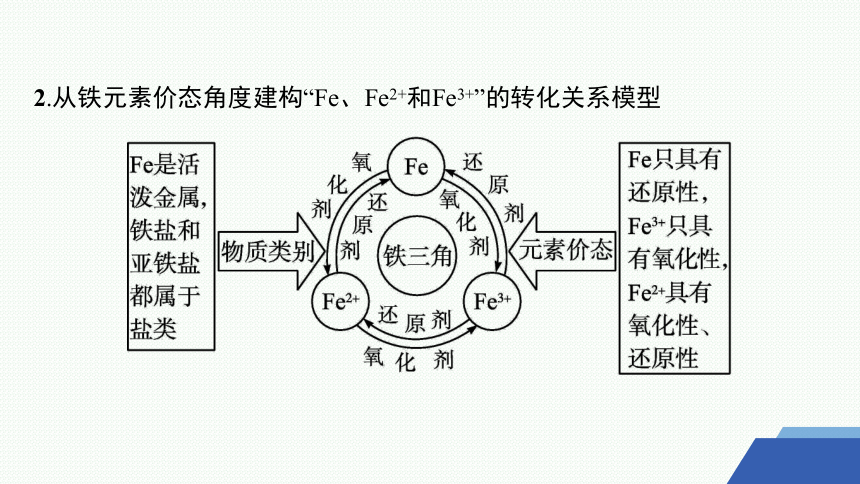
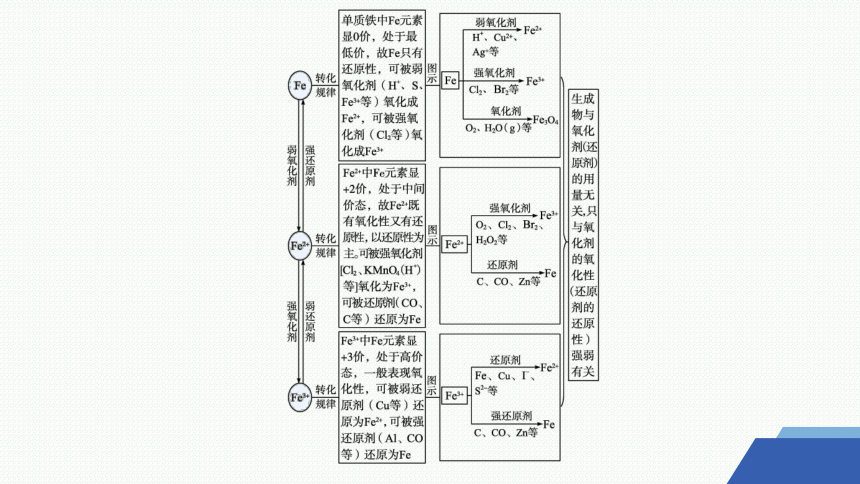
2.从铁元素价态角度建构“Fe、Fe2+和Fe3+”的转化关系模型
例2 某兴趣小组用油性笔在一小块覆铜板上写上“化学”,然后浸入盛有FeCl3溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中c(Fe3+)与c(Cu2+)之比为2∶3。下列说法不正确的是( )
A.反应后的溶液中:c(Fe3+)∶c(Fe2+)=1∶1
B.反应的离子方程式为2Fe3++Cu ══ 2Fe2++Cu2+
C.反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+)
D.反应后的溶液再生为FeCl3:加入足量铁粉,过滤,滤液中通入足量Cl2
A
解析 FeCl3溶液腐蚀覆铜板发生反应:2FeCl3+Cu ══ 2FeCl2+CuCl2,离子方程式为2Fe3++Cu ══ 2Fe2++Cu2+,B正确;测得反应后溶液中c(Fe3+)∶c(Cu2+)=2∶3,结合反应推知,溶液中c(Fe2+)∶c(Cu2+)=2∶1,从而推知溶液中c(Fe3+)∶c(Fe2+)=1∶3,A错误;结合A项分析可知,反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+),C正确;反应后的溶液含有FeCl2、CuCl2、FeCl3,加入足量铁粉置换出Cu,过滤,滤液中通入足量Cl2,将FeCl2氧化生成FeCl3,实现腐蚀液的再生,D正确。
专题精练
1.[2023辽宁辽阳高一期中]向含有一定物质的量的FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )
A
解析 FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,可先后发生反应:2FeCl3+Fe ══ 3FeCl2、CuCl2+Fe ══ FeCl2+Cu。Fe先与FeCl3溶液反应,溶液的质量增加,FeCl3反应完全后再与CuCl2溶液反应,由于Fe的相对原子质量小于Cu的相对原子质量,导致溶液质量减小,当FeCl3和CuCl2全部反应完全,溶液质量保持不变,故A图像正确。
2.部分含铁物质的分类与相应化合价关系如图所示。下列推断正确的是
( )
A.a可与水蒸气在高温条件下反应生成e
B.b是一种黑色粉末,在空气中受热,迅速被氧化生成e
C.c中加入新制氯水可生成d,此反应中c体现氧化性
D.e是碱性氧化物,e中加入盐酸可生成d
D
解析 根据图示物质所含Fe元素化合价及物质分类,可知:a是Fe,b是FeO,c是+2价的亚铁盐,d是+3价的铁盐,e是Fe2O3。a是Fe单质,与水蒸气在高温条件下反应生成Fe3O4,Fe3O4中Fe元素的化合价为+2价、+3价,而e是+3价的Fe的氧化物Fe2O3,A错误;b是FeO,该物质不稳定,在空气中加热时容易被空气中的氧气氧化为Fe3O4,氧化产物不是Fe2O3,B错误;c是+2价的亚铁盐,该物质具有还原性,容易被新制氯水氧化为+3价的铁盐,在该反应中c失去电子表现还原性,而不是氧化性,C错误;e是Fe2O3,Fe元素化合价为+3价,能够与酸反应产生盐和水,因此属于碱性氧化物,若酸是盐酸,二者反应产生氯化铁和水,氯化铁属于铁盐,D正确。
3.[2023江苏南通高一期中]如图所示物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2溶液 铜 KSCN溶液
B H2O2溶液 BaCl2溶液 铁粉 KSCN溶液
C NaOH溶液 Ba(NO3)2溶液 锌粉 KSCN溶液
D Na2O2 MgCl2溶液 Fe KSCN溶液
C
解析 黄色硫酸铁溶液中加入Ba(OH)2溶液,生成BaSO4和Fe(OH)3两种沉淀,观察不到白色沉淀,A错误。Fe2(SO4)3溶液中加入BaCl2溶液,生成白色沉淀BaSO4;Fe2(SO4)3溶液中加入H2O2溶液,得不到红褐色沉淀,B错误。Fe2(SO4)3溶液中加入NaOH溶液,发生复分解反应生成Fe(OH)3沉淀;Fe2(SO4)3溶液中加入Ba(NO3)2溶液,生成白色沉淀BaSO4;Fe2(SO4)3溶液中加入锌粉生成FeSO4和ZnSO4,溶液变成浅绿色;Fe2(SO4)3溶液中加入KSCN溶液,溶液变成红色,C正确。Fe2(SO4)3溶液中加入Na2O2,生成Fe(OH)3沉淀;Fe2(SO4)3溶液中加入MgCl2溶液,不发生反应,D错误。
4.某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
下列说法正确的是( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成完全相同
B
解析 从废水中回收硫酸亚铁和金属铜,加入过量铁粉,将Cu2+还原生成Cu,Fe3+与Fe反应生成Fe2+,发生置换反应和化合反应,A错误;固体B为Fe和Cu混合物,加入过量稀硫酸溶解Fe生成FeSO4,过滤得到固体E是Cu,B正确;最终制得FeSO4·7H2O,故物质D只能是稀硫酸,不能用稀盐酸,C错误;滤液C是FeSO4溶液,滤液F含有FeSO4和H2SO4,二者组成不相同,D错误。
本 课 结 束
第三章
微专题5 “铁三角”的相互转化及应用
专题阐释
1.从物质类别和元素价态角度建构铁及其化合物的“价—类”二维图
例1 部分含铁物质的“价—类”二维图关系如图所示。下列推断不合理的是( )
A.c既可被氧化,也可被还原
B.a可与f反应生成c
C.通过化合反应或复分解反应均能直接得到e
D.g→e的转化能由一步反应实现
D
解析 根据含铁物质的“价—类”二维图关系可知a是Fe,b是FeO,c是亚铁盐,d是氢氧化亚铁,e是氢氧化铁,f是铁盐,g是氧化铁。Fe2+既有氧化性也有还原性,因此c既可被氧化,也可被还原,A正确;单质铁和Fe3+反应生成Fe2+,即a可与f反应生成c,B正确;Fe(OH)2和O2、H2O化合生成Fe(OH)3,铁盐和强碱发生复分解反应生成Fe(OH)3,即通过化合反应或复分解反应均能直接得到e,C正确;Fe2O3不溶于水,不能直接转化为Fe(OH)3,即g→e的转化不能由一步反应实现,D错误。
2.从铁元素价态角度建构“Fe、Fe2+和Fe3+”的转化关系模型
例2 某兴趣小组用油性笔在一小块覆铜板上写上“化学”,然后浸入盛有FeCl3溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中c(Fe3+)与c(Cu2+)之比为2∶3。下列说法不正确的是( )
A.反应后的溶液中:c(Fe3+)∶c(Fe2+)=1∶1
B.反应的离子方程式为2Fe3++Cu ══ 2Fe2++Cu2+
C.反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+)
D.反应后的溶液再生为FeCl3:加入足量铁粉,过滤,滤液中通入足量Cl2
A
解析 FeCl3溶液腐蚀覆铜板发生反应:2FeCl3+Cu ══ 2FeCl2+CuCl2,离子方程式为2Fe3++Cu ══ 2Fe2++Cu2+,B正确;测得反应后溶液中c(Fe3+)∶c(Cu2+)=2∶3,结合反应推知,溶液中c(Fe2+)∶c(Cu2+)=2∶1,从而推知溶液中c(Fe3+)∶c(Fe2+)=1∶3,A错误;结合A项分析可知,反应后的溶液中:c(Cl-)>c(Fe2+)>c(Cu2+)>c(Fe3+),C正确;反应后的溶液含有FeCl2、CuCl2、FeCl3,加入足量铁粉置换出Cu,过滤,滤液中通入足量Cl2,将FeCl2氧化生成FeCl3,实现腐蚀液的再生,D正确。
专题精练
1.[2023辽宁辽阳高一期中]向含有一定物质的量的FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )
A
解析 FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,可先后发生反应:2FeCl3+Fe ══ 3FeCl2、CuCl2+Fe ══ FeCl2+Cu。Fe先与FeCl3溶液反应,溶液的质量增加,FeCl3反应完全后再与CuCl2溶液反应,由于Fe的相对原子质量小于Cu的相对原子质量,导致溶液质量减小,当FeCl3和CuCl2全部反应完全,溶液质量保持不变,故A图像正确。
2.部分含铁物质的分类与相应化合价关系如图所示。下列推断正确的是
( )
A.a可与水蒸气在高温条件下反应生成e
B.b是一种黑色粉末,在空气中受热,迅速被氧化生成e
C.c中加入新制氯水可生成d,此反应中c体现氧化性
D.e是碱性氧化物,e中加入盐酸可生成d
D
解析 根据图示物质所含Fe元素化合价及物质分类,可知:a是Fe,b是FeO,c是+2价的亚铁盐,d是+3价的铁盐,e是Fe2O3。a是Fe单质,与水蒸气在高温条件下反应生成Fe3O4,Fe3O4中Fe元素的化合价为+2价、+3价,而e是+3价的Fe的氧化物Fe2O3,A错误;b是FeO,该物质不稳定,在空气中加热时容易被空气中的氧气氧化为Fe3O4,氧化产物不是Fe2O3,B错误;c是+2价的亚铁盐,该物质具有还原性,容易被新制氯水氧化为+3价的铁盐,在该反应中c失去电子表现还原性,而不是氧化性,C错误;e是Fe2O3,Fe元素化合价为+3价,能够与酸反应产生盐和水,因此属于碱性氧化物,若酸是盐酸,二者反应产生氯化铁和水,氯化铁属于铁盐,D正确。
3.[2023江苏南通高一期中]如图所示物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2溶液 铜 KSCN溶液
B H2O2溶液 BaCl2溶液 铁粉 KSCN溶液
C NaOH溶液 Ba(NO3)2溶液 锌粉 KSCN溶液
D Na2O2 MgCl2溶液 Fe KSCN溶液
C
解析 黄色硫酸铁溶液中加入Ba(OH)2溶液,生成BaSO4和Fe(OH)3两种沉淀,观察不到白色沉淀,A错误。Fe2(SO4)3溶液中加入BaCl2溶液,生成白色沉淀BaSO4;Fe2(SO4)3溶液中加入H2O2溶液,得不到红褐色沉淀,B错误。Fe2(SO4)3溶液中加入NaOH溶液,发生复分解反应生成Fe(OH)3沉淀;Fe2(SO4)3溶液中加入Ba(NO3)2溶液,生成白色沉淀BaSO4;Fe2(SO4)3溶液中加入锌粉生成FeSO4和ZnSO4,溶液变成浅绿色;Fe2(SO4)3溶液中加入KSCN溶液,溶液变成红色,C正确。Fe2(SO4)3溶液中加入Na2O2,生成Fe(OH)3沉淀;Fe2(SO4)3溶液中加入MgCl2溶液,不发生反应,D错误。
4.某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程。
下列说法正确的是( )
A.加入过量A,发生的反应均为置换反应
B.固体B为混合物而固体E为纯净物
C.物质D既可以用稀硫酸也可以用稀盐酸
D.滤液C和滤液F组成完全相同
B
解析 从废水中回收硫酸亚铁和金属铜,加入过量铁粉,将Cu2+还原生成Cu,Fe3+与Fe反应生成Fe2+,发生置换反应和化合反应,A错误;固体B为Fe和Cu混合物,加入过量稀硫酸溶解Fe生成FeSO4,过滤得到固体E是Cu,B正确;最终制得FeSO4·7H2O,故物质D只能是稀硫酸,不能用稀盐酸,C错误;滤液C是FeSO4溶液,滤液F含有FeSO4和H2SO4,二者组成不相同,D错误。
本 课 结 束
