4.2.2 元素周期表和元素周期律的应用课件(共42张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 4.2.2 元素周期表和元素周期律的应用课件(共42张PPT)2023-2024学年高一化学人教版必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 15:59:50 | ||
图片预览









文档简介
(共42张PPT)
第四章
第二节 第2课时 元素周期表和元素周期律的应用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.基于元素“位置—结构—性质”认识元素性质,基于物质“结构—性质—用途”认识物质的性质,基于性质递变的本质原因认识物质世界,发展证据推理与模型认知的学科核心素养。
2.加深对分类法、归纳法等学科方法的认识,提高逻辑推理能力、论证能力,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、元素周期表的分区和元素化合价规律
1.元素周期表与元素周期律的关系
是 的表现形式,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。
元素周期表
元素周期律
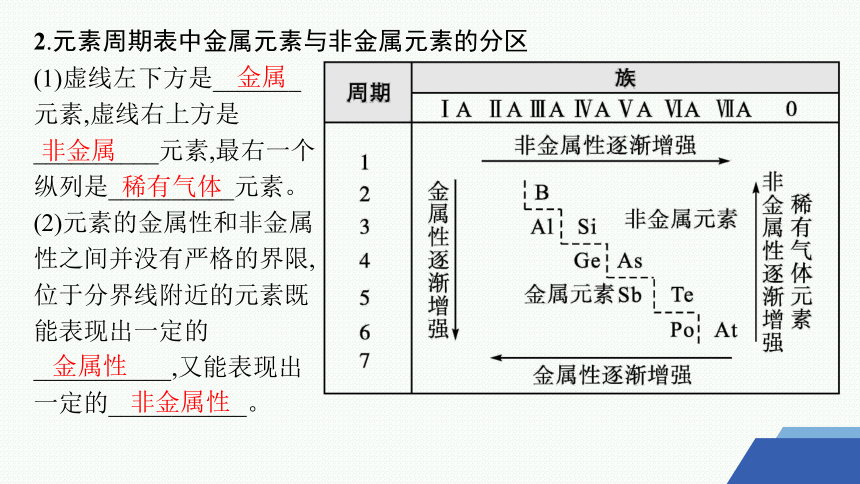
2.元素周期表中金属元素与非金属元素的分区
(1)虚线左下方是_______元素,虚线右上方是__________元素,最右一个纵列是__________元素。
(2)元素的金属性和非金属性之间并没有严格的界限,位于分界线附近的元素既能表现出一定的___________,又能表现出一定的___________。
金属
非金属
稀有气体
金属性
非金属性
3.元素的化合价与元素在周期表中的位置关系
(1)价电子
①含义:元素的化合价与原子的 电子数有密切的关系,所以元素原子的 中的电子也叫价电子。
②具体内容:主族元素原子的价电子是 中的电子;对于副族元素,有些元素的化合价与原子的 或倒数第三层的部分电子有关,这部分电子也叫价电子。
最外层
最外电子层
最外电子层
次外层
(2)化合价规律
①主族元素的最高正化合价=所处的 = (O、F除外)。
②非金属元素的最高正化合价等于原子所能失去或偏移的 ;最低负化合价等于使原子达到 稳定结构所需得到的电子数。
③对于非金属元素:最高正化合价+|最低负化合价|=8。
H、B、O、F等非金属元素除外
族序数
最外层电子数
最外层电子数
8电子
二、元素周期表和元素周期律的应用
1.元素周期表中“位—构—性”的关系
元素在周期表中的位置,反映了元素的 和 ,可以根据元素在周期表中的位置推测其原子结构和性质,并研究元素性质的变化规律;也可以根据元素的原子结构推测其在周期表中的位置和性质。
2.预测和发现新元素
科学家依据元素周期律和周期表,对 进行系统研究,可以为新元素的发现,以及预测它们的 和性质提供线索。
原子结构
性质
元素性质
原子结构
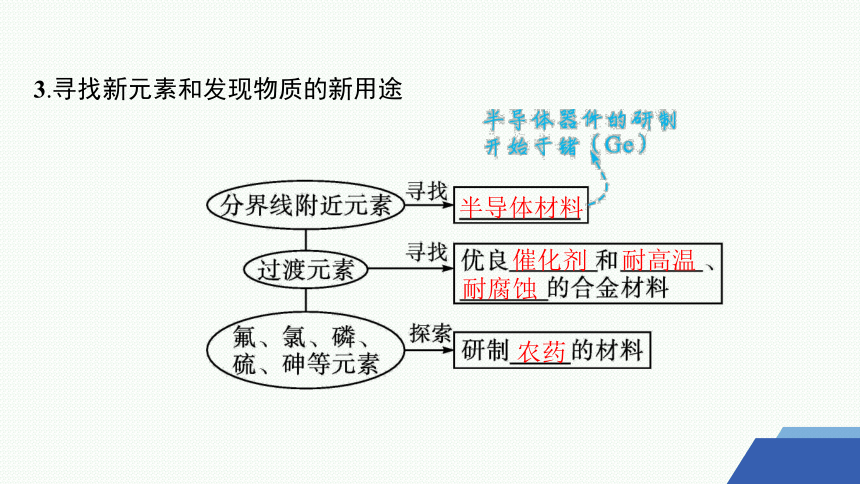
3.寻找新元素和发现物质的新用途
半导体材料
催化剂
耐高温
耐腐蚀
农药
归纳总结
元素周期表中元素的分区
(1)在金属元素与非金属元素分界线的左侧并非都是金属元素,第ⅠA族中还有氢元素。
(2)元素周期表中左下方金属性最强的元素是Cs(Fr是放射性元素,不考虑),右上方非金属性最强的元素是F。
要点图解
元素化合价与原子结构的关系
原子序数与化合价最外层电子数关系图
“序、价”规律
在短周期主族元素中,元素的原子序数与其主要化合价的数值在奇偶性上大多保持一致,即“序奇价奇,序偶价偶”。
归纳总结 元素周期表中结构与性质的递变规律
深度思考
某元素的最低负价为-a,则其最高正价一定为+(8-a)(a>0),该说法是否合理 举例说明。
提示 不正确;O、F等元素不符合这一规律,O无最高正价,F无正化合价。
重难探究·能力素养全提升
探究一 元素周期表中“位—构—性”的关系
情境探究
硒(Se)是人和动物生命所必需的微量元素,湖北省恩施市境内硒矿蕴藏量居世界第一,获得“世界硒都”称号。恩施市产出的各种农作物和中草药里含有大量的硒元素,经常食用可以保护视力,提高免疫力,防癌抗衰老。
在周期表中,34Se与O、S元素同处于第ⅥA族,与33As、35Br元素同处于第四周期,根据34Se元素在周期表中的位置判断(填“>”或“<”):
(1)原子半径:Se As;离子半径:Se2- Br-。
(2)稳定性:H2S H2Se;还原性:AsH3 H2Se。
(3)非金属性:Se O;酸性:H2SeO4 H3AsO4。
<
>
>
>
<
>
方法突破
1.元素周期表中“位—构—性”的关系
2.“位—构—性”的关系解读
应用体验
1.[2023河北保定高一期末]前三周期的四种主族元素X、Y、Z、W,X、Y、Z的相对位置如图,Y的原子序数为X、Z的原子序数之和,W与Z同周期且在同周期主族元素中W的原子半径最大。下列有关叙述正确的是( )
A.简单离子半径:Z>Y>W
B.原子序数:W>Y
C.Z元素最高正化合价为+7价
D.X的最高价氧化物对应的水化物是一种强酸
X Z
Y
D
解析 设X的原子序数为A,Z的原子序数为A+2,Y的原子序数为A+1+8,由题意知:A+1+8=A+A+2,A=7,X、Y、Z分别是氮、硫、氟元素,W与Z同周期且在同周期主族元素中W的原子半径最大,则W是锂元素。Y、Z、W对应的离子分别是S2-、F-、Li+,则离子半径:S2->F->Li+,A错误;由分析知原子序数Y大于W,B错误;氟元素没有正化合价,C错误;X的最高价氧化物对应的水化物是HNO3,是一种强酸,D正确。
思路分析 推断四种元素的思路如下:
(1)分析元素在周期表中相对位置 X、Z处于第二周期,Y处于第三周期。
(2)Y的原子序数为X、Z的原子序数之和,结合同主族元素原子序数的关系
X、Y、Z元素。
(3)W与Z同周期且在同周期主族元素中W的原子半径最大 W元素。
2.[2023湖北黄冈中学高一期末]短周期元素X、Y、Z、Q、W在元素周期表中的位置如表所示,其中Q的最低价氢化物的摩尔质量为34 g·mol-1,X的最低价氢化物不是电解质,则下列说法中正确的是( )
A.原子半径:X>Y>Z
B.Z是自然界中含量最多的元素
C.氧化物对应水化物的酸性:XD.简单氢化物的稳定性:Q X Y
Z Q W
D
解析 Q的最低价氢化物摩尔质量为34 g·mol-1,氢化物是硫化氢或磷化氢,X的最低价氢化物不是电解质,则X是N,Q是P,则Y是O,Z是Al,W是Cl。同周期主族元素自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,原子半径:Al>N>O,A错误;氧元素是自然界中含量最多的元素,B错误;最高价氧化物对应水化物的酸性与元素的非金属性有关,题目未指明最高价氧化物,不能比较其酸性,C错误;非金属性越强,简单氢化物越稳定,O的非金属性大于P,则简单氢化物的稳定性:PH3探究二 短周期主族元素的推断及元素周期律的应用
情境探究
我国“嫦娥五号”探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有短周期元素W、X、Y、Z,其原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。
(1)根据上述信息推断四种元素:
W ,X ,Y ,Z 。
O
Mg
Al
Si
解析 短周期元素W、X、Y、Z的原子序数依次增大,最外层电子数之和为15;X、Y、Z为同周期相邻元素,且均不与W同族,设X的最外层电子数为a,W的最外层电子数为b,Y、Z的最外层电子数分别为a+1、a+2,则a+a+1+a+2+b=15,即3a+b=12。讨论:a=1时b=9(舍弃);a=2时b=6;a=3时b=3(舍弃),结合原子序数大小可知,W为O元素,X为Mg元素,Y为Al元素,Z为Si元素。
(2)最高价氧化物对应水化物的碱性:X (填“>”或“<”,下同)Y;简单气态氢化物的稳定性:W Z。
>
>
方法突破
1.基于短周期主族元素及其化合物的特性推断元素
(1)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(2)地壳中含量最多的元素或简单氢化物在通常情况下呈液态的元素:O。
(3)地壳中含量最多的金属元素:Al。
(4)短周期中非金属性最强的元素:F;短周期中金属性最强的元素:Na。
(5)焰色试验呈黄色的元素:Na;焰色试验呈紫色(透过蓝色钴玻璃观察)的元素:K。
(6)最高价氧化物及其对应水化物既能与强酸反应,又能与强碱反应的元素:Al。
2.基于短周期主族元素原子结构特点推断元素
(1)族序数等于周期序数的元素:H、Be、Al。
(2)族序数等于周期序数2倍的元素:C、S。
(3)最外层电子数等于次外层电子数(或周期序数)3倍的元素:O。
(4)最高正价与最低负价代数和为0的短周期元素:H、C、Si。
(5)短周期中原子半径最大的元素:Na;短周期中原子半径最小的元素:H。
应用体验
1.[2023湖北武汉江岸区高一期末]2022年5月,人类首次利用月球土壤成功种活了植物,未来的航天员们有可能在月球上种植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,常见元素Z的单质是目前使用量最大的主族金属元素。下列叙述中正确的是( )
A.原子半径大小顺序:W>X>Y>Z
B.Y、Z、W的最高价氧化物对应水化物均显碱性,且碱性逐渐减弱
C.元素W和X的简单氢化物的稳定性:XD.X与Y、Z、W分别形成的化合物在常温下均呈固态
D
解析 X原子的最外层电子数是其内层电子总数的3倍,则X为O;W元素在地壳中的含量位居第二,则W为Si;元素Z的单质是目前使用量最大的主族金属元素,则Z为Al;X、Y、W的原子核外最外层电子数为互不相等的偶数,X最外层电子数为6,W最外层电子数为4,则Y为主族元素,且原子序数介于X与Z之间,Y最外层电子数为2,故Y为Mg。一般电子层数多,半径大,同周期主族元素,从左到右原子半径依次减小,则原子半径:Y>Z>W>X,A错误;Mg(OH)2显碱性,Al(OH)3为两性氢氧化物,H2SiO3显酸性,B错误;W为Si,X为O,非金属性:Si思路分析 推断四种元素的思路如下:
(1)X原子的最外层电子数是其内层电子总数的3倍 X是O元素。
(2)W元素在地壳中的含量位居第二 W是Si元素。
(3)常见元素Z的单质是目前使用量最大的主族金属元素 Z是Al元素。
(4)X、Y、W的原子核外最外层电子数为互不相等的偶数 Y元素的名称。
2.[2023广东江门高一期末]短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y是短周期中金属性最强的元素,X和Z同主族。下列说法不正确的是( )
A.原子半径:r(X)B.简单氢化物的稳定性:ZC.最高价氧化物对应的水化物的酸性:ZD.简单阴离子的还原性:WA
解析 X是地壳中含量最多的元素,为O元素,Y是短周期中金属性最强的元素,是Na元素,X和Z同主族,Z为S元素,W为Cl元素。同周期主族元素原子从左到右半径减小,电子层数越多半径越大,原子半径大小顺序为r(O)学以致用·随堂检测全达标
1
2
3
4
1.[2023广东惠州高一期末]某元素最高价含氧酸的化学式是H2RO4,该元素的气态氢化物化学式可表示为( )
A.HR B.H2R
C.RH3 D.不能确定
B
解析 某元素最高价含氧酸的化学式是H2RO4,R显+6价,则R的最低负价为-2价,推知其气态氢化物为H2R。
1
2
3
4
2.[2023湖北黄石高一期末]元素周期表中的金属和非金属元素的分界线处用虚线表示。下列说法正确的是( )
A.元素的性质总在不断发生明显的变化
B.紧靠虚线两侧的元素都是两性金属元素
C.可在虚线附近寻找半导体材料(如Ge、Si等)
D.可在虚线的右上方寻找耐高温材料
C
1
2
3
4
解析 同主族元素的性质是相似的,同周期元素的性质是递变的,A错误;紧靠虚线两侧的元素既表现金属性又表现非金属性,但没有两性金属元素这一说法,B错误;耐高温材料应该在过渡元素中寻找,D错误。
1
2
3
4
3.根据元素周期律和元素周期表,下列推断不合理的是( )
A.第8号元素的最高化合价是+6
B.第七周期0族元素的原子序数是118
C.第53号元素的单质在常温常压下是固体
D.位于第四周期第ⅣA族的元素的单质可作半导体
A
解析 第8号元素是O元素,无最高正化合价,A错误;第七周期0族元素处于该周期最后一种,其原子序数为118,B正确;第53号元素是I元素,其单质是I2,在常温下呈固态,C正确;第四周期第ⅣA族元素是Ge元素,其单质是半导体材料,D正确。
1
2
3
4
4.短周期元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,则下列叙述正确的是( )
A.还原性:Z->Y2- B.原子半径:W>X>Y>Z
C.离子半径:Y2->Z->X+>W3+ D.原子序数:d>c>b>a
C
解析 具有相同的电子层结构时,各离子核外电子总数相等,则有a-3=b-1=c+2=d+1,则原子序数:a>b>d>c,D错误。Y、Z处于第二周期,W、X处于第三周期,推知W是Al元素,X是Na元素,Y是O元素,Z是F元素。由于非金属性:OF-,A错误;原子半径:Na>Al>O>F,B错误;电子层结构相同时,核电荷数越小,离子半径越大,故离子半径:O2->F->Na+>Al3+,C正确。
本 课 结 束
第四章
第二节 第2课时 元素周期表和元素周期律的应用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.基于元素“位置—结构—性质”认识元素性质,基于物质“结构—性质—用途”认识物质的性质,基于性质递变的本质原因认识物质世界,发展证据推理与模型认知的学科核心素养。
2.加深对分类法、归纳法等学科方法的认识,提高逻辑推理能力、论证能力,发展证据推理与模型认知的学科核心素养。
基础落实·必备知识全过关
一、元素周期表的分区和元素化合价规律
1.元素周期表与元素周期律的关系
是 的表现形式,反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。
元素周期表
元素周期律
2.元素周期表中金属元素与非金属元素的分区
(1)虚线左下方是_______元素,虚线右上方是__________元素,最右一个纵列是__________元素。
(2)元素的金属性和非金属性之间并没有严格的界限,位于分界线附近的元素既能表现出一定的___________,又能表现出一定的___________。
金属
非金属
稀有气体
金属性
非金属性
3.元素的化合价与元素在周期表中的位置关系
(1)价电子
①含义:元素的化合价与原子的 电子数有密切的关系,所以元素原子的 中的电子也叫价电子。
②具体内容:主族元素原子的价电子是 中的电子;对于副族元素,有些元素的化合价与原子的 或倒数第三层的部分电子有关,这部分电子也叫价电子。
最外层
最外电子层
最外电子层
次外层
(2)化合价规律
①主族元素的最高正化合价=所处的 = (O、F除外)。
②非金属元素的最高正化合价等于原子所能失去或偏移的 ;最低负化合价等于使原子达到 稳定结构所需得到的电子数。
③对于非金属元素:最高正化合价+|最低负化合价|=8。
H、B、O、F等非金属元素除外
族序数
最外层电子数
最外层电子数
8电子
二、元素周期表和元素周期律的应用
1.元素周期表中“位—构—性”的关系
元素在周期表中的位置,反映了元素的 和 ,可以根据元素在周期表中的位置推测其原子结构和性质,并研究元素性质的变化规律;也可以根据元素的原子结构推测其在周期表中的位置和性质。
2.预测和发现新元素
科学家依据元素周期律和周期表,对 进行系统研究,可以为新元素的发现,以及预测它们的 和性质提供线索。
原子结构
性质
元素性质
原子结构
3.寻找新元素和发现物质的新用途
半导体材料
催化剂
耐高温
耐腐蚀
农药
归纳总结
元素周期表中元素的分区
(1)在金属元素与非金属元素分界线的左侧并非都是金属元素,第ⅠA族中还有氢元素。
(2)元素周期表中左下方金属性最强的元素是Cs(Fr是放射性元素,不考虑),右上方非金属性最强的元素是F。
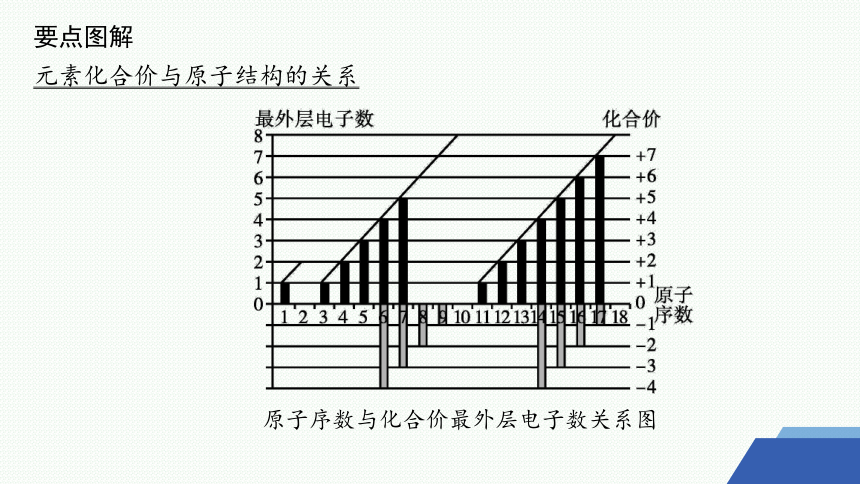
要点图解
元素化合价与原子结构的关系
原子序数与化合价最外层电子数关系图
“序、价”规律
在短周期主族元素中,元素的原子序数与其主要化合价的数值在奇偶性上大多保持一致,即“序奇价奇,序偶价偶”。
归纳总结 元素周期表中结构与性质的递变规律
深度思考
某元素的最低负价为-a,则其最高正价一定为+(8-a)(a>0),该说法是否合理 举例说明。
提示 不正确;O、F等元素不符合这一规律,O无最高正价,F无正化合价。
重难探究·能力素养全提升
探究一 元素周期表中“位—构—性”的关系
情境探究
硒(Se)是人和动物生命所必需的微量元素,湖北省恩施市境内硒矿蕴藏量居世界第一,获得“世界硒都”称号。恩施市产出的各种农作物和中草药里含有大量的硒元素,经常食用可以保护视力,提高免疫力,防癌抗衰老。
在周期表中,34Se与O、S元素同处于第ⅥA族,与33As、35Br元素同处于第四周期,根据34Se元素在周期表中的位置判断(填“>”或“<”):
(1)原子半径:Se As;离子半径:Se2- Br-。
(2)稳定性:H2S H2Se;还原性:AsH3 H2Se。
(3)非金属性:Se O;酸性:H2SeO4 H3AsO4。
<
>
>
>
<
>
方法突破
1.元素周期表中“位—构—性”的关系
2.“位—构—性”的关系解读
应用体验
1.[2023河北保定高一期末]前三周期的四种主族元素X、Y、Z、W,X、Y、Z的相对位置如图,Y的原子序数为X、Z的原子序数之和,W与Z同周期且在同周期主族元素中W的原子半径最大。下列有关叙述正确的是( )
A.简单离子半径:Z>Y>W
B.原子序数:W>Y
C.Z元素最高正化合价为+7价
D.X的最高价氧化物对应的水化物是一种强酸
X Z
Y
D
解析 设X的原子序数为A,Z的原子序数为A+2,Y的原子序数为A+1+8,由题意知:A+1+8=A+A+2,A=7,X、Y、Z分别是氮、硫、氟元素,W与Z同周期且在同周期主族元素中W的原子半径最大,则W是锂元素。Y、Z、W对应的离子分别是S2-、F-、Li+,则离子半径:S2->F->Li+,A错误;由分析知原子序数Y大于W,B错误;氟元素没有正化合价,C错误;X的最高价氧化物对应的水化物是HNO3,是一种强酸,D正确。
思路分析 推断四种元素的思路如下:
(1)分析元素在周期表中相对位置 X、Z处于第二周期,Y处于第三周期。
(2)Y的原子序数为X、Z的原子序数之和,结合同主族元素原子序数的关系
X、Y、Z元素。
(3)W与Z同周期且在同周期主族元素中W的原子半径最大 W元素。
2.[2023湖北黄冈中学高一期末]短周期元素X、Y、Z、Q、W在元素周期表中的位置如表所示,其中Q的最低价氢化物的摩尔质量为34 g·mol-1,X的最低价氢化物不是电解质,则下列说法中正确的是( )
A.原子半径:X>Y>Z
B.Z是自然界中含量最多的元素
C.氧化物对应水化物的酸性:X
Z Q W
D
解析 Q的最低价氢化物摩尔质量为34 g·mol-1,氢化物是硫化氢或磷化氢,X的最低价氢化物不是电解质,则X是N,Q是P,则Y是O,Z是Al,W是Cl。同周期主族元素自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,原子半径:Al>N>O,A错误;氧元素是自然界中含量最多的元素,B错误;最高价氧化物对应水化物的酸性与元素的非金属性有关,题目未指明最高价氧化物,不能比较其酸性,C错误;非金属性越强,简单氢化物越稳定,O的非金属性大于P,则简单氢化物的稳定性:PH3
情境探究
我国“嫦娥五号”探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有短周期元素W、X、Y、Z,其原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。
(1)根据上述信息推断四种元素:
W ,X ,Y ,Z 。
O
Mg
Al
Si
解析 短周期元素W、X、Y、Z的原子序数依次增大,最外层电子数之和为15;X、Y、Z为同周期相邻元素,且均不与W同族,设X的最外层电子数为a,W的最外层电子数为b,Y、Z的最外层电子数分别为a+1、a+2,则a+a+1+a+2+b=15,即3a+b=12。讨论:a=1时b=9(舍弃);a=2时b=6;a=3时b=3(舍弃),结合原子序数大小可知,W为O元素,X为Mg元素,Y为Al元素,Z为Si元素。
(2)最高价氧化物对应水化物的碱性:X (填“>”或“<”,下同)Y;简单气态氢化物的稳定性:W Z。
>
>
方法突破
1.基于短周期主族元素及其化合物的特性推断元素
(1)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(2)地壳中含量最多的元素或简单氢化物在通常情况下呈液态的元素:O。
(3)地壳中含量最多的金属元素:Al。
(4)短周期中非金属性最强的元素:F;短周期中金属性最强的元素:Na。
(5)焰色试验呈黄色的元素:Na;焰色试验呈紫色(透过蓝色钴玻璃观察)的元素:K。
(6)最高价氧化物及其对应水化物既能与强酸反应,又能与强碱反应的元素:Al。
2.基于短周期主族元素原子结构特点推断元素
(1)族序数等于周期序数的元素:H、Be、Al。
(2)族序数等于周期序数2倍的元素:C、S。
(3)最外层电子数等于次外层电子数(或周期序数)3倍的元素:O。
(4)最高正价与最低负价代数和为0的短周期元素:H、C、Si。
(5)短周期中原子半径最大的元素:Na;短周期中原子半径最小的元素:H。
应用体验
1.[2023湖北武汉江岸区高一期末]2022年5月,人类首次利用月球土壤成功种活了植物,未来的航天员们有可能在月球上种植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,常见元素Z的单质是目前使用量最大的主族金属元素。下列叙述中正确的是( )
A.原子半径大小顺序:W>X>Y>Z
B.Y、Z、W的最高价氧化物对应水化物均显碱性,且碱性逐渐减弱
C.元素W和X的简单氢化物的稳定性:X
D
解析 X原子的最外层电子数是其内层电子总数的3倍,则X为O;W元素在地壳中的含量位居第二,则W为Si;元素Z的单质是目前使用量最大的主族金属元素,则Z为Al;X、Y、W的原子核外最外层电子数为互不相等的偶数,X最外层电子数为6,W最外层电子数为4,则Y为主族元素,且原子序数介于X与Z之间,Y最外层电子数为2,故Y为Mg。一般电子层数多,半径大,同周期主族元素,从左到右原子半径依次减小,则原子半径:Y>Z>W>X,A错误;Mg(OH)2显碱性,Al(OH)3为两性氢氧化物,H2SiO3显酸性,B错误;W为Si,X为O,非金属性:Si
(1)X原子的最外层电子数是其内层电子总数的3倍 X是O元素。
(2)W元素在地壳中的含量位居第二 W是Si元素。
(3)常见元素Z的单质是目前使用量最大的主族金属元素 Z是Al元素。
(4)X、Y、W的原子核外最外层电子数为互不相等的偶数 Y元素的名称。
2.[2023广东江门高一期末]短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y是短周期中金属性最强的元素,X和Z同主族。下列说法不正确的是( )
A.原子半径:r(X)
解析 X是地壳中含量最多的元素,为O元素,Y是短周期中金属性最强的元素,是Na元素,X和Z同主族,Z为S元素,W为Cl元素。同周期主族元素原子从左到右半径减小,电子层数越多半径越大,原子半径大小顺序为r(O)
1
2
3
4
1.[2023广东惠州高一期末]某元素最高价含氧酸的化学式是H2RO4,该元素的气态氢化物化学式可表示为( )
A.HR B.H2R
C.RH3 D.不能确定
B
解析 某元素最高价含氧酸的化学式是H2RO4,R显+6价,则R的最低负价为-2价,推知其气态氢化物为H2R。
1
2
3
4
2.[2023湖北黄石高一期末]元素周期表中的金属和非金属元素的分界线处用虚线表示。下列说法正确的是( )
A.元素的性质总在不断发生明显的变化
B.紧靠虚线两侧的元素都是两性金属元素
C.可在虚线附近寻找半导体材料(如Ge、Si等)
D.可在虚线的右上方寻找耐高温材料
C
1
2
3
4
解析 同主族元素的性质是相似的,同周期元素的性质是递变的,A错误;紧靠虚线两侧的元素既表现金属性又表现非金属性,但没有两性金属元素这一说法,B错误;耐高温材料应该在过渡元素中寻找,D错误。
1
2
3
4
3.根据元素周期律和元素周期表,下列推断不合理的是( )
A.第8号元素的最高化合价是+6
B.第七周期0族元素的原子序数是118
C.第53号元素的单质在常温常压下是固体
D.位于第四周期第ⅣA族的元素的单质可作半导体
A
解析 第8号元素是O元素,无最高正化合价,A错误;第七周期0族元素处于该周期最后一种,其原子序数为118,B正确;第53号元素是I元素,其单质是I2,在常温下呈固态,C正确;第四周期第ⅣA族元素是Ge元素,其单质是半导体材料,D正确。
1
2
3
4
4.短周期元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,则下列叙述正确的是( )
A.还原性:Z->Y2- B.原子半径:W>X>Y>Z
C.离子半径:Y2->Z->X+>W3+ D.原子序数:d>c>b>a
C
解析 具有相同的电子层结构时,各离子核外电子总数相等,则有a-3=b-1=c+2=d+1,则原子序数:a>b>d>c,D错误。Y、Z处于第二周期,W、X处于第三周期,推知W是Al元素,X是Na元素,Y是O元素,Z是F元素。由于非金属性:O
本 课 结 束
