4.1.2 元素周期表 核素课件(共49张PPT)2023-2024学年高一化学人教版必修1
文档属性
| 名称 | 4.1.2 元素周期表 核素课件(共49张PPT)2023-2024学年高一化学人教版必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览









文档简介
(共49张PPT)
第四章
第一节 第2课时 元素周期表 核素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.通过了解元素周期表的结构,认识原子结构与元素在元素周期表中位置间的关系,发展证据推理与模型认知的学科核心素养。
2.知道质量数和 的含义,知道元素、核素、同位素的含义,发展宏观辨识与微观探析的学科核心素养。
基础落实·必备知识全过关
一、元素周期表
1.元素周期表的发展历程
门捷列夫
相对原子质量
化学性质
相对原子质量
核电荷数
2.原子序数
(1)含义:按照元素在周期表中的 给元素编号,得到原子序数。
(2)原子序数与元素的原子结构的关系:原子序数=核电荷数=质子数= 。
3.元素周期表的编排原则
顺序
核外电子数
电子层数目
原子序数
最外层电子数
电子层数
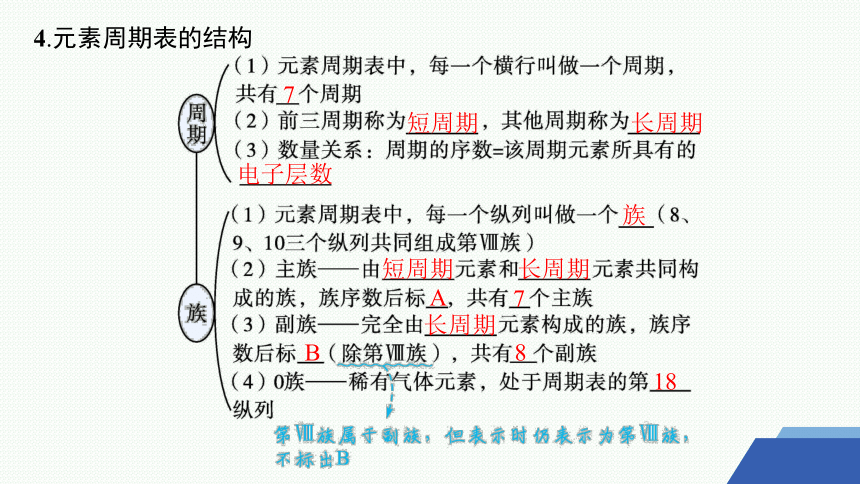
4.元素周期表的结构
7
短周期
长周期
电子层数
族
短周期
长周期
A
7
长周期
B
8
18
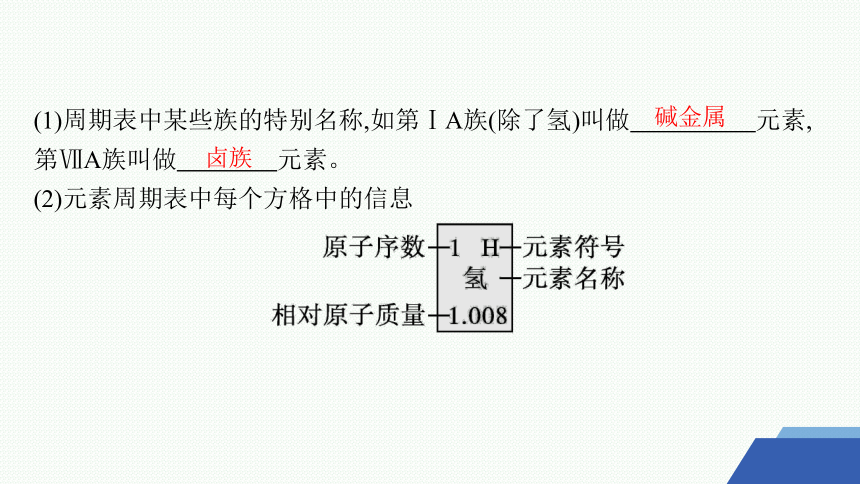
(1)周期表中某些族的特别名称,如第ⅠA族(除了氢)叫做 元素,第ⅦA族叫做 元素。
(2)元素周期表中每个方格中的信息
碱金属
卤族
二、核素
1.元素
(1)元素是具有相同 (核电荷数)的一类原子的总称。同种元素原子的原子核中 是相同的。
(2)精确的测定结果证明,同种元素原子的原子核中, 不一定相同。
质子数
质子数
中子数
2.核素
(1)含义
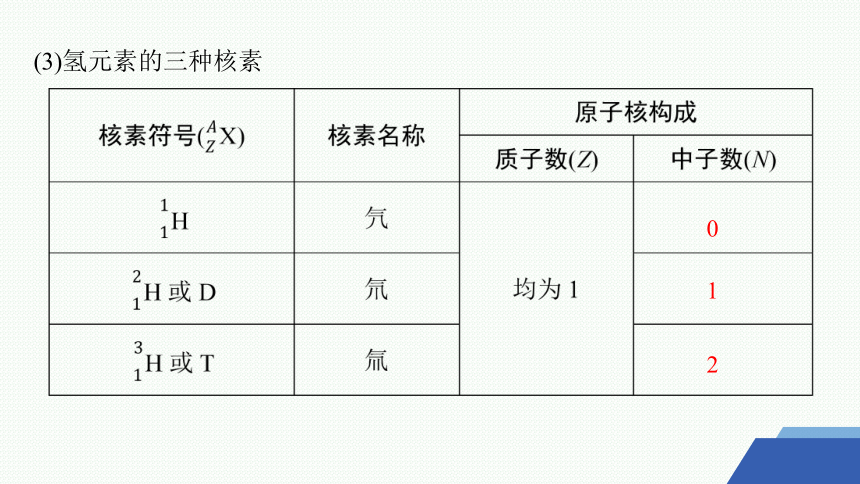
具有一定数目 和一定数目 的一种原子叫做核素。例如,
是氢元素的三种不同核素。
(2)表示方法
核素可以表示为 ,代表质量数为 ,质子数为 的X原子。
质子
中子
A
Z
(3)氢元素的三种核素
0
1
2
3.同位素
(1)含义
相同而 不同的同一元素的不同原子互称为同位素。
例如, 互为同位素。
质子数
中子数
(2)同位素的特点
位置 因质子数相同,故元素符号相同,在元素周期表中占据相同的
(即同位)
结构 质子数相同, 不同
性质 互为同位素的原子核外电子层结构相同,因此 性质几乎完全相同;因质量数不同, 性质略有差异
存在 天然存在的同位素,相互间保持一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值
(3)同位素的用途
①考古时,利用 测定一些文物的年代; 用于制造氢弹。
②利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
位置
中子数
化学
物理
14C
2H和3H
归纳总结
对于族的理解
(1)族包括三种类型:主族、副族和0族,主族元素的族序号后标A,副族元素的族序号后标B(第Ⅷ族除外)。
(2)元素周期表中从第ⅢB族到第ⅡB族,共有10个纵列,全部是金属元素,统称为过渡元素。
(3)第Ⅷ族属于副族,但表示时仍表示为第Ⅷ族,不标出B。
(4)第ⅢB族(第3个纵列)是所含元素种类最多的族,包括镧系元素、锕系元素,共有32种元素。
易错警示
族与原子结构的关系
(1)原子最外层电子数相同的元素不一定在同一族,如He、Mg最外层电子数均为2,前者处于0族,后者处于第ⅡA族。
(2)同族元素原子的最外层电子数不一定相同,如0族和某些副族,但同主族元素原子最外层电子数一定相同。
(3)第ⅠA族并非都是碱金属元素,还有氢元素。
记忆口诀
巧记元素周期表的结构
横行叫周期,现有一至七;
三四分长短,四长副族现;
竖列称作族,总共十六族;
Ⅷ族最特殊,三列是一族;
二三分主副,先主后副族;
镧锕各十五,均属第ⅢB族。
归纳总结
多角度认识元素
(1)元素是宏观概念,只讲种类不讲个数,其存在形式有游离态和化合态 两种。
(2)元素的种类是由质子数决定的,只要质子数相同就属于同一种元素。
易错辨析
(1)元素周期表中第一周期只有两种元素,第二、三周期均有8种元素。
( )
(2)第四、五周期均有18种元素,第六、七周期均有32种元素。( )
(3)元素周期表中包含元素种类最多的族是第ⅠA族。( )
(4)若将来第八、九周期的元素全部被发现,预测这两个周期均有50种元素。
( )
√
√
×
√
提示 (3)元素周期表中包含元素种类最多的族是第ⅢB族,含有32种元素。
归纳总结
多角度认识核素
(1)核素属于微观概念,核素界定的是一种原子,它由质子数和中子数共同确定。
(2)同一元素的不同核素,中子数不同、质量数不同,但质子数一定相同。
(3)除少数元素只有一种核素外,大多数元素都包含多种核素,故核素种类远大于元素种类。
(4)同一元素的不同核素之间的转化不是化学变化。
归纳总结
同位素的“六同”和“三不同”
深度思考
若某元素原子的最外层有2个电子,则该元素一定处于周期表的第ⅡA族,这种说法正确吗 举例说明。
提示 不正确;如He原子最外层有2个电子,但He元素处于周期表的0族。
重难探究·能力素养全提升
探究一 元素周期表的结构及应用
情境探究
1869年2月,俄国化学家门捷列夫给当时已经发现的63种元素设计并建造了新家——元素周期表,具有相同电子层数的元素被分在同一个楼层(同周期),具有相似性质的元素分在同一个单元(同族),并留下了一些空格,预示着这些元素的存在,部分记录如图所示。在元素周期表的指导下,人们“按图索骥”发现了这些元素。
(1)图中门捷列夫排列元素的依据是什么 图中元素排列有什么规律
(2)试确定图中甲、乙元素在现行元素周期表中的位置:
、 。
提示 依据是相对原子质量由小到大;图中同一周期元素排成一纵列,同一主族元素排成一横行。
第四周期第ⅢA族
第四周期第ⅣA族
方法突破
1.元素周期表的结构及规律
2.推测元素在周期表中的具体位置
(1)利用元素的位置与原子结构的关系推断
该方法常用于确定前20号元素,推断依据:①周期序数=电子层数;②主族序数=最外层电子数;③原子序数=核电荷数=质子数=核外电子数。
(2)利用“0族定位法”推断元素在周期表中位置
①0族元素的原子序数和所在周期序数
0族元素 He Ne Ar Kr Xe Rn Og
周期 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
②若比相近的稀有气体的原子序数多1或2,则该元素处于下一周期的第ⅠA族或第ⅡA族,如37号元素比36号(Kr)的原子序数多1,则该元素处于第五周期第ⅠA族。
③若比相近的稀有气体的原子序数小1~5时,则该元素在同周期的第ⅢA族~第ⅦA族,如84号元素比86号(Rn)的原子序数小2,则该元素处于第六周期第ⅥA族。
(3)利用“阴上阳下”规律推断元素在周期表中相对位置
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dRn-的电子层结构相同,则四种元素在周期表中相对位置关系如下:
…… cZ dR
bY aX ……
则四种元素的原子序数:a>b>d>c。
应用体验
1.X、Y、Z都为短周期元素,它们在周期表中的位置如图所示:
已知X、Y两元素原子序数之和等于Z元素的原子序数,下列说法正确的是
( )
A.元素X的原子序数为7
B.元素Y位于第ⅥA族
C.元素Z位于第四周期
D.元素Z原子的最外层有5个电子
A
解析 由三种元素的相对位置可知,X、Y处于第二周期,Z处于第三周期,设X的原子序数为x,则Y、Z的原子序数分别为x+2、x+9,又知“X、Y两元素原子序数之和等于Z元素的原子序数”,则有x+x+2=x+9,解得x=7,从而推知X、Y、Z分别代表N、F、S元素。元素X是N,其原子序数为7,A正确;元素Y是F,位于第ⅦA族,B错误;元素Z是S,位于第三周期第ⅥA族,C错误;元素Z是S,S原子最外层有6个电子,D错误。
2.甲、乙两种元素的原子序数递增且其原子的第2层电子数均为其他层电子总数的2倍。下列判断正确的是( )
A.甲、乙分别是镁和碳元素
B.甲、乙在元素周期表中处于同一周期
C.甲、乙在元素周期表中处于同一主族
D.甲和乙的原子序数之和是偶数
D
解析 甲、乙两元素原子的第2层电子数都是其他层电子总数的2倍,则两种原子的核外电子排布为2、4或2、8、2,从而推知甲、乙元素是碳、镁,二者既不处于同周期,也不处于同主族,A、B、C项均错误。碳、镁的原子序数分别为6和12,二者原子序数之和为18,是偶数,D正确。
探究二 核素和同位素及其判断
情境探究
硒(Se)是人体重要的微量元素之一,可以增强人体免疫功能、抗氧化、延缓衰老,并能有效抑制肿瘤生长,对手术和放化疗治疗后的患者有很好的辅助改善作用。人体缺硒易引发克山病、大骨节病、关节炎、心血管病等疾病。
方法突破
1.元素、核素、同位素和同素异形体的比较
类型 元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 原子或离子 原子 原子 单质
特性 只有种类,没有个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
决定 因素 质子数 (核电荷数) 质子数、中子数 质子数、中子数 组成元素、分子结构
2.元素、核素、同位素和同素异形体的联系
3.核素和同位素的判断
应用体验
1.[2023四川达州高一期末]铟(In)与铝是同族元素。下列说法不正确的是
( )
B
【变式设问】
2.[2023广东实验中学高一期末]239Pu是“于敏型”氢弹的重要原料。下列说法正确的是( )
A.239Pu原子的原子核中含有239个质子
B.239Pu衰变成235U属于化学变化
C.238Pu、239Pu和241Pu属于不同的核素
D.238Pu与238U在元素周期表中的位置相同
C
解析 239Pu中的239表示的是其质量数,A错误;由于化学变化不涉及原子核的变化,故元素的衰变不是化学变化,B错误;核素的种类是由质子数和中子数共同决定的,238Pu、239Pu和241Pu属于同种元素的不同核素,C正确;238Pu与238U核电荷数不相同,属于不同的元素,在元素周期表中的位置不同,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.元素硫在周期表中的位置是( )
A.第二周期第ⅣA族
B.第二周期第ⅥA族
C.第三周期第ⅣA族
D.第三周期第ⅥA族
D
解析 硫元素的原子序数为16,处于第三周期第ⅥA族。
1
2
3
4
5
2.元素碳有多种同位素,这些同位素具有相同的( )
A.质量数和电子数
B.质子数和电子数
C.质子数和中子数
D.质量数和中子数
B
解析 碳有多种同位素,其质子数、核电荷数和核外电子数相同,中子数、质量数不同。
1
2
3
4
5
3.[2023天津市实验中学高一期末]下列不属于短周期元素的是( )
A.S
B.Na
C.Ar
D.Br
D
解析 短周期元素是指周期表中前三周期的元素,S、Na、Ar都是第三周期元素,都是短周期元素。Br是第四周期元素,属于长周期元素。
1
2
3
4
5
4.[2023上海市第四中学高一期末]符号 中左上角的37代表( )
A.元素的质量数
B.原子的质量数
C.元素的平均相对原子质量
D.元素的近似相对原子质量
B
解析 元素符号的左上角是原子的质量数,而不是元素的质量数(中子数已经确定),A错误,B正确;元素符号的左上角是原子的质量数,不是元素的平均相对原子质量,可以是这种原子的近似相对原子质量,C、D错误。
1
2
3
4
5
5.如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 N O F X
三 Na Y Al Si S Cl
(1)X、Y两种元素符号分别是
和 。
(2)Mg的原子序数为 。
(3)氧元素位于第二周期第
族。
(4)表中某原子最外层电子数为4,其元素符号是 。
(5)NH3中N元素的化合价为 价,其水溶液呈 (填“酸性”或“碱性”)。
(6)Cl2与水反应的生成物中具有漂白作用的是 ,写出该反应的化学方程式: 。
答案 (1)Ne Mg
(2)12
(3)ⅥA
(4)Si
(5)-3 碱性
(6)HClO Cl2+H2O HCl+HClO
1
2
3
4
5
本 课 结 束
第四章
第一节 第2课时 元素周期表 核素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
学以致用·随堂检测全达标
素养 目标 1.通过了解元素周期表的结构,认识原子结构与元素在元素周期表中位置间的关系,发展证据推理与模型认知的学科核心素养。
2.知道质量数和 的含义,知道元素、核素、同位素的含义,发展宏观辨识与微观探析的学科核心素养。
基础落实·必备知识全过关
一、元素周期表
1.元素周期表的发展历程
门捷列夫
相对原子质量
化学性质
相对原子质量
核电荷数
2.原子序数
(1)含义:按照元素在周期表中的 给元素编号,得到原子序数。
(2)原子序数与元素的原子结构的关系:原子序数=核电荷数=质子数= 。
3.元素周期表的编排原则
顺序
核外电子数
电子层数目
原子序数
最外层电子数
电子层数
4.元素周期表的结构
7
短周期
长周期
电子层数
族
短周期
长周期
A
7
长周期
B
8
18
(1)周期表中某些族的特别名称,如第ⅠA族(除了氢)叫做 元素,第ⅦA族叫做 元素。
(2)元素周期表中每个方格中的信息
碱金属
卤族
二、核素
1.元素
(1)元素是具有相同 (核电荷数)的一类原子的总称。同种元素原子的原子核中 是相同的。
(2)精确的测定结果证明,同种元素原子的原子核中, 不一定相同。
质子数
质子数
中子数
2.核素
(1)含义
具有一定数目 和一定数目 的一种原子叫做核素。例如,
是氢元素的三种不同核素。
(2)表示方法
核素可以表示为 ,代表质量数为 ,质子数为 的X原子。
质子
中子
A
Z
(3)氢元素的三种核素
0
1
2
3.同位素
(1)含义
相同而 不同的同一元素的不同原子互称为同位素。
例如, 互为同位素。
质子数
中子数
(2)同位素的特点
位置 因质子数相同,故元素符号相同,在元素周期表中占据相同的
(即同位)
结构 质子数相同, 不同
性质 互为同位素的原子核外电子层结构相同,因此 性质几乎完全相同;因质量数不同, 性质略有差异
存在 天然存在的同位素,相互间保持一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值
(3)同位素的用途
①考古时,利用 测定一些文物的年代; 用于制造氢弹。
②利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
位置
中子数
化学
物理
14C
2H和3H
归纳总结
对于族的理解
(1)族包括三种类型:主族、副族和0族,主族元素的族序号后标A,副族元素的族序号后标B(第Ⅷ族除外)。
(2)元素周期表中从第ⅢB族到第ⅡB族,共有10个纵列,全部是金属元素,统称为过渡元素。
(3)第Ⅷ族属于副族,但表示时仍表示为第Ⅷ族,不标出B。
(4)第ⅢB族(第3个纵列)是所含元素种类最多的族,包括镧系元素、锕系元素,共有32种元素。
易错警示
族与原子结构的关系
(1)原子最外层电子数相同的元素不一定在同一族,如He、Mg最外层电子数均为2,前者处于0族,后者处于第ⅡA族。
(2)同族元素原子的最外层电子数不一定相同,如0族和某些副族,但同主族元素原子最外层电子数一定相同。
(3)第ⅠA族并非都是碱金属元素,还有氢元素。
记忆口诀
巧记元素周期表的结构
横行叫周期,现有一至七;
三四分长短,四长副族现;
竖列称作族,总共十六族;
Ⅷ族最特殊,三列是一族;
二三分主副,先主后副族;
镧锕各十五,均属第ⅢB族。
归纳总结
多角度认识元素
(1)元素是宏观概念,只讲种类不讲个数,其存在形式有游离态和化合态 两种。
(2)元素的种类是由质子数决定的,只要质子数相同就属于同一种元素。
易错辨析
(1)元素周期表中第一周期只有两种元素,第二、三周期均有8种元素。
( )
(2)第四、五周期均有18种元素,第六、七周期均有32种元素。( )
(3)元素周期表中包含元素种类最多的族是第ⅠA族。( )
(4)若将来第八、九周期的元素全部被发现,预测这两个周期均有50种元素。
( )
√
√
×
√
提示 (3)元素周期表中包含元素种类最多的族是第ⅢB族,含有32种元素。
归纳总结
多角度认识核素
(1)核素属于微观概念,核素界定的是一种原子,它由质子数和中子数共同确定。
(2)同一元素的不同核素,中子数不同、质量数不同,但质子数一定相同。
(3)除少数元素只有一种核素外,大多数元素都包含多种核素,故核素种类远大于元素种类。
(4)同一元素的不同核素之间的转化不是化学变化。
归纳总结
同位素的“六同”和“三不同”
深度思考
若某元素原子的最外层有2个电子,则该元素一定处于周期表的第ⅡA族,这种说法正确吗 举例说明。
提示 不正确;如He原子最外层有2个电子,但He元素处于周期表的0族。
重难探究·能力素养全提升
探究一 元素周期表的结构及应用
情境探究
1869年2月,俄国化学家门捷列夫给当时已经发现的63种元素设计并建造了新家——元素周期表,具有相同电子层数的元素被分在同一个楼层(同周期),具有相似性质的元素分在同一个单元(同族),并留下了一些空格,预示着这些元素的存在,部分记录如图所示。在元素周期表的指导下,人们“按图索骥”发现了这些元素。
(1)图中门捷列夫排列元素的依据是什么 图中元素排列有什么规律
(2)试确定图中甲、乙元素在现行元素周期表中的位置:
、 。
提示 依据是相对原子质量由小到大;图中同一周期元素排成一纵列,同一主族元素排成一横行。
第四周期第ⅢA族
第四周期第ⅣA族
方法突破
1.元素周期表的结构及规律
2.推测元素在周期表中的具体位置
(1)利用元素的位置与原子结构的关系推断
该方法常用于确定前20号元素,推断依据:①周期序数=电子层数;②主族序数=最外层电子数;③原子序数=核电荷数=质子数=核外电子数。
(2)利用“0族定位法”推断元素在周期表中位置
①0族元素的原子序数和所在周期序数
0族元素 He Ne Ar Kr Xe Rn Og
周期 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
②若比相近的稀有气体的原子序数多1或2,则该元素处于下一周期的第ⅠA族或第ⅡA族,如37号元素比36号(Kr)的原子序数多1,则该元素处于第五周期第ⅠA族。
③若比相近的稀有气体的原子序数小1~5时,则该元素在同周期的第ⅢA族~第ⅦA族,如84号元素比86号(Rn)的原子序数小2,则该元素处于第六周期第ⅥA族。
(3)利用“阴上阳下”规律推断元素在周期表中相对位置
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dRn-的电子层结构相同,则四种元素在周期表中相对位置关系如下:
…… cZ dR
bY aX ……
则四种元素的原子序数:a>b>d>c。
应用体验
1.X、Y、Z都为短周期元素,它们在周期表中的位置如图所示:
已知X、Y两元素原子序数之和等于Z元素的原子序数,下列说法正确的是
( )
A.元素X的原子序数为7
B.元素Y位于第ⅥA族
C.元素Z位于第四周期
D.元素Z原子的最外层有5个电子
A
解析 由三种元素的相对位置可知,X、Y处于第二周期,Z处于第三周期,设X的原子序数为x,则Y、Z的原子序数分别为x+2、x+9,又知“X、Y两元素原子序数之和等于Z元素的原子序数”,则有x+x+2=x+9,解得x=7,从而推知X、Y、Z分别代表N、F、S元素。元素X是N,其原子序数为7,A正确;元素Y是F,位于第ⅦA族,B错误;元素Z是S,位于第三周期第ⅥA族,C错误;元素Z是S,S原子最外层有6个电子,D错误。
2.甲、乙两种元素的原子序数递增且其原子的第2层电子数均为其他层电子总数的2倍。下列判断正确的是( )
A.甲、乙分别是镁和碳元素
B.甲、乙在元素周期表中处于同一周期
C.甲、乙在元素周期表中处于同一主族
D.甲和乙的原子序数之和是偶数
D
解析 甲、乙两元素原子的第2层电子数都是其他层电子总数的2倍,则两种原子的核外电子排布为2、4或2、8、2,从而推知甲、乙元素是碳、镁,二者既不处于同周期,也不处于同主族,A、B、C项均错误。碳、镁的原子序数分别为6和12,二者原子序数之和为18,是偶数,D正确。
探究二 核素和同位素及其判断
情境探究
硒(Se)是人体重要的微量元素之一,可以增强人体免疫功能、抗氧化、延缓衰老,并能有效抑制肿瘤生长,对手术和放化疗治疗后的患者有很好的辅助改善作用。人体缺硒易引发克山病、大骨节病、关节炎、心血管病等疾病。
方法突破
1.元素、核素、同位素和同素异形体的比较
类型 元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 原子或离子 原子 原子 单质
特性 只有种类,没有个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
决定 因素 质子数 (核电荷数) 质子数、中子数 质子数、中子数 组成元素、分子结构
2.元素、核素、同位素和同素异形体的联系
3.核素和同位素的判断
应用体验
1.[2023四川达州高一期末]铟(In)与铝是同族元素。下列说法不正确的是
( )
B
【变式设问】
2.[2023广东实验中学高一期末]239Pu是“于敏型”氢弹的重要原料。下列说法正确的是( )
A.239Pu原子的原子核中含有239个质子
B.239Pu衰变成235U属于化学变化
C.238Pu、239Pu和241Pu属于不同的核素
D.238Pu与238U在元素周期表中的位置相同
C
解析 239Pu中的239表示的是其质量数,A错误;由于化学变化不涉及原子核的变化,故元素的衰变不是化学变化,B错误;核素的种类是由质子数和中子数共同决定的,238Pu、239Pu和241Pu属于同种元素的不同核素,C正确;238Pu与238U核电荷数不相同,属于不同的元素,在元素周期表中的位置不同,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.元素硫在周期表中的位置是( )
A.第二周期第ⅣA族
B.第二周期第ⅥA族
C.第三周期第ⅣA族
D.第三周期第ⅥA族
D
解析 硫元素的原子序数为16,处于第三周期第ⅥA族。
1
2
3
4
5
2.元素碳有多种同位素,这些同位素具有相同的( )
A.质量数和电子数
B.质子数和电子数
C.质子数和中子数
D.质量数和中子数
B
解析 碳有多种同位素,其质子数、核电荷数和核外电子数相同,中子数、质量数不同。
1
2
3
4
5
3.[2023天津市实验中学高一期末]下列不属于短周期元素的是( )
A.S
B.Na
C.Ar
D.Br
D
解析 短周期元素是指周期表中前三周期的元素,S、Na、Ar都是第三周期元素,都是短周期元素。Br是第四周期元素,属于长周期元素。
1
2
3
4
5
4.[2023上海市第四中学高一期末]符号 中左上角的37代表( )
A.元素的质量数
B.原子的质量数
C.元素的平均相对原子质量
D.元素的近似相对原子质量
B
解析 元素符号的左上角是原子的质量数,而不是元素的质量数(中子数已经确定),A错误,B正确;元素符号的左上角是原子的质量数,不是元素的平均相对原子质量,可以是这种原子的近似相对原子质量,C、D错误。
1
2
3
4
5
5.如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 N O F X
三 Na Y Al Si S Cl
(1)X、Y两种元素符号分别是
和 。
(2)Mg的原子序数为 。
(3)氧元素位于第二周期第
族。
(4)表中某原子最外层电子数为4,其元素符号是 。
(5)NH3中N元素的化合价为 价,其水溶液呈 (填“酸性”或“碱性”)。
(6)Cl2与水反应的生成物中具有漂白作用的是 ,写出该反应的化学方程式: 。
答案 (1)Ne Mg
(2)12
(3)ⅥA
(4)Si
(5)-3 碱性
(6)HClO Cl2+H2O HCl+HClO
1
2
3
4
5
本 课 结 束
