3.2 盐类水解原理 教学课件(共27张PPT)
文档属性
| 名称 | 3.2 盐类水解原理 教学课件(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 00:00:00 | ||
图片预览





文档简介
(共27张PPT)
东营黄河口湿地“红地毯”
我们东营的盐碱地属于滨海盐碱类型区,地下水埋深浅、矿化度高,土体盐分重,以氯化钠为主,还有碳酸钠等其他成分。
盐分为什么会使土壤的pH值升高?
NaCl和 Na2CO3谁是造成东营盐碱地的主要因素?
科普知识
盐类水解的原理
实验探究盐溶液的酸碱性
01
宏
观
辨
识
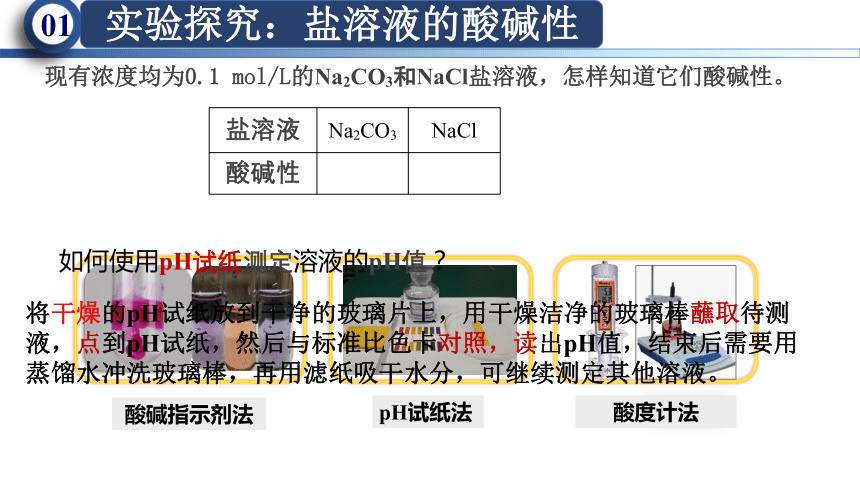
现有浓度均为0.1 mol/L的Na2CO3和NaCl盐溶液,怎样知道它们酸碱性。
盐溶液 Na2CO3 NaCl
酸碱性
酸碱指示剂法
pH试纸法
酸度计法
01
实验探究:盐溶液的酸碱性
如何使用pH试纸测定溶液的pH值?
将干燥的pH试纸放到干净的玻璃片上,用干燥洁净的玻璃棒蘸取待测液,点到pH试纸,然后与标准比色卡对照,读出pH值,结束后需要用蒸馏水冲洗玻璃棒,再用滤纸吸干水分,可继续测定其他溶液。
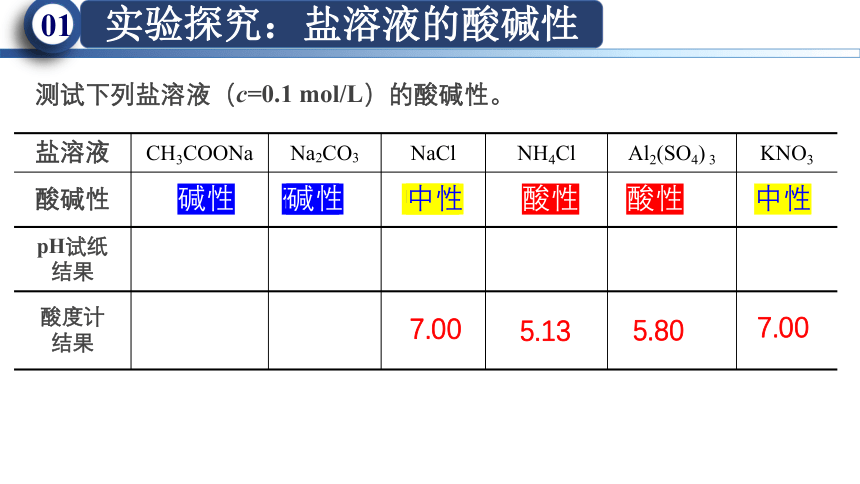
盐溶液 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
酸碱性
pH试纸 结果
酸度计 结果
测试下列盐溶液(c=0.1 mol/L)的酸碱性。
碱性 碱性 中性 酸性 酸性 中性
实验探究:盐溶液的酸碱性
01
实验探究:盐溶液的酸碱性
碱性 中性
7.00
7.00
5.13
5.80
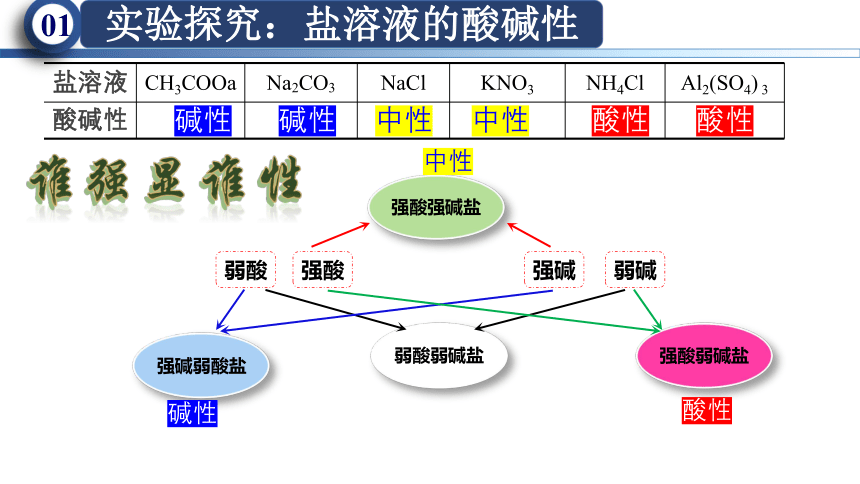
盐溶液 CH3COOa Na2CO3 NaCl KNO3 NH4Cl Al2(SO4) 3
酸碱性
强酸
强碱
弱酸
弱碱
弱酸弱碱盐
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
中性
酸性
碱性
碱性 碱性 中性 中性 酸性 酸性
谁强显谁性
01
实验探究:盐溶液的酸碱性
例析盐溶液呈现酸碱性的原因
02
微
观
探
析
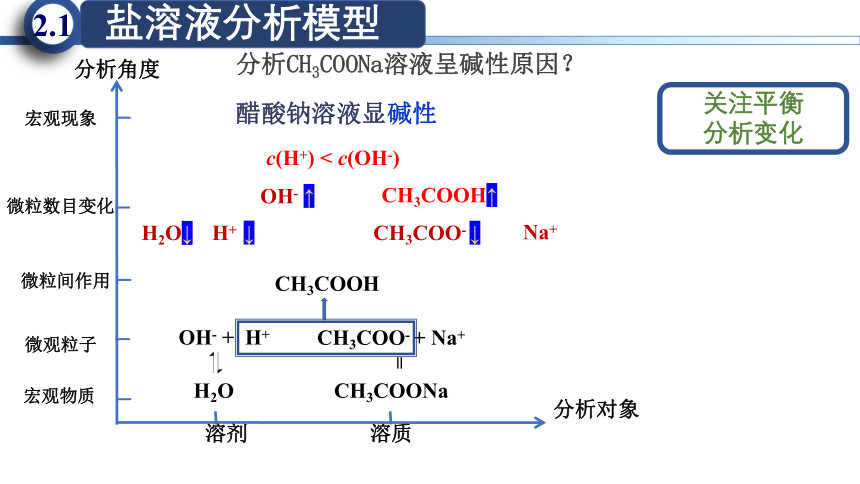
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
H2O
OH- + H+
CH3COO- + Na+
CH3COONa
CH3COO- ↓
H2O↓
c(H+) < c(OH-)
CH3COOH↑
醋酸钠溶液显碱性
CH3COOH
分析对象
分析角度
关注平衡
分析变化u
分析CH3COONa溶液呈碱性原因?
=
H+ ↓
OH- ↑
Na+
2.1
盐溶液分析模型
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
分析对象
分析角度
分析氯化铵溶液显酸性的原因?
2.1
盐溶液分析模型
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
H2O
H+ + OH-
NH4+ + Cl-
NH4Cl
NH4+ ↓
H2O↓
c(OH-) < c(H+)
NH3 H2O ↑
氯化铵溶液显酸性
NH3 H2O
分析对象
=
OH- ↓
H+ ↑
Cl-
2.1
盐溶液分析模型
2.1
盐溶液分析模型
meiyangyang8602
盐类的水解
水溶液中,盐电离产生的弱酸根离子或弱碱阳离子与水电离产生的H+或OH-
结合生成弱电解质的过程。
弱酸根结合H+
生成弱酸
破坏水的电离平衡
水的电离平衡
向右移动
弱碱阳离子
结合OH-
生成弱碱
破坏水的电离平衡
水的电离平衡
向右移动
水解平衡
2.2
盐类水解的原理
盐溶液 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
酸碱性 碱性 酸性 酸性
溶液中存在的微粒 CH3COO-、Na+、H2O、H+、OH- NH4+、Cl-、H2O、H+、OH- Al3+、SO42-、H2O、H+、OH-
哪些微粒可能发生相互作用 CH3COO-、H+ NH4+、OH- Al3+与OH-
溶液中呈现中性、酸性或碱性的原因 CH3COO-与H+结合成CH3COOH,导致c(OH-)>c(H+) , 溶液显碱性 NH4+与OH-结合成NH3 H2O,导致c(OH-)2.2
盐类水解的原理
水解规律
有弱就水解 无弱不水解
都弱都水解 谁强显谁性
盐类水解的规律
2.3
盐类水解的规律
东营盐碱地:
Na2CO3是造成东营盐碱地的主要因素,
它为什么会使土壤的pH值升高?
学以致用
水解反应方程式
03
符
号
表
征
CH3COO-+H2O
CH3COOH+OH-
①CH3COONa水解的离子方程式
NH4+ + H2O NH3·H2O + H+
②NH4Cl的水解的离子方程式
注意
(1)盐的水解一般是微弱的,而且反应是可逆的。故书写盐类水解离子方程式时要用“ ”,水解生成的难溶物及气体,一般不标“↓”或“↑”。
03
水解的离子方程式
一般模式:
盐的弱酸根离子(或弱碱阳离子)+水 弱酸(或弱碱)+OH-(或H+)
练一练:1、写出NaClO发生水解反应的离子方程式;
2、写出Na2CO3 发生水解的离子方程式。
03
水解的离子方程式
3、写出Al2(SO4) 3 发生水解的离子方程式。
(2)多元弱酸盐的水解分步写,以第一步为主;
注意事项
(1)盐的水解一般是微弱的,而且反应是可逆的。故书写盐类水解离子方程式时要用" ",水解生成的难溶物及气体,一般不标"↓"或"↑"。
(3)多元弱碱阳离子的水解方程式一步完成。
03
水解的离子方程式
水解平衡常数
04
定
量
分
析
CH3COO - + H2O CH3COOH+ OH_
CH3COONa溶液中的水解平衡:
请同学们表示该反应的平衡常数:
K =
h
=
Kw
Ka
1
Kw
Ka
Kh =
越弱越水解
04
水解平衡常数
学以致用:25 ℃时,CH3COOH的电离常数 Ka=1.7×10-5,HClO的电离常数Ka=4.7×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
04
水解平衡常数
试一试:Na2CO3溶液的水解平衡常数如何表示呢?(已知:H2CO3的电离平衡常数 分别为Ka1 和 Ka2
Na2CO3溶液中的水解平衡:
CO3 2- + H2O HCO3-+ OH_
HCO3- + H2O H2CO3+ OH_
Kw
Ka2
Kh1 =
Kw
Ka1
Kh2 =
H2CO3的电离常数 Ka1=4.2×10-7 ,Ka2=5.6×10-11。
等浓度CH3COONa 、Na2CO3溶液都显碱性,但Na2CO3溶液pH值更大
04
水解平衡常数
破坏水的
电离平衡
水的电离平
衡向右移动
盐类水解
生成弱电解质
弱酸根结合水
电离出的H+
弱碱阳离子结合
水电离出的OH -
微粒变化
平衡移动
宏观现象
c(OH-) > c( H+)
显碱性
c( H+)> c( OH-)
显酸性
c(OH-) ≠ c( H+)
物质反应
Kh
定性
定量
05
概括整合
盐碱地最大的问题就在于:不利于植物和农作物的生长,所以治理盐碱地一直是科学家们研究的课题。
请同学们查阅资料,写一篇关于盐碱地治理的小论文。
06
作业布置
谢谢各位专家指导
东营黄河口湿地“红地毯”
我们东营的盐碱地属于滨海盐碱类型区,地下水埋深浅、矿化度高,土体盐分重,以氯化钠为主,还有碳酸钠等其他成分。
盐分为什么会使土壤的pH值升高?
NaCl和 Na2CO3谁是造成东营盐碱地的主要因素?
科普知识
盐类水解的原理
实验探究盐溶液的酸碱性
01
宏
观
辨
识
现有浓度均为0.1 mol/L的Na2CO3和NaCl盐溶液,怎样知道它们酸碱性。
盐溶液 Na2CO3 NaCl
酸碱性
酸碱指示剂法
pH试纸法
酸度计法
01
实验探究:盐溶液的酸碱性
如何使用pH试纸测定溶液的pH值?
将干燥的pH试纸放到干净的玻璃片上,用干燥洁净的玻璃棒蘸取待测液,点到pH试纸,然后与标准比色卡对照,读出pH值,结束后需要用蒸馏水冲洗玻璃棒,再用滤纸吸干水分,可继续测定其他溶液。
盐溶液 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
酸碱性
pH试纸 结果
酸度计 结果
测试下列盐溶液(c=0.1 mol/L)的酸碱性。
碱性 碱性 中性 酸性 酸性 中性
实验探究:盐溶液的酸碱性
01
实验探究:盐溶液的酸碱性
碱性 中性
7.00
7.00
5.13
5.80
盐溶液 CH3COOa Na2CO3 NaCl KNO3 NH4Cl Al2(SO4) 3
酸碱性
强酸
强碱
弱酸
弱碱
弱酸弱碱盐
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
中性
酸性
碱性
碱性 碱性 中性 中性 酸性 酸性
谁强显谁性
01
实验探究:盐溶液的酸碱性
例析盐溶液呈现酸碱性的原因
02
微
观
探
析
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
H2O
OH- + H+
CH3COO- + Na+
CH3COONa
CH3COO- ↓
H2O↓
c(H+) < c(OH-)
CH3COOH↑
醋酸钠溶液显碱性
CH3COOH
分析对象
分析角度
关注平衡
分析变化u
分析CH3COONa溶液呈碱性原因?
=
H+ ↓
OH- ↑
Na+
2.1
盐溶液分析模型
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
分析对象
分析角度
分析氯化铵溶液显酸性的原因?
2.1
盐溶液分析模型
宏观物质
微粒间作用
宏观现象
溶质
溶剂
微观粒子
微粒数目变化
H2O
H+ + OH-
NH4+ + Cl-
NH4Cl
NH4+ ↓
H2O↓
c(OH-) < c(H+)
NH3 H2O ↑
氯化铵溶液显酸性
NH3 H2O
分析对象
=
OH- ↓
H+ ↑
Cl-
2.1
盐溶液分析模型
2.1
盐溶液分析模型
meiyangyang8602
盐类的水解
水溶液中,盐电离产生的弱酸根离子或弱碱阳离子与水电离产生的H+或OH-
结合生成弱电解质的过程。
弱酸根结合H+
生成弱酸
破坏水的电离平衡
水的电离平衡
向右移动
弱碱阳离子
结合OH-
生成弱碱
破坏水的电离平衡
水的电离平衡
向右移动
水解平衡
2.2
盐类水解的原理
盐溶液 CH3COONa Na2CO3 NaCl NH4Cl Al2(SO4) 3 KNO3
酸碱性 碱性 酸性 酸性
溶液中存在的微粒 CH3COO-、Na+、H2O、H+、OH- NH4+、Cl-、H2O、H+、OH- Al3+、SO42-、H2O、H+、OH-
哪些微粒可能发生相互作用 CH3COO-、H+ NH4+、OH- Al3+与OH-
溶液中呈现中性、酸性或碱性的原因 CH3COO-与H+结合成CH3COOH,导致c(OH-)>c(H+) , 溶液显碱性 NH4+与OH-结合成NH3 H2O,导致c(OH-)
盐类水解的原理
水解规律
有弱就水解 无弱不水解
都弱都水解 谁强显谁性
盐类水解的规律
2.3
盐类水解的规律
东营盐碱地:
Na2CO3是造成东营盐碱地的主要因素,
它为什么会使土壤的pH值升高?
学以致用
水解反应方程式
03
符
号
表
征
CH3COO-+H2O
CH3COOH+OH-
①CH3COONa水解的离子方程式
NH4+ + H2O NH3·H2O + H+
②NH4Cl的水解的离子方程式
注意
(1)盐的水解一般是微弱的,而且反应是可逆的。故书写盐类水解离子方程式时要用“ ”,水解生成的难溶物及气体,一般不标“↓”或“↑”。
03
水解的离子方程式
一般模式:
盐的弱酸根离子(或弱碱阳离子)+水 弱酸(或弱碱)+OH-(或H+)
练一练:1、写出NaClO发生水解反应的离子方程式;
2、写出Na2CO3 发生水解的离子方程式。
03
水解的离子方程式
3、写出Al2(SO4) 3 发生水解的离子方程式。
(2)多元弱酸盐的水解分步写,以第一步为主;
注意事项
(1)盐的水解一般是微弱的,而且反应是可逆的。故书写盐类水解离子方程式时要用" ",水解生成的难溶物及气体,一般不标"↓"或"↑"。
(3)多元弱碱阳离子的水解方程式一步完成。
03
水解的离子方程式
水解平衡常数
04
定
量
分
析
CH3COO - + H2O CH3COOH+ OH_
CH3COONa溶液中的水解平衡:
请同学们表示该反应的平衡常数:
K =
h
=
Kw
Ka
1
Kw
Ka
Kh =
越弱越水解
04
水解平衡常数
学以致用:25 ℃时,CH3COOH的电离常数 Ka=1.7×10-5,HClO的电离常数Ka=4.7×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
04
水解平衡常数
试一试:Na2CO3溶液的水解平衡常数如何表示呢?(已知:H2CO3的电离平衡常数 分别为Ka1 和 Ka2
Na2CO3溶液中的水解平衡:
CO3 2- + H2O HCO3-+ OH_
HCO3- + H2O H2CO3+ OH_
Kw
Ka2
Kh1 =
Kw
Ka1
Kh2 =
H2CO3的电离常数 Ka1=4.2×10-7 ,Ka2=5.6×10-11。
等浓度CH3COONa 、Na2CO3溶液都显碱性,但Na2CO3溶液pH值更大
04
水解平衡常数
破坏水的
电离平衡
水的电离平
衡向右移动
盐类水解
生成弱电解质
弱酸根结合水
电离出的H+
弱碱阳离子结合
水电离出的OH -
微粒变化
平衡移动
宏观现象
c(OH-) > c( H+)
显碱性
c( H+)> c( OH-)
显酸性
c(OH-) ≠ c( H+)
物质反应
Kh
定性
定量
05
概括整合
盐碱地最大的问题就在于:不利于植物和农作物的生长,所以治理盐碱地一直是科学家们研究的课题。
请同学们查阅资料,写一篇关于盐碱地治理的小论文。
06
作业布置
谢谢各位专家指导
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
