3.2 水解平衡的移动 教学课件(共19张PPT)
文档属性
| 名称 | 3.2 水解平衡的移动 教学课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 19:26:51 | ||
图片预览




文档简介
(共19张PPT)
盐类水解
-水解平衡的移动
盐类水解进行的程度小。
环节一、水解平衡
为了增强净水效果,请大家分析哪些措施可以获取更多的Fe(OH)3胶体?并设计实验方案。
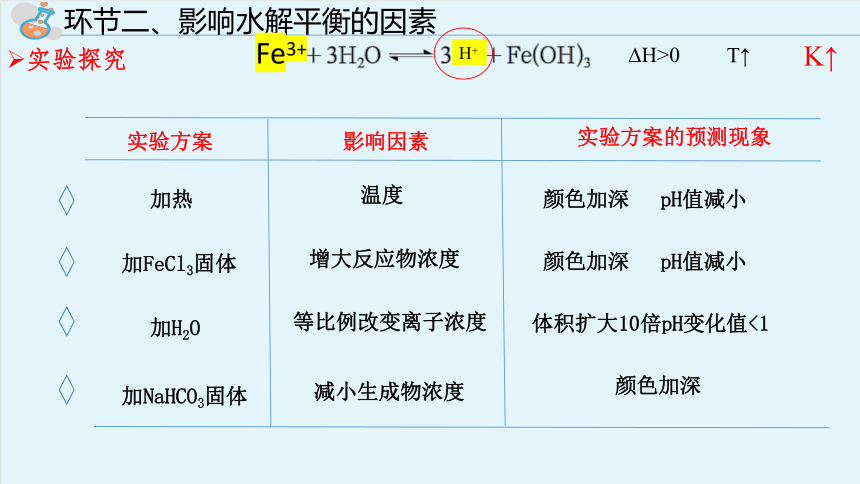
环节二、影响水解平衡的因素
环节二、影响水解平衡的因素
实验探究
加热
实验方案
影响因素
实验方案的预测现象
温度
颜色加深
pH值减小
加FeCl3固体
增大反应物浓度
颜色加深
pH值减小
加H2O
加NaHCO3固体
减小生成物浓度
颜色加深
体积扩大10倍pH变化值<1
H>0
T↑
K↑
Fe3+
H+
等比例改变离子浓度
环节二、影响水解平衡的因素
实验探究
实验方案
实验步骤
实验现象
向甲、乙两个烧杯中分别加入适量 0.01 mol/L FeCl 溶液,加热甲试管一段时间,测定两支烧杯中溶液的pH,对比观察溶液颜色的变化。
向甲、乙两支试管中分别加入10 mL0.01 mol/L FeCl 溶液,向甲试管中加入少量FeCl 晶体,振荡、静置,对比观察溶液颜色的变化。
向甲烧杯加入5 mL 0.01 mol/L FeCl 溶液,测溶液的pH,取甲烧杯2mL 0.01 mol/L FeCl 溶液于乙烧杯中加蒸馏水稀释到20ml测溶液的pH,记录两次pH值。
向甲试管中分别加入5 mL0.01 mol/L FeCl 溶液,然后再加入NaHCO3固体。
加热
加FeCl3固体
加H2O
加NaHCO3固体
甲试管中溶液的颜色明显加深,溶液的pH减小。
甲试管中溶液
的颜色加深。
pH变化小于1。
产生红褐色沉淀,伴有大量气泡产生。
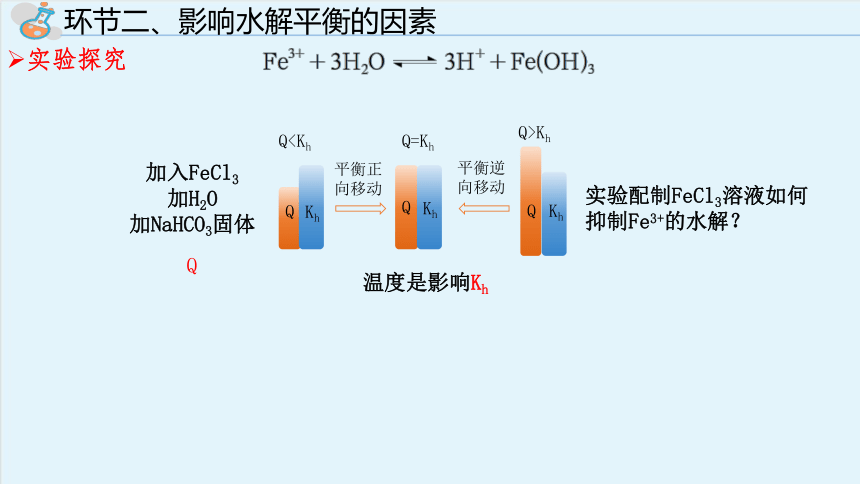
环节二、影响水解平衡的因素
实验探究
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q平衡正向移动
平衡逆向移动
温度是影响Kh
加入FeCl3
加H2O
加NaHCO3固体
Q
实验配制FeCl3溶液如何抑制Fe3+的水解?
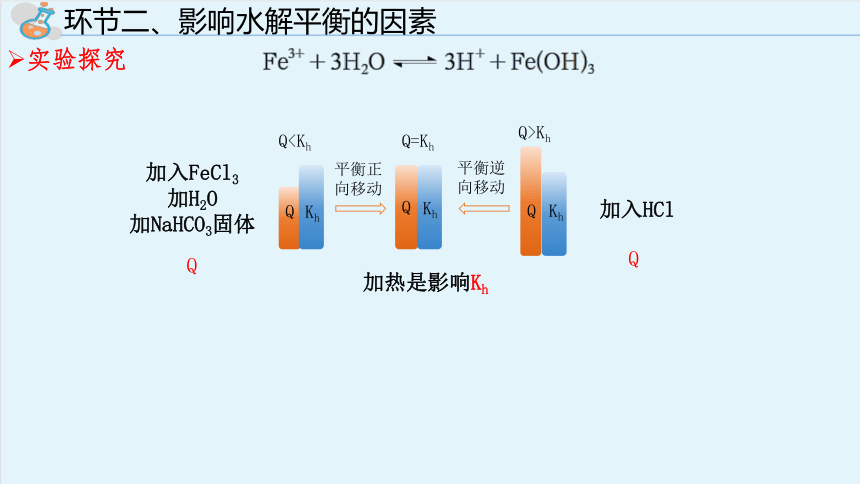
环节二、影响水解平衡的因素
实验探究
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q平衡正向移动
平衡逆向移动
加热是影响Kh
加入HCl
加入FeCl3
加H2O
加NaHCO3固体
Q
Q
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
Fe3++3HCO3- = Fe(OH)3 ↓+ 3CO2↑
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Fe3+
HCO3-
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
Fe3++3HCO3- = Fe(OH)3 ↓+ 3CO2↑
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
Al3+
Al(OH)3
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
Al3+
Al(OH)3
环节三、水解平衡的移动
迁移应用
CH3COONH4
环节三、水解平衡的移动
迁移应用
CH3COONH4
对比泡沫灭火器和CH3COONH4溶液的相互促进水解,宏观上满足什么条件能进行彻底?
阴、阳离子都能水解并分别生成气体和沉淀,大大促进平衡的移动,水解能够进行彻底。
环节三、水解平衡的移动
迁移应用
CH3COONH4
进行彻底
资料卡片
CH3COOH Ka=1.7×10-5mol L-1
NH3 H2O Kb=1.7×10-5mol L-1
课堂小结
微粒的观点
平衡的思想
单一水解体系
相互促进水解体系
泡沫灭火器
CH3COONH4
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q平衡正向移动
平衡逆向移动
日常生活
生产实践
应用
Fe(OH)3胶体制备
除锈剂(氯化铵和氯化锌)
土壤酸化
热碱去油污
明矾净水
化肥施用
课堂小结
课后拓展
请大家查阅资料还有哪些净水剂?
它们的适用条件以及净水原理。
感谢倾听
盐类水解
-水解平衡的移动
盐类水解进行的程度小。
环节一、水解平衡
为了增强净水效果,请大家分析哪些措施可以获取更多的Fe(OH)3胶体?并设计实验方案。
环节二、影响水解平衡的因素
环节二、影响水解平衡的因素
实验探究
加热
实验方案
影响因素
实验方案的预测现象
温度
颜色加深
pH值减小
加FeCl3固体
增大反应物浓度
颜色加深
pH值减小
加H2O
加NaHCO3固体
减小生成物浓度
颜色加深
体积扩大10倍pH变化值<1
H>0
T↑
K↑
Fe3+
H+
等比例改变离子浓度
环节二、影响水解平衡的因素
实验探究
实验方案
实验步骤
实验现象
向甲、乙两个烧杯中分别加入适量 0.01 mol/L FeCl 溶液,加热甲试管一段时间,测定两支烧杯中溶液的pH,对比观察溶液颜色的变化。
向甲、乙两支试管中分别加入10 mL0.01 mol/L FeCl 溶液,向甲试管中加入少量FeCl 晶体,振荡、静置,对比观察溶液颜色的变化。
向甲烧杯加入5 mL 0.01 mol/L FeCl 溶液,测溶液的pH,取甲烧杯2mL 0.01 mol/L FeCl 溶液于乙烧杯中加蒸馏水稀释到20ml测溶液的pH,记录两次pH值。
向甲试管中分别加入5 mL0.01 mol/L FeCl 溶液,然后再加入NaHCO3固体。
加热
加FeCl3固体
加H2O
加NaHCO3固体
甲试管中溶液的颜色明显加深,溶液的pH减小。
甲试管中溶液
的颜色加深。
pH变化小于1。
产生红褐色沉淀,伴有大量气泡产生。
环节二、影响水解平衡的因素
实验探究
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q
平衡逆向移动
温度是影响Kh
加入FeCl3
加H2O
加NaHCO3固体
Q
实验配制FeCl3溶液如何抑制Fe3+的水解?
环节二、影响水解平衡的因素
实验探究
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q
平衡逆向移动
加热是影响Kh
加入HCl
加入FeCl3
加H2O
加NaHCO3固体
Q
Q
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
Fe3++3HCO3- = Fe(OH)3 ↓+ 3CO2↑
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Fe3+
HCO3-
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
Fe3++3HCO3- = Fe(OH)3 ↓+ 3CO2↑
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
Al3+
Al(OH)3
环节三、水解平衡的移动
追本溯源
Fe3++3H2O Fe(OH)3 + 3H+
+
NaHCO3和FeCl3溶液混合后反应为什么那么剧烈?
Al2(SO4)3
Al3+
Al(OH)3
环节三、水解平衡的移动
迁移应用
CH3COONH4
环节三、水解平衡的移动
迁移应用
CH3COONH4
对比泡沫灭火器和CH3COONH4溶液的相互促进水解,宏观上满足什么条件能进行彻底?
阴、阳离子都能水解并分别生成气体和沉淀,大大促进平衡的移动,水解能够进行彻底。
环节三、水解平衡的移动
迁移应用
CH3COONH4
进行彻底
资料卡片
CH3COOH Ka=1.7×10-5mol L-1
NH3 H2O Kb=1.7×10-5mol L-1
课堂小结
微粒的观点
平衡的思想
单一水解体系
相互促进水解体系
泡沫灭火器
CH3COONH4
Q
Kh
Q
Kh
Q
Kh
Q=Kh
Q>Kh
Q
平衡逆向移动
日常生活
生产实践
应用
Fe(OH)3胶体制备
除锈剂(氯化铵和氯化锌)
土壤酸化
热碱去油污
明矾净水
化肥施用
课堂小结
课后拓展
请大家查阅资料还有哪些净水剂?
它们的适用条件以及净水原理。
感谢倾听
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
