人教版九年级化学下册 第九单元 课题3 溶质的质量分数(共41张PPT)
文档属性
| 名称 | 人教版九年级化学下册 第九单元 课题3 溶质的质量分数(共41张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-03-24 19:22:37 | ||
图片预览









文档简介
课件41张PPT。溶液复 习1.什么叫饱和溶液?2.KNO3不饱和溶液怎样变成饱和溶液?3.Ca(OH)2饱和溶液怎样变成不饱和溶液? “张裕”葡萄酒庄园在种植解百纳优质葡萄,根据受病虫害程液作低毒高效的杀菌剂,农技师配制三种不同浓度的硫酸铜溶度不同,需要配制波尔多液:如何配呢?我们来当一下农技师。观察与思考
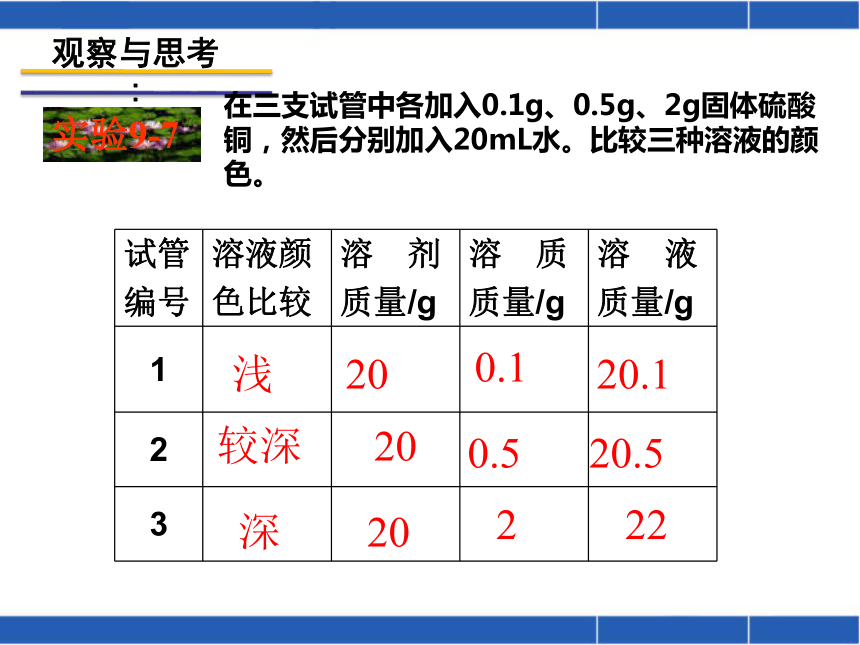
:实验9-7在三支试管中各加入0.1g、0.5g、2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。浅较深深2020200.10.5220.120.522实验9-7颜色:淡蓝 蓝色 深蓝 对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
通过观察颜色、尝味道等方法来判断溶液的浓稀,仅仅是判断溶液浓稀粗略的方法。
我们应该学习商家向消费者介绍产品那样明确地表示出溶液的组成。其中表示溶液组成的方法有多种,这里主要认识溶质的质量分数。
讨论 【溶液组成】
溶液的质量=溶质的质量+溶剂的质量3.导出公式:
溶质质量=溶液质量×溶质的质量分数
溶液质量=溶质质量÷溶质的质量分数
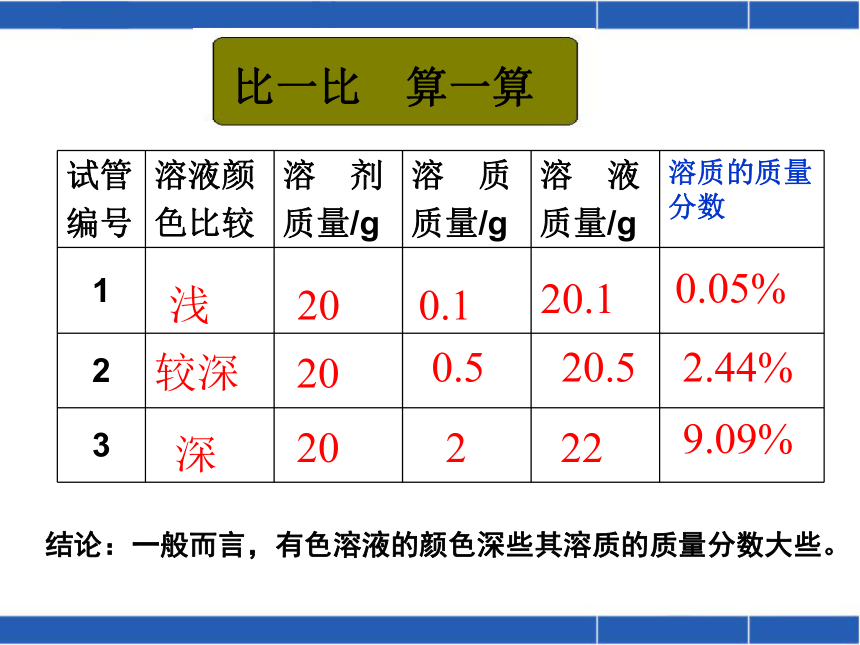
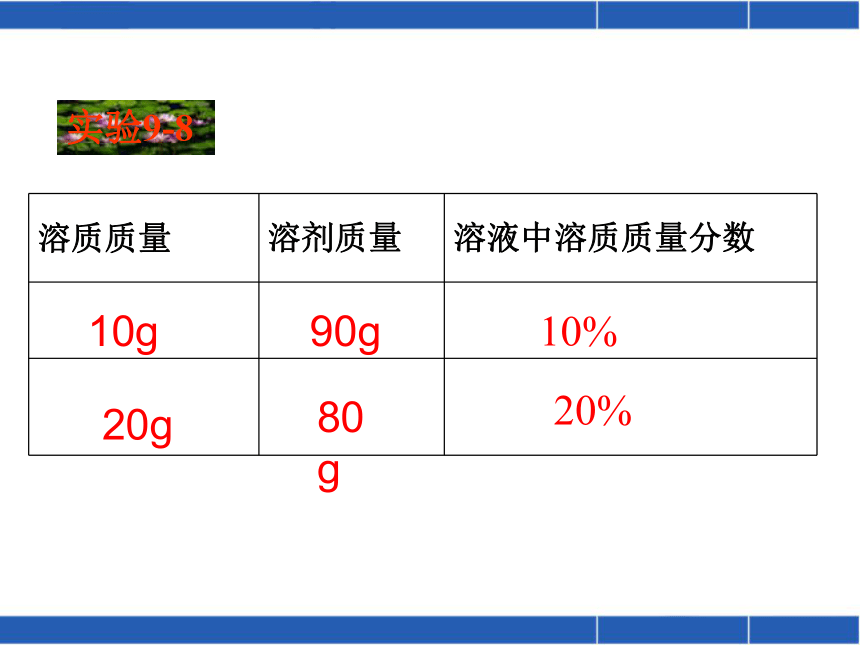
0.05%2.44%浅较深深2020200.10.5220.120.522比一比 算一算结论:一般而言,有色溶液的颜色深些其溶质的质量分数大些。9.09%10g20g90g80g10%20%实验9-8
⑴50克硝酸钾完全溶解在100克水中,所得溶液质量分数为50%;
⑵ 20升无水酒精溶解在80升水中,所得溶液的质量分数为20%;
⑶20克氯化钠完全溶解在80千克水中,所得溶液的质量分数为20%;
⑷20℃时,NaCl的溶解度为36g,则在20℃时,40克NaCl溶解在100克水中所得溶液中溶质质量为40克,溶液质量为140克。判断下列说法是否正确,如果不对的你能说出理由吗?想一想:已知溶质和溶剂的量,这样的溶液我们会配制了。哪如何求出已知溶液中溶质和溶剂的质量呢?人教版化学第九单元课题3比一比 看谁算得快溶质的质量=溶液的质量×溶质的质量分数溶液的质量=溶质的质量+溶剂的质量80g20%100g10%40g160g150g135g 【例1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:有没有其他的方法?或= 150Kg ×(1-16% )=126Kg答:需要24Kg氯化钠和126Kg水。理解与应用 【练习】 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?提示:溶质质量=溶液质量×溶质质量分数
=(溶液体积×密度)×溶质质量分数
溶剂质量=溶液质量-溶质质量
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。 ②溶质的质量分数一般用百分数表示。 ③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。 ④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意
1.生理盐水中氯化钠的质量分数为0.9%,它的含义是什么?
2.某硫酸钠溶液中硫酸钠的质量分数为 38%,下列描述正确的是
①每100 g的溶液里有硫酸钠38 g。
②每100 mL的溶液里有硫酸钠38 mL。①含义:每100g生理盐水中含有0.9g氯化钠二、拓展应用 【例题】200C时,NaCl的溶解度是36g。200C 在50g水放入20gNaCl,则求所得溶液的溶质质量分数? 分析:200C时50g水若溶不下20gNaCl,则溶液中溶质的质量应为18g。解:x = 18g < 20g则溶质在溶液中的质量分数为:×100%或 100g36g=50gx18g50g+18g设200C时,50g水中最多溶解NaCl的质量为X。36g100g+36g×100% = 26.5% 20℃时氯化钠的溶解度是36g,这句话的含义是什
么?将其关系代入下表: 20℃36g100g100g+36g 一定温度下,某物质的饱和溶液的溶质质量分数: 饱和溶液中的
溶质质量分数=溶解度S100g+溶解度S 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t0C时溶解度36g是指: 在t0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的联系和区别10%葡萄糖注射液的浓度0.9%生理盐水中NaCl的含量人教版化学第九单元课题3课后小结 1.什么是溶质的质量分数?2.溶质质量分数与溶解度的联系和区别:一定温度下:某物质的饱和溶液的溶质质量分数 溶解度100g+溶解度溶质质量分数= 例2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。三、稀释问题
观点:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。
则有:
Ag×a% = Bg×b%
(稀释前) (稀释后)
【练习】某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?设盐酸体积为X。
(稀释前) (稀释后)
(X×1.19g/mL)×38%=5000g×20%
X=2211.4mL溶 液 的 配 制配制步骤 1.计算 2.称量 3.溶解 4.装瓶例1 (溶质为固体)配制150g16%的食盐水。 计算 需食盐:150 g× 16% = 24 g 需水:150 g– 24 g= 126 g称量 用天平称量 24 g食盐 用量筒量取126mL水溶解 烧杯、玻璃棒 实验仪器 天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒3.实验操作
(参考下图进行操作,注意各步操作中的注意事项) 溶质的质量分数能准确地表示某溶液的组成,也能比较不同溶液浓度的大小,在生产、生活中广泛应用。这也说明了化学就在我们的身边。
练习 下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。下图是某同学配制50 g 5%的氯化钠溶液的全过程: (1)所需氯化钠的质量是 ,现实验室中有10 mL、50 mL、100 mL等不同规格的量筒,配制上述溶液时最好选用???????????mL的量筒。
(2)请找出上图中的错误:①
② ③
(3)如果配制的氯化钠溶液中NaCl 的质量分数小于5%,则可能造成误差的操作原因有(至少举出两点)
① ② 2.5g50瓶塞正放药品砝码位置颠倒量筒没有沿烧杯内壁倾倒水②转移固体时, 。 3.可造成配制的溶液质量分数偏低的实验操作因素③用量筒量取水时,用 视方法量取。 ④烧杯中残留有 。二、配制溶质质量分数一定的溶液①用天平称量时,指针 偏。右有部分固体残留在纸上或洒出仰水4.可造成配制的溶液质量分数偏高的实验操作因素:①溶解时水洒出一些;②用俯视方法量取水。
溶质质量分数在化学方程式中应用【综合计算专题】 解题思路
⒈化学方程式用于解决相关的纯物质质量,即代入的已知量和未知量均为纯量,则溶液中只有溶质参加化学反应。
(溶质质量=溶液质量×溶质质量分数)
2.反应后溶液质量可运用质量守恒法来解决:
反应后溶液的质量=
反应前物质的质量总和- 生成气体(或沉淀)质量
【注明】其中反应前物质包括参加反应的纯物质和溶液,但不包括难溶于水的杂质部分。【综合计算专题】 溶质质量分数在化学方程式中应用例题评讲(以课本为蓝本)例3 (课本习题P45中5题)100g某硫酸恰好与13g锌完全反应。
试通过计算回答下列问题:
⑴这种硫酸中溶质的质量分数?
⑵生成氢气质量为多少?
⑶反应后溶液中溶质是 (化学式),其溶质质量分数为 (精确到0.1%);
⑷将该溶液稀释到20%,需要加水多少?解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z。65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑴则w(H2SO4)= ×100%=19.6%19.6g100g解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑵解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑶则w(ZnSO4)= ×100%=28.6%32.2g13g+100g-0.4g 分析:解决这道题的关键是什么?解:溶液稀释前后,溶质的质量不变⑷设加水的质量为m。112.6g×28.6%=(112.6g+m)×20%则: m=48.4g 生产生活中的常见溶液(标签)9%(v/v)8%(v/v)52%(v/v)酒类的酒精度白醋的浓度饮料中各种营养成分的含量
(每100ml溶液中含某成分的质量) 化学试剂中溶质的含量
(每100g溶液中含溶质的质量)
:实验9-7在三支试管中各加入0.1g、0.5g、2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。浅较深深2020200.10.5220.120.522实验9-7颜色:淡蓝 蓝色 深蓝 对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
通过观察颜色、尝味道等方法来判断溶液的浓稀,仅仅是判断溶液浓稀粗略的方法。
我们应该学习商家向消费者介绍产品那样明确地表示出溶液的组成。其中表示溶液组成的方法有多种,这里主要认识溶质的质量分数。
讨论 【溶液组成】
溶液的质量=溶质的质量+溶剂的质量3.导出公式:
溶质质量=溶液质量×溶质的质量分数
溶液质量=溶质质量÷溶质的质量分数
0.05%2.44%浅较深深2020200.10.5220.120.522比一比 算一算结论:一般而言,有色溶液的颜色深些其溶质的质量分数大些。9.09%10g20g90g80g10%20%实验9-8
⑴50克硝酸钾完全溶解在100克水中,所得溶液质量分数为50%;
⑵ 20升无水酒精溶解在80升水中,所得溶液的质量分数为20%;
⑶20克氯化钠完全溶解在80千克水中,所得溶液的质量分数为20%;
⑷20℃时,NaCl的溶解度为36g,则在20℃时,40克NaCl溶解在100克水中所得溶液中溶质质量为40克,溶液质量为140克。判断下列说法是否正确,如果不对的你能说出理由吗?想一想:已知溶质和溶剂的量,这样的溶液我们会配制了。哪如何求出已知溶液中溶质和溶剂的质量呢?人教版化学第九单元课题3比一比 看谁算得快溶质的质量=溶液的质量×溶质的质量分数溶液的质量=溶质的质量+溶剂的质量80g20%100g10%40g160g150g135g 【例1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:有没有其他的方法?或= 150Kg ×(1-16% )=126Kg答:需要24Kg氯化钠和126Kg水。理解与应用 【练习】 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?提示:溶质质量=溶液质量×溶质质量分数
=(溶液体积×密度)×溶质质量分数
溶剂质量=溶液质量-溶质质量
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。 ②溶质的质量分数一般用百分数表示。 ③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。 ④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意
1.生理盐水中氯化钠的质量分数为0.9%,它的含义是什么?
2.某硫酸钠溶液中硫酸钠的质量分数为 38%,下列描述正确的是
①每100 g的溶液里有硫酸钠38 g。
②每100 mL的溶液里有硫酸钠38 mL。①含义:每100g生理盐水中含有0.9g氯化钠二、拓展应用 【例题】200C时,NaCl的溶解度是36g。200C 在50g水放入20gNaCl,则求所得溶液的溶质质量分数? 分析:200C时50g水若溶不下20gNaCl,则溶液中溶质的质量应为18g。解:x = 18g < 20g则溶质在溶液中的质量分数为:×100%或 100g36g=50gx18g50g+18g设200C时,50g水中最多溶解NaCl的质量为X。36g100g+36g×100% = 26.5% 20℃时氯化钠的溶解度是36g,这句话的含义是什
么?将其关系代入下表: 20℃36g100g100g+36g 一定温度下,某物质的饱和溶液的溶质质量分数: 饱和溶液中的
溶质质量分数=溶解度S100g+溶解度S 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t0C时溶解度36g是指: 在t0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的联系和区别10%葡萄糖注射液的浓度0.9%生理盐水中NaCl的含量人教版化学第九单元课题3课后小结 1.什么是溶质的质量分数?2.溶质质量分数与溶解度的联系和区别:一定温度下:某物质的饱和溶液的溶质质量分数 溶解度100g+溶解度溶质质量分数= 例2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。三、稀释问题
观点:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。
则有:
Ag×a% = Bg×b%
(稀释前) (稀释后)
【练习】某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?设盐酸体积为X。
(稀释前) (稀释后)
(X×1.19g/mL)×38%=5000g×20%
X=2211.4mL溶 液 的 配 制配制步骤 1.计算 2.称量 3.溶解 4.装瓶例1 (溶质为固体)配制150g16%的食盐水。 计算 需食盐:150 g× 16% = 24 g 需水:150 g– 24 g= 126 g称量 用天平称量 24 g食盐 用量筒量取126mL水溶解 烧杯、玻璃棒 实验仪器 天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒3.实验操作
(参考下图进行操作,注意各步操作中的注意事项) 溶质的质量分数能准确地表示某溶液的组成,也能比较不同溶液浓度的大小,在生产、生活中广泛应用。这也说明了化学就在我们的身边。
练习 下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。下图是某同学配制50 g 5%的氯化钠溶液的全过程: (1)所需氯化钠的质量是 ,现实验室中有10 mL、50 mL、100 mL等不同规格的量筒,配制上述溶液时最好选用???????????mL的量筒。
(2)请找出上图中的错误:①
② ③
(3)如果配制的氯化钠溶液中NaCl 的质量分数小于5%,则可能造成误差的操作原因有(至少举出两点)
① ② 2.5g50瓶塞正放药品砝码位置颠倒量筒没有沿烧杯内壁倾倒水②转移固体时, 。 3.可造成配制的溶液质量分数偏低的实验操作因素③用量筒量取水时,用 视方法量取。 ④烧杯中残留有 。二、配制溶质质量分数一定的溶液①用天平称量时,指针 偏。右有部分固体残留在纸上或洒出仰水4.可造成配制的溶液质量分数偏高的实验操作因素:①溶解时水洒出一些;②用俯视方法量取水。
溶质质量分数在化学方程式中应用【综合计算专题】 解题思路
⒈化学方程式用于解决相关的纯物质质量,即代入的已知量和未知量均为纯量,则溶液中只有溶质参加化学反应。
(溶质质量=溶液质量×溶质质量分数)
2.反应后溶液质量可运用质量守恒法来解决:
反应后溶液的质量=
反应前物质的质量总和- 生成气体(或沉淀)质量
【注明】其中反应前物质包括参加反应的纯物质和溶液,但不包括难溶于水的杂质部分。【综合计算专题】 溶质质量分数在化学方程式中应用例题评讲(以课本为蓝本)例3 (课本习题P45中5题)100g某硫酸恰好与13g锌完全反应。
试通过计算回答下列问题:
⑴这种硫酸中溶质的质量分数?
⑵生成氢气质量为多少?
⑶反应后溶液中溶质是 (化学式),其溶质质量分数为 (精确到0.1%);
⑷将该溶液稀释到20%,需要加水多少?解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z。65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑴则w(H2SO4)= ×100%=19.6%19.6g100g解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑵解:设纯硫酸质量为X,生成硫酸锌和氢气质量分别为Y、Z65 98 161 213g X Y ZZn + H2SO4 = ZnSO4+ H2↑⑶则w(ZnSO4)= ×100%=28.6%32.2g13g+100g-0.4g 分析:解决这道题的关键是什么?解:溶液稀释前后,溶质的质量不变⑷设加水的质量为m。112.6g×28.6%=(112.6g+m)×20%则: m=48.4g 生产生活中的常见溶液(标签)9%(v/v)8%(v/v)52%(v/v)酒类的酒精度白醋的浓度饮料中各种营养成分的含量
(每100ml溶液中含某成分的质量) 化学试剂中溶质的含量
(每100g溶液中含溶质的质量)
同课章节目录
