3.3.2三大守恒粒子浓度大小比较课件(共49张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3.2三大守恒粒子浓度大小比较课件(共49张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 781.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-10 22:01:16 | ||
图片预览








文档简介
(共49张PPT)
必修1 第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
三大守恒粒子浓度大小比较 【第2课时】
课程标准
1.掌握电离平衡和水解平衡的影响因素及其关系。
2.能运用电离平衡和水解平衡的关系解决三大守恒。
3.会判断混合溶液中粒子浓度的大小关系。
学习目标
一、三大守恒
1.电荷守恒:溶液中阴离子和阳离子所带的电荷总数相等
1.电荷守恒
①Na2SO4溶液
c(Na+) + c( H+ ) =2c ( SO42–) + c(OH–)
②NaHCO3溶液
c(Na+)+c (H+)=c(OH-) +c (HCO3-)+2c (CO32-)
做题关键:
①判断溶液中离子的种类;
②弄清离子浓度和电荷浓度的关系,即离子所带电荷量做系数。
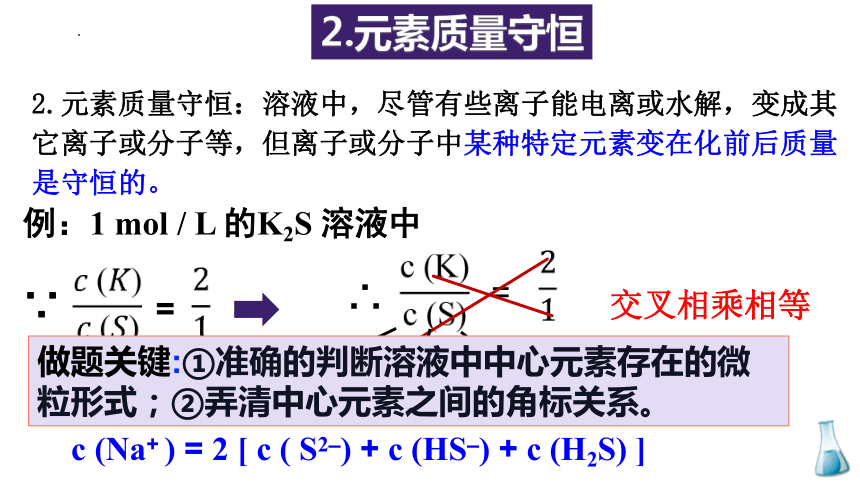
2.元素质量守恒
2.元素质量守恒:溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素变在化前后质量是守恒的。
例:1 mol / L 的K2S 溶液中
=
∵
∴
=
c (S2-)
c (HS-)
c (H2S)
交叉相乘相等
c (Na+ ) = 2 [ c ( S2–) + c (HS–) + c (H2S) ]
做题关键:①准确的判断溶液中中心元素存在的微粒形式;②弄清中心元素之间的角标关系。
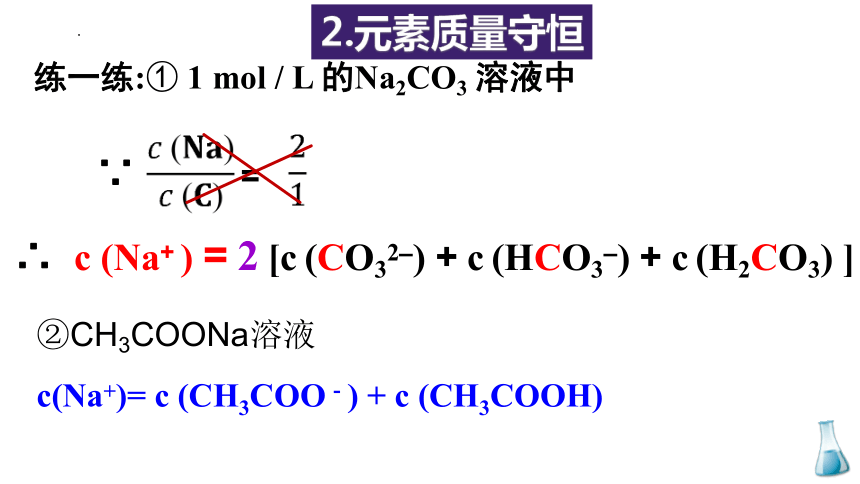
练一练:① 1 mol / L 的Na2CO3 溶液中
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
2.元素质量守恒
=
∵
②CH3COONa溶液
c(Na+)= c (CH3COO-) + c (CH3COOH)
3.质子守恒
例:Na2CO3 溶液
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
1含义:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。
例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:
c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)
法一:可将电荷守恒和物料守恒关系式叠加得到
写出NaHCO3溶液中三个守恒关系式
电荷守恒:
物料守恒:
质子守恒:
c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(CO32-)+ c(OH-)=c(H+)+c(H2CO3)
NaHCO3溶液中质子守恒关系式
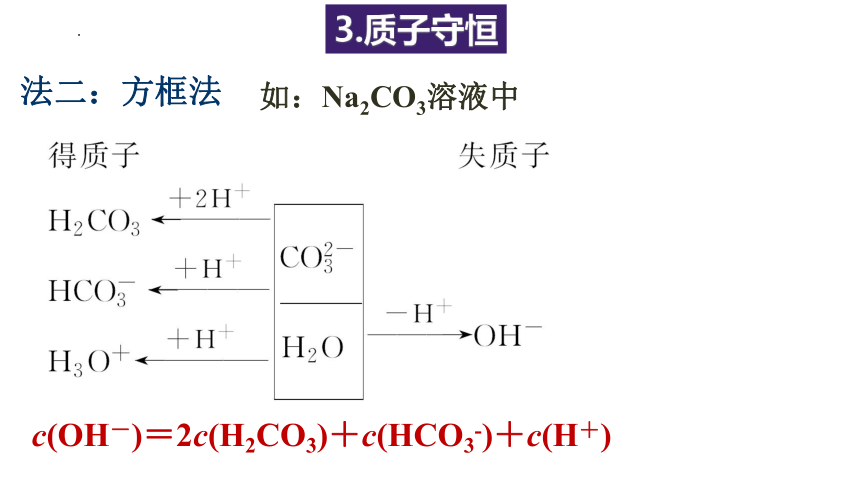
3.质子守恒
如:Na2CO3溶液中
3.质子守恒
法二:方框法
c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+)
例:Na2CO3 溶液
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
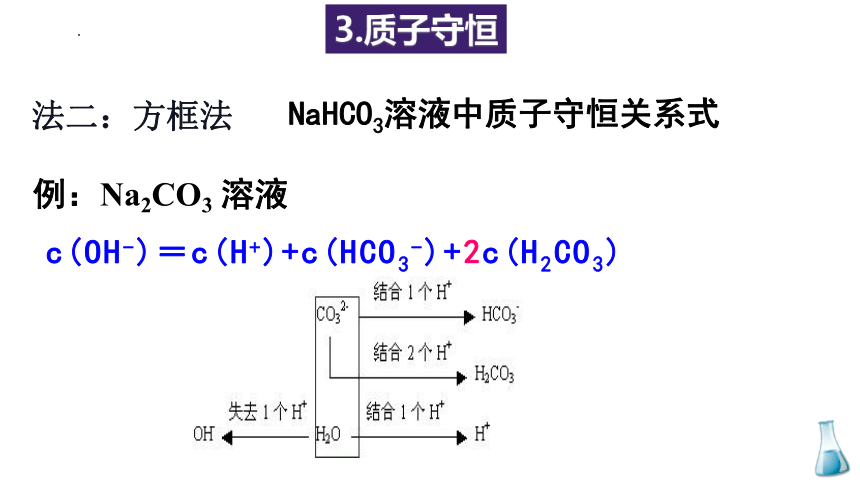
法二:方框法
NaHCO3溶液中质子守恒关系式
3.质子守恒
练一练 列出下列物质溶液的质子守恒
①Na2S 溶液
c(HS- )+c(H+) +2c(H2S)=c(OH-)
② NH4HCO3溶液
3.质子守恒
二、粒子浓度大小比较
关键:明确两个“微弱”(电离和水解),一个“极弱”(水的电离)
1.不同物质相同离子浓度的比较
如:在0.1mol/L的下列溶液中c(NH4 +)的由大到小的顺序①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3 ⑤(NH4)2CO3⑥NH3 · H2O
(1)不同溶液中同一离子浓度的大小比较
② ⑤ ③ ① ④ ⑥
2.单一溶质溶液中粒子浓度比较
(1)酸如:H2S溶液
(2)碱如:NH3 ·H2O溶液
H2O H++ OH–
H2S HS– + H+
HS– = H++S2–
c (H2S)> c (H+) >c (HS–) > c (S2–) >c(OH–)
c (NH3·H2O) >c (OH–)> c (NH4+) >c (H+)
做题关键:
份数程度优先原则,出现在前,不出现在后
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
①一元弱酸盐如:CH3COONa
CH3COO-+H2O CH3COOH+OH-
CH3COONa=Na+ +CH3COO-
H2O H++ OH–
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
②多元弱酸盐如:Na2CO3
Na2CO3 = 2Na+ + CO32-
CO32- + H2O OH– + HCO3-
HCO3- + H2O H2CO3 + OH–
c(Na+)>c(CO32- )>c(OH-)>c(HCO3-) >c(H2CO3 ) >c(H+)
H2O H++ OH–
③酸式盐溶液:NaHCO3溶液
H2O H+ + OH–
HCO3– CO32– + H+
HCO3– + H2O H2CO3 + OH–
Na2HCO3– == Na+ + HCO3–
溶液显碱性 故:
HCO3– 的电离程度<水解程度
c (Na+ ) > c (HCO3–) > c (OH– ) > c (H2CO3) > c (H+) > c (CO32–)
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
练习:NH4HSO4
NH4+ + H2O NH3·H2O + H+
H2O H++ OH–
NH4HSO4=NH4+ + SO42- + H+
c (H+) > c (SO42)- >c (NH4+) >c (NH3·H2O )
练一练 列出下列溶液中微粒浓度排序
NaHSO3 (显酸性)
c (Na+ ) > c (HSO3- ) >c (H+) > c (SO32-) >c (OH-) > c (H2SO3)
电离大于水解:
NaHSO3 KHC2O4 NaH2PO4
等物质的量浓度 NH4Cl 与NH3.H2O 的混合溶液
等物质的量浓度 CH3COOH 与 CH3COONa的混合溶液
水解大于电离:
NaHCO3 NaHS Na2HPO4
等浓度的HCN与NaCN的混合溶液
3.混合溶液(需判断真实的溶质)
例1.用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-)
B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
AB
①两种物质混合不反应
例2.在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO -)+c(CH3COO H)
D.c(Na+)+c(H+)=c(CH3COO -)+c(OH-)
A
②两种物质恰好完全反应
③两种物质反应,其中一种有剩余
例3:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(CH3COO -)>c(Na+)
B、c(CH3COOH)>c(CH3COO -)
C、2c(H+)=c(CH3COO -)-c(CH3COOH)
D、c(CH3COOH)+c(CH3COO -)=0.01 mol·L-1
AD
(1)若 “>”或“<”, “电离”和“水解”。
(2)若 “=”连接,应根据“守恒”原理,视不同情况而定。
①若等号一端全部是阴离子或阳离子,应首先考虑电荷守恒;
②若等号一端各项中都含有同一种元素,应首先考虑这种元素的元素质量守恒;
③若出现等号,但既不是电荷守恒,也不是元素质量守恒,则可考虑将电荷守恒和元素质量守恒进行合并处理,即推得质子守恒。
(3)溶液是混合溶液时,先考虑溶质的相互反应,然后再根据反应后的生成物进行比较。
粒子浓度关系的策略
三、数形结合
滴定曲线图像分析
数形结合滴定曲线图像分析
关键:分析起点 反应一半点
恰好中和点 中性点 过量点等
对应的物质组成
例1)298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确( )
A.该滴定过程应该选择酚酞作为指示剂 B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中
c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
例1 298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图1所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确 D
A.该滴定过程应该选择酚酞(甲基橙或甲基红)
作为指示剂
B.M点对应的盐酸体积为(小于)20.0mL
C.M点处溶液c(NH4+)=c(Cl-) =(﹥) c(H+)=c(OH-)
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
例1298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图1所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确 D
D.N点处的溶液中pH<12
起点:NH3·H2O
c(OH-)=1.32×10-3
< 10-2
例2:常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
①该滴定终点为__点;(填“a”、“b”或“c”)
②b点对应的溶液中,c(NH4+)_______ c(Cl-);(填“>”、“<”或“=”)
③室温下,NH3·H2O的Kb≈_______________。 (保留两位有效数字)
恰好中和点 : NH4Cl
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
碱性点:NH3·H2O+NH4Cl
突
变
范
围
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
①该滴定终点为c点;(填“a”、“b”或“c”)
恰好中和点 : NH4Cl
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
碱性点:NH3·H2O+NH4Cl
突
变
范
围
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
②b点对应的溶液中,c(NH4+)=c(Cl-);(填“>”、“<”或“=”)
中性点: NH4Cl+NH3·H2O,c(H+)=c(OH-)
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
③室温下,NH3·H2O的Kb≈ 2.2×10-5 。(保留两位有效数字)
恰好中和点 : NH4Cl,n(酸)=n(碱)
Kb=[c(NH4+)× c(OH-)]÷c(NH3·H2O)
HCl ~ NH3·H2O
起点:NH3·H2O
例3:常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是( )
A.b、d两点为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温0.1 mol/L氨水的电离常数K约为1×10-5
例3:常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是( )
A.b、d两点为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温0.1 mol/L氨水的电离常数K约为1×10-5
常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图6所示。则下列说法正确的是 D
A.b、d两点(C点)为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)> ( <) c(NH4+),c(H+)> ( <) c(OH-)
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
恰好中和点 : NH4Cl
酸过量:NH4Cl+HCl
常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是 D
D.常温0.1 mol/L氨水的电离常数K 约为1×10-5
起点:NH3·H2O
Kb=[c(NH4+)× c(OH-)]÷c(NH3·H2O)
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是( )
曲线P—J—N表示溶液中pH的变化
B. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
C. M、P两点的数值之和a+b=14
D. M点水的电离程度比Q点大
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是( )
曲线P—J—N表示溶液中pH的变化
B. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
C. M、P两点的数值之和a+b=14
D. M点水的电离程度比Q点大
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
曲线P—J—N表示溶液中pH ( pOH )的变化
B. pH与pOH交叉点J对应V(盐酸)= ( <)20.00 mL
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
酸性点:NH4Cl+HCl
碱性点:NH3·H2O+NH4Cl
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
曲线P—J—N表示溶液中pH ( pOH )的变化
B. pH与pOH交叉点J对应V(盐酸)= ( <)20.00 mL
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
酸性点:NH4Cl+HCl
碱性点:NH3·H2O+NH4Cl
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
C. M、P 两点的数值之和a+b=14
碱性区域:
NH3·H2O+NH4Cl
酸性区域:
NH4Cl+HCl
中性点:
NH4Cl
+NH3·H2O
关系:M、P 两点为酸碱中和同一点!
c(H+)M =
c(OH-)P =
c(H+)H2O = 10-a =c(H+)aq
c(OH-) NH3·H2O+NH4Cl=10-b=c(OH-)aq
pOH + pH =14
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
C. M、P 两点的数值之和a+b=14
D. M点水的电离程度比(等于)Q点大
碱性区域:
NH3·H2O+NH4Cl
酸性区域:
NH4Cl+HCl
中性点:
NH4Cl
+NH3·H2O
c(H+)M =c(H+)H2O= 10-a=c(OH-)H2O
c(H+)Q =
c(OH-)H2O=10b-14=c(H+)H2O
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是 ( )
A. t℃时,MOH的Kb>1.0×10-3
B.盐酸与MOH溶液恰好中和时溶液pH=6.5 C. a=12
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是 ( )
A. t℃时,MOH的Kb>1.0×10-3
B.盐酸与MOH溶液恰好中和时溶液pH=6.5 C. a=12
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图5所示,以下说法正确的是 A
A. t℃时,MOH的Kb>1.0×10-3
起点:NH3·H2O
起点:NH3·H2O
Kb=[c(M+)× c(OH-)]÷c(MOH)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图5所示,以下说法正确的是 A
B.盐酸与MOH溶液恰好中和时溶液pH= ( <) 6.5
C. a=12(11)
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)(c(M+)>c(H+))> c(MOH)>c(OH-)
必修1 第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
三大守恒粒子浓度大小比较 【第2课时】
课程标准
1.掌握电离平衡和水解平衡的影响因素及其关系。
2.能运用电离平衡和水解平衡的关系解决三大守恒。
3.会判断混合溶液中粒子浓度的大小关系。
学习目标
一、三大守恒
1.电荷守恒:溶液中阴离子和阳离子所带的电荷总数相等
1.电荷守恒
①Na2SO4溶液
c(Na+) + c( H+ ) =2c ( SO42–) + c(OH–)
②NaHCO3溶液
c(Na+)+c (H+)=c(OH-) +c (HCO3-)+2c (CO32-)
做题关键:
①判断溶液中离子的种类;
②弄清离子浓度和电荷浓度的关系,即离子所带电荷量做系数。
2.元素质量守恒
2.元素质量守恒:溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素变在化前后质量是守恒的。
例:1 mol / L 的K2S 溶液中
=
∵
∴
=
c (S2-)
c (HS-)
c (H2S)
交叉相乘相等
c (Na+ ) = 2 [ c ( S2–) + c (HS–) + c (H2S) ]
做题关键:①准确的判断溶液中中心元素存在的微粒形式;②弄清中心元素之间的角标关系。
练一练:① 1 mol / L 的Na2CO3 溶液中
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
2.元素质量守恒
=
∵
②CH3COONa溶液
c(Na+)= c (CH3COO-) + c (CH3COOH)
3.质子守恒
例:Na2CO3 溶液
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
1含义:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。
例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:
c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)
法一:可将电荷守恒和物料守恒关系式叠加得到
写出NaHCO3溶液中三个守恒关系式
电荷守恒:
物料守恒:
质子守恒:
c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(CO32-)+ c(OH-)=c(H+)+c(H2CO3)
NaHCO3溶液中质子守恒关系式
3.质子守恒
如:Na2CO3溶液中
3.质子守恒
法二:方框法
c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+)
例:Na2CO3 溶液
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
法二:方框法
NaHCO3溶液中质子守恒关系式
3.质子守恒
练一练 列出下列物质溶液的质子守恒
①Na2S 溶液
c(HS- )+c(H+) +2c(H2S)=c(OH-)
② NH4HCO3溶液
3.质子守恒
二、粒子浓度大小比较
关键:明确两个“微弱”(电离和水解),一个“极弱”(水的电离)
1.不同物质相同离子浓度的比较
如:在0.1mol/L的下列溶液中c(NH4 +)的由大到小的顺序①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3 ⑤(NH4)2CO3⑥NH3 · H2O
(1)不同溶液中同一离子浓度的大小比较
② ⑤ ③ ① ④ ⑥
2.单一溶质溶液中粒子浓度比较
(1)酸如:H2S溶液
(2)碱如:NH3 ·H2O溶液
H2O H++ OH–
H2S HS– + H+
HS– = H++S2–
c (H2S)> c (H+) >c (HS–) > c (S2–) >c(OH–)
c (NH3·H2O) >c (OH–)> c (NH4+) >c (H+)
做题关键:
份数程度优先原则,出现在前,不出现在后
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
①一元弱酸盐如:CH3COONa
CH3COO-+H2O CH3COOH+OH-
CH3COONa=Na+ +CH3COO-
H2O H++ OH–
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
②多元弱酸盐如:Na2CO3
Na2CO3 = 2Na+ + CO32-
CO32- + H2O OH– + HCO3-
HCO3- + H2O H2CO3 + OH–
c(Na+)>c(CO32- )>c(OH-)>c(HCO3-) >c(H2CO3 ) >c(H+)
H2O H++ OH–
③酸式盐溶液:NaHCO3溶液
H2O H+ + OH–
HCO3– CO32– + H+
HCO3– + H2O H2CO3 + OH–
Na2HCO3– == Na+ + HCO3–
溶液显碱性 故:
HCO3– 的电离程度<水解程度
c (Na+ ) > c (HCO3–) > c (OH– ) > c (H2CO3) > c (H+) > c (CO32–)
(3)盐溶液
2.单一溶质溶液中粒子浓度比较
练习:NH4HSO4
NH4+ + H2O NH3·H2O + H+
H2O H++ OH–
NH4HSO4=NH4+ + SO42- + H+
c (H+) > c (SO42)- >c (NH4+) >c (NH3·H2O )
练一练 列出下列溶液中微粒浓度排序
NaHSO3 (显酸性)
c (Na+ ) > c (HSO3- ) >c (H+) > c (SO32-) >c (OH-) > c (H2SO3)
电离大于水解:
NaHSO3 KHC2O4 NaH2PO4
等物质的量浓度 NH4Cl 与NH3.H2O 的混合溶液
等物质的量浓度 CH3COOH 与 CH3COONa的混合溶液
水解大于电离:
NaHCO3 NaHS Na2HPO4
等浓度的HCN与NaCN的混合溶液
3.混合溶液(需判断真实的溶质)
例1.用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-)
B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
AB
①两种物质混合不反应
例2.在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO -)+c(CH3COO H)
D.c(Na+)+c(H+)=c(CH3COO -)+c(OH-)
A
②两种物质恰好完全反应
③两种物质反应,其中一种有剩余
例3:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(CH3COO -)>c(Na+)
B、c(CH3COOH)>c(CH3COO -)
C、2c(H+)=c(CH3COO -)-c(CH3COOH)
D、c(CH3COOH)+c(CH3COO -)=0.01 mol·L-1
AD
(1)若 “>”或“<”, “电离”和“水解”。
(2)若 “=”连接,应根据“守恒”原理,视不同情况而定。
①若等号一端全部是阴离子或阳离子,应首先考虑电荷守恒;
②若等号一端各项中都含有同一种元素,应首先考虑这种元素的元素质量守恒;
③若出现等号,但既不是电荷守恒,也不是元素质量守恒,则可考虑将电荷守恒和元素质量守恒进行合并处理,即推得质子守恒。
(3)溶液是混合溶液时,先考虑溶质的相互反应,然后再根据反应后的生成物进行比较。
粒子浓度关系的策略
三、数形结合
滴定曲线图像分析
数形结合滴定曲线图像分析
关键:分析起点 反应一半点
恰好中和点 中性点 过量点等
对应的物质组成
例1)298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确( )
A.该滴定过程应该选择酚酞作为指示剂 B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中
c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
例1 298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图1所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确 D
A.该滴定过程应该选择酚酞(甲基橙或甲基红)
作为指示剂
B.M点对应的盐酸体积为(小于)20.0mL
C.M点处溶液c(NH4+)=c(Cl-) =(﹥) c(H+)=c(OH-)
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
例1298K时,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L 1的盐酸,溶液的pH与所加盐酸的体积关系如下图1所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确 D
D.N点处的溶液中pH<12
起点:NH3·H2O
c(OH-)=1.32×10-3
< 10-2
例2:常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
①该滴定终点为__点;(填“a”、“b”或“c”)
②b点对应的溶液中,c(NH4+)_______ c(Cl-);(填“>”、“<”或“=”)
③室温下,NH3·H2O的Kb≈_______________。 (保留两位有效数字)
恰好中和点 : NH4Cl
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
碱性点:NH3·H2O+NH4Cl
突
变
范
围
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
①该滴定终点为c点;(填“a”、“b”或“c”)
恰好中和点 : NH4Cl
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
碱性点:NH3·H2O+NH4Cl
突
变
范
围
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
②b点对应的溶液中,c(NH4+)=c(Cl-);(填“>”、“<”或“=”)
中性点: NH4Cl+NH3·H2O,c(H+)=c(OH-)
常温下取氨水25.00 mL于锥形瓶中,用0.0500 mol·L-1 HCl滴定,混合溶液的pH变化曲线如下图所示。
③室温下,NH3·H2O的Kb≈ 2.2×10-5 。(保留两位有效数字)
恰好中和点 : NH4Cl,n(酸)=n(碱)
Kb=[c(NH4+)× c(OH-)]÷c(NH3·H2O)
HCl ~ NH3·H2O
起点:NH3·H2O
例3:常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是( )
A.b、d两点为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温0.1 mol/L氨水的电离常数K约为1×10-5
例3:常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是( )
A.b、d两点为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温0.1 mol/L氨水的电离常数K约为1×10-5
常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图6所示。则下列说法正确的是 D
A.b、d两点(C点)为恰好完全反应点 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.a、b之间的任意一点:
c(Cl-)> ( <) c(NH4+),c(H+)> ( <) c(OH-)
起点:NH3·H2O
中性点:NH4Cl+NH3·H2O
恰好中和点 : NH4Cl
酸过量:NH4Cl+HCl
常温下,向20 mL 0.1 mol/L氨水中滴加盐酸,溶液中水电离出的氢离子浓度随加入盐酸体积变化如下图所示。则下列说法正确的是 D
D.常温0.1 mol/L氨水的电离常数K 约为1×10-5
起点:NH3·H2O
Kb=[c(NH4+)× c(OH-)]÷c(NH3·H2O)
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是( )
曲线P—J—N表示溶液中pH的变化
B. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
C. M、P两点的数值之和a+b=14
D. M点水的电离程度比Q点大
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是( )
曲线P—J—N表示溶液中pH的变化
B. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
C. M、P两点的数值之和a+b=14
D. M点水的电离程度比Q点大
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
曲线P—J—N表示溶液中pH ( pOH )的变化
B. pH与pOH交叉点J对应V(盐酸)= ( <)20.00 mL
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
酸性点:NH4Cl+HCl
碱性点:NH3·H2O+NH4Cl
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
曲线P—J—N表示溶液中pH ( pOH )的变化
B. pH与pOH交叉点J对应V(盐酸)= ( <)20.00 mL
起点:NH3·H2O
中性点: NH4Cl+NH3·H2O
酸性点:NH4Cl+HCl
碱性点:NH3·H2O+NH4Cl
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
C. M、P 两点的数值之和a+b=14
碱性区域:
NH3·H2O+NH4Cl
酸性区域:
NH4Cl+HCl
中性点:
NH4Cl
+NH3·H2O
关系:M、P 两点为酸碱中和同一点!
c(H+)M =
c(OH-)P =
c(H+)H2O = 10-a =c(H+)aq
c(OH-) NH3·H2O+NH4Cl=10-b=c(OH-)aq
pOH + pH =14
例4:已知pOH=-lg c(OH-)。298 K 时向 20.00 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1盐酸,溶液的pH和pOH与加入盐酸体积的关系如下图所示。下列说法正确的是 C
C. M、P 两点的数值之和a+b=14
D. M点水的电离程度比(等于)Q点大
碱性区域:
NH3·H2O+NH4Cl
酸性区域:
NH4Cl+HCl
中性点:
NH4Cl
+NH3·H2O
c(H+)M =c(H+)H2O= 10-a=c(OH-)H2O
c(H+)Q =
c(OH-)H2O=10b-14=c(H+)H2O
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是 ( )
A. t℃时,MOH的Kb>1.0×10-3
B.盐酸与MOH溶液恰好中和时溶液pH=6.5 C. a=12
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是 ( )
A. t℃时,MOH的Kb>1.0×10-3
B.盐酸与MOH溶液恰好中和时溶液pH=6.5 C. a=12
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图5所示,以下说法正确的是 A
A. t℃时,MOH的Kb>1.0×10-3
起点:NH3·H2O
起点:NH3·H2O
Kb=[c(M+)× c(OH-)]÷c(MOH)
已知pOH=-lgc(OH-)。
t℃时,往50mL 0.1mol·L-1MOH溶液滴加盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图5所示,以下说法正确的是 A
B.盐酸与MOH溶液恰好中和时溶液pH= ( <) 6.5
C. a=12(11)
D.滴入盐酸体积达26.0mL时,溶液中微粒浓度
c(Cl-)>c(H+)>c(M+)(c(M+)>c(H+))> c(MOH)>c(OH-)
