上海市曹杨第二中学2023-2024学年高二上学期10月月考化学试卷(含答案)
文档属性
| 名称 | 上海市曹杨第二中学2023-2024学年高二上学期10月月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 288.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 07:28:30 | ||
图片预览


文档简介
曹杨第二中学2023-2024学年高二上学期10月月考
化学
一、焓变的测量
化学反应的焓变通常用实验进行测定,也可进行理论推算。
1. 下列变化过程,属于放热反应的是____(填写序号)。
①浓H2SO4稀释 ②酸碱中和反应 ③H2在Cl2中燃烧
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
2. 肼(H2N-NH2,氮原子氢原子核外均达到稳定结构)燃烧涉及的共价键的键能与热化学方程式信息见下表:
共价键 N-H N-N O=O O-H
键能/(kJ·mol-1) 391 161 498 463
热化学方程式 N2H4(g)+O2(g)→N2(g)+2H2O(g)+570kJ
则N2(g)→2N(g)的焓变为( )
A. 1882kJ B. 941kJ C. 483kJ D. 241.5kJ
3. 某同学利用中和热实验装置测量中和热数值,中和热理论值=-57.3kJ·mol-1。
①用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行中和反应,通过计算得到=-54.8 kJ·mol-1。产生此偏差的原因可能是_____(双选)。
A. 实验时室温较高 B. 实验装置保温、隔热效果差
C. 一次性把NaOH溶液倒入 D. 使用实验最终温度计算温度差
4. 将溶质物质的量相同的酸溶液与碱溶液相混合,
a:盐酸和氢氧化钠, b:醋酸和氢氧化钠, C:醋酸和氨水。其所放出热量比较,正确的是( )
A. a>b>c B. c>b>a C. b>c>a D. a=b=c
二、聚焦碳中和
碳中和是指在是指在一定时间内产生的温室气体(CO2或CH4等),通过封存、造林、减排、再利用等形、
式,加以抵消,达到相对“零排放”。
5. 下列关于碳中和说法正确的是( )
A. 大力开发光伏,风电等清洁能源能是碳中和的重要措施
B. 植树造林能有效减少二氧化碳排放
C. 碳中和的最终目的是不再排放CO2等温室气体
D. 温室效应气体的大量排放是造成大气臭氧层空洞的主要原因
二氧化碳和甲烷是两种主要的温室效应气体
6. 写出碳在元素周期表的位置________,写出CO2的电子式_______。
7. 下列关于甲烷的描述正确的是____(双选)。
A. 可表示甲烷的空间填充模型
B. 可表示甲烷的球棍模型
C. 甲烷的燃烧热为-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l),=-890.3kJ/mol
D. 气态氢化物的热稳定性:CH4二氧化碳的封存是指将CO2废气富集后加压通入地下进行石油,天然气的开采
8. 对CO2加压过程中系统的W___0。
A. 大于 B. 小于 C. 等于
9. 工业上用Na2CO3溶液吸收废气中的CO2,流程如下:
写出反应一的离子方程式_________________________________________________。
10. 根据所学知识,推测反应一的____0。
A. 大于 B. 小于
11. 根据所学知识,推测反应二的____0。
A. 大于 B. 小于
富集后的CO2也可进行再利用,例如“加氢法减碳”制甲醇。
总反应可表示为①CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
该反应一般认为通过如下步骤来实现:
②CO2(g)+H2(g)CO(g)+H2O(g)
③CO(g)+2H2(g)CH3OH(g)
12. 上述总反应的=______(列式,用和表示);写出总反应的平衡常数表达式_____________。
13. 上述三个反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则____。
A. 大于 B. 小于 C. 等于
14. 对于上述反应体系,下列说法正确的是____(双选)。
A. 增大初始投料比n(CO2)/n(H2),有利于提高CO2的转化率
B. 当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
C. 体系达平衡后,若压缩容器体积,则反应②平衡不移动,反应①平衡正向移动
D. 选用合适的催化剂可以提高反应①中CO2的平衡转化率
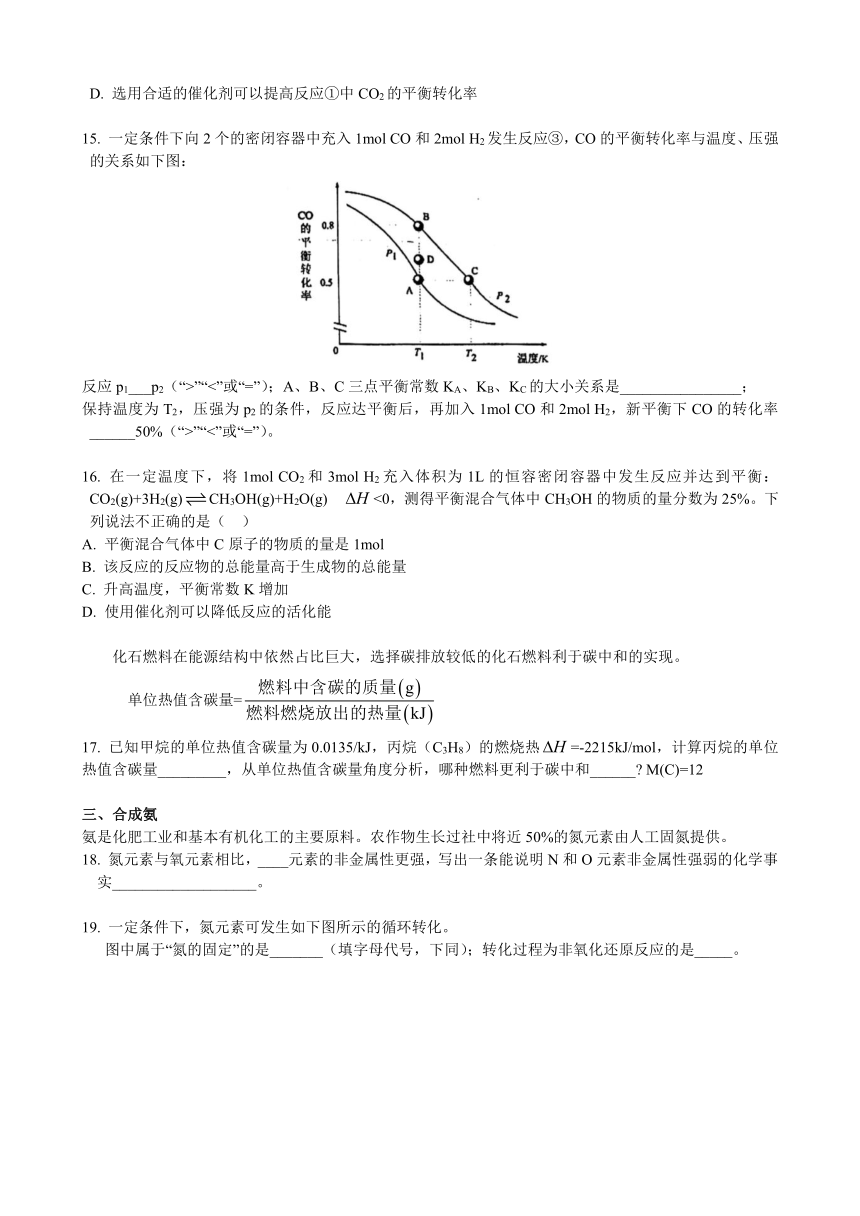
15. 一定条件下向2个的密闭容器中充入1mol CO和2mol H2发生反应③,CO的平衡转化率与温度、压强的关系如下图:
反应p1___p2(“>”“<”或“=”);A、B、C三点平衡常数KA、KB、KC的大小关系是________________;
保持温度为T2,压强为p2的条件,反应达平衡后,再加入1mol CO和2mol H2,新平衡下CO的转化率______50%(“>”“<”或“=”)。
16. 在一定温度下,将1mol CO2和3mol H2充入体积为1L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g)CH3OH(g)+H2O(g) <0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
A. 平衡混合气体中C原子的物质的量是1mol
B. 该反应的反应物的总能量高于生成物的总能量
C. 升高温度,平衡常数K增加
D. 使用催化剂可以降低反应的活化能
化石燃料在能源结构中依然占比巨大,选择碳排放较低的化石燃料利于碳中和的实现。
单位热值含碳量=
17. 已知甲烷的单位热值含碳量为0.0135/kJ,丙烷(C3H8)的燃烧热=-2215kJ/mol,计算丙烷的单位热值含碳量_________,从单位热值含碳量角度分析,哪种燃料更利于碳中和______ M(C)=12
三、合成氨
氨是化肥工业和基本有机化工的主要原料。农作物生长过社中将近50%的氮元素由人工固氮提供。
18. 氮元素与氧元素相比,____元素的非金属性更强,写出一条能说明N和O元素非金属性强弱的化学事实___________________。
19. 一定条件下,氮元素可发生如下图所示的循环转化。
图中属于“氮的固定”的是_______(填字母代号,下同);转化过程为非氧化还原反应的是_____。
20. 下图是未用催化剂N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线,并写出该条件下1mol NH3(g)分解对应的热化学方程式:______
______________________________________________。
21. 对于合成氨反应,达到平衡后,以下分析正确的是( )
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
22. 使用催化剂时反应历程和能量变化如图,其中吸附在催化剂表面上的物种用“吸”标性。
根据反应历程和能量变化图,计算反应决速步骤的活化能____kJ/mol。
23. 在定温度下,将3mol和1mol置于2L密闭容器中,反应达到平衡时,混合气体中NH3的体积分数为3/7,该反应的平衡常数K=_____(用分数表示)。
下图为工业合成氨的流程图:
24. ⑥循环利用的物质是________,①的气体若不净化,容易造成的问题是_____________________。
25. 上述流程中能增加反应速率的是_______,能提高原料转化率的是_______(填数字编号)。
某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相
同):
序号 起始投入量 平衡转化率
N2 H2 NH3
①恒温恒容 1mol 3mol 0 α1
②绝热恒容 1mol 3mol 0 α2
③恒温恒压 1mol 3mol 0 α3
26. 则:α1____α2、α1____α3(填“>”、“=”或“<”)。
四、H2S的回收处理
石油化工、煤化工等行业的废气中普遍含有硫化氢,H2S的回收利用有重要意义。以下是H2S处理的一些 方法。
Ⅰ. 用氢氧化钠溶液吸收
27. 写出用过量NaOH吸收H2S的离子方程式____________________,尾气中是否含有H2S可用硫酸铜溶液检验,若尾气含有硫化氢,现象是_________________。
Ⅱ. 制取CS2,其反应的能量示意如下图所示:
28. 写出由H2S、CH4生成CS2的热化学方程式___________________________________________。
Ⅲ. 高温分解:2H2S(g)S2(g)+2H2(g) =340kJ/mol
29. 能够判断上述反应到达平衡状态的是____(双选)。
A. H2的浓度保持不变 B. 气体的质量保持不变
C. 恒容时,容器的压强保持不变 D. 2v正(H2S)=v逆(S2)
30. 在恒温恒压条件下,充入氩气,发现:n(H2S):n(Ar)越小,H2S平衡转化率越大,请解释可能的原因:
_______________________________________________________________________________________
_______________________________________________________________________________________。
31. 某温度时,向体积不等的恒容容器中加入等量H2S,反应相同时间后,测得各容器中比H2S的转化率与容器体积关系如图所示。Vn之后,H2S的转化率下降的原因是_________________________________
______________________________________________________。
Ⅳ. 将H2S燃烧,产生的SO2与剩余H2S混合后反应,生成单质硫回收
①2H2S(g)+3O2(g)→2SO2(g)+2H2O(g) =-2072kJ/mol
②2H2S(g)+SO2(g)S8(s)+2H2O(g) =188kJ/mol
32. ②的平衡常数表达式为_____________,某温度下,若只发生反应②,从反应考试到15s时,测得容器内的气体密度减小了14.4g·L-1,则0~15s内,SO2平均反应速率v(SO2)=______。
33. 在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:
c(H2S)=0.3mol·L-1、c(SO2)=0.6mol·L-1、c(H2O)=2.4mol·L-1
请计算开始时投料比=__________。
Ⅴ. 活性炭吸附氧化法
可用表面喷淋水的活性炭吸附氧化H2S,其反应原理如下图所示:
34. 该方法的总反应方程式为____________________________。
参考答案
一、
1. ②③
2. B
3. AB
4. A
二、
5. A
6. 第二周期IVA族;
7. AC
8. A
9. CO2+CO32-+H2O=2HCO3-
10. B
11. A
12. +;
13. >
14. BC
15. <;KA=KB>KC;=
16. C
17. 0.0163 kJ/mol;甲烷;
三、
18. O;NO2中氮元素显正价,氧元素显负价
19. ck;ad
20. NH3(g) 1/2N2(g)+3/2H2(g) ΔH=46kJ/mol
21. B
22. 200
23. 25/3
24. N2、H2;催化剂中毒
25. ②③④;②⑤
26. >;<
四、
27. H2S+2OH-=S2-+2H2O;产生黑色沉淀
28. 2H2S(g)+CH4(g) CS2(g)+4H2(g) ΔH=+(b-d)kJ/mol
29. AC
30. 在恒温恒压的平衡体系中充入氩气,相当于减小压强,平衡正向移动,H2S平衡转化率增大
31. 容器容积越大,气体压强越小,反应速率越慢,相同时间内消耗的n(H2S)少
32. ;0.01mol/(L·s)
33. 3/2
34. 2H2S+O2=S↓+2H2O
化学
一、焓变的测量
化学反应的焓变通常用实验进行测定,也可进行理论推算。
1. 下列变化过程,属于放热反应的是____(填写序号)。
①浓H2SO4稀释 ②酸碱中和反应 ③H2在Cl2中燃烧
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
2. 肼(H2N-NH2,氮原子氢原子核外均达到稳定结构)燃烧涉及的共价键的键能与热化学方程式信息见下表:
共价键 N-H N-N O=O O-H
键能/(kJ·mol-1) 391 161 498 463
热化学方程式 N2H4(g)+O2(g)→N2(g)+2H2O(g)+570kJ
则N2(g)→2N(g)的焓变为( )
A. 1882kJ B. 941kJ C. 483kJ D. 241.5kJ
3. 某同学利用中和热实验装置测量中和热数值,中和热理论值=-57.3kJ·mol-1。
①用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行中和反应,通过计算得到=-54.8 kJ·mol-1。产生此偏差的原因可能是_____(双选)。
A. 实验时室温较高 B. 实验装置保温、隔热效果差
C. 一次性把NaOH溶液倒入 D. 使用实验最终温度计算温度差
4. 将溶质物质的量相同的酸溶液与碱溶液相混合,
a:盐酸和氢氧化钠, b:醋酸和氢氧化钠, C:醋酸和氨水。其所放出热量比较,正确的是( )
A. a>b>c B. c>b>a C. b>c>a D. a=b=c
二、聚焦碳中和
碳中和是指在是指在一定时间内产生的温室气体(CO2或CH4等),通过封存、造林、减排、再利用等形、
式,加以抵消,达到相对“零排放”。
5. 下列关于碳中和说法正确的是( )
A. 大力开发光伏,风电等清洁能源能是碳中和的重要措施
B. 植树造林能有效减少二氧化碳排放
C. 碳中和的最终目的是不再排放CO2等温室气体
D. 温室效应气体的大量排放是造成大气臭氧层空洞的主要原因
二氧化碳和甲烷是两种主要的温室效应气体
6. 写出碳在元素周期表的位置________,写出CO2的电子式_______。
7. 下列关于甲烷的描述正确的是____(双选)。
A. 可表示甲烷的空间填充模型
B. 可表示甲烷的球棍模型
C. 甲烷的燃烧热为-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l),=-890.3kJ/mol
D. 气态氢化物的热稳定性:CH4
8. 对CO2加压过程中系统的W___0。
A. 大于 B. 小于 C. 等于
9. 工业上用Na2CO3溶液吸收废气中的CO2,流程如下:
写出反应一的离子方程式_________________________________________________。
10. 根据所学知识,推测反应一的____0。
A. 大于 B. 小于
11. 根据所学知识,推测反应二的____0。
A. 大于 B. 小于
富集后的CO2也可进行再利用,例如“加氢法减碳”制甲醇。
总反应可表示为①CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
该反应一般认为通过如下步骤来实现:
②CO2(g)+H2(g)CO(g)+H2O(g)
③CO(g)+2H2(g)CH3OH(g)
12. 上述总反应的=______(列式,用和表示);写出总反应的平衡常数表达式_____________。
13. 上述三个反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则____。
A. 大于 B. 小于 C. 等于
14. 对于上述反应体系,下列说法正确的是____(双选)。
A. 增大初始投料比n(CO2)/n(H2),有利于提高CO2的转化率
B. 当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
C. 体系达平衡后,若压缩容器体积,则反应②平衡不移动,反应①平衡正向移动
D. 选用合适的催化剂可以提高反应①中CO2的平衡转化率
15. 一定条件下向2个的密闭容器中充入1mol CO和2mol H2发生反应③,CO的平衡转化率与温度、压强的关系如下图:
反应p1___p2(“>”“<”或“=”);A、B、C三点平衡常数KA、KB、KC的大小关系是________________;
保持温度为T2,压强为p2的条件,反应达平衡后,再加入1mol CO和2mol H2,新平衡下CO的转化率______50%(“>”“<”或“=”)。
16. 在一定温度下,将1mol CO2和3mol H2充入体积为1L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g)CH3OH(g)+H2O(g) <0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
A. 平衡混合气体中C原子的物质的量是1mol
B. 该反应的反应物的总能量高于生成物的总能量
C. 升高温度,平衡常数K增加
D. 使用催化剂可以降低反应的活化能
化石燃料在能源结构中依然占比巨大,选择碳排放较低的化石燃料利于碳中和的实现。
单位热值含碳量=
17. 已知甲烷的单位热值含碳量为0.0135/kJ,丙烷(C3H8)的燃烧热=-2215kJ/mol,计算丙烷的单位热值含碳量_________,从单位热值含碳量角度分析,哪种燃料更利于碳中和______ M(C)=12
三、合成氨
氨是化肥工业和基本有机化工的主要原料。农作物生长过社中将近50%的氮元素由人工固氮提供。
18. 氮元素与氧元素相比,____元素的非金属性更强,写出一条能说明N和O元素非金属性强弱的化学事实___________________。
19. 一定条件下,氮元素可发生如下图所示的循环转化。
图中属于“氮的固定”的是_______(填字母代号,下同);转化过程为非氧化还原反应的是_____。
20. 下图是未用催化剂N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请在图中绘制同条件下加入铁触媒后相应的能量变化曲线,并写出该条件下1mol NH3(g)分解对应的热化学方程式:______
______________________________________________。
21. 对于合成氨反应,达到平衡后,以下分析正确的是( )
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
22. 使用催化剂时反应历程和能量变化如图,其中吸附在催化剂表面上的物种用“吸”标性。
根据反应历程和能量变化图,计算反应决速步骤的活化能____kJ/mol。
23. 在定温度下,将3mol和1mol置于2L密闭容器中,反应达到平衡时,混合气体中NH3的体积分数为3/7,该反应的平衡常数K=_____(用分数表示)。
下图为工业合成氨的流程图:
24. ⑥循环利用的物质是________,①的气体若不净化,容易造成的问题是_____________________。
25. 上述流程中能增加反应速率的是_______,能提高原料转化率的是_______(填数字编号)。
某兴趣小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:(反应起始的温度和体积均相
同):
序号 起始投入量 平衡转化率
N2 H2 NH3
①恒温恒容 1mol 3mol 0 α1
②绝热恒容 1mol 3mol 0 α2
③恒温恒压 1mol 3mol 0 α3
26. 则:α1____α2、α1____α3(填“>”、“=”或“<”)。
四、H2S的回收处理
石油化工、煤化工等行业的废气中普遍含有硫化氢,H2S的回收利用有重要意义。以下是H2S处理的一些 方法。
Ⅰ. 用氢氧化钠溶液吸收
27. 写出用过量NaOH吸收H2S的离子方程式____________________,尾气中是否含有H2S可用硫酸铜溶液检验,若尾气含有硫化氢,现象是_________________。
Ⅱ. 制取CS2,其反应的能量示意如下图所示:
28. 写出由H2S、CH4生成CS2的热化学方程式___________________________________________。
Ⅲ. 高温分解:2H2S(g)S2(g)+2H2(g) =340kJ/mol
29. 能够判断上述反应到达平衡状态的是____(双选)。
A. H2的浓度保持不变 B. 气体的质量保持不变
C. 恒容时,容器的压强保持不变 D. 2v正(H2S)=v逆(S2)
30. 在恒温恒压条件下,充入氩气,发现:n(H2S):n(Ar)越小,H2S平衡转化率越大,请解释可能的原因:
_______________________________________________________________________________________
_______________________________________________________________________________________。
31. 某温度时,向体积不等的恒容容器中加入等量H2S,反应相同时间后,测得各容器中比H2S的转化率与容器体积关系如图所示。Vn之后,H2S的转化率下降的原因是_________________________________
______________________________________________________。
Ⅳ. 将H2S燃烧,产生的SO2与剩余H2S混合后反应,生成单质硫回收
①2H2S(g)+3O2(g)→2SO2(g)+2H2O(g) =-2072kJ/mol
②2H2S(g)+SO2(g)S8(s)+2H2O(g) =188kJ/mol
32. ②的平衡常数表达式为_____________,某温度下,若只发生反应②,从反应考试到15s时,测得容器内的气体密度减小了14.4g·L-1,则0~15s内,SO2平均反应速率v(SO2)=______。
33. 在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:
c(H2S)=0.3mol·L-1、c(SO2)=0.6mol·L-1、c(H2O)=2.4mol·L-1
请计算开始时投料比=__________。
Ⅴ. 活性炭吸附氧化法
可用表面喷淋水的活性炭吸附氧化H2S,其反应原理如下图所示:
34. 该方法的总反应方程式为____________________________。
参考答案
一、
1. ②③
2. B
3. AB
4. A
二、
5. A
6. 第二周期IVA族;
7. AC
8. A
9. CO2+CO32-+H2O=2HCO3-
10. B
11. A
12. +;
13. >
14. BC
15. <;KA=KB>KC;=
16. C
17. 0.0163 kJ/mol;甲烷;
三、
18. O;NO2中氮元素显正价,氧元素显负价
19. ck;ad
20. NH3(g) 1/2N2(g)+3/2H2(g) ΔH=46kJ/mol
21. B
22. 200
23. 25/3
24. N2、H2;催化剂中毒
25. ②③④;②⑤
26. >;<
四、
27. H2S+2OH-=S2-+2H2O;产生黑色沉淀
28. 2H2S(g)+CH4(g) CS2(g)+4H2(g) ΔH=+(b-d)kJ/mol
29. AC
30. 在恒温恒压的平衡体系中充入氩气,相当于减小压强,平衡正向移动,H2S平衡转化率增大
31. 容器容积越大,气体压强越小,反应速率越慢,相同时间内消耗的n(H2S)少
32. ;0.01mol/(L·s)
33. 3/2
34. 2H2S+O2=S↓+2H2O
同课章节目录
