上海市青浦区2023-2024学年高一上学期10月月考化学试卷(含答案)
文档属性
| 名称 | 上海市青浦区2023-2024学年高一上学期10月月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 72.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 07:29:36 | ||
图片预览

文档简介
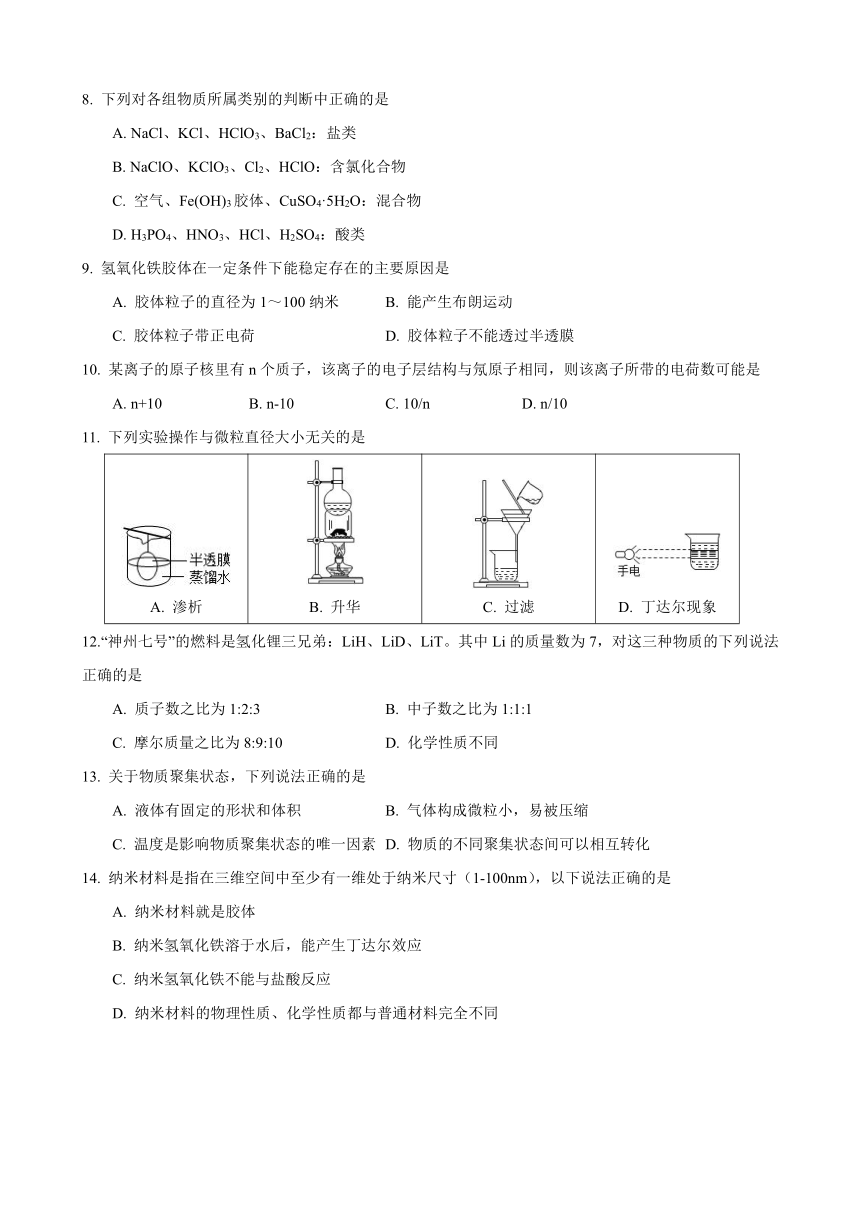
上海市青浦区2023-2024学年高一上学期10月月考
化学试卷
可能用到的相对原子质量:H-1、He-4、C-12、N-14、O-16、Mg-24、Al-27、Fe-56
一、选择题(每小题只有一个正确答案,每题2分,共40分)
1. 化学是一门充满神奇色彩的科学,关于其研究领域说法错误的是
A. 探索原子、分子的特征和行为,从而控制原子、分子之间的反应
B. 分析自然界物质构成,以便在工厂中实现规模生产
C. 合成与开发自然界中并不存在的新物质、新材料以满足人们生产生活需求
D. 合成与开发自然界中并不存在的新元素,解决环境、能源、资源问题
2. 人们用DNA制造出一种臂长只有7nm的纳米镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米镊子具有相同数量级的是
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
3. 根据某种共性,将CO2、P2O5、SiO2归为一类,下列物质中符合此共性而被归为一类的是
A. SO2 B. CaO C. NO2 D. CO
4. 下列物质一定属于混合物的是
A. 固态物质 B. 含多种元素的物质
C. 液态物质 D. 没有颜色的溶液
5. 下列各对物质中,互为同位素的是
①H、H ②H2O、D2O ③Cl、Cl ④金刚石、石墨 ⑤O2、O3 ⑥D2、H+
A. ①②③ B. ①③ C. ③④⑤ D. ①③⑥
6. 下列说法中肯定错误的是
A. 某原子在K层上只有一个电子
B. 某原子M层上电子数为L层电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
7. aX和bY分别是元素X和元素Y的一种核素,已知a>b,则元素X和元素Y的近似相对原子质量的关系是
A. 大于 B. 等于 C. 小于 D. 不能确定
8. 下列对各组物质所属类别的判断中正确的是
A. NaCl、KCl、HClO3、BaCl2:盐类
B. NaClO、KClO3、Cl2、HClO:含氯化合物
C. 空气、Fe(OH)3胶体、CuSO4·5H2O:混合物
D. H3PO4、HNO3、HCl、H2SO4:酸类
9. 氢氧化铁胶体在一定条件下能稳定存在的主要原因是
A. 胶体粒子的直径为1~100纳米 B. 能产生布朗运动
C. 胶体粒子带正电荷 D. 胶体粒子不能透过半透膜
10. 某离子的原子核里有n个质子,该离子的电子层结构与氖原子相同,则该离子所带的电荷数可能是
A. n+10 B. n-10 C. 10/n D. n/10
11. 下列实验操作与微粒直径大小无关的是
A. 渗析 B. 升华 C. 过滤 D. 丁达尔现象
12.“神州七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不同
13. 关于物质聚集状态,下列说法正确的是
A. 液体有固定的形状和体积 B. 气体构成微粒小,易被压缩
C. 温度是影响物质聚集状态的唯一因素 D. 物质的不同聚集状态间可以相互转化
14. 纳米材料是指在三维空间中至少有一维处于纳米尺寸(1-100nm),以下说法正确的是
A. 纳米材料就是胶体
B. 纳米氢氧化铁溶于水后,能产生丁达尔效应
C. 纳米氢氧化铁不能与盐酸反应
D. 纳米材料的物理性质、化学性质都与普通材料完全不同
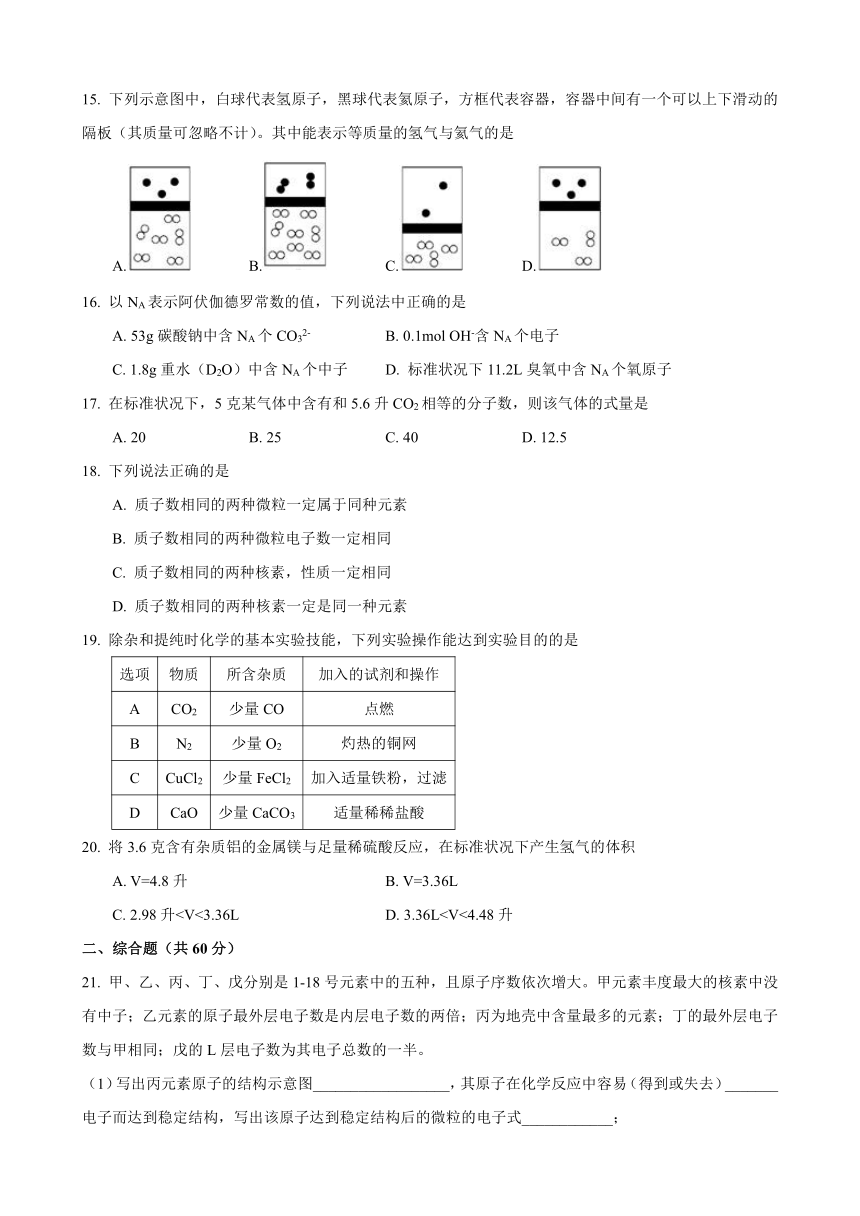
15. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是
A. B. C. D.
16. 以NA表示阿伏伽德罗常数的值,下列说法中正确的是
A. 53g碳酸钠中含NA个CO32- B. 0.1mol OH-含NA个电子
C. 1.8g重水(D2O)中含NA个中子 D. 标准状况下11.2L臭氧中含NA个氧原子
17. 在标准状况下,5克某气体中含有和5.6升CO2相等的分子数,则该气体的式量是
A. 20 B. 25 C. 40 D. 12.5
18. 下列说法正确的是
A. 质子数相同的两种微粒一定属于同种元素
B. 质子数相同的两种微粒电子数一定相同
C. 质子数相同的两种核素,性质一定相同
D. 质子数相同的两种核素一定是同一种元素
19. 除杂和提纯时化学的基本实验技能,下列实验操作能达到实验目的的是
选项 物质 所含杂质 加入的试剂和操作
A CO2 少量CO 点燃
B N2 少量O2 灼热的铜网
C CuCl2 少量FeCl2 加入适量铁粉,过滤
D CaO 少量CaCO3 适量稀稀盐酸
20. 将3.6克含有杂质铝的金属镁与足量稀硫酸反应,在标准状况下产生氢气的体积
A. V=4.8升 B. V=3.36L
C. 2.98升二、综合题(共60分)
21. 甲、乙、丙、丁、戊分别是1-18号元素中的五种,且原子序数依次增大。甲元素丰度最大的核素中没有中子;乙元素的原子最外层电子数是内层电子数的两倍;丙为地壳中含量最多的元素;丁的最外层电子数与甲相同;戊的L层电子数为其电子总数的一半。
(1)写出丙元素原子的结构示意图__________________,其原子在化学反应中容易(得到或失去)_______电子而达到稳定结构,写出该原子达到稳定结构后的微粒的电子式____________;
(2)戊元素在自然界中有四种稳定的核素,其中子数分别为16、17、18、20,各核素的丰度依次为95.02%、0.75%、4.21%和0.02%,其中中子数为18的核素的符号为_________,戊元素的近似相对原子质量为_______(保留2为小数);
(3)上述五种元素的原子形成的简单离子中电子层结构相同的是(写离子符号)_________________;
(4)写出甲元素的三种核素的名称__________________,甲和丁元素能形成化合物,试写出化学式并标出各元素的化合价____________。
22. 近年来,人类生产、生活所产生的污染,如机动车、燃煤、工业等排放的废气,使灰霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。
(1)下列有关说法正确的是__________(填序号)。
A. 灰霾是一种分散系 B. 灰霾能产生丁达尔效应
C. 灰霾形成的是稳定的体系 D. 戴口罩不能阻止吸入灰霾粒子
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,是近地面层空气中水汽凝结(或凝华)的产物。霾也成灰霾,空气中的灰尘(如煤炭及三氧化二铁粉尘)、一氧化氮、二氧化碳、二氧化氮、二氧化硫、硫酸、有机碳氢化合物等粒子使大气浑浊,造成视野模糊并导致能见度较低。形成灰霾的主要物质中能发生若干反应,其中金属氧化物与硫酸反应的化学方程式为_________________________,碳氧化物与足量氢氧化钠溶液反应的化学方程式为______________________________。
(3)雾是气溶胶,氢氧化铁胶体是液溶胶,写出实验室制备氢氧化铁胶体的化学方程式:________________,提纯胶体的方法是_________________。
(4)现有甲、乙、丙三名同学分别进行硅酸胶体的制备实验:
分组 实验操作 实验现象
甲 将1%硅酸钠溶液滴入沸水中,冷却后用激光笔进行照射 无明显现象,未出现“光亮的通路”
乙 向1%硅酸钠溶液中加入几滴酚酞溶液,缓慢滴入稀盐酸,溶液红色褪去后停止滴加,用激光笔进行照射 出现“光亮的通路”
丙 向1%硅酸钠溶液中加入等体积的稀盐酸,用激光笔进行照射 未出现“光亮的通路”,溶液中出现浑浊
已知:硅酸钠(Na2SiO3)溶液呈碱性,遇酚酞变红;常温下硅酸(H2SiO3)难溶于水。
试回答:
成功制备硅酸胶体的是_______同学,根据三位同学的实验操作可知,成功制备硅酸胶体的关键在于
_____________________________________________________,丙同学实验中出现浑浊的原因是
______________________________________________________。
23. 硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
(1)实验室制取硫化氢的化学反应方程式为_________________________。
(2)根据装置图回答下列问题:
制取硫化氢气体的发生装置可以选_______;若用C装置收集硫化氢气体,进气口应为________,原因是____________________________________;为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是__________________,现象是_______________________________。
(3)做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为____________溶液。
(4)标准状况下硫化氢气体的密度是_________g·L-1。
24. 物质的量是架起微观粒子和宏观物质的桥梁,试回答:
(1)甲烷的摩尔质量为___________,8g甲烷气体中约含有___________个分子,在标准状况下所占的体积约为___________L,与其所含原子数相等的氨气的质量为___________g。
(2)在标准状况下,一个装满Cl2的容器为74.6g,若装满N2,则质量为66g,则此容器的容积为________L;若充满某X气体的质量是69.2g,则X气体的摩尔质量为____________。
(3)有一种FeSO4和Fe2(SO4)3的固体混合物,已测得含硫的质量分数为23%,则含铁的质量分数为
_____________。
参考答案
一、选择题
1 2 3 4 5 6 7 8 9 10
D B A D B B D D C B
11 12 13 14 15 16 17 18 19 20
B C D B A B A D B D
二、综合题
21.(1);得到;
(2)S;32.09
(3)O2-、Na+
(4)氕、氘、氚;
22.(1)A
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;CO2+2NaOH=Na2CO3+H2O
(3)FeCl3+3H2OFe(OH)3(胶体)+3HCl;渗析
(4)稀盐酸的加入量;过量的盐酸导致胶体发生聚沉
23.(1)FeS+H2SO4=FeSO4+H2S↑
(2)B;b;硫化氢气体密度大于空气;紫色石蕊溶液;紫色石蕊溶液变红
(3)NaOH溶液
(4)1.52
24.(1)16g/mol;3.01×1023;11.2;10.625
(2)4.48;44g/mol
(3)31%
化学试卷
可能用到的相对原子质量:H-1、He-4、C-12、N-14、O-16、Mg-24、Al-27、Fe-56
一、选择题(每小题只有一个正确答案,每题2分,共40分)
1. 化学是一门充满神奇色彩的科学,关于其研究领域说法错误的是
A. 探索原子、分子的特征和行为,从而控制原子、分子之间的反应
B. 分析自然界物质构成,以便在工厂中实现规模生产
C. 合成与开发自然界中并不存在的新物质、新材料以满足人们生产生活需求
D. 合成与开发自然界中并不存在的新元素,解决环境、能源、资源问题
2. 人们用DNA制造出一种臂长只有7nm的纳米镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米镊子具有相同数量级的是
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
3. 根据某种共性,将CO2、P2O5、SiO2归为一类,下列物质中符合此共性而被归为一类的是
A. SO2 B. CaO C. NO2 D. CO
4. 下列物质一定属于混合物的是
A. 固态物质 B. 含多种元素的物质
C. 液态物质 D. 没有颜色的溶液
5. 下列各对物质中,互为同位素的是
①H、H ②H2O、D2O ③Cl、Cl ④金刚石、石墨 ⑤O2、O3 ⑥D2、H+
A. ①②③ B. ①③ C. ③④⑤ D. ①③⑥
6. 下列说法中肯定错误的是
A. 某原子在K层上只有一个电子
B. 某原子M层上电子数为L层电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
7. aX和bY分别是元素X和元素Y的一种核素,已知a>b,则元素X和元素Y的近似相对原子质量的关系是
A. 大于 B. 等于 C. 小于 D. 不能确定
8. 下列对各组物质所属类别的判断中正确的是
A. NaCl、KCl、HClO3、BaCl2:盐类
B. NaClO、KClO3、Cl2、HClO:含氯化合物
C. 空气、Fe(OH)3胶体、CuSO4·5H2O:混合物
D. H3PO4、HNO3、HCl、H2SO4:酸类
9. 氢氧化铁胶体在一定条件下能稳定存在的主要原因是
A. 胶体粒子的直径为1~100纳米 B. 能产生布朗运动
C. 胶体粒子带正电荷 D. 胶体粒子不能透过半透膜
10. 某离子的原子核里有n个质子,该离子的电子层结构与氖原子相同,则该离子所带的电荷数可能是
A. n+10 B. n-10 C. 10/n D. n/10
11. 下列实验操作与微粒直径大小无关的是
A. 渗析 B. 升华 C. 过滤 D. 丁达尔现象
12.“神州七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不同
13. 关于物质聚集状态,下列说法正确的是
A. 液体有固定的形状和体积 B. 气体构成微粒小,易被压缩
C. 温度是影响物质聚集状态的唯一因素 D. 物质的不同聚集状态间可以相互转化
14. 纳米材料是指在三维空间中至少有一维处于纳米尺寸(1-100nm),以下说法正确的是
A. 纳米材料就是胶体
B. 纳米氢氧化铁溶于水后,能产生丁达尔效应
C. 纳米氢氧化铁不能与盐酸反应
D. 纳米材料的物理性质、化学性质都与普通材料完全不同
15. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是
A. B. C. D.
16. 以NA表示阿伏伽德罗常数的值,下列说法中正确的是
A. 53g碳酸钠中含NA个CO32- B. 0.1mol OH-含NA个电子
C. 1.8g重水(D2O)中含NA个中子 D. 标准状况下11.2L臭氧中含NA个氧原子
17. 在标准状况下,5克某气体中含有和5.6升CO2相等的分子数,则该气体的式量是
A. 20 B. 25 C. 40 D. 12.5
18. 下列说法正确的是
A. 质子数相同的两种微粒一定属于同种元素
B. 质子数相同的两种微粒电子数一定相同
C. 质子数相同的两种核素,性质一定相同
D. 质子数相同的两种核素一定是同一种元素
19. 除杂和提纯时化学的基本实验技能,下列实验操作能达到实验目的的是
选项 物质 所含杂质 加入的试剂和操作
A CO2 少量CO 点燃
B N2 少量O2 灼热的铜网
C CuCl2 少量FeCl2 加入适量铁粉,过滤
D CaO 少量CaCO3 适量稀稀盐酸
20. 将3.6克含有杂质铝的金属镁与足量稀硫酸反应,在标准状况下产生氢气的体积
A. V=4.8升 B. V=3.36L
C. 2.98升
21. 甲、乙、丙、丁、戊分别是1-18号元素中的五种,且原子序数依次增大。甲元素丰度最大的核素中没有中子;乙元素的原子最外层电子数是内层电子数的两倍;丙为地壳中含量最多的元素;丁的最外层电子数与甲相同;戊的L层电子数为其电子总数的一半。
(1)写出丙元素原子的结构示意图__________________,其原子在化学反应中容易(得到或失去)_______电子而达到稳定结构,写出该原子达到稳定结构后的微粒的电子式____________;
(2)戊元素在自然界中有四种稳定的核素,其中子数分别为16、17、18、20,各核素的丰度依次为95.02%、0.75%、4.21%和0.02%,其中中子数为18的核素的符号为_________,戊元素的近似相对原子质量为_______(保留2为小数);
(3)上述五种元素的原子形成的简单离子中电子层结构相同的是(写离子符号)_________________;
(4)写出甲元素的三种核素的名称__________________,甲和丁元素能形成化合物,试写出化学式并标出各元素的化合价____________。
22. 近年来,人类生产、生活所产生的污染,如机动车、燃煤、工业等排放的废气,使灰霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。
(1)下列有关说法正确的是__________(填序号)。
A. 灰霾是一种分散系 B. 灰霾能产生丁达尔效应
C. 灰霾形成的是稳定的体系 D. 戴口罩不能阻止吸入灰霾粒子
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,是近地面层空气中水汽凝结(或凝华)的产物。霾也成灰霾,空气中的灰尘(如煤炭及三氧化二铁粉尘)、一氧化氮、二氧化碳、二氧化氮、二氧化硫、硫酸、有机碳氢化合物等粒子使大气浑浊,造成视野模糊并导致能见度较低。形成灰霾的主要物质中能发生若干反应,其中金属氧化物与硫酸反应的化学方程式为_________________________,碳氧化物与足量氢氧化钠溶液反应的化学方程式为______________________________。
(3)雾是气溶胶,氢氧化铁胶体是液溶胶,写出实验室制备氢氧化铁胶体的化学方程式:________________,提纯胶体的方法是_________________。
(4)现有甲、乙、丙三名同学分别进行硅酸胶体的制备实验:
分组 实验操作 实验现象
甲 将1%硅酸钠溶液滴入沸水中,冷却后用激光笔进行照射 无明显现象,未出现“光亮的通路”
乙 向1%硅酸钠溶液中加入几滴酚酞溶液,缓慢滴入稀盐酸,溶液红色褪去后停止滴加,用激光笔进行照射 出现“光亮的通路”
丙 向1%硅酸钠溶液中加入等体积的稀盐酸,用激光笔进行照射 未出现“光亮的通路”,溶液中出现浑浊
已知:硅酸钠(Na2SiO3)溶液呈碱性,遇酚酞变红;常温下硅酸(H2SiO3)难溶于水。
试回答:
成功制备硅酸胶体的是_______同学,根据三位同学的实验操作可知,成功制备硅酸胶体的关键在于
_____________________________________________________,丙同学实验中出现浑浊的原因是
______________________________________________________。
23. 硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
(1)实验室制取硫化氢的化学反应方程式为_________________________。
(2)根据装置图回答下列问题:
制取硫化氢气体的发生装置可以选_______;若用C装置收集硫化氢气体,进气口应为________,原因是____________________________________;为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是__________________,现象是_______________________________。
(3)做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为____________溶液。
(4)标准状况下硫化氢气体的密度是_________g·L-1。
24. 物质的量是架起微观粒子和宏观物质的桥梁,试回答:
(1)甲烷的摩尔质量为___________,8g甲烷气体中约含有___________个分子,在标准状况下所占的体积约为___________L,与其所含原子数相等的氨气的质量为___________g。
(2)在标准状况下,一个装满Cl2的容器为74.6g,若装满N2,则质量为66g,则此容器的容积为________L;若充满某X气体的质量是69.2g,则X气体的摩尔质量为____________。
(3)有一种FeSO4和Fe2(SO4)3的固体混合物,已测得含硫的质量分数为23%,则含铁的质量分数为
_____________。
参考答案
一、选择题
1 2 3 4 5 6 7 8 9 10
D B A D B B D D C B
11 12 13 14 15 16 17 18 19 20
B C D B A B A D B D
二、综合题
21.(1);得到;
(2)S;32.09
(3)O2-、Na+
(4)氕、氘、氚;
22.(1)A
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;CO2+2NaOH=Na2CO3+H2O
(3)FeCl3+3H2OFe(OH)3(胶体)+3HCl;渗析
(4)稀盐酸的加入量;过量的盐酸导致胶体发生聚沉
23.(1)FeS+H2SO4=FeSO4+H2S↑
(2)B;b;硫化氢气体密度大于空气;紫色石蕊溶液;紫色石蕊溶液变红
(3)NaOH溶液
(4)1.52
24.(1)16g/mol;3.01×1023;11.2;10.625
(2)4.48;44g/mol
(3)31%
同课章节目录
