化学人教版(2019)必修第一册1.1.1根据物质的组成和性质分类(共26张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.1根据物质的组成和性质分类(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 08:48:27 | ||
图片预览





文档简介
(共26张PPT)
物质的分类与转化
——第一课时 根据物质的组成和性质分类
生活实例引发思考
方便、快捷、高效……
图1.1 图书馆
图1.2 超市
如何快速找到你想看的书?
如何快速找到你想吃的零食?
生活中的分类
环保、提升资源利用率……
生活中的分类
生活中的分类
物质的分类
分分类
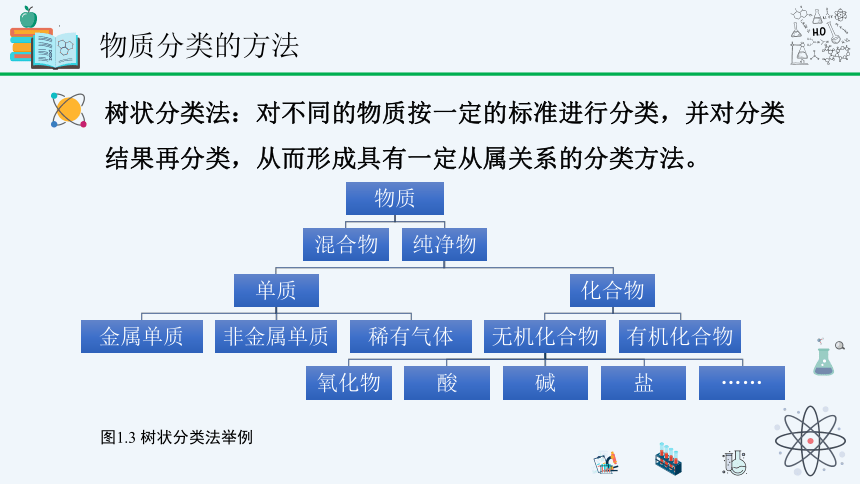
物质分类的方法
树状分类法:对不同的物质按一定的标准进行分类,并对分类结果再分类,从而形成具有一定从属关系的分类方法。
图1.3 树状分类法举例
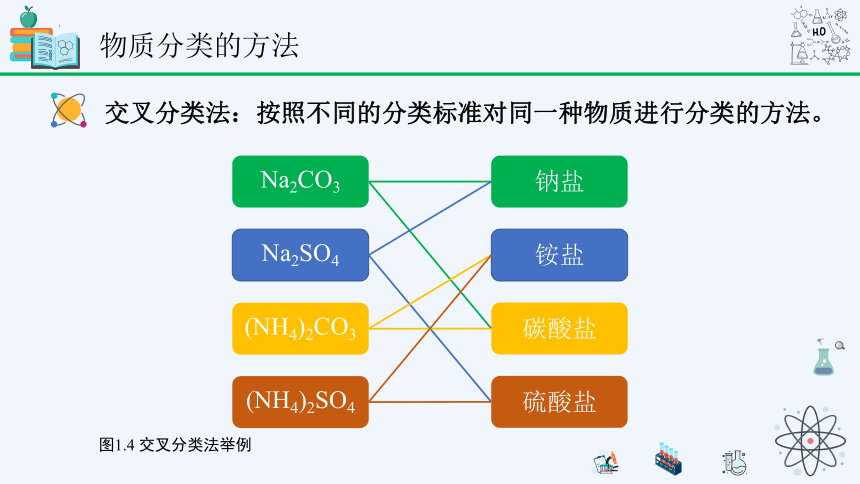
物质分类的方法
交叉分类法:按照不同的分类标准对同一种物质进行分类的方法。
图1.4 交叉分类法举例
Na2SO4
Na2CO3
钠盐
(NH4)2CO3
(NH4)2SO4
硫酸盐
铵盐
碳酸盐
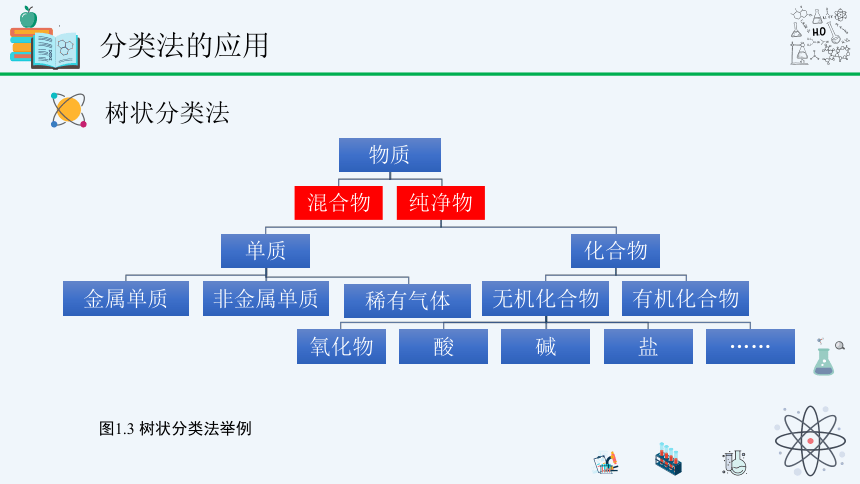
分类法的应用
树状分类法
图1.3 树状分类法举例
混合物和纯净物
纯净物:
判断:空气、冰水混合物、盐酸、硫酸、CuSO4·5H2O是混合物还是纯净物。
混合物:空气、盐酸。
纯净物:冰水混合物、 CuSO4·5H2O
混合物:
由两种或两种以上的物质混合而成的物质。
只由一种物质组成,有固定的性质,可以用化学式表示。
混合物和纯净物
常见纯净物的微粒构成:
分子:如CO2、H2、NH3、CH4、CH3CH2OH等
离子:NaCl、BaSO4、NH4Cl等
原子:SiO2、金刚石、石墨、Fe等
分类法的应用
树状分类法
图1.3 树状分类法举例
单质
单质:
由同种元素组成的纯净物。
同素异形体:
由同一种元素形成的几种性质不同的单质,叫做
这种元素的同素异形体。
图1.5 碳元素的几种同素异形体
金刚石
石墨
C60(足球烯、富勒烯)
碳纳米管
分类法的应用
树状分类法
图1.3 树状分类法举例
氧化物
氧化物:
由两种元素组成且其中一种元素是氧元素的化合物。
酸性氧化物:能与碱反应生成盐和水的氧化物。
如:CO2、SO2、SO3、N2O5、Mn2O7等
碱性氧化物:能与酸反应生成盐和水的氧化物。
如:CuO、FeO、Fe2O3、CaO等
不成盐氧化物
如:CO、NO、NO2等
氧化物
判断下列说法是否正确:
酸性氧化物一定是非金属氧化物。
碱性氧化物一定是金属氧化物。
非金属氧化物一定是酸性氧化物。
金属氧化物一定是碱性氧化物。
√
×
×
×
分类法的应用
树状分类法
图1.3 树状分类法举例
酸的分类
(1)根据酸最多电离出氢离子的个数可将酸分为:一元酸、二元酸、多元酸。
(2)根据酸分子中是否含有氧元素可将酸分为:含氧酸和无氧酸。
(3)根据酸在水溶液中是否完全电离可将酸分为:强酸、中强酸、弱酸。
(4)根据酸有无挥发性可将酸分为:挥发性酸和难挥发性酸。
分类法的应用
树状分类法
图1.3 树状分类法举例
碱的分类
(1)根据碱最多电离出氢氧根离子的个数可将碱分为:一元碱、二元碱、多元碱。
(2)根据碱在水溶液中是否完全电离可将碱分为:强碱、中强碱、弱碱。
分类法的应用
树状分类法
图1.3 树状分类法举例
盐的分类
(1)根据盐在水溶液中的溶解性可将盐分为:易溶、可溶、微溶、难溶性盐。
常见的物质溶解性口诀:碳酸只溶钾钠铵,溶碱钾钠钙钡氨
硫酸不溶钙钡银,盐酸不溶氯化银
(2)根据盐在水溶液中能否电离产生氢离子或氢氧根离子可将盐分为:酸式盐、碱式盐、正盐。
盐的分类
(3)根据中和生成盐的酸碱的强弱可将盐分为:
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
弱酸弱碱盐
例题精讲
例1:判一判:
(1)由同种元素形成的物质一定为纯净物。 ( )
(2)任何元素之间一定能形成化合物。 ( )
(3)含氧化合物一定是氧化物。 ( )
(4)碱性氧化物一定是金属氧化物。 ( )
(5)HNO3既属于一元酸又属于含氧酸,这种分类方法是树状分类法。( )
(6)酸性氧化物都能与水反应生成酸。 ( )
(7)碱性氧化物都能与酸反应生成盐。 ( )
√
×
×
×
×
×
√
例题精讲
例2:下列物质:①洁净的空气;②矿泉水;③纯碱;④小苏打;⑤烧碱;⑥盐酸;⑦硫酸;⑧浓硝酸;⑨氨水;⑩熟石灰; 干冰; 冰水混合物; CuSO4·5H2O ; NaCl溶液; 合金
属于混合物的有: ; 属于纯净物的有: ;
属于氧化物的有: ; 属于酸的有: ;
属于碱的有: ; 属于盐的有: ;
①②⑥⑧⑨
③④⑤⑦⑩
③④
⑦
⑤⑩
例题精讲
例3:H3PO2是一种酸,当过量的NaOH溶液与它反应时,只生成NaH2PO2一种盐,则下列说法正确的是:
A.H3PO2是三元酸 B.H3PO2是一元酸
C.NaH2PO2属于酸式盐 D.NaH2PO2还能电离出H+
B
物质的分类与转化
——第一课时 根据物质的组成和性质分类
生活实例引发思考
方便、快捷、高效……
图1.1 图书馆
图1.2 超市
如何快速找到你想看的书?
如何快速找到你想吃的零食?
生活中的分类
环保、提升资源利用率……
生活中的分类
生活中的分类
物质的分类
分分类
物质分类的方法
树状分类法:对不同的物质按一定的标准进行分类,并对分类结果再分类,从而形成具有一定从属关系的分类方法。
图1.3 树状分类法举例
物质分类的方法
交叉分类法:按照不同的分类标准对同一种物质进行分类的方法。
图1.4 交叉分类法举例
Na2SO4
Na2CO3
钠盐
(NH4)2CO3
(NH4)2SO4
硫酸盐
铵盐
碳酸盐
分类法的应用
树状分类法
图1.3 树状分类法举例
混合物和纯净物
纯净物:
判断:空气、冰水混合物、盐酸、硫酸、CuSO4·5H2O是混合物还是纯净物。
混合物:空气、盐酸。
纯净物:冰水混合物、 CuSO4·5H2O
混合物:
由两种或两种以上的物质混合而成的物质。
只由一种物质组成,有固定的性质,可以用化学式表示。
混合物和纯净物
常见纯净物的微粒构成:
分子:如CO2、H2、NH3、CH4、CH3CH2OH等
离子:NaCl、BaSO4、NH4Cl等
原子:SiO2、金刚石、石墨、Fe等
分类法的应用
树状分类法
图1.3 树状分类法举例
单质
单质:
由同种元素组成的纯净物。
同素异形体:
由同一种元素形成的几种性质不同的单质,叫做
这种元素的同素异形体。
图1.5 碳元素的几种同素异形体
金刚石
石墨
C60(足球烯、富勒烯)
碳纳米管
分类法的应用
树状分类法
图1.3 树状分类法举例
氧化物
氧化物:
由两种元素组成且其中一种元素是氧元素的化合物。
酸性氧化物:能与碱反应生成盐和水的氧化物。
如:CO2、SO2、SO3、N2O5、Mn2O7等
碱性氧化物:能与酸反应生成盐和水的氧化物。
如:CuO、FeO、Fe2O3、CaO等
不成盐氧化物
如:CO、NO、NO2等
氧化物
判断下列说法是否正确:
酸性氧化物一定是非金属氧化物。
碱性氧化物一定是金属氧化物。
非金属氧化物一定是酸性氧化物。
金属氧化物一定是碱性氧化物。
√
×
×
×
分类法的应用
树状分类法
图1.3 树状分类法举例
酸的分类
(1)根据酸最多电离出氢离子的个数可将酸分为:一元酸、二元酸、多元酸。
(2)根据酸分子中是否含有氧元素可将酸分为:含氧酸和无氧酸。
(3)根据酸在水溶液中是否完全电离可将酸分为:强酸、中强酸、弱酸。
(4)根据酸有无挥发性可将酸分为:挥发性酸和难挥发性酸。
分类法的应用
树状分类法
图1.3 树状分类法举例
碱的分类
(1)根据碱最多电离出氢氧根离子的个数可将碱分为:一元碱、二元碱、多元碱。
(2)根据碱在水溶液中是否完全电离可将碱分为:强碱、中强碱、弱碱。
分类法的应用
树状分类法
图1.3 树状分类法举例
盐的分类
(1)根据盐在水溶液中的溶解性可将盐分为:易溶、可溶、微溶、难溶性盐。
常见的物质溶解性口诀:碳酸只溶钾钠铵,溶碱钾钠钙钡氨
硫酸不溶钙钡银,盐酸不溶氯化银
(2)根据盐在水溶液中能否电离产生氢离子或氢氧根离子可将盐分为:酸式盐、碱式盐、正盐。
盐的分类
(3)根据中和生成盐的酸碱的强弱可将盐分为:
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
弱酸弱碱盐
例题精讲
例1:判一判:
(1)由同种元素形成的物质一定为纯净物。 ( )
(2)任何元素之间一定能形成化合物。 ( )
(3)含氧化合物一定是氧化物。 ( )
(4)碱性氧化物一定是金属氧化物。 ( )
(5)HNO3既属于一元酸又属于含氧酸,这种分类方法是树状分类法。( )
(6)酸性氧化物都能与水反应生成酸。 ( )
(7)碱性氧化物都能与酸反应生成盐。 ( )
√
×
×
×
×
×
√
例题精讲
例2:下列物质:①洁净的空气;②矿泉水;③纯碱;④小苏打;⑤烧碱;⑥盐酸;⑦硫酸;⑧浓硝酸;⑨氨水;⑩熟石灰; 干冰; 冰水混合物; CuSO4·5H2O ; NaCl溶液; 合金
属于混合物的有: ; 属于纯净物的有: ;
属于氧化物的有: ; 属于酸的有: ;
属于碱的有: ; 属于盐的有: ;
①②⑥⑧⑨
③④⑤⑦⑩
③④
⑦
⑤⑩
例题精讲
例3:H3PO2是一种酸,当过量的NaOH溶液与它反应时,只生成NaH2PO2一种盐,则下列说法正确的是:
A.H3PO2是三元酸 B.H3PO2是一元酸
C.NaH2PO2属于酸式盐 D.NaH2PO2还能电离出H+
B
