1.1.2分散系及其分类课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2分散系及其分类课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 14:37:27 | ||
图片预览



文档简介
(共17张PPT)
物质的分类与转化
——第二课时 分散系及其分类
你见过这样的美景吗?知道它是如何产生的吗?
图1.6 光的形状
阅读与思考
阅读课本第8页,思考下列问题:
(1)什么是分散系?分散系的组成是什么?
(2)分散系可以如何分类?分类的依据是什么?
分散系
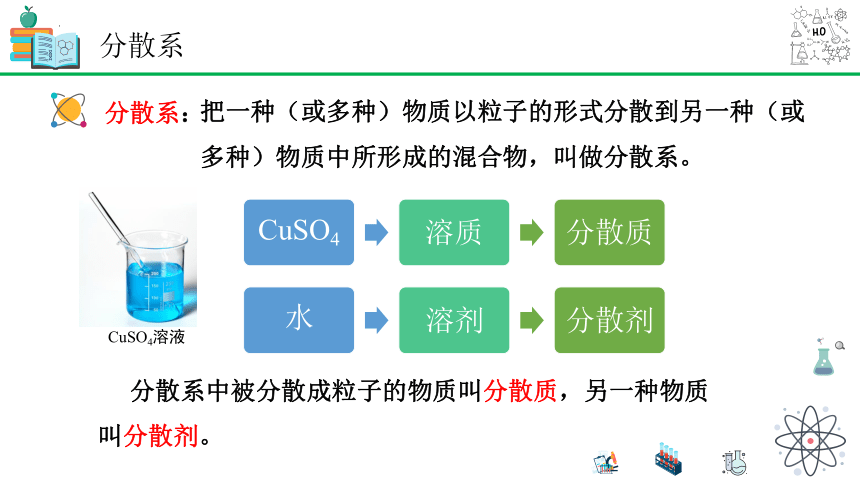
分散系:
把一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物,叫做分散系。
CuSO4溶液
分散系中被分散成粒子的物质叫分散质,另一种物质叫分散剂。
分散系的分类
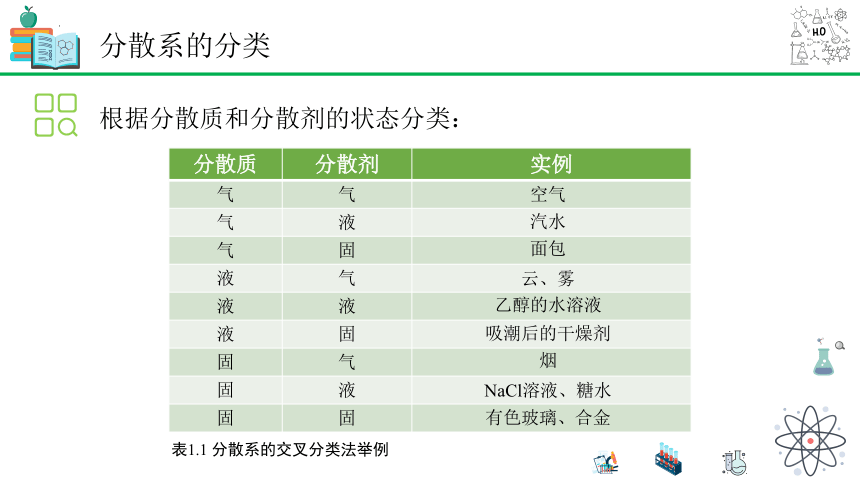
根据分散质和分散剂的状态分类:
分散质 分散剂 实例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
表1.1 分散系的交叉分类法举例
空气
汽水
面包
云、雾
乙醇的水溶液
吸潮后的干燥剂
烟
NaCl溶液、糖水
有色玻璃、合金
分散系的分类
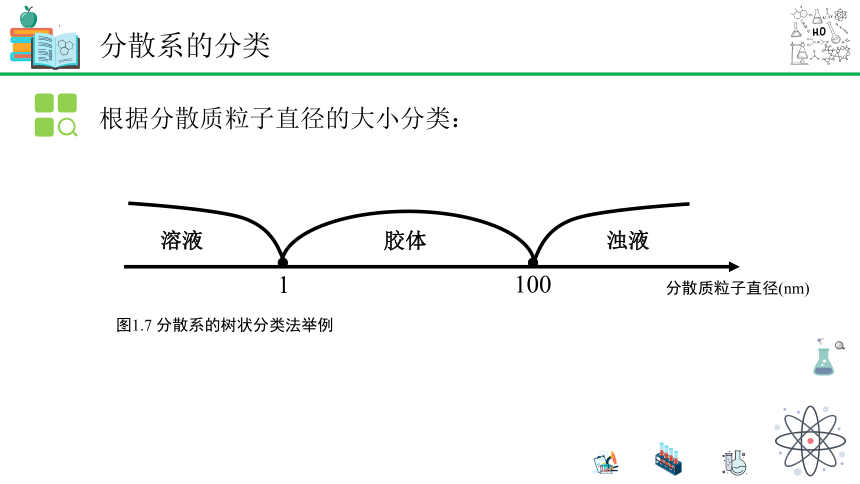
根据分散质粒子直径的大小分类:
图1.7 分散系的树状分类法举例
分散质粒子直径(nm)
1
100
溶液
胶体
浊液
淀粉“溶液”、鸡蛋清、 等
胶体
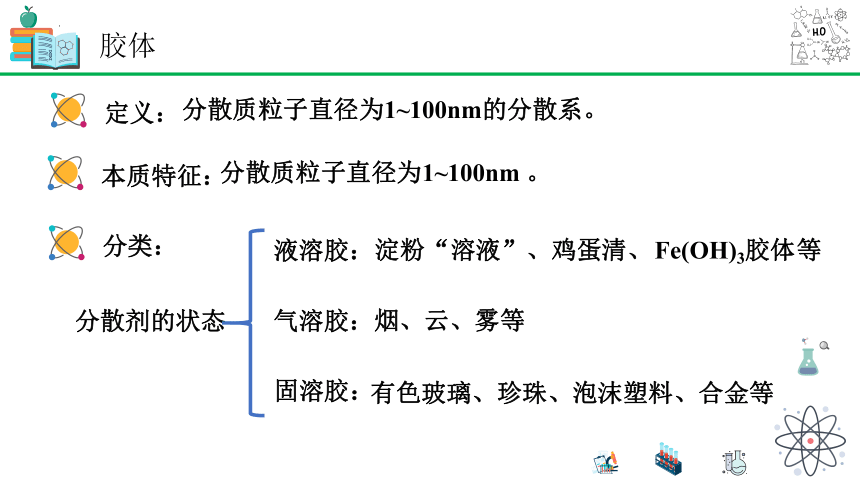
本质特征:
定义:
分散质粒子直径为1~100nm的分散系。
分散质粒子直径为1~100nm 。
分类:
分散剂的状态
气溶胶:
固溶胶:
液溶胶:
烟、云、雾等
有色玻璃、珍珠、泡沫塑料、合金等
Fe(OH)3胶体
Fe(OH)3胶体的制备
Fe(OH)3胶体的制备
Fe(OH)3胶体的制备:
向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色。
FeCl3 + 3H2O == Fe(OH)3(胶体)+ 3HCl
如何区分溶液和胶体?
胶体的性质
(1)丁达尔效应:
丁达尔效应实验
胶体的性质
(1)丁达尔效应:
当光束通过胶体时,可以看到一条光亮的“通路”。这是由于胶粒对光线的散射作用形成的。
图1.8 丁达尔效应
胶体的性质
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
图1.9 电泳现象
(3)电泳现象:带电荷的胶体粒子在电场作用下发生定向移动的现象。
(4)聚沉:胶体形成沉淀析出的现象。
胶体聚沉方法:①加热或搅拌;②加入电解质;
③加入带相反电荷胶粒的胶体。
胶体的分离提纯
(1)胶体和浊液的分离——过滤,胶体能透过滤纸。
(2)胶体和溶液的分离——渗析,胶体粒子不能通过半透膜。
图1.9 根据分散质粒径分离示意图
> 100 nm
1~100 nm
< 1 nm
滤纸
孔径≈100 nm
半透膜
孔径≈1 nm
图1.10 渗析
不同分散系的比较
溶液 胶体 浊液
分散质粒子的直径
分散质粒子种类
性质 外观
稳定性
能否透过滤纸
能否透过半透膜
是否具有丁达尔效应
实例
表1.2 溶液、胶体、浊液的比较
泥水
<1 nm
许多分子集合体或单个大分子
分子或离子
>100 nm
1~100 nm
稳定
不均一、不透明
均一
均一、透明
巨大数目分子集合体
是
否
能
不稳定
介稳性
能
能
否
否
否
否
豆浆、牛奶
NaCl溶液
例题精讲
例1:胶体与其他分散系的本质区别是: ( )
A.能产生丁达尔效应
B.胶体微粒能通过滤纸
C.分散质粒子直径在1~100 nm之间
D.胶体在一定条件下能稳定存在
例2:当一束可见光通过下列分散系:①有尘埃的空气;②稀硫酸;③硫酸铜溶液;④稀豆浆,能产生丁达尔效应的是: ( )
A.①② B.①④ C.②③ D.②④
C
B
作业布置
物质的分类与转化
——第二课时 分散系及其分类
你见过这样的美景吗?知道它是如何产生的吗?
图1.6 光的形状
阅读与思考
阅读课本第8页,思考下列问题:
(1)什么是分散系?分散系的组成是什么?
(2)分散系可以如何分类?分类的依据是什么?
分散系
分散系:
把一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物,叫做分散系。
CuSO4溶液
分散系中被分散成粒子的物质叫分散质,另一种物质叫分散剂。
分散系的分类
根据分散质和分散剂的状态分类:
分散质 分散剂 实例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
表1.1 分散系的交叉分类法举例
空气
汽水
面包
云、雾
乙醇的水溶液
吸潮后的干燥剂
烟
NaCl溶液、糖水
有色玻璃、合金
分散系的分类
根据分散质粒子直径的大小分类:
图1.7 分散系的树状分类法举例
分散质粒子直径(nm)
1
100
溶液
胶体
浊液
淀粉“溶液”、鸡蛋清、 等
胶体
本质特征:
定义:
分散质粒子直径为1~100nm的分散系。
分散质粒子直径为1~100nm 。
分类:
分散剂的状态
气溶胶:
固溶胶:
液溶胶:
烟、云、雾等
有色玻璃、珍珠、泡沫塑料、合金等
Fe(OH)3胶体
Fe(OH)3胶体的制备
Fe(OH)3胶体的制备
Fe(OH)3胶体的制备:
向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色。
FeCl3 + 3H2O == Fe(OH)3(胶体)+ 3HCl
如何区分溶液和胶体?
胶体的性质
(1)丁达尔效应:
丁达尔效应实验
胶体的性质
(1)丁达尔效应:
当光束通过胶体时,可以看到一条光亮的“通路”。这是由于胶粒对光线的散射作用形成的。
图1.8 丁达尔效应
胶体的性质
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
图1.9 电泳现象
(3)电泳现象:带电荷的胶体粒子在电场作用下发生定向移动的现象。
(4)聚沉:胶体形成沉淀析出的现象。
胶体聚沉方法:①加热或搅拌;②加入电解质;
③加入带相反电荷胶粒的胶体。
胶体的分离提纯
(1)胶体和浊液的分离——过滤,胶体能透过滤纸。
(2)胶体和溶液的分离——渗析,胶体粒子不能通过半透膜。
图1.9 根据分散质粒径分离示意图
> 100 nm
1~100 nm
< 1 nm
滤纸
孔径≈100 nm
半透膜
孔径≈1 nm
图1.10 渗析
不同分散系的比较
溶液 胶体 浊液
分散质粒子的直径
分散质粒子种类
性质 外观
稳定性
能否透过滤纸
能否透过半透膜
是否具有丁达尔效应
实例
表1.2 溶液、胶体、浊液的比较
泥水
<1 nm
许多分子集合体或单个大分子
分子或离子
>100 nm
1~100 nm
稳定
不均一、不透明
均一
均一、透明
巨大数目分子集合体
是
否
能
不稳定
介稳性
能
能
否
否
否
否
豆浆、牛奶
NaCl溶液
例题精讲
例1:胶体与其他分散系的本质区别是: ( )
A.能产生丁达尔效应
B.胶体微粒能通过滤纸
C.分散质粒子直径在1~100 nm之间
D.胶体在一定条件下能稳定存在
例2:当一束可见光通过下列分散系:①有尘埃的空气;②稀硫酸;③硫酸铜溶液;④稀豆浆,能产生丁达尔效应的是: ( )
A.①② B.①④ C.②③ D.②④
C
B
作业布置
