专题1化学反应与电能 (含解析)单元检测题 2023-2024学年高二上学期苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1化学反应与电能 (含解析)单元检测题 2023-2024学年高二上学期苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 222.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-11 19:29:20 | ||
图片预览


文档简介
专题1《化学反应与电能》单元检测题
一、单选题
1.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
2.下列说法错误的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应都不需要加热就能发生
C.吸热反应在一定条件(如常温、加热等)也能发生
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
3.下列与反应热大小无关的是( )
A.反应物的状态 B.反应物的多少
C.反应条件 D.生成物的状态
4.工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1
下列判断正确的是( )
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)→C(s)+H2O(l) ΔH=-131.4 kJ·mol-1
C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
5.下列关于反应热的表述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
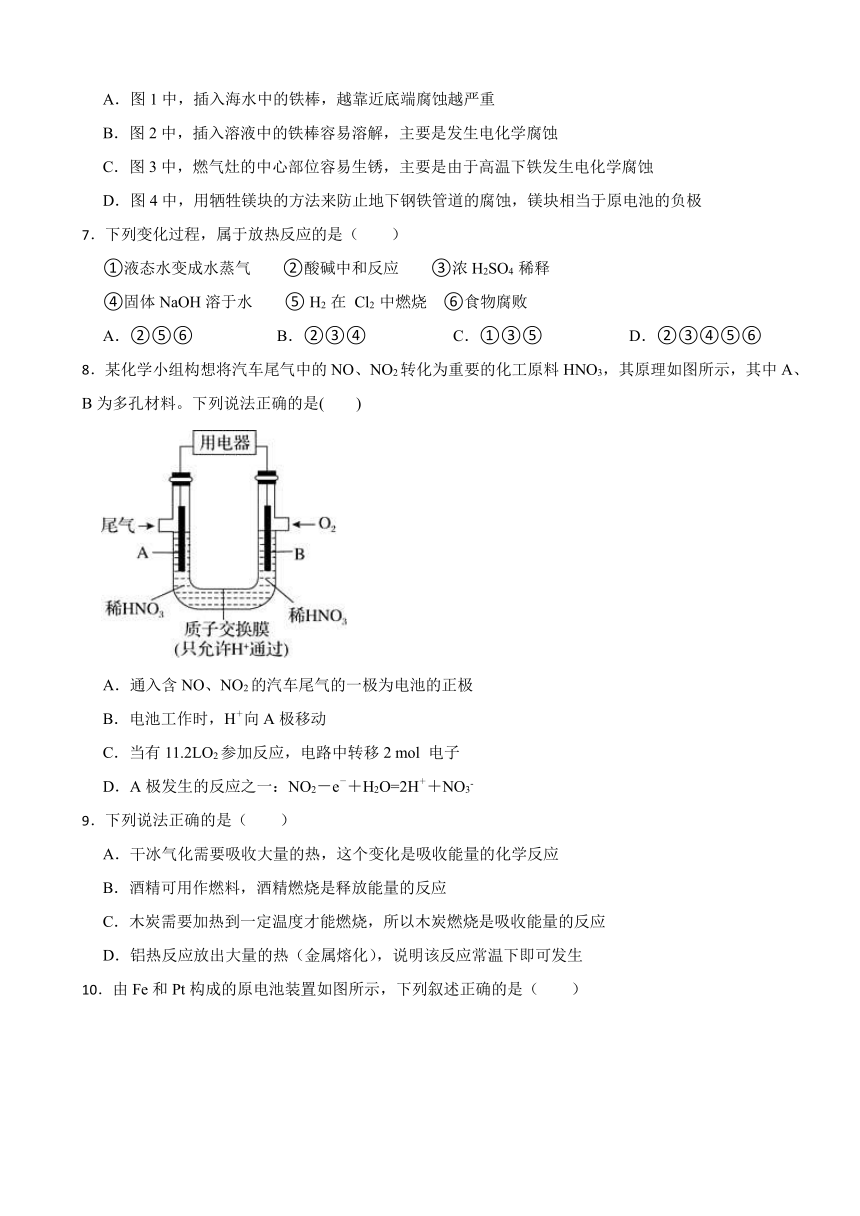
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH6.下列与金属腐蚀有关的说法,正确的是( )
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
7.下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4 稀释
④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败
A.②⑤⑥ B.②③④ C.①③⑤ D.②③④⑤⑥
8.某化学小组构想将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
A.通入含NO、NO2的汽车尾气的一极为电池的正极
B.电池工作时,H+向A极移动
C.当有11.2LO2参加反应,电路中转移2 mol 电子
D.A极发生的反应之一:NO2-e-+H2O=2H++NO3-
9.下列说法正确的是( )
A.干冰气化需要吸收大量的热,这个变化是吸收能量的化学反应
B.酒精可用作燃料,酒精燃烧是释放能量的反应
C.木炭需要加热到一定温度才能燃烧,所以木炭燃烧是吸收能量的反应
D.铝热反应放出大量的热(金属熔化),说明该反应常温下即可发生
10.由Fe和Pt构成的原电池装置如图所示,下列叙述正确的是( )
A.该装置中Pt为正极,电极反应为
B.该装置中Fe为负极,电极反应为
C.溶液中向Fe极移动
D.该原电池装置的最终产物是
11.如图为一原电池装置,下列叙述中正确的是( )
A.铜是阳极,铜片上有气泡产生 B.盐桥中的K+移向ZnSO4溶液
C.电流从锌片经导线流向铜片 D.铜离子在铜片表面被还原
12.对下列化学反应的热现象的说法不正确的是( )
①化学反应中的能量变化都表现为热量变化
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关.
A.①② B.②③ C.①③ D.②④
13.已知反应 为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.因该反应为放热反应,故不必加热就可发生
C.Y的能量一定高于N
D.X和Y的总能量一定高于M和N的总能量
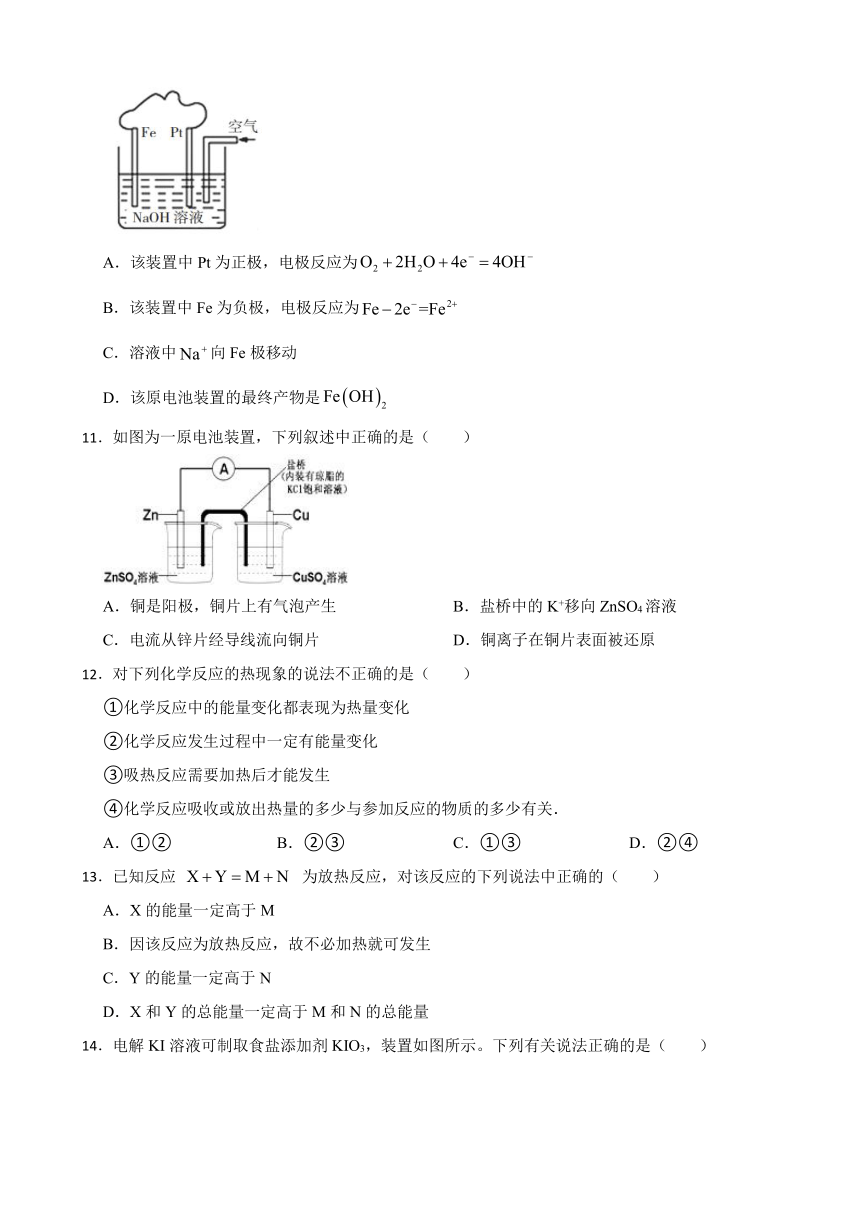
14.电解KI溶液可制取食盐添加剂KIO3,装置如图所示。下列有关说法正确的是( )
A.正极区溶液可使淀粉溶液变蓝色
B.膜b为阳离子交换膜,负极区pH增大
C.每制备1mol ,负极区生成67.2LH2
D.正极区的电极反应为I-+6OH-=6e-= +3H2O
15.已知共价键的键能与热化学方程式信息如下表:
共价键 H- H H-O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1
则2O(g)=O2(g)的ΔH为( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
16.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=-22.68 kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452 kJ/mol
17.为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法错误的是( )
A.CO2过量排放是导致温室效应的原因之一
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2-=CO32-
D.CO2最终转化为C和O2
18.某新型电池可净化废水,同时还能获得能源或有价值的化学产品,其工作原理如图所示,下列叙述错误的是( )
A.该电池左室电极为负极
B.正极区溶液的pH降低、负极区溶液的pH升高
C.H+通过质子膜从左向右迁移
D.左池消耗的S2-与右池消耗的NO 的物质的量之比为5:8
二、综合题
19.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是 _____
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与 CO2 反应 D.H2 与 Cl2 燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
①电池的负极反应式为: 。
②电池工作时 OH-向 移动(填“正极”或“负极”)。
③正极上消耗标况下 4.48L 气体时, 转移电子的数目为 。
20.某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
(1)甲池中通入CH3OH电极的电极反应为 .
(2)乙池中A(石墨)电极的名称为 (填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为 .
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况),丙池中 (填“C”或“D”)极析出 g铜.
21.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为 。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为 。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为 ;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
22.
(1)Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 Na S Al2O3
熔点/℃ 97.8 115 2050
沸点/℃ 892 444.6 2980
请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃
C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为 极。
(3)放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3(5)Ⅱ、用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
图中a极要连接电源的(填“正”或“负”) 极,C口流出的物质是 。
(6)SO32-放电的电极反应式为 。
(7)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因 。
23.在新能源中,氢能将会成为21世纪最理想的能源,但现阶段氢气的主要用于合成氨工业;已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如表:
物质 氢气 原煤 (主要成分是C) 汽油 (主要成分C8H18)
热量(kJ) 285.8 250.9 4910
(1)H2燃烧的热化学方程式是 .
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是 .
答案解析部分
1.【答案】D
【解析】【解答】解:A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A错误;
B.△S为正值的反应不一定是自发反应,如水的分解,故B错误;
C.只有气体的物质的量增加的反应,△S为正值,故C错误;
D.如果△H和△S均为正值,当温度升高时,可满足△H﹣T △S<0时,反应可自发进行,故D正确.
故选D.
【分析】反应能否自发进行,取决于焓变与熵变的综合判据,当△H﹣T △S<0时,反应可自发进行,否则不能,以此解答.
2.【答案】B
【解析】【解答】A.化学反应遵循质量守恒和能量守恒,除了生成新物质外,还伴随着能量的变化,故A不符合题意;
B.有些放热反应如铝热反应,需要加热才能发生,故B符合题意;
C.反应的能量变化和反应条件无关,吸热反应如氯化铵和氢氧化钡的反应常温下就能发生,故C不符合题意;
D.化学反应的能量变化取决于反应物和生成物的总能量之差,故D不符合题意;
故答案为:B。
【分析】A、化学反应伴随能量的变化;
B、放热反应和是否需要加热无关;
C、吸热反应在一定条件下可以发生;
D、化学反应的能量变化取决于反应物和生成物的总能量之差。
3.【答案】C
【解析】【解答】反应热指化学反应在一定的温度下进行时,反应所释放或吸收的热量,反应热与可燃物的物质的量成正比,与物质状态有关,与反应条件无关,
故答案为:C。
【分析】根据热化学方程式的注意事项可以知道,热化学方程式是联系物质的量和反应热的方程式,跟物质的量有关,物质的量不同,其反应热也不同,同时还跟物质的状态有关,同一种物质不同的状态,其内能不同,反应热也不同。
4.【答案】C
【解析】【解答】该反应为吸热反应,反应物的总能量小于生成物的总能量,A错误;B项为制水煤气的反方向,但水应为气态,错误;热化学方程式中的计量数表示物质的量,所以D项中1体积应是1 mol。
故答案为:C
【分析】A.根据吸热反应判断物质的能量;
B.水的状态不同, ΔH 不同;
C.根据热化学式概念进行分析;
D.1体积并不等效于1mol。
5.【答案】D
【解析】【解答】A.当ΔH<0时,表示该反应为放热反应,A错误;
B.需要加热才能进行的反应不一定是吸热反应,例如木炭燃烧,B错误;
C.反应热的大小与反应物所具有的能量和生成物所具有的能量有关,C错误;
D.醋酸电离吸热,则1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH故答案为:D
【分析】本题主要考查反应热的相关知识。
A.根据吸热、反应反应与 ΔH 关系判断;
B.根据吸热反应的概念与特点进行分析;
C.化学反应的反应热和反应物与生成物能量大小有关;
D.根据酸碱中和反应的概念分析,强酸强碱完全反应生成1mol水放出的热量,醋酸是弱酸存在电离平衡是吸热过程。
6.【答案】D
【解析】【解答】A.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,插入海水中的铁棒,越靠近底端氧气的浓度越小,则腐蚀越轻,故A不符合题意;
B.该装置为电解池,铁棒连接了电源的负极,为电解池的阴极,所以铁棒被保护,不易腐蚀,故B不符合题意;
C.温度越高,铁越容易被氧化,所以高温下铁越容易生锈,主要是高温下Fe发生化学腐蚀,故C不符合题意;
D.用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D符合题意;
故答案为:D。
【分析】金属腐蚀的速率:由电解原理引起的腐蚀>由原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
7.【答案】A
【解析】【解答】一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等都是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。①③④不是化学变化,其中①和④是吸热过程,③是放热过程,
故答案为:A。
【分析】 常见的放热反应:1、金属和水或酸反应。2、酸碱中和反应。3、一切燃烧。4、大多数化合反应和置换反应。5、缓慢氧化反应如生锈。
8.【答案】D
【解析】【解答】本题主要考查了原电池知识,意在考查考生的理解能力和判断能力。通入汽车尾气的一极为电池的负极,A项错误;电池工作时,阳离子向正极移动,B项错误;未指明氧气所处的状态,无法计算其物质的量,故电路中转移电子的物质的量也无法计算,C项错误;D项正确。
【分析】原电池的负极失去电子,发生的是氧化反应,正极得到电子,发生的是还原反应;在电解液中,阴离子向负极移动,阳离子向正极移动。
9.【答案】B
【解析】【解答】解:A.吸热反应是指化学反应,干冰气化是物理变化,故A错误;
B.燃烧都是放热反应,故B正确;
C.木炭需加热到一定温度达到木炭的着火点时才燃烧,但木炭燃烧时放出热量,故C错误;
D.铝热反应需要引发才能发生反应,常温不能发生,故D错误;
故选B.
【分析】A.干冰气化是物理变化;
B.燃烧都是放热反应;
C.木炭燃烧是放热反应;
D.铝热反应需要引发才能发生反应;
10.【答案】A
【解析】【解答】A.该装置中Pt为正极,氧气发生还原反应,电极反应为,故A项符合题意;
B.该装置中Fe为负极,电极反应为,故B项不符合题意;
C.Fe是负极,Pt是正极,因此溶液中向Pt极移动,故C项不符合题意;
D.氢氧化亚铁易被氧化,因此该原电池装置的最终产物是,故D项不符合题意;
故答案为:A。
【分析】原电池中通入O2的一极一般都为正极。
11.【答案】D
【解析】【解答】解:A.该原电池中,铜是正极,铜片上铜离子得电子生成铜单质,故A错误;
B.在溶液中,阳离子往正极移动,K+移向CuSO4溶液,故B错误;
C.电流从正极铜沿导线流向锌,故C错误;
D.该原电池中,铜片上发生电极反应式为:Cu2++2e﹣=Cu,铜离子得电子被还原,故D正确;
故选D.
【分析】该原电池中负极为较活泼金属锌,发生氧化反应,铜作正极,在外电路中,电流从正极流向负极,溶液中,阳离子向正极移动,反应的总方程式为Zn+Cu2+=Zn2++Cu.
12.【答案】C
【解析】【解答】解:①化学反应中的能量变化形式有多种,如光能、声能、电能等,但通常表现为热量的变化,故①错误;②化学反应的实质是旧化学键断裂和新化学键的形成.而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同,导致化学反应中发生了能量的变化,故②正确;③化学反应过程中的能量变化与反应条件无必然联系,有些吸热反应不需要加热就能进行,如Ba(OH)2 8H2O和NH4Cl反应,故③错误;④化学反应吸收或放出热量的多少与参加反应的物质的多少成正比,故④正确;
故选C.
【分析】①化学反应中的能量变化主要表现为热量变化;②化学反应的实质是旧化学键断裂和新化学键的形成.而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同;③有些吸热反应不需要加热,如Ba(OH)2 8H2O和NH4Cl反应;④化学反应吸收或放出热量的多少与参加反应的物质的多少成正比.
13.【答案】D
【解析】【解答】A.根据分析,该反应只能比较X和Y的总能量与M和N的总能量,不能比较X和M的能量关系,A不符合题意;
B.放热反应不需要持续加热,但不一定不需要加热,有的反应需要加热达到反应的活化能后反应才能进行,B不符合题意;
C.根据A选项的解析,不能比较Y与M的能量关系,C不符合题意;
D.根据分析,放热反应中反应物的总能量大于生成物的总能量,D符合题意;
故答案为:D。
【分析】反应 为放热反应,放热反应中反应物的总能量大于生成物的总能量,所以X和Y的总能量高于M和N的总能量。
14.【答案】D
【解析】【解答】A.正极区为电解池的阳极,发生反应I-+6OH--6e-= +3H2O,无碘单质生成,不能使淀粉溶液变蓝色,故A不符合题意;
B.I-通过膜b进入正极区,膜b为阴离子交换膜,负极区水电离出的氢离子放电生成氢气,余下OH-,负极区pH增大,故B不符合题意;
C.气体未指明标准状况,无法计算,故C不符合题意;
D.正极区I-放电生成 ,电极反应为I-+6OH--6e-= +3H2O,故D符合题意;
故答案为:D。
【分析】根据题意可知碘酸根离子在正极产生,膜b是阴离子交换膜,膜a是阳离子交换膜,负极区域pH增大,根据转移的电子数即可计算出负极的氢气的物质的量
15.【答案】D
【解析】【解答】反应的ΔH=2(H-H)+(O-O)-4(H-O);-482kJ/mol=2×436kJ/mol+(O-O)-4×463kJ/mol,解得O-O键的键能为498kJ/mol,2个氧原子结合生成氧气的过程需要释放能量,因此2O(g)=O2(g)的ΔH=-498kJ/mol。
【分析】根据ΔH=反应物的键能总和-生成物的键能总和计算
16.【答案】B
【解析】【解答】1g甲醇燃烧放出的热量为22.68kJ,因此1mol(即32g)甲醇燃烧放出的热量为725.76kJ,因此可得甲醇燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76kJ/mol×2=-1452kJ/mol,B符合题意;
故答案为:B
【分析】根据1g甲醇燃烧放出的热量,计算1mol甲醇燃烧放出的热量,从而得出反应的热化学方程式。
17.【答案】B
【解析】【解答】A.太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长波辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应,二氧化碳过量排放导致大气中二氧化碳含量过高,温度逐渐升高,形成“温室效应”,故A不符合题意;
B.根据分析,过程②中,a极的电极反应为:2C2O52 4e =4CO2↑+O2↑,该电极反应为氧化反应,故B符合题意;
C.根据题中信息,可以推出过程③中的反应可表示为:CO2+O2-=CO32-,故C不符合题意;
D.根据分析,熔盐电解池的总的化学方程式为:CO2 C+O2,故D不符合题意;
故答案为:B。
【分析】由装置图可知,a极上,电极反应有:4CO2+2O2-=2C2O52-,2C2O52--4e-=4CO2↑+O2↑,总的电极反应为:2O2--4e-=O2↑;b极上,电极反应有:CO2+O2-=CO32-,CO32-+4e-=C+3O2-,总的电极反应为:CO2+4e-=C+2O2-;熔盐电解池的总的化学方程式为:CO2 C+O2,据此分析解答。
18.【答案】B
【解析】【解答】A.由分析可知,该装置为原电池,左室电极为原电池的负极,故A不符合题意;
B.由分析可知,左室电极为原电池的负极,硫离子在负极失去电子发生氧化反应生成硫酸根离子,电极反应式为S2--8e-+4H2O=SO +8H+,放电时生成氢离子,溶液的pH降低,右室电极为正极,酸性条件下,硝酸根离子在正极得到电子发生还原反应生成氮气,电极反应式为2NO +10 e-+ 12H+=N2↑+6 H2O,放电时消耗氢离子,溶液的pH升高,故B符合题意;
C.电池工作时,阳离子向正极移动,由分析可知,左室电极为原电池的负极,右室电极为正极,则氢离子通过质子膜从左向右迁移,故C不符合题意;
D.由分析可知,硫离子在负极失去电子发生氧化反应生成硫酸根离子,硝酸根离子在正极得到电子发生还原反应生成氮气,由得失电子数目守恒可知,左池消耗的硫离子与右池消耗的硝酸根的物质的量之比为5:8,故D不符合题意;
故答案为:B。
【分析】由题给示意图可知,该装置为原电池,左室电极为原电池的负极,硫离子在负极失去电子发生氧化反应生成硫酸根离子,电极反应式为S2--8e-+4H2O=SO +8H+,右室电极为正极,酸性条件下,硝酸根离子在正极得到电子发生还原反应生成氮气,电极反应式为2NO +10 e-+ 12H+=N2↑+6 H2O。
19.【答案】(1)D
(2)H2-2e-+2OH-=2H2O;负极;0.8NA
【解析】【解答】(1)A.Ba(OH)2·8H2O与NH4Cl反应属于吸热反应,不能设计成原电池,A不选;
B.氢氧化钠与稀盐酸反应,属于放热反应,但不是氧化还原反应,不能设计成原电池,B不选;
C.灼热的炭与CO2反应属于吸热反应,不能设计成原电池,C不选;
D.H2与Cl2燃烧反应属于放热反应,是氧化还原反应,可设计成原电池,H2在负极失去电子,Cl2在正极得到电子,D选;
故故答案为:D;(2)①根据题干信息,电解质溶液为KOH溶液,O2在正极得到电子,电极反应式为O2+4e-+H2O=4OH-,H2在负极失去电子,与OH-结合生成水,则负极反应式为H2-2e-+2OH-=2H2O;②原电池工作时,阴离子向负极移动,即OH-向负极移动;③正极的电极反应式为O2+4e-+H2O=4OH-,消耗4.48L气体,即消耗0.2mol气体时,转移的电子数为0.8NA。
【分析】(1)原电池的特点是自发的氧化还原反应。
(2)负极的反应根据氧化反应进行书写,离子的移动实质是异性相吸原理判断。
20.【答案】(1)CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
(2)阳极;4AgNO3+2H2O 4Ag+O2↑+4HNO3
(3)280;D;1.6
【解析】【解答】解:(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O 4Ag+O2↑+4HNO3,
故答案为:阳极;4AgNO3+2H2O 4Ag+O2↑+4HNO3 ;(3)当乙池中B极质量增加5.4g为Ag,物质的量= =0.05mol,依据电子守恒计算4Ag~O2~4e﹣,甲池中理论上消耗O2的体积= mol×22,4L/mol=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算2Ag~Cu~2e﹣,析出铜质量= ×64g/mol=1.6g;
故答案为:280;D;1.6.
【分析】(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;(3)乙池是电解池结合电子守恒计算消耗氧气的体积,丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜.
21.【答案】(1)c
(2)Fe-2e-=Fe2+
(3)4Fe2++10H2O+O2=4Fe(OH)3↓+8H+或4Fe2++4H++O2=4Fe3++2H2O,Fe3++3OH-=Fe(OH)3↓
(4)O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-);CO2
(5)11.2
【解析】【解答】(1)由题意可知,保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使溶液导电能力增强的电解质,必须是可溶于水的、显中性的盐,
故答案为:c,故答案为:c;
(2)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极,铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)阳极铁失去电子转化为亚铁离子,亚铁离子具有还原性,能被氧气氧化生成铁离子,铁离子与氢氧根离子结合生成氢氧化铁红褐色沉淀,反应的离子方程式可表示为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,正极得到电子发生还原反应,即一定是氧气得电子的过程。由于电解质是熔融碳酸盐,因此正极电极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
②负极甲烷失去电子转化为CO2,而正极需要消耗CO2,所以可以循环利用的物质是CO2,故答案为:CO2;
(5)阴极电极反应为2H++2e-=H2↑,即44.8L(标准状况)气体是氢气,物质的量是2mol,转移电子的物质的量为4mol。根据电池的负极电极反应CH4+4CO32--8e-=5CO2+2H2O可知当转移4mol电子时,消耗CH40.5mol,在标准状况下的体积V=0.5mol×22.4L/mol=11.2L,故答案为:11.2。
【分析】(1)根据生成氢氧化铁沉淀需要在酸性条件下进行,结合需要加入电解质进行判断;
(2)铁做电解池的阳极,被氧化为亚铁离子;
(3)亚铁离子被氧化为铁离子,然后生成氢氧化铁沉淀;
(4)原电池的正极发生还原反应,在整个反应过程中二氧化碳可循环使用;
(5)根据电子守恒计算甲烷的物质的量,然后计算标准状况下的体积。
22.【答案】(1)C
(2)负
(3)从A到B
(4)Sx2--2e-=xS
(5)负;硫酸
(6)SO32--2e-+H2O=SO42- +2H+
(7)2H2O+2e-=H2↑+2OH-
【解析】【解答】I.(1)电池工作时,要求为熔融状态的Na、S,根据物质的熔点表中数据,温度应高于115℃,小于444.6℃,答案为C;(2)放电时,Na失电子生成钠离子,则A电极做负极;(3)放电时,电池内部中阳离子向正极移动,则Na+的移动方向为从A到B;(4)充电时为电解池,阳极Sx2-失电子,生成xS,电极反应式为Sx2--2e-=xS;II. (5根据图像可知,此装置为电解池,溶液中的Na+向阴极移动,则a与电池负极相连;b极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,则C口流出的为浓度较大的硫酸;(6)SO32-放电的电极反应式为SO32--2e-+H2O=SO42- +2H+;(7)电解过程中阴极区发生2H2O+2e-=H2↑+2OH-,使溶液中的氢氧根离子浓度增大,碱性增强。
【分析】I.该装置放电时为原电池,负极为Na失电子生成钠离子,正极为S得电子生成Sx2-;充电时为电解池,阴极为钠离子得电子生成钠,阳极为Sx2--2e-=xS;Ⅱ.此装置为电解池,溶液中的阳离子向阴极移动,阴离子向阳极移动,则a为负极,b为正极,阳极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子;阴极:2H2O+2e-=H2↑+2OH-;
23.【答案】(1)2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ/mol
(2)2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑
【解析】【解答】解:(1)1molH2完全燃烧放出的热量为:285.8kJ,所以热化学方程式是2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol,故答案为:2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol;(2)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑,故答案为:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑.
【分析】(1)1molH2完全燃烧放出的热量为:285.8kJ,所以热化学方程式是2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol;(2)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式.
一、单选题
1.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
2.下列说法错误的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应都不需要加热就能发生
C.吸热反应在一定条件(如常温、加热等)也能发生
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
3.下列与反应热大小无关的是( )
A.反应物的状态 B.反应物的多少
C.反应条件 D.生成物的状态
4.工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1
下列判断正确的是( )
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)→C(s)+H2O(l) ΔH=-131.4 kJ·mol-1
C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
5.下列关于反应热的表述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
7.下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4 稀释
④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败
A.②⑤⑥ B.②③④ C.①③⑤ D.②③④⑤⑥
8.某化学小组构想将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
A.通入含NO、NO2的汽车尾气的一极为电池的正极
B.电池工作时,H+向A极移动
C.当有11.2LO2参加反应,电路中转移2 mol 电子
D.A极发生的反应之一:NO2-e-+H2O=2H++NO3-
9.下列说法正确的是( )
A.干冰气化需要吸收大量的热,这个变化是吸收能量的化学反应
B.酒精可用作燃料,酒精燃烧是释放能量的反应
C.木炭需要加热到一定温度才能燃烧,所以木炭燃烧是吸收能量的反应
D.铝热反应放出大量的热(金属熔化),说明该反应常温下即可发生
10.由Fe和Pt构成的原电池装置如图所示,下列叙述正确的是( )
A.该装置中Pt为正极,电极反应为
B.该装置中Fe为负极,电极反应为
C.溶液中向Fe极移动
D.该原电池装置的最终产物是
11.如图为一原电池装置,下列叙述中正确的是( )
A.铜是阳极,铜片上有气泡产生 B.盐桥中的K+移向ZnSO4溶液
C.电流从锌片经导线流向铜片 D.铜离子在铜片表面被还原
12.对下列化学反应的热现象的说法不正确的是( )
①化学反应中的能量变化都表现为热量变化
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关.
A.①② B.②③ C.①③ D.②④
13.已知反应 为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.因该反应为放热反应,故不必加热就可发生
C.Y的能量一定高于N
D.X和Y的总能量一定高于M和N的总能量
14.电解KI溶液可制取食盐添加剂KIO3,装置如图所示。下列有关说法正确的是( )
A.正极区溶液可使淀粉溶液变蓝色
B.膜b为阳离子交换膜,负极区pH增大
C.每制备1mol ,负极区生成67.2LH2
D.正极区的电极反应为I-+6OH-=6e-= +3H2O
15.已知共价键的键能与热化学方程式信息如下表:
共价键 H- H H-O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1
则2O(g)=O2(g)的ΔH为( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
16.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=-22.68 kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452 kJ/mol
17.为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法错误的是( )
A.CO2过量排放是导致温室效应的原因之一
B.过程②中C2O52-在a极上发生了还原反应
C.过程③中的反应可表示为:CO2+O2-=CO32-
D.CO2最终转化为C和O2
18.某新型电池可净化废水,同时还能获得能源或有价值的化学产品,其工作原理如图所示,下列叙述错误的是( )
A.该电池左室电极为负极
B.正极区溶液的pH降低、负极区溶液的pH升高
C.H+通过质子膜从左向右迁移
D.左池消耗的S2-与右池消耗的NO 的物质的量之比为5:8
二、综合题
19.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是 _____
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与 CO2 反应 D.H2 与 Cl2 燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
①电池的负极反应式为: 。
②电池工作时 OH-向 移动(填“正极”或“负极”)。
③正极上消耗标况下 4.48L 气体时, 转移电子的数目为 。
20.某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
(1)甲池中通入CH3OH电极的电极反应为 .
(2)乙池中A(石墨)电极的名称为 (填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为 .
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为 mL(标准状况),丙池中 (填“C”或“D”)极析出 g铜.
21.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4
b.CH3CH2OH
c.Na2SO4
d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为 。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为 。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为 ;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
22.
(1)Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 Na S Al2O3
熔点/℃ 97.8 115 2050
沸点/℃ 892 444.6 2980
请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃
C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为 极。
(3)放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3
图中a极要连接电源的(填“正”或“负”) 极,C口流出的物质是 。
(6)SO32-放电的电极反应式为 。
(7)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因 。
23.在新能源中,氢能将会成为21世纪最理想的能源,但现阶段氢气的主要用于合成氨工业;已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如表:
物质 氢气 原煤 (主要成分是C) 汽油 (主要成分C8H18)
热量(kJ) 285.8 250.9 4910
(1)H2燃烧的热化学方程式是 .
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是 .
答案解析部分
1.【答案】D
【解析】【解答】解:A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A错误;
B.△S为正值的反应不一定是自发反应,如水的分解,故B错误;
C.只有气体的物质的量增加的反应,△S为正值,故C错误;
D.如果△H和△S均为正值,当温度升高时,可满足△H﹣T △S<0时,反应可自发进行,故D正确.
故选D.
【分析】反应能否自发进行,取决于焓变与熵变的综合判据,当△H﹣T △S<0时,反应可自发进行,否则不能,以此解答.
2.【答案】B
【解析】【解答】A.化学反应遵循质量守恒和能量守恒,除了生成新物质外,还伴随着能量的变化,故A不符合题意;
B.有些放热反应如铝热反应,需要加热才能发生,故B符合题意;
C.反应的能量变化和反应条件无关,吸热反应如氯化铵和氢氧化钡的反应常温下就能发生,故C不符合题意;
D.化学反应的能量变化取决于反应物和生成物的总能量之差,故D不符合题意;
故答案为:B。
【分析】A、化学反应伴随能量的变化;
B、放热反应和是否需要加热无关;
C、吸热反应在一定条件下可以发生;
D、化学反应的能量变化取决于反应物和生成物的总能量之差。
3.【答案】C
【解析】【解答】反应热指化学反应在一定的温度下进行时,反应所释放或吸收的热量,反应热与可燃物的物质的量成正比,与物质状态有关,与反应条件无关,
故答案为:C。
【分析】根据热化学方程式的注意事项可以知道,热化学方程式是联系物质的量和反应热的方程式,跟物质的量有关,物质的量不同,其反应热也不同,同时还跟物质的状态有关,同一种物质不同的状态,其内能不同,反应热也不同。
4.【答案】C
【解析】【解答】该反应为吸热反应,反应物的总能量小于生成物的总能量,A错误;B项为制水煤气的反方向,但水应为气态,错误;热化学方程式中的计量数表示物质的量,所以D项中1体积应是1 mol。
故答案为:C
【分析】A.根据吸热反应判断物质的能量;
B.水的状态不同, ΔH 不同;
C.根据热化学式概念进行分析;
D.1体积并不等效于1mol。
5.【答案】D
【解析】【解答】A.当ΔH<0时,表示该反应为放热反应,A错误;
B.需要加热才能进行的反应不一定是吸热反应,例如木炭燃烧,B错误;
C.反应热的大小与反应物所具有的能量和生成物所具有的能量有关,C错误;
D.醋酸电离吸热,则1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH
【分析】本题主要考查反应热的相关知识。
A.根据吸热、反应反应与 ΔH 关系判断;
B.根据吸热反应的概念与特点进行分析;
C.化学反应的反应热和反应物与生成物能量大小有关;
D.根据酸碱中和反应的概念分析,强酸强碱完全反应生成1mol水放出的热量,醋酸是弱酸存在电离平衡是吸热过程。
6.【答案】D
【解析】【解答】A.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,插入海水中的铁棒,越靠近底端氧气的浓度越小,则腐蚀越轻,故A不符合题意;
B.该装置为电解池,铁棒连接了电源的负极,为电解池的阴极,所以铁棒被保护,不易腐蚀,故B不符合题意;
C.温度越高,铁越容易被氧化,所以高温下铁越容易生锈,主要是高温下Fe发生化学腐蚀,故C不符合题意;
D.用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D符合题意;
故答案为:D。
【分析】金属腐蚀的速率:由电解原理引起的腐蚀>由原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
7.【答案】A
【解析】【解答】一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等都是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。①③④不是化学变化,其中①和④是吸热过程,③是放热过程,
故答案为:A。
【分析】 常见的放热反应:1、金属和水或酸反应。2、酸碱中和反应。3、一切燃烧。4、大多数化合反应和置换反应。5、缓慢氧化反应如生锈。
8.【答案】D
【解析】【解答】本题主要考查了原电池知识,意在考查考生的理解能力和判断能力。通入汽车尾气的一极为电池的负极,A项错误;电池工作时,阳离子向正极移动,B项错误;未指明氧气所处的状态,无法计算其物质的量,故电路中转移电子的物质的量也无法计算,C项错误;D项正确。
【分析】原电池的负极失去电子,发生的是氧化反应,正极得到电子,发生的是还原反应;在电解液中,阴离子向负极移动,阳离子向正极移动。
9.【答案】B
【解析】【解答】解:A.吸热反应是指化学反应,干冰气化是物理变化,故A错误;
B.燃烧都是放热反应,故B正确;
C.木炭需加热到一定温度达到木炭的着火点时才燃烧,但木炭燃烧时放出热量,故C错误;
D.铝热反应需要引发才能发生反应,常温不能发生,故D错误;
故选B.
【分析】A.干冰气化是物理变化;
B.燃烧都是放热反应;
C.木炭燃烧是放热反应;
D.铝热反应需要引发才能发生反应;
10.【答案】A
【解析】【解答】A.该装置中Pt为正极,氧气发生还原反应,电极反应为,故A项符合题意;
B.该装置中Fe为负极,电极反应为,故B项不符合题意;
C.Fe是负极,Pt是正极,因此溶液中向Pt极移动,故C项不符合题意;
D.氢氧化亚铁易被氧化,因此该原电池装置的最终产物是,故D项不符合题意;
故答案为:A。
【分析】原电池中通入O2的一极一般都为正极。
11.【答案】D
【解析】【解答】解:A.该原电池中,铜是正极,铜片上铜离子得电子生成铜单质,故A错误;
B.在溶液中,阳离子往正极移动,K+移向CuSO4溶液,故B错误;
C.电流从正极铜沿导线流向锌,故C错误;
D.该原电池中,铜片上发生电极反应式为:Cu2++2e﹣=Cu,铜离子得电子被还原,故D正确;
故选D.
【分析】该原电池中负极为较活泼金属锌,发生氧化反应,铜作正极,在外电路中,电流从正极流向负极,溶液中,阳离子向正极移动,反应的总方程式为Zn+Cu2+=Zn2++Cu.
12.【答案】C
【解析】【解答】解:①化学反应中的能量变化形式有多种,如光能、声能、电能等,但通常表现为热量的变化,故①错误;②化学反应的实质是旧化学键断裂和新化学键的形成.而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同,导致化学反应中发生了能量的变化,故②正确;③化学反应过程中的能量变化与反应条件无必然联系,有些吸热反应不需要加热就能进行,如Ba(OH)2 8H2O和NH4Cl反应,故③错误;④化学反应吸收或放出热量的多少与参加反应的物质的多少成正比,故④正确;
故选C.
【分析】①化学反应中的能量变化主要表现为热量变化;②化学反应的实质是旧化学键断裂和新化学键的形成.而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同;③有些吸热反应不需要加热,如Ba(OH)2 8H2O和NH4Cl反应;④化学反应吸收或放出热量的多少与参加反应的物质的多少成正比.
13.【答案】D
【解析】【解答】A.根据分析,该反应只能比较X和Y的总能量与M和N的总能量,不能比较X和M的能量关系,A不符合题意;
B.放热反应不需要持续加热,但不一定不需要加热,有的反应需要加热达到反应的活化能后反应才能进行,B不符合题意;
C.根据A选项的解析,不能比较Y与M的能量关系,C不符合题意;
D.根据分析,放热反应中反应物的总能量大于生成物的总能量,D符合题意;
故答案为:D。
【分析】反应 为放热反应,放热反应中反应物的总能量大于生成物的总能量,所以X和Y的总能量高于M和N的总能量。
14.【答案】D
【解析】【解答】A.正极区为电解池的阳极,发生反应I-+6OH--6e-= +3H2O,无碘单质生成,不能使淀粉溶液变蓝色,故A不符合题意;
B.I-通过膜b进入正极区,膜b为阴离子交换膜,负极区水电离出的氢离子放电生成氢气,余下OH-,负极区pH增大,故B不符合题意;
C.气体未指明标准状况,无法计算,故C不符合题意;
D.正极区I-放电生成 ,电极反应为I-+6OH--6e-= +3H2O,故D符合题意;
故答案为:D。
【分析】根据题意可知碘酸根离子在正极产生,膜b是阴离子交换膜,膜a是阳离子交换膜,负极区域pH增大,根据转移的电子数即可计算出负极的氢气的物质的量
15.【答案】D
【解析】【解答】反应的ΔH=2(H-H)+(O-O)-4(H-O);-482kJ/mol=2×436kJ/mol+(O-O)-4×463kJ/mol,解得O-O键的键能为498kJ/mol,2个氧原子结合生成氧气的过程需要释放能量,因此2O(g)=O2(g)的ΔH=-498kJ/mol。
【分析】根据ΔH=反应物的键能总和-生成物的键能总和计算
16.【答案】B
【解析】【解答】1g甲醇燃烧放出的热量为22.68kJ,因此1mol(即32g)甲醇燃烧放出的热量为725.76kJ,因此可得甲醇燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76kJ/mol×2=-1452kJ/mol,B符合题意;
故答案为:B
【分析】根据1g甲醇燃烧放出的热量,计算1mol甲醇燃烧放出的热量,从而得出反应的热化学方程式。
17.【答案】B
【解析】【解答】A.太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长波辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应,二氧化碳过量排放导致大气中二氧化碳含量过高,温度逐渐升高,形成“温室效应”,故A不符合题意;
B.根据分析,过程②中,a极的电极反应为:2C2O52 4e =4CO2↑+O2↑,该电极反应为氧化反应,故B符合题意;
C.根据题中信息,可以推出过程③中的反应可表示为:CO2+O2-=CO32-,故C不符合题意;
D.根据分析,熔盐电解池的总的化学方程式为:CO2 C+O2,故D不符合题意;
故答案为:B。
【分析】由装置图可知,a极上,电极反应有:4CO2+2O2-=2C2O52-,2C2O52--4e-=4CO2↑+O2↑,总的电极反应为:2O2--4e-=O2↑;b极上,电极反应有:CO2+O2-=CO32-,CO32-+4e-=C+3O2-,总的电极反应为:CO2+4e-=C+2O2-;熔盐电解池的总的化学方程式为:CO2 C+O2,据此分析解答。
18.【答案】B
【解析】【解答】A.由分析可知,该装置为原电池,左室电极为原电池的负极,故A不符合题意;
B.由分析可知,左室电极为原电池的负极,硫离子在负极失去电子发生氧化反应生成硫酸根离子,电极反应式为S2--8e-+4H2O=SO +8H+,放电时生成氢离子,溶液的pH降低,右室电极为正极,酸性条件下,硝酸根离子在正极得到电子发生还原反应生成氮气,电极反应式为2NO +10 e-+ 12H+=N2↑+6 H2O,放电时消耗氢离子,溶液的pH升高,故B符合题意;
C.电池工作时,阳离子向正极移动,由分析可知,左室电极为原电池的负极,右室电极为正极,则氢离子通过质子膜从左向右迁移,故C不符合题意;
D.由分析可知,硫离子在负极失去电子发生氧化反应生成硫酸根离子,硝酸根离子在正极得到电子发生还原反应生成氮气,由得失电子数目守恒可知,左池消耗的硫离子与右池消耗的硝酸根的物质的量之比为5:8,故D不符合题意;
故答案为:B。
【分析】由题给示意图可知,该装置为原电池,左室电极为原电池的负极,硫离子在负极失去电子发生氧化反应生成硫酸根离子,电极反应式为S2--8e-+4H2O=SO +8H+,右室电极为正极,酸性条件下,硝酸根离子在正极得到电子发生还原反应生成氮气,电极反应式为2NO +10 e-+ 12H+=N2↑+6 H2O。
19.【答案】(1)D
(2)H2-2e-+2OH-=2H2O;负极;0.8NA
【解析】【解答】(1)A.Ba(OH)2·8H2O与NH4Cl反应属于吸热反应,不能设计成原电池,A不选;
B.氢氧化钠与稀盐酸反应,属于放热反应,但不是氧化还原反应,不能设计成原电池,B不选;
C.灼热的炭与CO2反应属于吸热反应,不能设计成原电池,C不选;
D.H2与Cl2燃烧反应属于放热反应,是氧化还原反应,可设计成原电池,H2在负极失去电子,Cl2在正极得到电子,D选;
故故答案为:D;(2)①根据题干信息,电解质溶液为KOH溶液,O2在正极得到电子,电极反应式为O2+4e-+H2O=4OH-,H2在负极失去电子,与OH-结合生成水,则负极反应式为H2-2e-+2OH-=2H2O;②原电池工作时,阴离子向负极移动,即OH-向负极移动;③正极的电极反应式为O2+4e-+H2O=4OH-,消耗4.48L气体,即消耗0.2mol气体时,转移的电子数为0.8NA。
【分析】(1)原电池的特点是自发的氧化还原反应。
(2)负极的反应根据氧化反应进行书写,离子的移动实质是异性相吸原理判断。
20.【答案】(1)CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
(2)阳极;4AgNO3+2H2O 4Ag+O2↑+4HNO3
(3)280;D;1.6
【解析】【解答】解:(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O 4Ag+O2↑+4HNO3,
故答案为:阳极;4AgNO3+2H2O 4Ag+O2↑+4HNO3 ;(3)当乙池中B极质量增加5.4g为Ag,物质的量= =0.05mol,依据电子守恒计算4Ag~O2~4e﹣,甲池中理论上消耗O2的体积= mol×22,4L/mol=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算2Ag~Cu~2e﹣,析出铜质量= ×64g/mol=1.6g;
故答案为:280;D;1.6.
【分析】(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;(3)乙池是电解池结合电子守恒计算消耗氧气的体积,丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜.
21.【答案】(1)c
(2)Fe-2e-=Fe2+
(3)4Fe2++10H2O+O2=4Fe(OH)3↓+8H+或4Fe2++4H++O2=4Fe3++2H2O,Fe3++3OH-=Fe(OH)3↓
(4)O2+2CO2+4e-=2CO32-(或2O2+4CO2+8e-=4CO32-);CO2
(5)11.2
【解析】【解答】(1)由题意可知,保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使溶液导电能力增强的电解质,必须是可溶于水的、显中性的盐,
故答案为:c,故答案为:c;
(2)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极,铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)阳极铁失去电子转化为亚铁离子,亚铁离子具有还原性,能被氧气氧化生成铁离子,铁离子与氢氧根离子结合生成氢氧化铁红褐色沉淀,反应的离子方程式可表示为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,正极得到电子发生还原反应,即一定是氧气得电子的过程。由于电解质是熔融碳酸盐,因此正极电极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
②负极甲烷失去电子转化为CO2,而正极需要消耗CO2,所以可以循环利用的物质是CO2,故答案为:CO2;
(5)阴极电极反应为2H++2e-=H2↑,即44.8L(标准状况)气体是氢气,物质的量是2mol,转移电子的物质的量为4mol。根据电池的负极电极反应CH4+4CO32--8e-=5CO2+2H2O可知当转移4mol电子时,消耗CH40.5mol,在标准状况下的体积V=0.5mol×22.4L/mol=11.2L,故答案为:11.2。
【分析】(1)根据生成氢氧化铁沉淀需要在酸性条件下进行,结合需要加入电解质进行判断;
(2)铁做电解池的阳极,被氧化为亚铁离子;
(3)亚铁离子被氧化为铁离子,然后生成氢氧化铁沉淀;
(4)原电池的正极发生还原反应,在整个反应过程中二氧化碳可循环使用;
(5)根据电子守恒计算甲烷的物质的量,然后计算标准状况下的体积。
22.【答案】(1)C
(2)负
(3)从A到B
(4)Sx2--2e-=xS
(5)负;硫酸
(6)SO32--2e-+H2O=SO42- +2H+
(7)2H2O+2e-=H2↑+2OH-
【解析】【解答】I.(1)电池工作时,要求为熔融状态的Na、S,根据物质的熔点表中数据,温度应高于115℃,小于444.6℃,答案为C;(2)放电时,Na失电子生成钠离子,则A电极做负极;(3)放电时,电池内部中阳离子向正极移动,则Na+的移动方向为从A到B;(4)充电时为电解池,阳极Sx2-失电子,生成xS,电极反应式为Sx2--2e-=xS;II. (5根据图像可知,此装置为电解池,溶液中的Na+向阴极移动,则a与电池负极相连;b极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,则C口流出的为浓度较大的硫酸;(6)SO32-放电的电极反应式为SO32--2e-+H2O=SO42- +2H+;(7)电解过程中阴极区发生2H2O+2e-=H2↑+2OH-,使溶液中的氢氧根离子浓度增大,碱性增强。
【分析】I.该装置放电时为原电池,负极为Na失电子生成钠离子,正极为S得电子生成Sx2-;充电时为电解池,阴极为钠离子得电子生成钠,阳极为Sx2--2e-=xS;Ⅱ.此装置为电解池,溶液中的阳离子向阴极移动,阴离子向阳极移动,则a为负极,b为正极,阳极为亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子;阴极:2H2O+2e-=H2↑+2OH-;
23.【答案】(1)2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ/mol
(2)2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑
【解析】【解答】解:(1)1molH2完全燃烧放出的热量为:285.8kJ,所以热化学方程式是2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol,故答案为:2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol;(2)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑,故答案为:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑.
【分析】(1)1molH2完全燃烧放出的热量为:285.8kJ,所以热化学方程式是2H2(g)+O2(g)=2H2O (l)△H=﹣571.6 kJ/mol;(2)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式.
